特殊染色:阿利新蓝-过碘酸-雪夫(AB-PAS)染色实验案例
- 格式:docx
- 大小:1.70 MB
- 文档页数:4
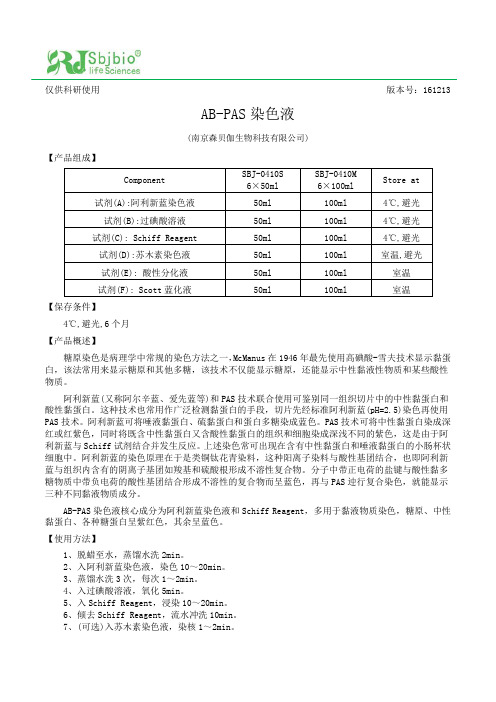
仅供科研使用版本号:161213AB-PAS染色液(南京森贝伽生物科技有限公司)【产品组成】Component SBJ-0410S6×50mlSBJ-0410M6×100mlStore at试剂(A):阿利新蓝染色液50ml 100ml 4℃,避光试剂(B):过碘酸溶液50ml 100ml 4℃,避光试剂(C): Schiff Reagent 50ml 100ml 4℃,避光试剂(D):苏木素染色液50ml 100ml 室温,避光试剂(E): 酸性分化液50ml 100ml 室温试剂(F): Scott蓝化液50ml 100ml 室温【保存条件】4℃,避光,6个月【产品概述】糖原染色是病理学中常规的染色方法之一,McManus在1946年最先使用高碘酸-雪夫技术显示黏蛋白,该法常用来显示糖原和其他多糖,该技术不仅能显示糖原,还能显示中性黏液性物质和某些酸性物质。
阿利新蓝(又称阿尔辛蓝、爱先蓝等)和PAS技术联合使用可鉴别同一组织切片中的中性黏蛋白和酸性黏蛋白。
这种技术也常用作广泛检测黏蛋白的手段,切片先经标准阿利新蓝(pH=2.5)染色再使用PAS技术。
阿利新蓝可将唾液黏蛋白、硫黏蛋白和蛋白多糖染成蓝色。
PAS技术可将中性黏蛋白染成深红或红紫色,同时将既含中性黏蛋白又含酸性黏蛋白的组织和细胞染成深浅不同的紫色,这是由于阿利新蓝与Schiff试剂结合并发生反应。
上述染色常可出现在含有中性黏蛋白和唾液黏蛋白的小肠杯状细胞中。
阿利新蓝的染色原理在于是类铜钛花青染料,这种阳离子染料与酸性基团结合,也即阿利新蓝与组织内含有的阴离子基团如羧基和硫酸根形成不溶性复合物。
分子中带正电荷的盐键与酸性黏多糖物质中带负电荷的酸性基团结合形成不溶性的复合物而呈蓝色,再与PAS迚行复合染色,就能显示三种不同黏液物质成分。
AB-PAS染色液核心成分为阿利新蓝染色液和Schiff Reagent,多用于黏液物质染色,糖原、中性黏蛋白、各种糖蛋白呈紫红色,其余呈蓝色。

AB-PAS染色某些细胞如胃肠的杯状细胞能分泌粘稠的分泌物,含有大量的糖称粘多糖。
中性粘液物质含有氨基己糖和游离的己糖基,酸性粘液物质也含有氨基己糖并含有各种酸根。
此方法先染阿利新蓝染酸性粘液物质为蓝色,并阻断酸性粘液物质的羧酸分子中的乙二醇被高碘酸氧化生产二醛而着红色。
只有中性粘液物质的乙二醇基被高碘酸生成二醛后与雪夫试剂中的无色品红作用生成红紫色复合物。
染色实验步骤:1、切片脱蜡至水。
2、阿利新蓝染液浸染或滴染5-10min。
稍水洗。
3、0.5%高碘酸水溶液氧化5-10min。
4、流水冲洗数分钟蒸馏水换洗两次。
5、雪夫试剂暗处浸染或滴染15~30min。
6、流水冲洗5-10min。
7、苏木素复染核1min左右,盐酸酒精分化,氨水返蓝。
8、95%酒精I 5min-95%酒精II 5min-无水乙醇I 5min-无水乙醇II 5min脱水,二甲苯透明中性树胶封固。
(一定要湿封,在组织上的二甲苯未挥发完组织变干之前封片,否则易出现黑色的结晶状物即空气结晶)。
染色结果:糖原、中性粘液物质呈红色,酸性粘液物质呈蓝色,混合性粘液物质呈蓝紫色或紫蓝色,胞核呈蓝色。
1、高碘酸溶液为透明溶液,长时间染色如果没有带入杂质的话此溶液一直是透明的,所以无法从常规的颜色辨别高碘酸的好坏,只有定期更换,根据标本的多少1~2月更换一次。
2、雪夫试剂要放入冰箱保存,临用前半小时取出恢复至室温,用后又倒回原瓶内放冰箱保存;雪夫试剂出现淡红色就不能继续使用了。
3、如果没有要求,可以不染核,要染核的话染色一定要浅。
因为酸性粘液物质着蓝色,如果核蓝色太深对比不明显。
4、一定要先染阿利新蓝后染PAS,否则蓝色着染少而浅结果不准确,原因是酸性粘液物质的羧酸分子中的乙二醇被高碘酸氧化生产二醛与雪夫试剂中的无色品红作用生成红紫色复合物后再难跟阿利新蓝结合。

过碘酸-Schiff(PAS)染色方法的改良及其在病理诊断中的应用祁珊珊【期刊名称】《临床与实验病理学杂志》【年(卷),期】2016(032)007【总页数】2页(P825-826)【关键词】PAS;染色;改良;病理【作者】祁珊珊【作者单位】峡西理工大学维生素D生理与应用研究所病理室,汉中723000【正文语种】中文【中图分类】R361.2PAS作为一种特殊染色技术最早发现于1946年,该技术最早仅用于生物化学,后经不断改进,广泛应用于临床生化、组织化学及病理诊断中。
PAS染色不仅能显示糖原,而且还能显示中性黏液性物质以及软骨、脑垂体、霉菌、脂质、色素、淀粉样物质及基膜等,广泛应用于人体和实验动物组织的诊断和研究。
PAS染色过程中关键染液的配制方法及氧化时间等对染色效果影响较大。
本实验室经过反复试验,对影响其染色效果的因素加以总结分析,并做相应的调整和改进,染色效果较为满意,现介绍如下。
1.1 实验动物健康成年SD大鼠6只,由西安交通大学实验动物中心提供。
1.2 取材与固定 CO2麻醉处死大鼠,取十二指肠(标本大小不超过1.0 cm×1.0 cm)固定于3.7%多聚甲醛溶液中4 ℃保存,固定24 h后梯度乙醇脱水,二甲苯透明,常规石蜡包埋。
1.3 试剂配制 (1)多聚甲醛溶液:取3.7 g多聚甲醛至80 ml PBS(0.1 mol/L,pH 7.4)中加热至60 ℃,边加热边搅拌,同时滴加1 mol/L NaOH至溶液透亮,自然冷却后用0.1 mol/L的PBS定容至100 ml。
(2)1%过碘酸水溶液:过碘酸1 g,蒸馏水100 ml,溶解后避光贮存于4 ℃冰箱,临用前取出,待溶液温度达室温时使用。
(3)Schiff试剂的配制:所需试剂为1 N盐酸20 ml,碱性品红1 g,活性炭2 g,亚硫酸氢钠1 g,蒸馏水200 ml。
先将蒸馏水加热煮沸后,去火加入碱性品红,置于磁力搅拌器使其充分溶解;待溶液冷却至50 ℃时过滤,再加入适量盐酸;冷却至25 ℃时加入亚硫酸氢钠。

过碘酸-雪夫(PAS)染色实验原理胞浆内存在糖原或多糖类物质(如粘多糖、粘蛋白、糖蛋白、糖脂等)中的乙二醇基(CHOH-CHOH)经过碘酸(periodicacid)氧化,转变为二醛基(CHO-CHO),与雪夫(Schiff)试剂中的无色品红结合,形成紫红色染料而沉积于细胞内多糖所在处。
该反应称为过碘酸-雪夫(PAS)阳性反应,以前也称为糖原染色。
实验方法材料:1.高碘酸氧化液:HIO4·2H2O1g,蒸馏水加至100ml。
此液溶解后保存于冰箱中待用。
2.Schiff试剂:将1g碱性品红溶于200ml煮沸的蒸馏水中。
摇荡5分钟,冷却至600C左右,过滤,并向滤液中入1mol/LHCl20ml,混匀。
冷至 250C时,加2g偏重亚硫酸钠(或钾)(Na2S2O5)。
将此液置带塞的棕色玻璃瓶中,放暗处24小时。
加1g活性碳,摇动1分钟,滤纸过滤。
保存于冰箱中。
3.亚硫酸液100g/L偏重亚硫酸钠6ml1mol/L盐酸5ml蒸馏水100ml每次用前新鲜配置。
4.20g/L甲绿甲绿2g蒸馏水加至100ml5.淀粉酶嚼石蜡刺激分泌唾液离心取上清液,内含淀粉酶,将麦芽糖淀粉酶0.1~1.0g溶于0.02mol/L磷酸盐缓冲液(pH6.0)100ml中。
方法:1.固定新鲜干燥的涂片用品5%乙醇固定10min,蒸馏水冲洗,待干;2.如涂片需要消化,可加唾液或麦芽糖淀酶,置室温消化60min,然后用蒸馏水冲洗;3.10g/L高碘酸氧化15~20min,蒸馏水冲洗,待干;4.置雪夫染液中室温染色30~60min;5.用亚硫酸溶液冲洗3次后,再用自来水冲洗2~3min,待干;6.20g/L甲绿复染10~20min;7.水洗,待干,镜检。
实验结果计算(1)中性粒细胞糖原含量参考标准:(-)胞质无颗粒(+)胞质呈淡红色,无颗粒(++)胞质呈红色,有少量颗粒(+++)胞质呈暗红色,颗粒较密(++++)胞质呈紫红色,颗粒极密(2)淋巴细胞系:大多数淋巴细胞呈阴性反应,少数为(+)的阳性反应。

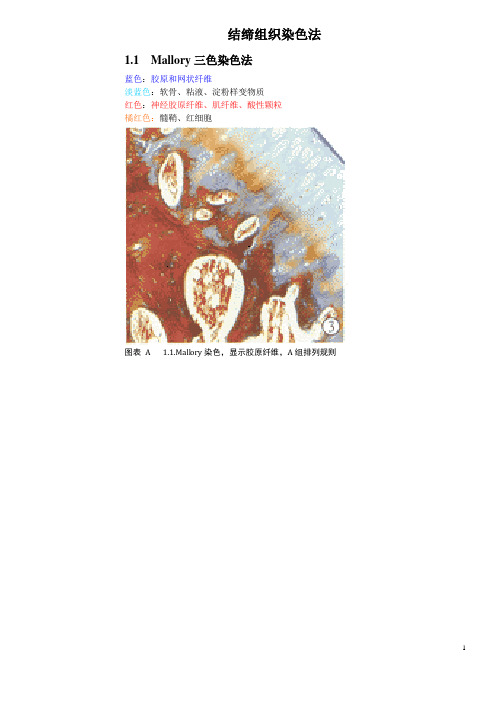
病理学技术—特殊染色最最全总结(均配图)结缔组织染色法1.1 Mallory三色染色法蓝色:胶原和网状纤维淡蓝色:软骨、粘液、淀粉样变物质红色:神经胶原纤维、肌纤维、酸性颗粒橘红色:髓鞘、红细胞图表 A 1.1.Mallory染色,显示胶原纤维,A组排列规则1.2. Masson三色染色法绿色:胶原纤维红色:肌纤维橘红色:红细胞图表 B 1.2 Mssson三色法图表 C 1.2.Masson三色染色胃癌组织中血管平滑肌1.3. 显示胶原、网状和弹性纤维的三联染色法红色:胶原纤维黑色:网状纤维绿色:弹性纤维淡黄色:肌肉、红细胞图表 D 4.Weigert间苯二酚法二、胶原纤维染色法2.2. Van Gieson(V.G)苦味酸-酸性品红法鲜红色:胶原纤维黄色:肌纤维、细胞质、红细胞蓝褐色:胞核图表 E 2.胶原纤维,Van Gieson(V.G.)苦味酸-酸性品红法图心肌梗塞 myocardial infarction:心肌梗塞后2个月,van Gieson 染色, 坏死心肌被染成红色的纤维组织所代替,黄色区域为残留的心肌纤维。
2.1 天狼星红(Sirius red)苦味酸染色法(参照上图)红色:胶原纤维绿色:细胞核黄色:其他三、网状纤维染色3.1 Gordon-Sweets银氨染色法(梅花开枝图,金色阳光伴树枝)黑色:网状纤维红色:胞核(核固红复染)黄棕色:胶原纤维淡红色:细胞质(红液复染)图表 F 3.Gordon-Sweets氢氧化银氨液浸染法3.2 Gomori氏银氨液配制法图表 G Gomori氏银氨液配制法四、弹性纤维染色Gomori醛复红染色法*甲醛生理盐水液固定的染色效果最佳图表 H 4.GOMORI醛复红染色法五、显示弹性、胶原纤维的双重组合染色法蓝绿色:弹性纤维红色:胶原纤维黄色:背景图表 I 4.Weigert间苯二酚法六、肌肉组织染色△横纹肌组织染色Mallory磷钨酸苏木精染色法(PTAH)蓝色:胞核、纤维、肌肉、神经胶质纤维、纤维蛋白、横纹肌黄色或枚红色:胶原纤维、网状纤维软骨基质、骨微紫色:粗弹性纤维(有时)紫蓝色或棕黄色:缺血缺氧早期病变的心肌图表 J 6.1.磷钨酸苏木素法图表 K 6.1.磷钨酸苏木素染色液△早期心肌病变组织染色1.Nagar-Olsen染色法(1974年)红色:缺氧心肌、红细胞黄色或黄棕色:正常心肌蓝色:细胞核图各组小鼠心肌组织Nagar-Olsen染色(光学显微镜, ×200)2.Poley显示缺氧心肌染色法(1964年)红色:缺氧心肌紫色:胞核绿色:其他组织七、糖类染色过碘酸-Schiff(PAS)染色法红色:糖原及其他PAS反应阳性物质蓝色:细胞核图表 L 7.胃贲门腺体胞浆呈PAS阳性八、黏液物质(黏多糖)染色1.Mowry阿尔辛蓝过碘酸雪夫(ABPAS)染色法(1956)红色:中性黏液物质蓝色:酸性黏液物质紫红色:混合性黏液物质图表 M 8.1.AB-PAS染色结肠粘膜图表 N 8.1.胃粘膜组织 AB-PAS染色 40×:2.爱先蓝(PH2.5)法蓝色:唾液酸、弱硫酸化黏液物质、一般粘液红色:胞核不着色:强硫酸化黏液物质图表 O 8.2.爱先蓝(PH2.5)染色液图表 P 8.2.爱先蓝法图表 Q 8.2.爱先蓝法—3、爱先蓝(PH1.0)法蓝色:含硫酸黏液物质不着色:非硫酸化酸性黏液物质红色:复染后的胞核九、黑色素染色1.Masson-Fontana黑色素银浸染色法黑色:黑色素及嗜银细胞颗粒红色:胶原纤维浅黄色:背景图表 R 9.1.Melanin pigment in cells of9.1. malignant melanoma, Fontana-Masson stain.2.Lillie亚铁染色法暗绿色:黑色素浅绿或不着色:背景黄色:肌纤维和背景十、含铁血黄素染色Perls blue(普鲁士蓝)反应显示三价铁蓝色:含铁血黄素浅红色:其他组织图表 S 10.普鲁士蓝染色肝脏普鲁士蓝染色呈蓝色的含铁血黄素颗粒大量沉着在肝实质细胞和库普弗细胞内。

abpas染色实验原理
AB-PAS染色实验是一种通过染色来检测糖原在细胞和组织中分布和含量的方法。
该实验常用于病理学领域,特别是在肝脏病理学中,用于检测肝细胞内的糖原沉积和分布,从而评估肝脏疾病的类型和严重程度。
实验原理:AB-PAS染色实验是一种组合染色方法,由Alcian Blue和Periodic Acid-Schiff(PAS)染色组成。
Alcian Blue是一种酸性染色剂,主要用于染色酸性多糖,如硫酸肝素和酸性黏多糖。
而PAS染色则是一种选择性染色方法,用于检测组织中存在的糖原。
在AB-PAS染色实验中,细胞或组织切片首先被Alcian Blue染色剂染成蓝色,随后用Periodic Acid-Schiff溶液进行氧化,将细胞或组织中的糖原氧化为醛基。
最后,用Fuchsin染色剂染色,使氧化后的糖原变成颜色暗红色至紫色。
根据Alcian Blue和PAS染色剂的特殊性质,AB-PAS染色实验可以用于检测不同类型的糖原。
例如,肝细胞内的糖原可用AB-PAS染色进行鉴定,来帮助诊断肝脏病变。
总之,AB-PAS染色实验是一种常见的组织染色方法,可用于检测糖原在细胞和组织中的分布和含量,对于病理学研究和诊断具有重要意义。

AB-PAS染色实验报告一、实验器材及试剂1、实验器材名称厂家型号脱水机武汉俊杰电子有限公司JJ-12J包埋机武汉俊杰电子有限公司JB-P5病理切片机上海徕卡仪器有限公司RM2016冻台武汉俊杰电子有限公司JB-L5组织摊片机浙江省金华市科迪仪器设备有限公司KD-P烤箱天津市莱玻瑞仪器设备有限公司GFL-230载玻片Servicebio正置光学显微镜日本尼康NIKON ECLIPSE E100成像系统日本尼康NIKON DS-U32、主要实验试剂试剂名称厂家货号无水乙醇国药集团化学试剂有限公司100092683二甲苯国药集团化学试剂有限公司10023418AB-PAS染液套装Servicebio G1049苏木素染液servicebio G1004分化液servicebio G1005-3返蓝液servicebio G1005-4中性树胶国药集团化学试剂有限公司10004160二、实验步骤1、石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ20min-二甲苯Ⅱ20min-无水乙醇Ⅰ5min-无水乙醇Ⅱ5min-75%酒精5min,自来水洗。
2、阿利新蓝染色:切片入阿利新蓝染液中染色5min,自来水洗2min;3、高碘酸染色:切片入高碘酸染液中15min,自来水洗,蒸馏水洗两遍;4、雪弗染色:切片入雪弗染液避光染色30min,,流水冲洗5min;5、苏木素染色:切片入苏木素染液染3-5min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。
6、脱水封片:切片依次入无水乙醇I 5min -无水乙醇II 5min-无水乙醇Ⅲ5min -二甲苯Ⅰ5min -二甲苯Ⅱ5min透明,中性树胶封片。
7、显微镜镜检,图像采集分析。
三、结果判读:酸性粘液物质呈蓝色,糖原,中性粘液物质呈紫红色,混合黏液物质呈紫蓝色或蓝紫色。
四、注意事项:1、染液配制的量需要根据实际情况来定,配制过多易造成浪费。
2、染液一定要避光保存,并且实验过程中的每一步操作都要求避光。

红河州第一人民医院检验科质量管理体系文件 SOP文件1.检验原理血细胞内含乙二醇的糖类物质(PAS)能被过碘酸氧化,形成双基醛类物质。
后者与无色品红结合,形成紫红色沉淀物,沉淀物的显色深浅与乙二醛的含量成正比。
2.主要组成成分2.1、PAS固定液:2.5ml×5(含甲醇等)2.2、PASI液:2.0ml×5(含过碘酸等)2.3、PASII液:30ml×5(含碱性品红、偏重亚硫酸钠等)2.4、苏木素复染液:2.5ml×5(含苏木精等)2.5、说明书:1份注:不同批号试剂盒中PASS固定液,苏木素复染液可以互换。
2.储存条件及有效期有效期:一年(十二个月)。
储存条件:本试剂盒应储存于2~8℃低温环境。
4.检验方法4.1、涂片滴加固定液5-8滴盖满血膜即可。
5分钟水洗待干。
4.2、滴加I液十分钟水洗待干。
4.3、置入II液内室温(20-25℃为宜)暗处放置30分钟,流水冲4.4、洗数分钟。
4.5、苏木素复染1-2分钟,水洗待干,镜检。
5.临床意义用于营养性巨幼细胞贫血与红(白)血病的鉴别,前者的正常红细胞及有核红细胞常为阴性,而后者可呈强阳性反应.用于鉴别急性淋巴细胞性白血病与急性非淋巴细胞性白血病,前者的原淋巴细胞和幼稚淋巴细胞可见大块红色物质.后者的原始阶段细胞常为阴性.高雪氏细胞呈强阳性,而尼曼匹克氏细胞呈微弱阳9.49g溶解于1L水中80ml,再加0.07MKH2PO4(即9.08g溶解于1L水中)20ml,混匀.6.注意事项6.1、本产品仅供体外诊断使用。
6.2、样本和使用器材应避免带醛基和还原性的物质污染,以免出现假阳性。
6.3、滴加I液后水洗应充分,然后待涂片完全干燥后才能置入II液内。
6.4、涂片染色后,复染时可采用血膜纵向一半复染,另一半勿复染,以利于弱阳性的检出。
6.5、PAS II液保存不当或时间过久将会变红,并使阳性强度降低,且不能反复使用。


结缔组织染色法1.1 Mallory三色染色法蓝色:胶原和网状纤维淡蓝色:软骨、粘液、淀粉样变物质红色:神经胶原纤维、肌纤维、酸性颗粒橘红色:髓鞘、红细胞图表 A 1.1.Mallory染色,显示胶原纤维,A组排列规则1.2. Masson三色染色法绿色:胶原纤维红色:肌纤维橘红色:红细胞图表 B 1.2 Mssson三色法图表 C 1.2.Masson三色染色胃癌组织中血管平滑肌1.3. 显示胶原、网状和弹性纤维的三联染色法红色:胶原纤维黑色:网状纤维绿色:弹性纤维淡黄色:肌肉、红细胞图表 D 4.Weigert间苯二酚法二、胶原纤维染色法2.2. Van Gieson(V.G)苦味酸-酸性品红法鲜红色:胶原纤维黄色:肌纤维、细胞质、红细胞蓝褐色:胞核图表E 2.胶原纤维,Van Gieson(V.G.)苦味酸-酸性品红法图心肌梗塞myocardial infarction:心肌梗塞后2个月,van Gieson 染色, 坏死心肌被染成红色的纤维组织所代替,黄色区域为残留的心肌纤维。
2.1 天狼星红(Sirius red)苦味酸染色法(参照上图) 红色:胶原纤维绿色:细胞核黄色:其他3.1 Gordon-Sweets银氨染色法(梅花开枝图,金色阳光伴树枝)黑色:网状纤维红色:胞核(核固红复染)黄棕色:胶原纤维淡红色:细胞质(红液复染)图表 F 3.Gordon-Sweets氢氧化银氨液浸染法3.2 Gomori氏银氨液配制法图表G Gomori氏银氨液配制法Gomori醛复红染色法*甲醛生理盐水液固定的染色效果最佳图表H 4.GOMORI醛复红染色法五、显示弹性、胶原纤维的双重组合染色法蓝绿色:弹性纤维红色:胶原纤维黄色:背景图表I 4.Weigert间苯二酚法六、肌肉组织染色△横纹肌组织染色Mallory磷钨酸苏木精染色法(PTAH)蓝色:胞核、纤维、肌肉、神经胶质纤维、纤维蛋白、横纹肌黄色或枚红色:胶原纤维、网状纤维软骨基质、骨微紫色:粗弹性纤维(有时)紫蓝色或棕黄色:缺血缺氧早期病变的心肌图表J 6.1.磷钨酸苏木素法图表K 6.1.磷钨酸苏木素染色液△早期心肌病变组织染色1.Nagar-Olsen染色法(1974年)红色:缺氧心肌、红细胞黄色或黄棕色:正常心肌蓝色:细胞核图各组小鼠心肌组织Nagar-Olsen染色(光学显微镜, ×200)2.Poley显示缺氧心肌染色法(1964年)红色:缺氧心肌紫色:胞核绿色:其他组织七、糖类染色过碘酸-Schiff(PAS)染色法红色:糖原及其他PAS反应阳性物质蓝色:细胞核图表L 7.胃贲门腺体胞浆呈PAS阳性八、黏液物质(黏多糖)染色1.Mowry阿尔辛蓝过碘酸雪夫(ABPAS)染色法(1956)红色:中性黏液物质蓝色:酸性黏液物质紫红色:混合性黏液物质图表M 8.1.AB-PAS染色结肠粘膜图表N 8.1.胃粘膜组织AB-PAS染色40×:2.爱先蓝(PH2.5)法蓝色:唾液酸、弱硫酸化黏液物质、一般粘液红色:胞核不着色:强硫酸化黏液物质图表O 8.2.爱先蓝(PH2.5)染色液图表P 8.2.爱先蓝法图表Q 8.2.爱先蓝法—3、爱先蓝(PH1.0)法蓝色:含硫酸黏液物质不着色:非硫酸化酸性黏液物质红色:复染后的胞核九、黑色素染色1.Masson-Fontana黑色素银浸染色法黑色:黑色素及嗜银细胞颗粒红色:胶原纤维浅黄色:背景图表R 9.1.Melanin pigment in cells of9.1. malignant melanoma, Fontana-Masson stain.2.Lillie亚铁染色法暗绿色:黑色素浅绿或不着色:背景黄色:肌纤维和背景十、含铁血黄素染色Perls blue(普鲁士蓝)反应显示三价铁蓝色:含铁血黄素浅红色:其他组织图表S 10.普鲁士蓝染色肝脏普鲁士蓝染色呈蓝色的含铁血黄素颗粒大量沉着在肝实质细胞和库普弗细胞内。

特殊染色法一,抗酸杆菌染色1,试剂配制:(1)碱性品红乙醇液:碱性品红5g,无水乙醇100ml(2)5%苯酚水溶液:苯酚(稍加温使共溶解)5ml,蒸馏水95ml(3)苯酚碱性品红液:碱性品红乙醇液1ml,5%苯酚水溶液9ml(4)20%硫酸水溶液:浓硫酸20ml,蒸馏水80ml(5)汽油松节油液:航空汽油(也可为普通汽油)1份,松节油1份2,染色程序:(1)切片用汽油松节油脱蜡2次,每次5-10min。
(2)不经乙醇洗,只用纱布将切片周围余液擦干。
(3)流水稍洗。
(4)滴入苯酚碱性品红液,于室温下染15—30min。
(5)流水去多余液体。
(6)用20%硫酸水溶液分化至适当为止(一般需1—5min)(7)流水充分冲洗。
(8)用Mayer苏木精液浅染细胞核。
(9)洗流水冲洗10—15min。
(10)用风扇把切片吹干,随即二甲苯透明,中性树胶封固。
3,结果:抗酸杆菌(包括麻风杆菌和结核杆菌)呈鲜红色,胞核呈蓝色。
二,奥新兰过碘酸雪夫代染色简称(AB—PAS染色)(溶液配制)1,0.3%的奥辛兰醋酸液:奥新兰0.3g,蒸馏水97ml,冰醋酸3ml2,1%过碘酸水溶液,schitf代试剂及亚硫酸冲洗液配发同。
(染色方法)1,切片按常规脱蜡水洗,再入蒸馏水洗。
2,染于0.3%或1%奥新兰醋酸液中10—30分钟。
3,用蒸馏水充分洗,至少洗4次。
4,1%过碘酸水溶液氧化5—10分钟。
5,用蒸馏水从分洗,至少3—4次。
6,Schiff代试剂染10—30分钟。
7,直接用亚硫酸冲洗3次,每次2分钟。
(有固定的作用,把多余的schiff试液洗净)8,流动自来水洗5分钟后蒸馏水洗。
9,苏木素染核。
必要时盐酸究竟稍分化后充分用自来水洗。
10,95%酒精,无水酒精脱水,二甲苯透明,树胶封固。
(结果)酸性粘多糖呈靛兰色,中性粘旦白呈鲜紫红色或品红色,中性及酸性粘蛋白混合物呈紫兰色。
软骨紫蓝核呈蓝色。
三,改良Hale胶状铁染色液的配制和应用(溶液配制)29%氯化铁4.4ml,蒸馏水250ml将蒸馏水置于烧杯内煮沸,然后滴加氯化铁不断搅动直至溶液变成暗红色。

特殊染⾊:阿利新蓝-过碘酸-雪夫(AB-PAS)染⾊实验案例特殊染⾊:阿利新蓝-过碘酸-雪夫(AB-PAS)染⾊实验案例1、临床应⽤⽤于胃标本组织切⽚的胃粘膜上⽪肠化⽣分类、糖原和粘液物质形态观察前的染⾊。
主要应⽤于胃粘膜上⽪化⽣分类。
在胃粘膜活检时,判别肠化⽣的类型较之受累程度可能更为重要。
在判别完全或不完全性肠化⽣时,⼀般的HE染⾊即可辩认,但判别是⼤肠型或⼩肠型,必须采⽤AB、PAS及HID粘液的组化染⾊。
阿利新蓝染⾊液(PH2.5)⽤于显⽰酸性粘液物质,主要应⽤于粘液性疾病的鉴别诊断。
PAS过碘酸雪夫⽒染⾊液⽤于糖原和黏液物质染⾊,主要应⽤于鉴别细胞内的空泡状变性及⼼肌病变和⼼⾎管⽅⾯的疾病,还可⽤于鉴别观察缺⾎缺氧早期⼼肌坏死或梗死区的糖原和糖原累积疾病,糖尿病器官,某些肿瘤的(如:肝细胞瘤、胆管瘤、横纹肌等)诊断及研究。
主要⽤于糖元、中性粘液的染⾊。
2、适⽤范围适宜于组织的⽯蜡切⽚、冰冻切⽚、⽕棉胶切⽚、树脂切⽚等染⾊3、原理⽅法阿利新蓝-过碘酸雪夫⽒套染法3、PAS染⾊液A试剂(⾼碘酸) B试剂(Schiff⽒试剂)4、染⾊⽅法切⽚脱蜡⽔洗后:1)AB染⾊液(阿利新蓝染⾊液PH2.5)染⾊5~10分钟,⽔洗;2)PAS染⾊液A试剂(⾼碘酸)染⾊5分钟,蒸馏⽔洗;3)PAS染⾊液B试剂(Schiff⽒试剂)染⾊5~10分钟,⽔洗;4)脱⽔、透明、封固、镜检。
结果参考:硫酸化粘液呈⿊⾊,酸性粘液呈兰⾊,中性粘液呈红⾊。
5、AB染⾊液(阿利新蓝染⾊液PH2.5)做酸性粘液物质染⾊时操作说明染⾊⽅法:切⽚脱蜡⽔洗后:1)阿利新蓝染⾊液染⾊5~10分钟,⽔洗⾄⽆染料脱落;2)脱⽔、透明、封固、镜检。
结果参考:酸性粘液物质呈蓝⾊。
6、PAS染⾊液(过碘酸雪夫⽒染⾊液)做糖元、中性粘液染⾊时操作说明染⾊⽅法:切⽚脱蜡⽔洗后:1)⾼碘酸染⾊5分钟,蒸馏⽔洗;2)Schiff⽒试剂染⾊5~10分钟,⽔洗;3)脱⽔、透明、封固、镜检。


(一)过碘酸-希夫氏染色(PAS染色)PAS染色可以显示肾小球内的细胞增生、浸润和系膜基质等,并能很好的显示基底膜,是显示糖原和糖蛋白的基本染色。
1.需要试剂2.具体染色步骤(1)切片常规脱蜡入水。
(2)入1%过碘酸氧化10~15min,水洗。
(3)入schiff氏液染10~30min,水洗。
(4)苏木素染细胞核1~2min,水洗。
(5)入1%盐酸乙醇分化数秒,水洗。
(6)氨水返蓝数秒,水洗。
(7)流水冲洗,镜下观察细胞核成蓝色,基底膜染成粉红色。
(8)梯度乙醇脱水、二甲苯透明、树胶封片。
3.染色结果PAS阳性物质(多糖和糖原)呈红色,核呈蓝色。
4.注意事项(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)S chiff氏液染色的时间需严格控制。
时间过长标本基底膜着色太深,时间过短标本基底膜着色淡。
(3)入1%盐酸乙醇分化时间要短,时间长容易使标本褪色。
(4)染色后的组织切片要将组织四周的污染物痕迹擦掉。
(二)六胺银-马松染色(PAM-Masson染色)PAM-Masson染色能更清晰显示基底膜、免疫复合物和胶原纤维,免疫复合物和胶原纤维,免疫复合物的定位更为准确。
1.需要试剂①1%过碘酸;②六胺银液;③苏木素染液;④氨水;⑤Masson液;⑥1%亮绿液。
2.具体操作步骤(1)切片常规脱蜡入水。
(2)入1%过碘酸氧化10~15min,水洗5min。
(3)入六银胺液72℃染30~50分钟,以显微镜下见基底膜呈黑色即可。
(4)加2%氯化金数滴于组织,5%硫代硫酸钠洗。
(5)苏木素染细胞核1~2min,1%盐酸乙醇分化,氨水返蓝。
(6)入Masson液约10min,1%醋酸洗。
(7)入1%亮绿5~8min,1%醋酸洗。
(8)梯度乙醇脱水,二甲苯透明,树胶封片。
3.染色结果基底膜及系膜基质黑色,免疫复合物红色。
3.注意事项(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)染色时间与室温和切片厚度有关,室温低、切片厚需染色时间长,反则需染色时间短。
特殊染色:阿利新蓝-过碘酸-雪夫(AB-PAS)染色实验
案例
1、临床应用
用于胃标本组织切片的胃粘膜上皮肠化生分类、糖原和粘液物质形态观察前的染色。
主要应
用于胃粘膜上皮化生分类。
在胃粘膜活检时,判别肠化生的类型较之受累程度可能更为重要。
在判别完全或不完全性肠化生时,一般的HE染色即可辩认,但判别是大肠型或小肠型,必
须采用AB、PAS及HID粘液的组化染色。
阿利新蓝染色液(PH2.5)用于显示酸性粘液物质,主要应用于粘液性疾病的鉴别诊断。
PAS过碘酸雪夫氏染色液用于糖原和黏液物质染色,主
要应用于鉴别细胞内的空泡状变性及心肌病变和心血管方面的疾病,还可用于鉴别观察缺血
缺氧早期心肌坏死或梗死区的糖原和糖原累积疾病,糖尿病器官,某些肿瘤的(如:肝细胞瘤、胆管瘤、横纹肌等)诊断及研究。
主要用于糖元、中性粘液的染色。
2、适用范围
适宜于组织的石蜡切片、冰冻切片、火棉胶切片、树脂切片等染色
3、原理方法
阿利新蓝-过碘酸雪夫氏套染法
3、PAS染色液
A试剂(高碘酸) B试剂(Schiff氏试剂)
4、染色方法
切片脱蜡水洗后:
1)AB染色液(阿利新蓝染色液PH2.5)染色5~10分钟,水洗;
2)PAS染色液A试剂(高碘酸)染色5分钟,蒸馏水洗;
3)PAS染色液B试剂(Schiff氏试剂)染色5~10分钟,水洗;
4)脱水、透明、封固、镜检。
结果参考:硫酸化粘液呈黑色,酸性粘液呈兰色,中性粘液呈红色。
5、AB染色液(阿利新蓝染色液PH2.5)做酸性粘液物质染色时操作说明
染色方法:切片脱蜡水洗后:
1)阿利新蓝染色液染色5~10分钟,水洗至无染料脱落;
2)脱水、透明、封固、镜检。
结果参考:酸性粘液物质呈蓝色。
6、PAS染色液(过碘酸雪夫氏染色液)做糖元、中性粘液染色时操作说明
染色方法:切片脱蜡水洗后:
1)高碘酸染色5分钟,蒸馏水洗;
2)Schiff氏试剂染色5~10分钟,水洗;
3)脱水、透明、封固、镜检。
结果参考:糖元、中性粘液物质呈红色。
7、实验操作体会及说明
1)在胃粘膜活检时,判别肠化生的类型较之受累程度可能更为重要。
在判别完全或不完全性肠化生时,一般的HE染色即可辩认,但判别是大肠型或小肠型,必须采用PAS、AB或HID粘液的组化染色。
2)根据肠化生上皮分泌粘液的情况以及其所分泌粘液的性质,将肠化生分为几种:
Ming(1967)将肠化生分为完全型及不完全型。
肠化生的杯状细胞间的柱状上皮可为分化成熟的带刷状缘发育不完全而且胞浆内还可见粘液颗粒称此为不完全型肠化生。
Teglbjaerg(1978)将肠化生细胞分泌乙酰基唾液酸和硫酸粘蛋白及不分泌这类粘蛋白的肠化生分别称之为大肠型肠化生和小肠型化生;Jass(1988)则将肠化生分为Ⅰ型,即类似小肠的完全型肠化生;Ⅱ型肠化生,即杯状细胞间以分泌粘液的细胞的不完全型肠化生,又将杯状细胞含有唾液酸粘液而柱状细胞含中性粘液者称为ⅡA型肠化生,将含硫酸粘液或同时含唾液者称之为ⅡB 型肠化生。
8、部分结果案例。