利用Aspen查询化合物生成焓和计算反应焓变2
- 格式:doc
- 大小:638.50 KB
- 文档页数:9

化学反应的热力学分析和能量转化问题的计算技巧热力学是研究物质在不同温度和压力下的能量转化、能量关系和反应性质的学科。
化学反应的热力学分析是确定反应的进程方向和平衡条件的重要工具。
本文将介绍化学反应的热力学分析以及相关的能量转化问题的计算技巧。
一、热力学基本概念热力学中的基本概念包括能量、焓、熵和自由能。
能量是物质的内在属性,可分为热能和化学能。
焓是指物质的热能与压力之积,用H 表示。
熵是表示物质分子无序程度的物理量,用S表示。
自由能是系统可用能量的度量,用G表示。
二、热力学第一定律热力学第一定律是能量守恒定律,在化学反应中,总能量守恒。
该定律可表达为以下公式:△U = q + w其中,△U表示系统的内能变化,q表示系统吸收或释放的热量,w表示系统对外界做功。
三、热化学方程式和焓变热化学方程式描述了化学反应伴随的热量变化。
焓变(△H)表示化学反应过程中系统的焓变化。
利用热化学方程式,可以通过计算反应前后的焓差来确定焓变。
△H = ∑n△H(生成物) - ∑n△H(反应物)其中,n表示反应物和生成物的摩尔数。
通过查找相应的焓变数据表,可以得到反应物和生成物的焓变值。
四、熵变和自由能变化熵是描述物质分子无序程度的物理量,化学反应可能引起体系的熵变(△S)。
正的△S表示体系的无序程度增加,负的△S表示体系的无序程度减少。
自由能变化(△G)是衡量反应进行方向的指标。
通过△G的正负可以判断反应的推进性质。
当△G<0时,反应是自发推进的;当△G>0时,反应不自发进行;当△G=0时,反应处于平衡状态。
△G = △H - T△S其中,T表示绝对温度。
通过计算反应前后的焓变和熵变,可以得到反应的自由能变化。
五、能量转化问题的计算技巧1. 利用标准生成焓计算反应焓变:首先确定反应涉及的反应物和生成物,查找相应的标准生成焓数据表,然后根据热化学方程式计算反应的焓变。
2. 利用热力学方程式计算热量:通过热力学方程式△U = q + w,计算反应过程中的吸热或放热量。


基于ASPEN PLUS的甲醇和苯烷基化反应热力学分析冯志武;胡博;郭旭青【摘要】利用ASPEN PLUS软件进行了甲醇和苯烷基化过程的热力学研究,计算了非标准状态下的反应焓、反应熵及反应吉布斯自由能变,为该反应体系提供了非标准状态下的热力学依据.研究结果表明,利用ASPEN PLUS软件的纯组分物性分析计算非标准状态的热力学数据可以大大减少人工计算量.甲醇和苯烷基化反应的反应焓变、反应熵变和反应吉布斯自由能变随压力变化不大,温度一定时,该体系中主副反应的热力学数据均可当作常数.该体系的主副反应均为放热反应,反应启动后,可以依靠体系放出的热量维持反应进行.除生成甲苯的反应为熵增反应外,其余反应均为熵减反应.从平衡常数看,该反应体系中乙苯、丙苯、异丙苯、二甲醚等副产物很可能不存在,甲醇作为原料并没有全部参与烷基化反应.【期刊名称】《山西化工》【年(卷),期】2019(039)001【总页数】6页(P16-21)【关键词】甲醇;苯;烷基化;ASPENPLUS【作者】冯志武;胡博;郭旭青【作者单位】阳泉煤业化工集团有限责任公司,山西太原 030021;阳泉煤业化工集团有限责任公司,山西太原 030021;阳泉煤业化工集团有限责任公司,山西太原030021【正文语种】中文【中图分类】TQ626引言甲醇和苯是用途广泛的基础有机化工原料。
近年来,随着煤化工的迅猛发展,我国甲醇和苯的产能迅速增加。
到2017年,我国甲醇产能达到了7 855.5万t,但开工率在50%~60%,纯苯的产能达到了1 250万t/a,而总产量为510.41万t,甲醇和苯的产能严重过剩。
因此,增加甲醇和苯下游衍生物的需求是化解产能过剩的有效途径。
甲醇和苯烷基化反应得到的混合芳烃广泛应用于炼油、乙烯、对二甲苯(PX)、精对苯二甲酸(PTA)、聚酯(PET)、合成纤维、塑料加工等领域,是重要的化工原料,其下游产品广泛应用于高端合成材料、有机原料及各种中间体的制造[1],而我国的混合芳烃主要依赖进口,近年来进口量超过1 000万t。






物性分析方法(Property Analysis)在进行一个流程模拟之前,最好先了解一下你所选物系,以及物系中物质的物性和相平衡关系,对所选体系偏离理想体系的程度有个初步的了解,对所选体系热力计算方法有个初步的认识。
只有这样才能够选择合适的物性计算方法,在得出模拟结果之后,才能保证模拟结果的可信度。
下面做一个CO2/Ar体系物性分析的例子,旨在抛砖引玉,有错误的地方还请读者批评指正。
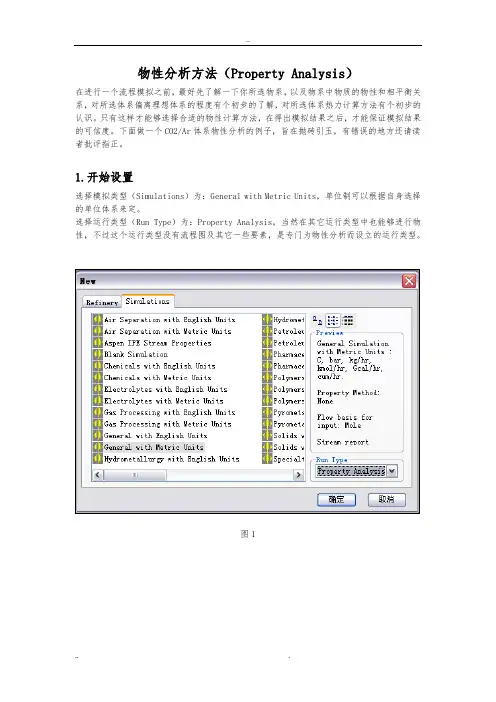
1.开始设置选择模拟类型(Simulations)为:General with Metric Units,单位制可以根据自身选择的单位体系来定。
选择运行类型(Run Type)为:Property Analysis,当然在其它运行类型中也能够进行物性,不过这个运行类型没有流程图及其它一些要素,是专门为物性分析而设立的运行类型。
图12. Setup参数设置设置Setup中的一些参数,如Title,(这里可以不填写,但是最好还是设置一下,可以方便其它用户对你的模拟进行了解,增加其互通性)Unit,Run Type,其中Unit,Run Type 中的设置相当于第一步中的Simulation,Run Type设置,对于前面已经选择的类型在这里可以看到设置的结果如图2。
当然也可以重新设置。
它好处就是,可以很方便的使用户可以在不建立新模拟的情况下,改变单位制及运行类型。
在Description中可以填写对模拟的一些简单描述,可以在报告(.rep)中输出,可以增加其可读性。
其它的一些选项这里就不做介绍了。
图23. 在Component中定义组分在Component ID中输入CO2,AR即可,对于其它一些常用的物质直接输入其名字或分子式就行。
而对于一些结构复杂的物质可以运用Find来查找。
输入后结果如图3。
图3注:Elec Wizard:电解质向导,可以帮助用户输入电解质。
User Defined:输入用户自定义的组分。
Reorder:重新调整输入物质的顺序。
RStoic ——连接RStoicRStoic RStoic ————模型设定模型设定包含操作条件设定和有效相态设定模型设定包含操作条件设定和有效相态设定:1操作条件(O ti C diti )汽1、操作条件(Operation Conditions)(1) 压力;(2) 温度/热负荷2、有效相态(Valid Phases)/ 液/ 固/ 汽-液/ 汽-液-液/ 液-游离水/ 汽-液-游离水RStoic RStoic ————化学反应定义RStoic 中进行的每一个化学反应的编号、化学计量关系、产物生成速率或反应物转化率。
并指明计算多个反应的转化率时是否按照串联反应方式计算。
RStoic RStoic ————反应热设定反应热的计算类型:1、不计算反应热;2、根据生成热计算反应热;3、用户指定反应热。
RStoic RStoic ————选择性选择性定义为:[][]idealrealA P A P A P S ∆∆∆∆=//,△P 代表选定组分(selected)P 的生成摩尔数;△A 代表参照组分(reference)A 的消耗摩尔数;real 代表反应器内的实际情况;ideal 代表只有A →P 一个反应发生时的情况。
RStoic RStoic ——示例示例((1)甲烷与水蒸汽在镍催化剂下的转化反应为:4H CO O 2H CH +↔+2224原料气中甲烷与水蒸汽的摩尔比为1:4,流量为100 kmol/hr 。
若反应在恒压及等温条件下进行,系统总压为0.1013 MPa ,温度为750 ℃,当反应器出口处CH 4转化率为73%时,CO 2和H 2的产量是多少?反应热负荷是多少?RStoic RStoic ——示例示例((2)反应和原料同示例(1),若反应在恒压及绝热条件下进行,系统总压为0.1013 MPa ,反应器进口温度为950 ℃,当反应器出口处CH 4转化率为73%时,反应器出口温度是多少?——连接RYield ——RYieldREquil REquil ————模型设定模型设定包含操作条件设定和有效相态设定模型设定包含操作条件设定和有效相态设定:1操作条件(O ti C diti )汽1、操作条件(Operation Conditions)(1) 压力;(2) 温度/热负荷2、有效相态(Valid Phases)/ 液/ 固/ 汽-液/ 汽-液-液/ 液-游离水/ 汽-液-游离水REquil REquil ————化学反应定义REquil 中进行的每一个化学反应的编号化学计量关系产物生成比速率比速率=速率/化学计量系数的编号、化学计量关系、产物生成比速率(Extend)或趋近平衡温度(Temperature Approach)。
ASPEN PLUS 基本输入报告人:宋维仁导师:漆志文教授华东理工大学联合化学反应工程研究所2010年6月30日星期三1主要内容以回收废水中的DMF(N,N-二甲基甲酰胺,分子式为C3H7NO)为例,来说明建立和运行一个模拟所要求的基本输入。
主要演讲内容包括:Setup 输入建立工艺流程图Components 输入Properties 输入Streams 输入Blocks 输入运行和查看结果2Setup 输入建立工艺流程图Components 输入Properties 输入Streams 输入Blocks 输入运行和查看结果3 Setup : Specifications -Global选择不同的运行类型,其功能也不同。
详情见下一页。
输入标题、报告输入输出单位、运行类型、输入模式、物流类型、有效相态等。
在这里你可以选择是否采用自由水计算。
自由水计算主要用于水-烃系统。
Aspen可以处理作为第二液相的水的存在和倾析。
45运行类型(Run type )Flowsheet 标准ASPEN PLUS 流程运行包括灵敏度研究和优化。
流程运行可以包括物性估算、化验数据分析、和/或物性分析。
Assay Data Analysis 它是一个独立Assay Data Analysis (化验数据分析)和生成虚拟组分的运行。
当你不想在同一个运行中执行流程模拟时,用Assay Data Analysis 来分析化验数据 Data Regression 一个独立运行的Data Regression (数据回归)用Data Regression 把ASPEN PLUS 要求的物性模型参数与已测量纯组分、VLE 、LLE和其它混合数据相拟合。
Data Regression 可以含由物性估值和物性分析计算。
ASPEN PLUS 在Flowsheet 运行中不能执行数据回归PROPERTIES PLUS PROPERTIES PLUS 设臵运行用PROPERTIES PLUS 制备一个物性包,以便用于Aspen Custom Modeler (以前是SPEEDUP) 或 ADVENT 、第三方商业工程程序、或你公司内部程序。