湖北省武汉市高中化学 第三章 金属及其化合物 3.2 几种重要的金属化合物-铝及其化合物限时训练(无答案)
- 格式:doc
- 大小:101.50 KB
- 文档页数:2





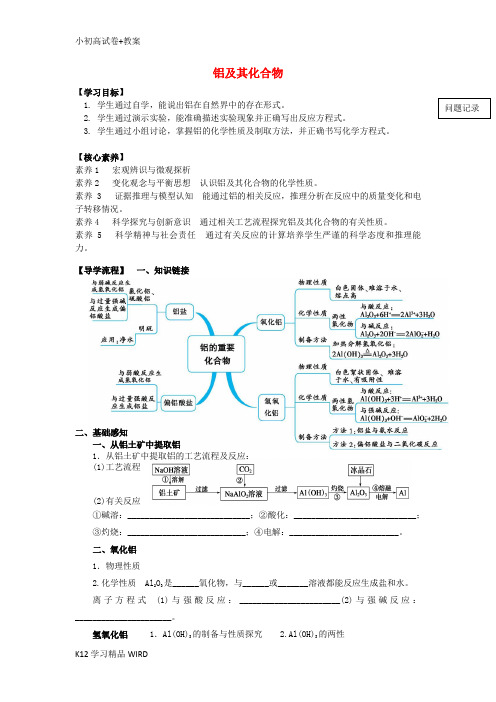
铝及其化合物【学习目标】2. 学生通过演示实验,能准确描述实验现象并正确写出反应方程式。
3. 学生通过小组讨论,掌握铝的化学性质及制取方法,并正确书写化学方程式。
【核心素养】素养1 宏观辨识与微观探析素养2 变化观念与平衡思想认识铝及其化合物的化学性质。
素养3 证据推理与模型认知能通过铝的相关反应,推理分析在反应中的质量变化和电子转移情况。
素养4 科学探究与创新意识通过相关工艺流程探究铝及其化合物的有关性质。
素养 5 科学精神与社会责任通过有关反应的计算培养学生严谨的科学态度和推理能力。
【导学流程】一、知识链接二、基础感知一、从铝土矿中提取铝1.从铝土矿中提取铝的工艺流程及反应:(1)工艺流程(2)有关反应①碱溶:____________________________;②酸化:____________________________;③灼烧:___________________________;④电解:_________________________。
二、氧化铝1.物理性质2.化学性质 Al2O3是______氧化物,与______或_______溶液都能反应生成盐和水。
离子方程式(1)与强酸反应:_______________________(2)与强碱反应:______________________。
氢氧化铝1.Al(OH)3的制备与性质探究 2.Al(OH)3的两性既能跟______溶液起反应,又能跟______溶液起反应,是一种________氢氧化物。
三.深入学习硫酸铝钾课本66页1.KAl(SO4)2的电离方程式为:__________________________________________。
2.十二水合硫酸铝钾的化学式为________________,俗名________,是一种________晶体,____________于水,可用作__________。
铝的性质1.铝与氧气的反应2.铝与HCl溶液的反应(写化学方程式和离子方程式)3.铝与NaOH溶液的反应(写化学方程式和离子方程式)4.钝化常温下,铝或铁遇浓H2SO4、浓HNO3发生________,原因是:________________________。
![【配套K12】[学习]湖北省武汉市高中物理 第三章 金属及其化合物 3.2 几种重要的金属化合物-铝](https://img.taocdn.com/s1/m/b16a66e0da38376baf1fae32.png)
铝三角【学习目标】2. 学生通过演示实验,能准确描述实验现象并正确写出反应方程式。
3. 学生通过小组讨论,掌握铝的化学性质及制取方法,并正确书写化学方程式。
【核心素养】素养1 宏观辨识与微观探析素养2 变化观念与平衡思想认识钠及其化合物的化学性质。
素养3 证据推理与模型认知能通过铝三角,推理分析在反应中的物质变化情况。
素养4 科学探究与创新意识通过实验探究铝盐、偏铝酸盐、氢氧化铝的有关性质。
素养5 科学精神与社会责任通过定量计算培养学生严谨的科学态度和推理能力。
【导学流程】一、知识链接二、基础感知1往AlCl3溶液中逐滴滴加NH3 H2O至过量,观察实验现象记录下来,并写出化学方程式,离子方程式。
2以实验1中沉淀物为反应物,分成两份①往沉淀物上逐滴滴加HCl,观察实验现象记录下来,并写出化学方程式,离子方程式。
(所得溶液用于反应3)②往沉淀物上逐滴滴加NaOH,观察实验现象记录下来,并写出化学方程式,离子方程式。
(所得溶液用于反应4)3往AlCl3溶液中(实验2-①中生成物)逐滴滴加NaOH至过量,观察实验现象记录下来,并写出化学方程式,离子方程式。
4往NaAlO2溶液中(实验2-②中生成物)逐滴滴加HCl至过量,观察实验现象记录下来,并写出化学方程式,离子方程式。
三.深入学习1 向AlCl3溶液中滴加NaOH溶液至过量 2向NaAlO2溶液中滴加盐酸至过量3向含1 mol AlCl3的溶液中加入氨水至过量 4向含1 mol NaAlO2的溶液中通入CO2至过量5 向含MgCl2、AlCl3各1 mol的混合溶液中加入氢氧化钠溶液至过量当堂检测:1.下列离子方程式中,正确的是( )A.铝与稀硫酸反应:Al+2H+===Al3++H2↑B.铝与氢氧化钠溶液反应: 2Al+2OH-+2H2O===2AlO-2+3H2↑C.氢氧化镁与稀盐酸反应:OH-+H+===H2OD.AlCl3溶液与稀氨水混合: Al3++3OH-===Al(OH)3↓2.已知Ba(AlO2)2可溶于水。



教学资料参考范本
【精品】湖北省武汉市高中物理第三章金属及其化合物3-2几种重要的金属化合物-钠及其化合物导学案新人教版必修1
撰写人:__________________
部门:__________________
时间:__________________
【学习目标】
1. 学生通过自学,能正确书写钠与其他物质反应的化学方程式。
2. 学生通过小组实验,能准确描述实验现象并作出合理解释。
3. 学生通过小组讨论,能初步掌握钠的相关化学性质及其在生活中的应用。
【核心素养】
素养1 宏观辨识与微观探析
素养2 变化观念与平衡思想认识钠及其化合物的化学性质。
素养3 证据推理与模型认知能通过钠的相关反应,推理分析在反应中的质量变化和电子转移情况。
素养4 科学探究与创新意识通过实验探究钠的有关性质。
素养5 科学精神与社会责任通过有关反应的计算培养学生严谨的科学态度和推理能力。
【导学流程】
一、知识链接
二、基础感知
第1课时金属钠的性质与应用
一、钠的化学性质 1.钠与氧气的反应
实验操作实验现象实验结论。

第2节几种重要的金属化合物(第3课时)教学目标(1)知识技能①通过实验探究认识+3价和+2价的铁的重要化合物,了解Fe2+、Fe3+的检验方法,培养学生基本实验操作技能、观察和描述实验现象能力;以及由实验现象分析得出结论的能力②通过对灰绿色沉淀成因的分析,使学生认识+2价铁的化合物易被氧化的性质③从氧化还原的角度,认识不同价态的铁的化合物的性质;掌握铁与铁的化合物的相互转化关系。
(2)过程与方法①初步学会从物质分类和氧化还原的角度研究物质性质的方法。
②通过对铁的化合物氧化还原性的预测,初步学会用氧化还原反应理论研究物质氧化还原性。
③通过对铁的化合物氧化还原性的实验探究活动,初步学会通过实验研究物质氧化还原性的思路和方法。
(3)情感态度与价值观①通过对氢氧化亚铁、氢氧化铁的制备的实验探究,培养小组合作意识②通过对铁的化合物性质的学习,让学生体验科学探究成功的喜悦;培养他们的探究意识和善于与他人合作的精神③通过印刷电路板的讨论了解铁的化合物知识在人类生活和生产中的重要作用④创设和谐积极的学习氛围,通过师生、生生之间的多边互动,培养学生乐群,互助合作的人生态度。
三、教学重点(必须掌握的内容)、难点(难于理解、迁移应用困难的内容)1、教学重点Fe(OH)2的性质、Fe2+和Fe3+的检验及相互转化。
2、教学难点:Fe2+和Fe3+的相互转化。
四、主要教学过程【引言】上一节课我们学习了铝及其铝的重要化合物的性质,这节课我们共同学习铁的重要化合物。
【板书】三、铁的重要化合物。
【设问】铁的化合物在生活中有广泛应用,初三也接触过一些,一起来回顾一些例子:细铁丝燃烧、磁铁成分、外墙涂料、补血口服液、天然赤铁矿、磁铁矿、红砖、青砖等图片情景,列举:Fe3O4、Fe2O3、FeSO4等。
【思考】如何从化学角度去学习和认识这些物质呢?(组成物质、价态、类别),并根据化合价,写出铁的氧化物的化学式。
【板书】1、铁的氧化物(1)物理性质:FeO 黑色粉末,不溶于水Fe2O3 暗红色粉末,不溶于水Fe3O4 黑色晶体,不溶于水(2)类别FeO 碱性氧化物Fe2O3 碱性氧化物 Fe3O4复杂氧化物【设问】根据类别,预言它们可能有什么化学性质?【板书】(3)化学性质a、可以与酸反应:【教师】请分别写出FeO、Fe2O3与盐酸反应的离子方程式。

铁及其化合物【学习目标】2. 学生通过演示实验,能准确描述实验现象并正确写出反应方程式。
3. 学生通过小组讨论,掌握铁的化学性质并正确书写化学方程式。
【核心素养】素养1 宏观辨识与微观探析素养2 变化观念与平衡思想认识铁的重要化合物的化学性质。
素养3 证据推理与模型认知具有证据意识,能基于假设进行分析推理并得出正确结论。
素养4 科学探究与创新意识通过氢氧化铁和氢氧化亚铁的制备,探究其性质。
素养5 科学精神与社会责任【导学流程】一、知识链接二、基础感知一、铁的获取1.存在 (1)含量:铁元素在地壳中的含量居第____位。
(2)形态:主要以________形式存在,铁单质只有在_________中存在。
2.铁的冶炼 (1)设备:_______________。
(2)原料:___________、___________、_____________、_____________等。
(3)原理:高温下,用__________把铁从铁矿石中还原出来。
(4)主要反应:①还原剂的生成:________________________,__________________。
②铁矿石的还原:_______________________________________________________。
③炉渣的形成:______________________________,__________________________。
(5)铁合金:含C__________的为生铁,含C____________的为钢。
二.铁的性质及应用(1)物理性质:________色有________光泽的固体,熔点____,具有良好的________性、________性、________性,可以被________吸引。
(2)化学性质:①与非金属单质的反应(如Cl2、O2):________________________________、____________________________________。
铝及其化合物
班级: 姓名: 小组: 分数:
A卷基础题(20分)
1.下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气中还是纯氧中都不会燃烧
2.有关Al与NaOH溶液反应的说法中,正确的是( )
A.Al是还原剂,NaOH及H2O均是氧化剂
B.还原产物是H2,且由H2O还原所得的H2与由NaOH还原所得的H2的量之比为2∶1
C.此反应说明铝具有两性,铝的活泼性比只具有金属性的金属弱
D.此反应中,只有H2O是氧化剂,NaOH既不是氧化剂也不是还原剂
3.小明家收藏了一张清末的铝制佛像,至今保存完好。
其未被锈蚀的主要原因是( ) A.铝不易发生化学反应 B.铝的氧化物易发生还原反应
C.铝不易被氧化 D.铝易被氧化,但氧化铝膜具有保护内部铝的作用
4.除去镁粉中的少量铝粉,可选用的试剂是( )
A.硫酸 B.氨水 C.盐酸 D.氢氧化钠溶液
5.属于铝热反应的是( )
A.Al+HCl B.Al+H2SO4 C.Al+MgO D.Al+MnO2
6.铝分别与足量的稀盐酸和氢氧化钠溶液反应时,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和氢氧化钠的物质的量之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
7.把铝粉和Fe3O4粉末配成铝热剂,并均分成两份。
第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( )
A.1∶1 B.9∶8 C.3∶4 D.4∶3
8.下列化学反应的离子方程式错误的是( )
A.Al(OH)3与盐酸反应:Al(OH)3+3H+===Al3++3H2O
B.Al2O3溶于过量NaOH溶液:Al2O3+2OH-===2AlO-2+H2O
C.铁溶于稀H2SO4中:Fe+2H+===Fe2++H2↑
D.Al(OH)3溶于NaOH溶液:Al(OH)3+3OH-===AlO-2+3H2O
9.为较简便地将溶液中的Mg2+和Al3+分离应加( )
A.盐酸 B.HNO3 C.NaOH溶液 D.水
10.有100 mL 3 mol·L-1的氢氧化钠溶液和100 mL 1 mol·L-1的氯化铝溶液。
按如下两种方法进行实验:
①将氢氧化钠溶液分多次加入到氯化铝溶液中;②将氯化铝溶液分多次加入到氢氧化钠溶液中。
比较两次
实验的结果是( )
A.现象相同,最终沉淀量相等 B.现象不同,最终沉淀量不相等
C.现象相同,最终沉淀量不相等 D.现象不同,最终沉淀量相等
B卷拓展题(60分)
11.把4.6 g钠投入100 mL 0.1 mol·L-1 AlCl3溶液中,待其充分反应后,下列叙述中错误的是( ) A.Cl-浓度不变 B.溶液仍有浑浊
C.溶液中几乎不存在Al3+ D.溶液中存在最多的是Na+
12.有200 mL MgCl2和AlCl3混合溶液,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。
使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A.40 mL B.72 mL C.80 mL D.128 mL
C卷挑战题(20分)
13.向一个铝制易拉罐中充满CO2,然后往罐内注入足量的浓NaOH溶液,立即用胶布密封罐口,不多会儿听到易拉罐“咔咔”作响,发现易拉罐变瘪,再过一会儿又鼓起来。
(1)易拉罐变瘪的原因是__________________________________________________。
(2)易拉罐又鼓起来的原因是______________________________________________。
(3)有关反应的离子方程式为______________________________________________。
14.某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回
答下列问题:
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式: 。
(2)氢氧化钠溶液能否用氨水代替,为什么? 。
(3)溶液a中存在的离子有;在溶液a中加入盐酸时需控制盐酸的量的原因
是。
为此,改进方法是。
15.已知单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转化关系,C为密度最小的气体,甲是一种高熔点的物质,丙在常温下是液体。
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A ;B ;乙。
(2)写出下列反应的化学方程式或离子方程式:
①A与NaOH溶液反应的化学方程式: 。
②甲与NaOH溶液反应的离子方程式: 。