物质怎么分类
- 格式:ppt
- 大小:173.00 KB
- 文档页数:5

化学物质可以按照多种标准进行分类,以下是一些常见的分类标准:
1. 化学元素:最基本的分类是根据元素的不同。
元素是由相同类型的原子组成的,例如氧、氢、碳等。
2. 化合物:化合物是由两种或更多种不同元素以固定比例结合而成的物质。
例如水 H2O)是由氢和氧元素组成的化合物。
3. 混合物: 混合物是由两种或更多种不同的物质混合在一起,但它们没有通过化学反应结合。
混合物可以是均匀混合物 溶液)或非均匀混合物 悬浮物质)。
4. 有机化合物和无机化合物: 这是基于化合物中包含的元素类型的分类。
有机化合物通常包含碳,并且通常与生物体相关,而无机化合物通常不包含碳-碳键。
5. 酸、碱和盐:这是基于化合物的酸性、碱性或中性性质的分类。
酸通常释放质子 H+离子),碱通常释放氢氧根离子 OH-离子),而盐是由酸和碱中的阳离子和阴离子组成的。
6. 物质的聚合状态: 化学物质可以是固体、液体或气体。
例如,水在室温下是液体,而冰是水的固态形式,水蒸气是其气体形式。
7. 有机物的功能团: 在有机化学中,有机物可以根据其分子中的特定功能团进行分类。
例如,醇、醛、酮等。
8. 金属、非金属和过渡金属: 化学元素可以根据其在元素周期表中的位置分为金属、非金属和过渡金属。
9. 同素异形体: 同一种化学元素的不同结构形式被称为同素异形体。
例如,碳的同素异形体包括石墨、金刚石等。
这些是一些常见的分类标准,具体的分类方法取决于研究或应用的需要。

物质的分类并举例
1、元素:元素是由原子组成的化学物质,是构成物质的基本成分,没有可分解的小分子,元素可以组合形成化合物。
常见的元素有氢、氦、锂、铁、钙、铜等。
2、化合物:化合物是由两种或更多元素组成,以特定比例在原子键中化合而成的物质。
它是拥有固定化学式,具有固定物理性质的组分。
常见的化合物有醋酸、氢氧化钠、氯化钾等。
3、复合物:复合物由两种或更多种不同物质通过晶体结构或分子互相结合形成的物质,每一种物质在晶体结构或分子中都有独立的存在特性。
常见的复合物有水、石油和陶瓷等。
4、混合物:混合物是由不同物质混合而成的物质,每一种混入物质在整体结构中都能够独立被辨识,并可以经过收缩或聚焦等物理化学处理程序可以使混合物分离出来。
混合物有有机混合物、无机混合物等,其中常见的有水溶液、铁锈和冰淇淋等。
5、聚合物:聚合物是由一定数量的同类单体构成的大分子物质,它们关系密切,组成大分子结构。
它们有很多特性,例如熔点、气味、折光率等。
常见的聚合物有塑料、纤维素、橡胶等。

物质的组成与分类一、物质的组成1.微观组成:物质由原子、分子、离子等微观粒子组成。
2.宏观组成:物质由元素和化合物组成。
3.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
4.特点:互为同位素,具有独特的物理和化学性质。
5.分类:金属元素、非金属元素、稀有气体元素。
6.定义:化合物是由两种或两种以上不同元素以固定的比例结合成的纯净物。
7.分类:离子化合物、共价化合物。
四、物质的分类1.纯净物:由一种物质组成的物质,分为单质和化合物。
2.混合物:由两种或两种以上的物质混合而成的物质。
3.溶液:均一、稳定的混合物,溶质以分子或离子形式存在于溶剂中。
4.浊液:不均一、不稳定的混合物,分为悬浊液和乳浊液。
5.胶体:均一、稳定的混合物,分散质粒子介于1-100nm之间。
五、物质的性质1.物理性质:不需要发生化学变化就表现出来的性质,如颜色、状态、密度、熔点、沸点等。
2.化学性质:在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性等。
六、物质的鉴别与分析1.鉴别:根据物质的性质差异进行区分。
2.分析:研究物质的组成、结构、性质及变化规律。
七、物质的制取与合成1.制取:通过化学反应或物理方法获取物质。
2.合成:通过化学反应将两种或两种以上的物质结合成新的物质。
八、物质的用途与环境保护1.用途:根据物质的性质将其应用于生产、生活等领域。
2.环境保护:合理利用和保护资源,减少污染物排放,防止环境污染。
综上所述,物质的组成与分类涉及元素、化合物、纯净物、混合物等多种概念,以及物理性质、化学性质、鉴别、分析、制取、合成等方面的知识。
掌握这些知识点有助于我们更好地理解物质世界,为学习化学和其他科学领域奠定基础。
习题及方法:1.习题:区分下列物质中属于纯净物的是?方法:根据纯净物的定义,由一种物质组成的物质属于纯净物。
因此,选项B蒸馏水是由一种物质组成的,属于纯净物。
2.习题:下列哪种物质属于化合物?方法:化合物是由两种或两种以上不同元素以固定的比例结合成的纯净物。

课题物质分类的基本方法教学目标1、掌握对纯净物进行分类的基本方法。
2、能根据物质的组成对纯净物进行分类,并能运用实验的方法,通过对比对物质进行分类。
3、了解金属与非金属不同的性质,了解金属的用途。
重点、难点根据物质的组成对纯净物进行分类,并能运用实验的方法,通过对比对物质进行分类。
考点及考试要求掌握物质分类的基本方法,能根据物质的组成对纯净物进行分类,并能运用实验的方法教学内容知识框架1、物质分类的方法:根据纯净物的颜色、状态、气味、溶解性、可燃性及组成等对物质进行分类。
如对下列七种物质:氯化钠、硫酸、氧气、醋酸、氯气、氧化镁、高锰酸钾,根据分类标准不同可以有不同的分类结果:按颜色分类白色:氯化钠、氧化镁无色:硫酸、氧气、醋酸黄绿色:氯气紫黑色:高锰酸钾按状态分类固态:氯化钠、氧化镁、高锰酸钾液态:硫酸、醋酸气态:氧气、氯气按组成分类单质:氧气、氯气化合物:高锰酸钾、氧化镁、氯化钠、硫酸、醋酸按气味分类有气味的物质:氯气、醋酸无气味的物质:氧气、高锰酸钾、氧化镁、氯化钠、硫酸2、单质和化合物:(1)单质的概念:单质是由同种元素组成的纯净物。
说明:①单质必须是纯净物,两者是从属关系,即单质概念小,纯净物概念大。
②单质必须是由同一种元素组成。
③一种元素可以组成多种单质,如氧气(O2)和臭氧(O3),两者混在一起不是单质而是混合物,除此之外还有红磷和白磷、金刚石和石墨等。
④单质的分类:根据单质的性质不同,单质可分为金属单质和非金属单质。
(2)化合物的概念:化合物是由不同种元素组成的纯净物。
(3)列表对比化合物和单质的区别与联系:单质化合物宏观组成同种元素不同种元素微观构成同种原子或由同种原子构成的分子由不同种原子构成的同一种分子化学性质不能发生分解反应一定条件下能发生分解反应联系它们均属于纯净物,单质之间发生化合反应可以生成化合物,化合物发生分解反应可以生成单质。
3、氧化物:(1)概念:由两种元素组成,其中一种是氧元素的化合物称为氧化物。

物质的分类知识点总结一、物质的基本概念物质是构成万物的基本要素,是宇宙中自然存在的一切实体的总称,是占据一定空间,有一定质量的任何事物的总称,是构成一切物体的基本成分。
物质是由微观粒子组成的,包括原子、分子等微粒。
物质是具有一定质量、占据一定空间、具有可观察性和可度量性的,是人们认识和利用的客观存在。
物质性质是物质的固有属性,成为物质被认识的依据。
物质的三态:固、液、气。
物质的基本概念包括物质的组成、性质和分类。
二、物质的组成1.原子原子是构成一切物质的基本微粒,是化学元素的最小单位,化学反应中不会分解的微粒。
原子是由质子、中子和电子组成。
2.分子分子是原子按照一定比例结合而成的,分子的组成是由原子组成的。
分子在化学反应中会发生改变,化学反应中发生的都是分子的变化。
分子的构成有原子殊,分子中原子的种类与比例确定了分子的性质。
3.离子离子是由失去或者获得电子而具有电荷的粒子,可以是单个原子,也可以是分子,称为单一离子,或者多个原子或分子部分组成的有电荷的团体,称为复合离子。
离子在水溶液中自由移动,具有导电性和电化学反应性。
三、物质的性质1.物质的物理性质物质的物理性质是指不改变物质本质情况下,其所具有的固有性质,可以通过物理方法进行观察和度量。
物质的物理性质包括:颜色、气味、密度、熔点、沸点、导电性、磁性等。
2.物质的化学性质物质的化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
物质的化学性质是通过化学反应和实验才能得以确认。
物质的化学性质包括:与其他物质发生反应、氧化还原性、酸碱性、水解性等。
3.物质的结构性质物质的结构性质是指物质内部微观结构和组成的性质。
物质的结构性质决定了物质的各种物理和化学性质。
物质的结构性质包括:原子和分子的结构、离子的组合方式等。
四、物质的分类1.物质的分类方法物质的分类可以通过不同的角度和属性来进行分类,包括化学性质、物理性质、组成结构等方面的分类。
物质的分类方法包括:按组成结构分类、按化学性质分类、按物理性质分类等。
物质的分类和性质我们生活在一个丰富多彩的世界,在这个世界上,有许多我们感兴趣的事物,我们也在不断地研究者这个世界。
研究着与我们的生存和生活有关的物质。
为了更好地了解这些物质,我们就必须对这些物质进行一定的分类,认识这些物质间存在的联系,最后才能为我们认识世界提供帮助。
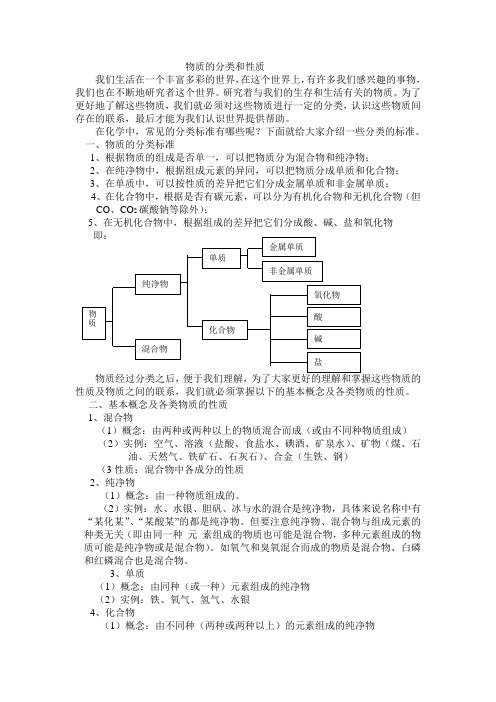
在化学中,常见的分类标准有哪些呢?下面就给大家介绍一些分类的标准。
一、物质的分类标准1、根据物质的组成是否单一,可以把物质分为混合物和纯净物;2、在纯净物中,根据组成元素的异同,可以把物质分成单质和化合物;3、在单质中,可以按性质的差异把它们分成金属单质和非金属单质;4、在化合物中,根据是否有碳元素,可以分为有机化合物和无机化合物(但CO、CO2碳酸钠等除外);5、在无机化合物中,根据组成的差异把它们分成酸、碱、盐和氧化物性质及物质之间的联系,我们就必须掌握以下的基本概念及各类物质的性质。
二、基本概念及各类物质的性质1、混合物(1)概念:由两种或两种以上的物质混合而成(或由不同种物质组成)(2)实例:空气、溶液(盐酸、食盐水、碘酒、矿泉水)、矿物(煤、石油、天然气、铁矿石、石灰石)、合金(生铁、钢)(3性质:混合物中各成分的性质2、纯净物(1)概念:由一种物质组成的。
(2)实例:水、水银、胆矾、冰与水的混合是纯净物,具体来说名称中有“某化某”、“某酸某”的都是纯净物。
但要注意纯净物、混合物与组成元素的种类无关(即由同一种元素组成的物质也可能是混合物,多种元素组成的物质可能是纯净物或是混合物)。
如氧气和臭氧混合而成的物质是混合物、白磷和红磷混合也是混合物。
3、单质(1)概念:由同种(或一种)元素组成的纯净物(2)实例:铁、氧气、氢气、水银4、化合物(1)概念:由不同种(两种或两种以上)的元素组成的纯净物(2)实例:氢氧化钠、碳酸钙、硝酸钾,氯化镁5 氧化物(1)概念:由两种元素组成且其中一种是氧元素的化合物(2(3)6 (1)概念:跟碱反应生成盐和水的氧化物 ,如CO 2 、SO 2、SO 3、SiO 2 。

物质可以通过何种方式进行分类?一、按物质的组成分类1.元素:元素是物质的基本单位,由相同类型的原子组成。
所有元素都具有独特的原子序数和特性,如金属元素、非金属元素和惰性元素等。
2.化合物:化合物由两种或更多不同元素的原子结合而成。
化合物具有不同于其组成元素的独特化学性质,如氧化物、硫化物和盐等。
二、按物质的状态分类1.固体:固体物质的分子或原子保持紧密结合,具有固定的形状和体积。
固体物质可进一步分类为晶体、非晶体和多晶体。
2.液体:液体物质的分子或原子之间的结合较弱,具有流动性和固定的体积。
液体物质的分子以不规则的方式堆积。
3.气体:气体物质的分子或原子之间的结合非常弱,它们以高速运动的自由状态存在,各自占据着容器内的空间。
三、按物质的性质分类1.有机物:有机物是指由碳和氢等非金属元素组成的化合物。
它们通常存在于生物体内,如脂肪、蛋白质和糖类等。
2.无机物:无机物是指除了碳和氢之外的元素组成的化合物。
无机物可以是金属和非金属元素的化合物,如金属氧化物和酸等。
四、按物质的来源分类1.天然物质:天然物质是自然界存在的物质,如矿石、岩石和水等。
天然物质大多未经过人为处理或改变。
2.人工合成物质:人工合成物质是人类通过实验室或工业方法合成出来的物质,如合成药物、材料和化学品等。
三、按物质的用途分类1.食物:食物是人们日常所需的营养来源,如谷物、蔬菜、水果和肉类等。
2.药物:药物是用于预防疾病、治疗疾病或缓解症状的化学物质,如抗生素、止痛药和维生素等。
3.材料:材料是用于建筑、制造和制造其他产品的物质,如金属、塑料和纺织品等。
4.能源:能源是人类社会运转所需的物质,如燃料、电力和太阳能等。
总结:物质可以通过其组成、状态、性质、来源和用途等多种方式进行分类。
这些分类方法有助于我们更好地理解和研究不同类型的物质,及其在社会生活和工业发展中的应用和意义。

物质分类混和物(含多种组分(即多种纯净物),没有固定的组成,没有固定的熔点和沸点。
金属单质物质单质非金属单质纯净物(含一种组分)有机化合物氢化物化合物氧化物无机化合物酸碱盐从宏观组成分析:物质——————元素(只论种类不论个数)聚集总称从微观结构分析:分子——————原子(既论种类又论个数)表述物质的组成时,必须是宏观对宏观,微观对微观。
如:硫酸是由氢元素、硫元素和氧元素组成的。
(宏观组成观点)一个硫酸分子是由二个氢原子、一个硫原子和四个氧原子组成的。
(微观结构观点)一、元素(一)定义:具有相同核电荷数(质子数)的一类原子(含简单离子)的总称(二)分类:金属元素:名称符号非金属元素:氢,硼,碳、硅,氮、磷、砷,氧、硫、硒、碲,氟、氯、溴、碘、砹,氦、氖、氩、氪、氙、氡。
写出1—20号元素的名称和符号:二、单质(一)定义:(二)分类金属单质:和。
和。
单原子分子:双原子分子:三原子分子:非金属单质四原子分子:多原子复杂分子:原子晶体:三、化合物1.定义:。
2.化合物的化学式书写规则:化合价交叉相约(先相约后交叉)(一)氧化物1.定义:。
2.分类(1)根据组成元素的种类来分金属氧化物:。
非金属氧化物:。
过氧化物(含过氧根:O22—):过氧化钾、过氧化钠、过氧化钙、过氧化氢(俗称双氧水)化学式:、、、。
(2)根据性质来分:碱性氧化物成盐氧化物两性氧化物氧化物酸性氧化物不成盐氧化物。
化学通性1.碱性氧化物+水→(可溶性)碱碱性氧化物2.碱性氧化物+酸→盐+水3.碱性氧化物+酸性氧化物→含氧酸盐1.酸性氧化物+水→含氧酸酸性氧化物2.酸性氧化物+碱→盐+水3.酸性氧化物+碱性氧化物→含氧酸盐(二)氢化物1.定义:。
2.分类离子型氢化物(固态)NaH、KH、CaH2。
氢化物共价型氢化物(气态)(三)酸1.定义:电离时生成的阳离子全部是H+的一类化合物叫做酸。
(二)分类:无氧酸含氧酸一元酸酸二元酸三元酸命名氢某酸某酸高正亚次正偏HClO4HClO3HClO2HClO H3PO4HPO3(1)根据电离时产生H+的程度强酸酸中强酸弱酸。

第1节物质的分类知识回顾在化学学习过程中,对于数以千万计的化学物质和为数更多的化学反应,常常要用到分类法,利用分类法学习化学,可以起到事半功倍的效果。
人们常按物质的组成、结构、性质等知识将物质进行分类。
分类标准可以从物质的组成、结构和性质去确定。
1.物质简单分类如下:2材料又可分为天然高分子材料和合成高分子材料,塑料、纤维和橡胶都属于合成高分子材料。
例1 物质的分类标准有多种,标准可以是物质的组成、性质、用途……请根据所学知识,依据物质所具有的某种性质,自拟两种分类标准,对以下物质进行分类,每类至少包括三种物质(填化学式)氢气、氧气、一氧化碳、二氧化硫、二氧化氮(红棕色、有毒)、水、碳。
分类标准一,包括物质分类标准二,包括物质例2请你仔细研读下列表格中的例子:现其他的规律:(1)(2)例3 生活中的下列物质,属于合成纤维的是()A.棉花B.涤纶C.羊毛D.蚕丝入门衔接一、按物质种类分类分类方法:树状分类法:如化合物分为氧化物、酸、碱、盐。
1.氧化物根据氧化物对酸碱反应的不同,可以将氧化物分为酸性氧化物、碱性氧化物、两性氧化物不成盐氧化物四类。
(1)酸性氧化物(又称酸酐):能与碱反应生成盐和水的氧化物,如2CO 、2SO 、3SO ,其对应的酸分别是32CO H 、32SO H 、42SO H 。
(2)碱性氧化物:能与酸反应生成盐和水的氧化物,如O Na 2、MgO 、CaO ,其对应的碱分别为NaOH 、2)(OH Mg 、2)(OH Ca(3)两性氧化物:既能与酸又能与碱反应生成盐和水的氧化物,如32O Al 、2)(OH ZnO H AlCl HCl OH Al 23333)(+=+ 23)(N a A l O N a O H OH Al =+(偏铝酸钠)+ O H 22(4)不成盐氧化物:既不能与酸、又不能与碱反应生成盐和水的氧化物,如CO 、NO 。
说明:不是所有的非金属氧化物都是酸性氧化物,如CO 、NO 等;也不是所有的酸性氧化物都是非金属氧化物,如72O Mn 是酸性氧化物,但所有的碱性氧化物都是金属氧化物。

物质分类依据1. 引言物质分类是科学研究和日常生活中常见的一个问题。
通过对物质进行分类,可以更好地认识和理解物质的性质、结构和功能。
物质分类的依据可以是多样的,包括物质的组成、性质、来源等方面。
本文将介绍一些常见的物质分类依据,并探讨其背后的科学原理和应用。
2. 物质分类的基本原则物质分类的基本原则是根据物质的特征和性质进行分类。
根据物质的组成,可以将物质分为单质和化合物;根据物质的性质,可以将物质分为固体、液体和气体等;根据物质的来源,可以将物质分为天然物质和人工合成物质等。
下面将详细介绍这些物质分类依据。
2.1 根据组成分类2.1.1 单质单质是指由同一种元素组成的物质。
元素是构成物质的基本单位,具有独特的化学性质。
常见的单质有金属元素(如铁、铜、铝等)、非金属元素(如氧、氢、氮等)和半金属元素(如硅、锗等)。
单质可以进一步分为金属、非金属和半金属。
金属是一类具有良好的导电、导热和延展性的物质,常见的金属有铁、铜、铝等。
非金属是一类通常不具有良好导电、导热性能的物质,常见的非金属有氧、氢、氮等。
半金属是介于金属和非金属之间的一类物质,具有一些金属和非金属的性质,常见的半金属有硅、锗等。
2.1.2 化合物化合物是由两种或更多种元素按照一定的比例结合而成的物质。
化合物具有与组成元素不同的性质和组成。
常见的化合物有水(H2O)、二氧化碳(CO2)等。
化合物可以进一步分为无机化合物和有机化合物。
无机化合物是由无机元素组成的化合物,如氯化钠(NaCl)、硫酸铜(CuSO4)等。
有机化合物是由碳元素和其他元素组成的化合物,如甲烷(CH4)、乙醇(C2H5OH)等。
有机化合物通常与生命活动密切相关。
2.2 根据性质分类根据物质的性质,可以将物质分为固体、液体和气体。
2.2.1 固体固体是一种具有一定形状和体积的物质,其分子或原子间有着较强的相互作用力。
固体的分子或原子通常排列有序,具有固定的结构和形状。
常见的固体有金属、石英、冰等。

物质的性质及分类一、引言物质是构成我们周围世界的基本单位,它们具有丰富多样的性质。
本文旨在探讨物质的性质以及它们的分类方法。
二、物质的性质1.物理性质物理性质是指不改变物质本质的性质,包括颜色、形状、质量、密度、熔点、沸点等。
举例来说,铁块是黑色的、具有固定的形状和质量,在常温下是固体状态。
2.化学性质化学性质是指物质参与化学反应时发生的变化。
例如,氧气与氢气在适当条件下反应会产生水,这是氧气和水的化学性质。
3.物质的特性物质的特性是指每种物质独特的性质,可以用于区分其他物质。
这包括某些物质的颜色、味道、气味等。
例如,黄色的硫磺具有独特的硫黄味。
三、物质的分类方法1.纯物质和混合物纯物质是由相同种类的物质组成,其成分相对固定,可以进一步分为元素和化合物。
元素是由相同类型的原子组成,化合物由不同类型的原子以一定比例结合而成。
与此相反,混合物是由不同种类的物质混合而成,成分相对可变。
2.元素的分类元素可按照物理性质或化学性质进行分类。
根据物理性质,元素可分为金属、非金属和半金属。
金属具有良好的导电性、导热性和延展性,如铁、铜等。
非金属通常没有良好的导电性、导热性和延展性,如氧、氮等。
半金属的性质介于金属和非金属之间,如硅。
3.化合物的分类化合物可根据化学组成和实验性质进行分类。
化学组成指的是化合物的元素所组成的组合,例如水(H2O)由氢和氧组成。
实验性质是指化合物在实验条件下表现出的性质,例如硫酸(H2SO4)具有腐蚀性。
4.混合物的分类混合物可按照物理性质进行分类。
根据各组分的颗粒大小和相对比例,混合物可分为溶液、胶体和悬浮液。
溶液是由溶质溶解于溶剂而形成的透明体系,如盐水。
胶体是由颗粒在溶液中悬浮而形成的,如牛奶。
悬浮液是由固体颗粒悬浮于液体中而形成的不透明体系,如石灰水。
四、结论物质的性质及其分类的了解有助于我们认识世界和深入研究科学。
通过研究物质的性质,我们可以更好地理解物质之间的相互作用和变化规律,为实际应用和科学研究提供指导。

物质的分类一、单质与化合物:1、概念:①、单质:由 元素组成的纯净物 例:氢气(H 2)、氧气(O 2)、红磷(P)等;②、化合物:由 元素组成的纯净物 例:水(H 2O)、高锰酸钾(KMnO 4)等;③、氧化物:由 元素组成,且含有 元素的纯净物 例:二氧化硫(SO 2)、 氧化铁(Fe 2O 3)、水(H 2O)等。
注意:单质、化合物前提必须是 ,即划分单质、化合物的标准是根据纯净物的元素种类来划分的。
若只含 元素的纯净物就属于单质;若含有 元素的纯净物就属于化合物。
2、单质与化合物的微观构成:单质由 直接构成或单质的分子由 原子构成 分子;化合物的分子由 原子构成 分子。
【练习】如右图所示:(以下填序号)(1)、表示纯净物的是: ;(2)、表示混合物的是: ;(3)、表示由原子直接构成的是: ;(4)、表示单质的是: ; (5)、表示化合物的是: ;3、物质分类的步骤:①、根据物质种类分为纯净物与混合物; ②、写出纯净物的化学符号;③、根据元素种类将纯净物分为单质与化合物; ④、在化合物中根据氧化物的概念找出氧化物。
二、物质的组成、构成及分类:组成(宏观):物质(纯净物)由 组成。
原子:金属、稀有气体、碳、硅等。
构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N 2、Cl 2。
物质 (微观) 离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +)氯离子(Cl -)构成混合物(多种物质)分类 单质:金属、非金属、稀有气体纯净物 (一种元素)(一种物质) 化合物:有机化合物: CH 4、C 2H 5OH 、C 6H 12O 6、淀粉、蛋白质(多种元素) 氧化物 H 2O CuO CO 2无机化合物 酸 HCl H 2SO 4 HNO 3碱 NaOH Ca(OH)2三、区别及例题:[提醒大家注意]1.含氧化合物与氧化物(只含2种元素):属于含氧化合物,但不是含氧化合物是指含有氧元素的化合物,它不一定是氧化物。


