2018年上海市青浦区高考二模化学-精校版(含答案)
- 格式:doc
- 大小:244.50 KB
- 文档页数:7

青浦区2017学年高三年级第二次学业质量调研测试化学学科试卷2018.04相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH3COOHƒCH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2OƒHS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A.苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B.乙烯和苯都能与H 2 发生加成反应,说明二者均含有碳碳双键C.乙醇、乙酸均能与Na 反应放出H 2 ,二者分子中官能团相同D.乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L-1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH-石墨食盐溶液铁棒C.石墨上有Cl 2 放出D. 铁棒上有H 2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照 2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B ƒ2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3-→ H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。
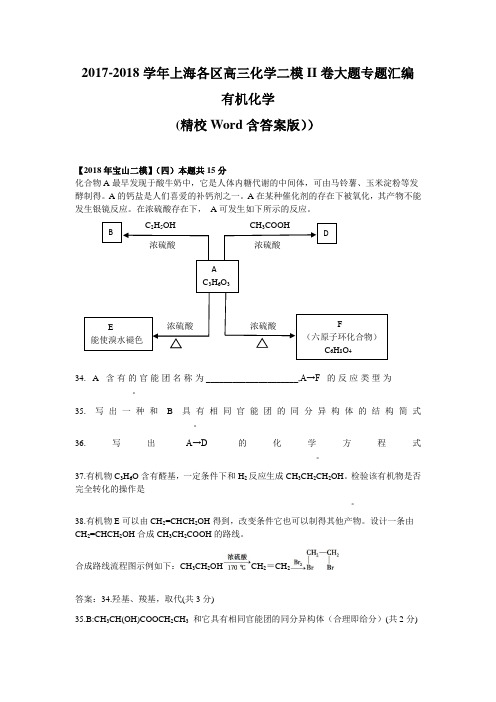
B DAC3H6O3E能使溴水褪色F(六原子环化合物)C6H8O42017-2018学年上海各区高三化学二模II卷大题专题汇编有机化学(精校Word含答案版))【2018年宝山二模】(四)本题共15分化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。
A的钙盐是人们喜爱的补钙剂之一。
A在某种催化剂的存在下被氧化,其产物不能发生银镜反应。
在浓硫酸存在下,A可发生如下所示的反应。
C2H5OH CH3COOH浓硫酸浓硫酸浓硫酸浓硫酸34. A含有的官能团名称为_____________________,A→F的反应类型为____-_____________。
35. 写出一种和B具有相同官能团的同分异构体的结构简式___________________________。
36.写出A→D的化学方程式_______________________________________________________。
37.有机物C3H6O含有醛基,一定条件下和H2反应生成CH3CH2CH2OH。
检验该有机物是否完全转化的操作是_______________________________________________________________。
38.有机物E可以由CH2=CHCH2OH得到,改变条件它也可以制得其他产物。
设计一条由CH2=CHCH2OH合成CH3CH2COOH的路线。
合成路线流程图示例如下:CH3CH2OH CH2=CH2答案:34.羟基、羧基,取代(共3分)35.B:CH3CH(OH)COOCH2CH3和它具有相同官能团的同分异构体(合理即给分)(共2分)浓硫酸36. CH3CH(OH)COOH+CH3COOH →CH3CH(COOH)OOCCH3+H2O (共3分)37.取样,加入新制氢氧化铜,煮沸,观察是否有砖红色沉淀生成,若有砖红色沉淀生成,则未全部转化;若没有砖红色沉淀生成,则已全部转化。

2018年上海各区化学等级考二模试题分类汇编 -非金属及其化合物【2018年上海长宁区二模】1. SO 2排放会导致的主要环境问题是( ) A. 酸雨B.温室效应C.臭氧空洞D.光化学烟雾【答案】A【2018年上海长宁区二模】3.下列关于次氯酸(HCIO )的判断正确的是( )A.见光易分解B.很稳定C.是强酸D.呈黄绿色【答案】A【2018年上海长宁区二模】6.下列各组气体通常条件下不能相互发生化学反应的是( )A. SO 和 H 2SB.CI 2和 COC. H 2和 F 2D. NH s 和 HCI【答案】B【2018年上海长宁区二模】18. H 2S 分子结构和H 2O 相似,但S-H 键键能比O-H 键键能低。
下列判断错误的是( )A. H 2S 分子呈折线型B. H 2S 分子是极性分子C. H 2S 沸点低于HaO,因为S-H 键键能低 D . H 2S 分子稳定性低于分子【答案】C【2018年上海长宁区二模】20.只用下列一种物质不能鉴别① CCI 4、②Nal 溶液、③Na t SO 溶液三者的是( )A.溴水 B .硫酸溶液C . BaCl 2溶液D.淀粉溶液【答案】D【2018年上海杨浦区二模】4.右图喷泉实验的现象与下列性质无关的是()【答案】DA.氨易溶于水B. 氨能与水反应C.氨水显碱性D. 氨易液化【2018年上海杨浦区二模】 9.属于人工固氮的是(A. 4NH+5Q 4NO+6HOB. 2NO+O22NO2hi- -IC.2NH32N2+3H2D. Nk+C 二"『戸d 2NO 【答案】C【2018年上海杨浦区二模】 (三)(本题共15分)实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I.碘含量的测定干海带①灼烧|片②浸泡|海带灰|③过滤「含厂|④转移 定容 20〕00g ----- |海带灰| ------ * |悬浊液| |的溶液| 仪器30. 步骤①是将海带置于 _____________ 中(填仪器名称)进行灼烧。

2018年上海各区化学等级考二模试题分类汇编-物质制备【2018年上海市长宁区二模】11. 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。
下列对该实验的描述错误的是()A.不能用水浴加热B.长玻璃管起冷凝回流作用C.为提纯乙酸丁酯,可用水和碳酸钠溶液洗涤D.通常加入过量1-丁醇以提高乙酸的转化率【答案】D【2018年上海市长宁区二模】(三)(本题共15分)无水MgBr2可广泛用于有机反应催化剂、污水处理剂等。
实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:29.识别下图中仪器。
A的名称是____________,B是。
30.实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
干燥的氮气能将液溴吹出,因为液溴具有的性质;实验中不能用干燥空气代替干燥N2,原因是:。
31.已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。
MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
第一次过滤除去的物质是___________。
过滤必须用到的玻璃仪器是:。
32.试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:。
33.为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-====Mg Y2-①滴定前润洗滴定管的操作方法是。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是____________(以质量分数表示)。
【答案】(三)本题共15分29.(每空1分,共2分)干燥管冷凝管30.(共3分)极易挥发。

一、选择题1.(2018青浦二模01)生活中的下列变化,属于物理变化的是A.植物的光合作用B.燃放烟花C.灯泡发光D.蜡烛燃烧2.(2018青浦二模02)下列物质的主要成分属于氧化物的是A.钻石(C)B.水晶(SiO2)C.食盐(NaCl)D.钟乳石(CaCO3)3.(2018青浦二模03)下列物质放入水中,能形成溶液的是A.白糖B.牛奶C.植物油D.面粉4.(2018青浦二模04)每年5月31日为世界无烟日。
吸烟有害健康,烟气中的一种有毒气体是A.O2B.N2C.COD.CO25.(2018青浦二模05)自来水生产过程中,通入氯气的目的是A.除去易挥发的杂质B.消毒杀菌C.沉降泥沙D.吸附悬浮物6.(2018青浦二模06)下列物质中,既含有游离态氧元素又含有化合态氧元素的是A.氧化镁B.碳酸C.氧气D.空气7.(2018青浦二模07)臭氧主要分布在距地面10~50km的高空,它能吸收大部分紫外线,保护地球生物。
臭氧属于A.单质B.混合物C.氧化物D.稀有气体8.(2018青浦二模08)Al2O3中Al的化合价是A.+3B.+2C.-2D.-39.(2018青浦二模09)下图是地壳中各元素的含量(质量分数)图,地壳中含量最多的金属元素是A.氧B.硅C.铝D.铁10.(2018青浦二模10)化学物质给生活带来了极大的便利,也使我们的生活变得丰富多彩。
下列物质有关应用错误的是A.金刚石:用于切割玻璃B.明矾:用于净水C.烧碱:用于食用碱D.氯化钠:用于配制生理盐水11.(2018青浦二模11)下图所示的情况中,铁钉最容易生锈的是12.(2018青浦二模12)属于同素异形体的一组物质是A.氧气和液氧B.水和双氧水C.一氧化碳和二氧化碳D.金刚石和石墨13.(2018青浦二模13)根据反应3NO2+H2O→2HNO3+X,推断X的化学式为A.N2B.NOC.NH3D.N2O514.(2018青浦二模14)下列物质的用途错误的是A.干冰:人工降雨B.氮气:用作保护气C.稀有气体:制作霓虹灯D.氧气:光合作用的原料15.(2018青浦二模15)下列物质露置于空气中,一段时间后,总质量减小的是A.碳酸钙B.氯化钠C.氢氧化钠D.浓盐酸16.(2018青浦二模16)配制50g溶质的质量分数为10%的氯化钠溶液,不需要的仪器是A.铁架台B.烧杯C.量筒D.电子天平17.(2018青浦二模17)固体碘受热升华,下列关于此过程的说法正确的是A.碘分子间的间隔变大B.碘分子质量变大C.碘分子体积变小D.碘分子运动速率不变18.(2018青浦二模18)下列实验操作中,正确的是实验操作正确的是19.(2018青浦二模19)压轴题下列各组物质仅用稀硫酸不能完全区分开的是A.镁粉、氧化铜粉、木炭粉B.NaOH溶液、Ba(OH)2溶液、KOH溶液C.铝片、铁片、银片D.Na2CO3溶液、NaCl溶液、BaCl2溶液20.(2018青浦二模20)压轴题两个烧杯中装有等质量的金属锌和镁,分别逐滴滴加同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。

青浦区2017学年高三年级第二次学业质量调研测试化学学科 试卷 2018.04相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A .2─甲基戊烷B .3─乙基戊烷C .3,4─二甲基戊烷D .3─甲基己烷 5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A .氯气B .二氧化碳C .氯化钾D .醋酸钠6.下列变化过程中Q >0的是A.CH 3COOH CH 3COO -+ H + + Q B. CaCO 3(s )→ CaO (s )+ CO 2(g )+ QC.S 2- + H 2O HS - + OH - + QD.S (g )→S (l )+ Q7.下列有关有机物结构、性质的分析正确的是A .苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B .乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键C .乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同D .乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L -1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH -C.石墨上有Cl 2 放出D. 铁棒上有H 2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照 2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3-→ H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。

浦东新区2017学年度第二学期教学质量检测高三化学试卷考生注意:1.试卷满分100分,考试时间60分钟。
2.本考试分设试卷和答题纸,试卷包括两部分,第一部分为选择题,第二部分为综合题。
3.答题前,考生务必在答题纸上填写姓名、学校、准考证号,并将核对后的条形码贴在指定位置上。
作答必须涂或写在答题纸上,在试卷上作答一律不得分。
第一部分的作答必须涂在答题纸上相应的区域。
第二部分的作答必须写在答题纸上与试卷题号对应的位置。
相对原子质量:C-12 O-16 K-39一、选择题(共40分,每小题2分,每小题只有一个正确答案)1.合金在生产生活中具有广泛的用途。
不属于合金的是A.明矾B.硬铝C.生铁D.青铜2.12C和13C原子之间,相等的是A.原子质量B.中子数C.质量数D.电子数3.含有共价键的离子晶体是A.H2SO4 B.KOH C.MgCl2D.Na2O 4.硫化氢能与二氧化硫反应,说明硫化氢具有A.还原性B.氧化性C.酸性D.不稳定性5.化学反应中的能量变化符合右图所示的是A.甲烷燃烧B.碳酸钙高温分解C.电石与水反应D.酸碱中和生成物总能量反应物总能量高三化学试卷第1页共6页高三化学试卷 第2页 共6页6.铁在一定条件下与下列物质发生的反应,不属于置换反应的是A .水B .稀盐酸C .硫粉D .硫酸铜7.氮是植物生长的必需元素。
有关说法中错误的是A .氮气分子很稳定B .氨气是极性分子C .尿素属于铵态氮肥D .闪电实现了大气固氮8.有关Al 2O 3的叙述正确的是 A .可用于净水B .是碱性氧化物C .可与水化合成Al(OH)3D .可通过铝热反应生成9.下列物质中能使酸性高锰酸钾溶液褪色的是A .溴乙烷B .乙酸乙酯C .甲烷D .乙炔10.物质之间发生化学反应时,一定发生变化的是 A .总物质的量B .原子个数C .化学键D. 化合价11.测定胆矾晶体中结晶水含量的实验中,有关操作所用仪器错误的是ABCD12.有关水的表述正确的是A .电子式为H +O ........-H ][B .是直线型分子C .是非电解质D .可以作氧化剂13.能证明乙酸是弱酸的是 A .乙酸钠溶液pH >7B .乙酸溶液能导电C .乙酸溶液能使石蕊变红D .乙酸溶液易挥发14.氧和硫是同主族元素,下列事实不能说明氧的非金属性比硫强的是 A .酸性:H 2S >H 2O B .热稳定性:H 2O >H 2SC .原子半径:S >OD .化合价:SO 2中S 为正价高三化学试卷 第3页 共6页15.海水提溴和海带提碘都需要经过浓缩、氧化、提取三个步骤。

2018年上海市青浦区高三二模化学试卷(精校版Word版含答案)(时间60分钟满分100分)Q2018.04 相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH3COOHƒCH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2OƒHS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A .苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B .乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键C .乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同D .乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L -1的食盐溶液中(如右图所示),下列说法正确的是 A.铁棒是阴极 B. 石墨附近产生OH - C.石墨上有Cl 2 放出 D. 铁棒上有H 2放出 9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液 10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等 11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 4 12.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚 13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2OB.工业合成盐酸:H 2 + Cl 2 −−−→光照2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B ƒ2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化石墨食盐溶液铁棒的情况,由此推断错误的是 A .正反应是放热反应 B .A 、B 一定都是气体C .D 一定不是气体 D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3- → H 2O+CO 2 ↑表示的是 A. 碳酸钠溶液中加入足量醋酸溶液 B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液 16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。


普陀区2017~2018学年第二学期教学质量检测高三化学试卷2018.04考生注意:1.本试卷满分100分,考试时间60分钟。
2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择题)或写(非选择题)在答题纸上;做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写学校、班级、姓名、准考证号。
4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23一、选择题(共40分,每小题2分。
每小题只有一个正确答案)1、属于合金的物质是A. 石墨B. 水银C. 硬铝D. 明矾2、据报道科学家在宇宙中发现了H3分子。
H3与H2属于A. 同素异形体B. 同分异构体C. 同系物D. 同位素3、不属于化学变化的是A. 煤的干馏B. 石油的分馏C. 石蜡的裂化D. 重油的裂解4、不属于氮的固定的是A. 在根瘤菌作用下氮气转变成氮肥B. 打雷时氮气转变成一氧化氮C. 氨气与二氧化碳反应生成尿素D. 氮气与氢气合成氨5、不能用于鉴别甲烷和乙炔的方法是A. 点燃B. 通入溴水C. 通入酸性KMnO4溶液D. 观察气体的颜色6、物质性质的差异与分子间作用力有关的是A. 沸点:Cl2<I2B. 热稳定性:HF>HClC. 硬度:晶体硅<金刚石D. 熔点:MgO>NaCl7、2016年IUPAC将117号元素命名为Ts(中文名“石田”,tián),Ts的原子核外最外层电子数是7。
下列说法错误的是A. Ts与F同主族B. Ts的最外层p轨道中有5个电子TsC. 在同族元素中Ts金属性最强D. 中子数为176的Ts符号是1761178、自来水生产过程中可以依次使用明矾、活性炭、氯气处理天然水,与这三种试剂对应的生产环节是A. 消毒、絮凝、吸附B. 吸附、絮凝、消毒C. 絮凝、吸附、消毒D. 消毒、吸附、絮凝9、下列反应的离子方程式正确的是A. 烧碱与氢溴酸反应OH-+H+→H2OB. 大理石与盐酸反应CO32-+2H+→CO2↑+H2OC. 氯化铝与氨水反应Al3++3OH-→Al(OH)3↓D. 硫酸与铁粉反应2H++Fe→Fe3++H2↑10、右图是一种铁的电化学保护模拟装置,有关叙述正确的是A. 此装置属于电解池B. 电子从铁经导线流向锌C. 铁电极上发生氧化反应D. 该方法称为“牺牲阳极阴极保护法”11、用标准盐酸滴定未知浓度的NaOH溶液,若滴定管用蒸馏水洗涤后未用标准盐酸润洗,其他操作均正确,则NaOH溶液浓度的测定值A. 一定偏低B. 一定偏高C. 仍然准确D. 可能偏高也可能偏低12、气体在化学变化中被还原的是A. CO2使Na2O2固体变白B. Cl2使KI-淀粉试纸变蓝C. C2H4使Br2的CCl4溶液褪色D. H2S使酸性KMnO4溶液褪色13、铝、铁的单质及其化合物应用广泛。

青浦区2017学年高三年级第二次学业质量调研测试化学学科试卷Q2018.04相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH 3COOH CH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2O HS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A.苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B.乙烯和苯都能与H 2 发生加成反应,说明二者均含有碳碳双键C.乙醇、乙酸均能与Na 反应放出H 2 ,二者分子中官能团相同D.乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L-1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH-C.石墨上有Cl2 放出D.铁棒上有H2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照 2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3- → H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。

青浦区2017学年高三年级第二次学业质量调研测试
化学学科试卷
(时间60分钟,满分100分)
Q2018.04
考生注意:
1 •
本考试设试卷和答题纸两部分, 所有答题必须涂或写在答题纸上; 做在试卷上一律不得分。
2.
答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚 地填写姓名、准考证号。
3.
答题纸与试卷在试题编号上是一一对应的,答题时应特别注意, 不能错位。
相对原子质量: H-1 C-12 N-14 0-16 Na-23 、选择题(本题共 40分,每小题2分,每题只有一个正确选项) 1•下列物质属于混合物的是
A. 冰醋酸
B.石油裂解气 2•干冰气化时,发生变化的是
A.分子间作用力
C.分子的大小
6•下列变化过程中 Q > 0的是 — + AQH 3COOH CH 3COO + H + Q B. CaCO 3 (s ) T CaO (s ) + CO 2 (g ) + Q
2- % C. S + H 2O HS + OH + Q
D. S (g ) T S (l ) + Q C. 硫磺 D.酒精 B.分子内共价键 D. 分子的化学性质 3•为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须
A.除去铁锈
B.用盐酸清洗
C.彻底干燥 4•下列烷烃命名错误的是
A . 2—甲基戊烷
C . 3,4 ^二甲基戊烷
5•下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
A .氯气
B .二氧化碳
C .氯化钾 D.加点铁粉 B . 3 —基戊烷
D . 3 —甲基己烷 D .醋酸钠。

2018届上海市青浦区高三第二次学业质量调研测试化学试卷(时间60分钟,满分100分)Q2018.04考生注意:1.本考试设试卷和答题纸两部分,所有答题必须涂或写在答题纸上;做在试卷上一律不得分。
2.答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号。
3.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH3COOH CH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2O HS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A.苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B.乙烯和苯都能与H 2 发生加成反应,说明二者均含有碳碳双键C.乙醇、乙酸均能与Na 反应放出H 2 ,二者分子中官能团相同D.乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L-1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH-C.石墨上有Cl2 放出D.铁棒上有H2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A.观察颜色B.加热C.加水D.加紫色石蕊试液10.标准状况下的1mol N2和1mol13C2H2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na2O2B.C→CO2C.S→SO3D.Fe→Fe3O412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯:C2H5OH CH2=CH2↑+H2OB. 工业合成盐酸:H2 + Cl2 2HClC. 工业获取氯化钠:2Na + Cl2 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl2 → Ca(ClO)2+CaCl2+2H2O14.右图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A.正反应是放热反应B.A、B一定都是气体C.D一定不是气体D.C可能是气体15.下列物质之间进行反应时,可用离子方程式2H+ + CO3- → H2O+CO2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。

青浦区2017学年高三年级第二次学业质量调研测试化学学科试卷Q2018.04相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q >0的是A.CH 3COOH CH 3COO -+ H + + Q B. CaCO 3(s )→ CaO (s )+ CO 2(g )+ QC.S 2- + H 2O HS - + OH - + QD.S (g )→S (l )+ Q7.下列有关有机物结构、性质的分析正确的是A .苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B .乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键C .乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同D .乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L -1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH -C.石墨上有Cl 2 放出D. 铁棒上有H 2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液石墨食盐溶液 铁棒10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照 2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3- → H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。

2018年浦东新区高三化学二模试卷及参考答案编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年浦东新区高三化学二模试卷及参考答案)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年浦东新区高三化学二模试卷及参考答案的全部内容。
浦东新区2017学年度第二学期教学质量检测高三化学试卷考生注意:1.试卷满分100分,考试时间60分钟.2.本考试分设试卷和答题纸,试卷包括两部分,第一部分为选择题,第二部分为综合题.3.答题前,考生务必在答题纸上填写姓名、学校、准考证号,并将核对后的条形码贴在指定位置上。
作答必须涂或写在答题纸上,在试卷上作答一律不得分.第一部分的作答必须涂在答题纸上相应的区域。
第二部分的作答必须写在答题纸上与试卷题号对应的位置。
相对原子质量: C-12 O—16 K—39一、选择题(共40分,每小题2分,每小题只有一个正确答案)1.合金在生产生活中具有广泛的用途。
不属于合金的是A.明矾B.硬铝C.生铁D.青铜2. 12C和13C原子之间,相等的是A.原子质量B.中子数C.质量数D.电子数3.含有共价键的离子晶体是A.H2SO4 B.KOH C.MgCl2D.Na2O 4.硫化氢能与二氧化硫反应,说明硫化氢具有A.还原性B.氧化性C.酸性D.不稳定性5.化学反应中的能量变化符合右图所示的是A.甲烷燃烧B.碳酸钙高温分解C.电石与水反应D.酸碱中和6.铁在一定条件下与下列物质发生的反应,不属于置换反应的是A .水B .稀盐酸C .硫粉D .硫酸铜7.氮是植物生长的必需元素。
有关说法中错误的是A .氮气分子很稳定B .氨气是极性分子C .尿素属于铵态氮肥D .闪电实现了大气固氮8.有关Al 2O 3的叙述正确的是 A .可用于净水B .是碱性氧化物C .可与水化合成Al(OH )3D .可通过铝热反应生成9.下列物质中能使酸性高锰酸钾溶液褪色的是A .溴乙烷B .乙酸乙酯C .甲烷D .乙炔10.物质之间发生化学反应时,一定发生变化的是A .总物质的量B .原子个数C .化学键D 。
青浦区2017~2018学年第二学期教学质量检测高三化学试卷2018.04考生注意:1.本试卷满分100分,考试时间60分钟。
2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择题)或写(非选择题)在答题纸上;做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写学校、班级、姓名、准考证号。
4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH3COOH CH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2O HS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A.苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B.乙烯和苯都能与H2发生加成反应,说明二者均含有碳碳双键C.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同D.乙醇在铜催化作用下,能发生还原反应生成乙醛下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH-C.石墨上有Cl2 放出D.铁棒上有H2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体 D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 32-→ H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。
此过程中二氧化硫表现出A. 酸性B. 还原性C. 氧化性D. 漂白性 17.常温下,若HA 溶液和NaOH 溶液混合后pH=7,下列说法错误的是A .反应后HA 溶液可能有剩余B .HA 溶液和NaOH 溶液的体积可能相等C .溶液中c(Na +)>c( A)D .HA 溶液的c (H +)和NaOH 溶液的c (OH -)可能不相等18.根据相关化学原理,下列判断正确的是A .若R 2-和M +的电子层结构相同,则原子序数:M > RB .若R 2-和M +的电子层结构相同,则离子半径:M +>R 2-C .若X 是原子晶体,Y 是分子晶体,则熔点:Y >XD .若A 2+2D -→2A -+D 2,则氧化性:D ->A- 19.下列各组离子,能在同种溶液中大量共存的是A 、NH 4+、Na +、OH -、SO 42-B 、NH 4+、Mg 2+ NO 3- Cl -C 、Ba 2+、OH -、Cl -、SO 42-D 、Fe 2 +、H +、Cl -、NO 3-20.在0.1 mol/L Na2CO3溶液中,微粒间浓度关系正确的是A.[Na+] + [H+]=[OH-] + [HCO3-] + [CO32-] B.[Na+]>[CO32-]>[HCO3-]>[OH-]C.[Na+]=2[CO32-] + 2[HCO3-] + 2[H2CO3] D.[Na+]>[HCO3-]>[CO32-]>[OH-]二、综合题(一)本题共16分研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
+ 12 H2O处理NO2。
I. 利用反应:6NO2 + 8NHII. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2SO3(g)+NO(g) −Q(Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2CH3OH(g)。
21.硫离子最外层电子的电子排布式为____________________,氨气分子的电子式为____________,氨气分子属于____________分子(填“极性”或者“非极性”)。
22.C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_________________,能证明其递变规律的事实是()a、最高价氧化物对应水化物的酸性b、气态氢化物的沸点c、单质与氢气反应的难易程度d、其两两组合形成的化合物中元素的化合价23. 对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =____________________。
24. 对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________a. 体系压强保持不变b. NO2浓度保持不变c. NO2和SO3的体积比保持不变d. 混合气体的平均相对分子质量保持不变25. 请写出II中反应的平衡常数表达式K=_____________________________________如果II中反应的平衡常数K值变大,该反应___________a.一定向正反应方向移动b. 平衡移动时,正反应速率先减小后增大c.一定向逆反应方向移动d. 平衡移动时,逆反应速率先增大后减小的关系如右图。
实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:______________________________________________________________________________________。
(二)本题共14分海洋是资源的宝库,含有丰富的化学元素。
27.在电解饱和食盐水的实验中,阳极产物的检验方法是_____________________________________。
28. 目前从海水中提溴(Br2)大致有以下步骤。
(1)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。
(2)用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。
吸收1 moL Br2需消耗Na2CO3__________moL。
(3)再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
____ Br-+____ BrO3-+____ H +→____ Br2 +____ H2O29.碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是:_____________________________________。
30.同温同浓度的Na2CO3溶液、NaHCO3溶液,pH大小顺序为_____________˃_____________。
NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-)_____________ (填变大或变小),请用平衡理论解释发生这种变化的原因。
__________________________________________________________(三)本题共15分联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:31.两种方法的沉淀池中均发生的反应化学方程式为______________________________。
32.X是____________,Y是____________,Z是____________。
(填化学式)33.Z中除了溶解的氨气、食盐外,其它溶质还有;排出液中的溶质除了氢氧化钙外,还有__________。
34.根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是_____________。
a.常温时氯化铵的溶解度比氯化钠小b.通入氨气能增大NH4+的浓度,使氯化铵更多析出c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出35.为检验产品碳酸钠中是否含有氯化钠,请设计实验方案。
___________________________________36.联碱法中,每当通入NH3 22.4L(折合成标准状况下)时可以得到纯碱50.0g,则NH3的利用率为__________________。
(结果精确到0.01)(四)本题共15分有机物E 是医药合成中间体。
其合成路线如下:37. 的官能团名称为_____________________。
E 的分子式为_____________________。
38. B→D 的过程中,B 分子的羧基全部酯化,写出该反应方程式:___________________________。
39.D→E 的反应历程如下:写出反应Ⅱ、Ⅲ的反应类型:Ⅱ_____________________、Ⅲ_____________________。
40.写出满足下列条件的A 的所有同分异构体的结构简式____________________________________。
a .能与新制氢氧化铜悬浊液反应产生砖红色沉淀b .常温下能与Na 2CO 3反应并释放出气体41.请写出以CH 2=CH 2为主要原料(无机试剂任用)制备OHC —CHO (乙二醛)的合成路线流程图。