物质的制备
- 格式:ppt
- 大小:146.00 KB
- 文档页数:6


物质的制备一、常见气体的实验室制法1.O 2的实验室制法⑴反应原理:①用KClO 3和MnO 2制取:2KClO 3 =====MnO 2△2KCl +3O 2↑ ②用H 2O 2和MnO 2制取:2H 2O 2 =====MnO 22H 2O +O 2↑ ⑵反应装置:固+固气(KClO 3和MnO 2)⑶收集方法排水法或向上排空气法或排饱和食盐水法.⑷验满方法:用带火星的木条靠近集气瓶口,观察是否复燃.2.CO 2的实验室制法:⑴反应原理:CaCO 3+2HCl = CaCl 2+CO 2↑+H 2O⑵反应装置:固+液―→气⑶收集方法:向上排空气法⑷验满方法:蘸有石灰水的玻璃棒靠近瓶口,表面变浑浊,证明CO 2已收集满3.H 2的实验室制法:⑴反应原理:Zn +H 2SO 4 = ZnSO 4+H 2↑⑵反应装置:固+液―→气⑶收集方法:排水法或向下排空气法4.NH 3的实验室制法⑴反应原理:Ca(OH)2+2NH 4ClCaCl 2+2NH 3↑+2H 2O ⑵反应装置:固+固气⑶收集方法:向下排空气法⑷除杂:用向上排空气或排饱和食盐水除去混有的水蒸气.5.氯气的实验室制法⑴反应原理:MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O⑵收集方法:向上排空气法或排饱和食盐水法。
⑶验满方法:将湿润的淀粉KI 试纸放在集气瓶口。
⑷尾气处理:多余的Cl 2用强碱溶液吸收。
二、几种重要物质的制备1.乙酸乙酯的制备⑴原理:CH 3COOH+CH 3CH 2OH3COOCH2CH 3+H 2O⑵收集:饱和碳酸钠溶液现象:碳酸钠溶液上层有无色油状特殊香味的液体。
⑶注意事项:①试剂的混合方法:先取无水乙醇,再沿器壁慢慢加入浓硫酸,冷却至室温后再加冰醋酸; 浓硫酸 △②长导管不要插入液面下;③饱和碳酸钠溶液的作用:中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度。
2.氢氧化铝的制备⑴原理离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+⑵注意事项:氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液,但不溶于氨水,制备时一般用可溶性盐与氨水反应。



物质制备的化学方法总结
物质的制备方法包括物质的分离提纯、合成、萃取、电解和加热等。
下面是常见的物质制备的化学方法总结:
1. 合成反应:化学合成反应是最常见的制备物质的方法之一。
通过控制反应条件,将原料中的各种元素或化合物进行反应,并得到目标物质。
2. 沉淀法:将含有目标物质的溶液与另一种反应物反应,产生难溶于溶液中的沉淀。
通过过滤、洗涤等步骤分离出沉淀物,得到目标物质。
3. 溶解结晶法:将固体物质溶解于适当的溶剂中,然后通过减少溶剂浓度或调节温度来诱导物质重新结晶。
通过过滤、洗涤等步骤分离出结晶物,得到目标物质。
4. 蒸馏法:适用于需要分离液体混合物的情况。
通过不同挥发度的物质在加热条件下汽化,再在冷凝条件下液化,从而获得目标物质。
5. 萃取法:适用于需要提取特定物质的情况。
通过物质在两个或多个不同溶剂之间的分配系数差异,将目标物质从混合物中提取出来。
6. 电解法:将电能转化为化学能,通过电解液使离子在电解质溶液中移动,从而反应生成目标物质。
7. 气相合成法:适用于气态物质的制备。
通过将气体反应物在适宜的温度和压力下,通过化学反应生成目标物质。
总之,物质制备的化学方法多种多样,具体方法的选择取决于目标物质的性质、制备要求以及经济和安全等方面的考虑。

H Cl 散热铁片合成塔里的燃烧器H 2Cl 2HCl 合成塔结构图视孔视孔一、盐酸的制备1.原理:氯气在氢气中燃烧,HCl 气体溶于水,得到盐酸。
2.设备3.生产过程:如上图,先通入________,点燃,再通入_________,让氯气在氢气的包裹中燃烧,生成氯化氢气体。
这样操作的目的是:_________________________________________ 工业浓盐酸略带黄色,是因为_______________的缘故。
二、硫酸的制备1.接触法:二氧化硫跟氧气在催化剂表面上接触时发生反应生成三氧化硫,所以这种生产硫酸的方法,称为接触法。
2.原料:黄铁矿(或硫磺)、空气 3.设备:知识梳理常见物质的工业制备4.生产过程:(三个阶段、三个反应、三套设备) (1)SO 2的制取(_________炉)原理:___________________________________________________(黄铁矿燃烧反应是放热的,故燃烧的黄铁矿不需要多加燃料,矿石粉碎是为了扩大反应物的接触面,通入持续大量的空气流可以加快反应,提高原料利用率。
)净化:除尘(防止堵塞反应管道)→洗涤(除去杂质,防止__________________________)→干燥(防止腐蚀设备)。
(2)SO 2的催化氧化制取SO 3(_________室)原理:2522222+高温+V O SO O SO Q 垐垎噲垐 利用化学反应速率、化学平衡原理,选择适宜的反应条件如下:温度:400C ︒~500C ︒(选择原因:_____________________________________________________________________________________。
)压强:常压(选择原因:_________________________________。
) 催化剂:____________(采用多段催化氧化)接触室里有热交换器,充分利用了能源。

第五章物质的制备、分离与提纯简介通过化学方法制备或从天然产物中所提取的物质多为一些混合物或不纯的物质。
因此,利用分离和提纯的手段来精制物质是十分重要和必不可少的。
分离和提纯物质最常用和最简单的方法包括:用化学方法除去一些杂质;固体化合物的重结晶、升华;液体化合物的蒸馏与分馏;天然产物中有效成分的提取;层析法等。
重结晶是提纯固体化合物的常用方法之一。
它是用溶解的方法把晶体结构全部破坏,然后让晶体重新形成,利用被提纯物质和杂质在某种溶剂中的溶解度不同以及溶解度随温度变化的差异,选择适当的溶剂,加热将固体制成饱和溶液,然后令其冷却,析出晶体,让杂质全部或大部分留在溶液中(或被过滤除去),从而达到提纯的目的。
蒸馏与分馏是分离和提纯液体有机化合物最常用的方法。
它是利用液体有机化合物沸点的不同,将液体混合物加热至沸,使液体汽化,然后将蒸气冷凝为液体,再分别收集不同沸点的馏分,从而使混合物中各组分有效地分离。
天然产物的提取法常见的有溶剂提取法、水蒸气蒸馏法、升华法等。
常见的分离法有溶剂分离、萃取法、铅盐法、盐析法、离子交换法、透析法、层析法、色谱法等。
在实际操作中,一般是将植物切碎磨成均匀的细粒或粉状物,再根据其有效成分的理化性质,经常将数种分离法配合使用,才能达到预期的目的。
物质的分离、提纯,可根据对象的不同,选择不同的方法。
本章结合实验介绍的几种分离、提纯法是经常使用的方法,其基本操作可参阅第二章有关章节。
5.1 粗食盐的提纯5.1.1 实验目的1. 掌握粗食盐的提纯方法和基本原理;2. 学习称量、溶解、过滤、蒸发、浓缩及减压抽滤等基本操作;3.了解SO4 2-、Ca 2+、Mg2+等离子的定性鉴定。
5.1.2 实验原理科学研究及医药用的NaCl都是以粗食盐为原料提纯的。
粗食盐中通常含有Ca 2+、Mg2+、K+、SO42-、CO32-等可溶性杂质离子和泥沙等不溶杂质。
不溶性的杂质可用溶解、过滤方法除去,而选择适当的化学试剂,可使Ca2+、Mg2+、SO42-、CO32-等离子生成沉淀而除去。




高中化学物质的制备教案课题:物质的制备教学目标:1. 了解物质的制备原理和方法;2. 掌握常见物质的制备实验操作;3. 提高实验操作的技能和安全意识。
教学重点和难点:重点:了解常见物质的制备原理和方法;难点:掌握物质的实验操作及安全注意事项。
教学过程:一、导入课题(5分钟)通过展示实验室设备和化学品,引导学生探讨物质的制备过程以及在实验中需要注意的安全问题。
二、讲解物质的制备原理和方法(10分钟)1. 介绍物质的制备原理,包括化学反应方程式;2. 分析常见物质的制备方法,如氧气、氢氧化铜等。
三、实验操作演示(15分钟)老师对常见物质的制备实验进行操作演示,重点讲解实验操作流程和注意事项。
四、学生实验操作(30分钟)学生根据老师的演示,分组进行物质的制备实验操作,实践操作能力,加强安全意识。
五、实验结果分析(10分钟)学生观察实验结果,总结实验过程中出现的问题和经验,提出改进意见。
六、实验报告撰写(10分钟)学生根据实验结果撰写实验报告,包括实验目的、原理、操作步骤、结果分析等内容。
七、课堂讨论(10分钟)学生就实验过程中遇到的问题和心得进行讨论交流,促进思维碰撞和学习提高。
八、课堂总结(5分钟)通过本节课的学习,总结物质的制备原理和方法,强化实验操作技能和安全意识。
九、作业布置(5分钟)布置相关作业,对本节课内容进行巩固和拓展。
教学反思:本节课注重通过实验操作引导学生深入了解物质的制备过程,提高实验操作技能和安全意识。
学生在实验中不仅能够掌握物质的制备方法,还能够培养观察能力和实践能力。
在今后的教学中,应注重提高学生的自主学习能力,激发其科学探索兴趣,促进知识的积累和应用能力的提升。

材料的基本制备原理有哪些
材料的基本制备原理主要有以下几种:
1. 熔融法:将物质加热至足够高的温度,使其熔化,并将其凝固成所需形状,如金属铸造、玻璃制备等。
2. 溶液法:将物质溶解在适当的溶剂中,形成溶液,通过溶液的蒸发或其他处理方法使溶质重新结晶,如盐结晶、化学合成等。
3. 沉淀法:通过加入适当的反应剂,使反应生成的沉淀物凝聚成形,如氧化物、碳酸盐等的制备。
4. 气相法:将气体或蒸气送入高温反应室中,通过化学反应生成固态或液态物质,如氧化物薄膜的制备、气相沉积等。
5. 粉末冶金法:将物质粉末加压成型,经过烧结或热处理,使粉末颗粒结合成坚固的物体,如硬质合金的制备、陶瓷材料的制备等。
6. 薄膜制备法:通过物理或化学方法在基底上沉积薄膜,如溅射法、化学气相沉积等。
这些原理在材料制备中常常结合使用,根据不同的材料要求和制备方法的特点,
选择合适的原理进行材料的制备。


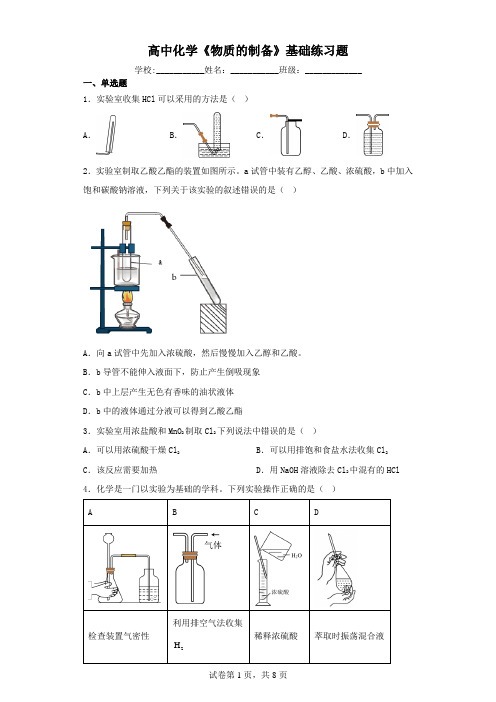
高中化学《物质的制备》基础练习题学校:___________姓名:___________班级:_____________一、单选题1.实验室收集HCl可以采用的方法是()A.B.C.D.2.实验室制取乙酸乙酯的装置如图所示。
a试管中装有乙醇、乙酸、浓硫酸,b中加入饱和碳酸钠溶液,下列关于该实验的叙述错误的是()A.向a试管中先加入浓硫酸,然后慢慢加入乙醇和乙酸。
B.b导管不能伸入液面下,防止产生倒吸现象C.b中上层产生无色有香味的油状液体D.b中的液体通过分液可以得到乙酸乙酯3.实验室用浓盐酸和MnO2制取Cl2下列说法中错误的是()A.可以用浓硫酸干燥Cl2B.可以用排饱和食盐水法收集Cl2 C.该反应需要加热D.用NaOH溶液除去Cl2中混有的HCl 4.化学是一门以实验为基础的学科。
下列实验操作正确的是()A .AB .BC .CD .D5.实验室用氯化铵和消石灰制氨气的装置和下列哪种制气装置相同( ) A .加热氯酸钾、二氧化锰混合物制O 2 B .石灰石和稀盐酸反应制CO 2 C .MnO 2催化过氧化氢溶液分解制O 2 D .MnO 2与浓HCl 加热制取氯气6.以叶蛇纹石[主要成分是()()64108Mg Si O OH ,含少量Fe 2O 3、FeO 、Al 2O 3等]为原料提取高纯硅的流程如下:叶蛇纹石稀硫酸操作1反应1−−−−−→SiO 2焦炭1800℃反应2−−−−−→粗硅HCl300℃反应3−−−−−→SiHCl 32H1100℃反应4−−−−−→高纯硅 下列说法错误的是( ) A .反应2的副产物可作燃料B .反应3和反应4的副产物可循环利用C .反应1、2、3、4都是氧化还原反应D .上述流程中反应3和反应4不可在同一容器中进行 7.用下列实验装置能达到相关实验目的的是A .AB .BC .CD .D8.下列实验装置图所示的实验操作,正确的是( )A.A B.B C.C D.D 9.下列实验中,能达到相应实验目的的是()A.A B.B C.C D.D 10.下列实验装置、原理或操作错误的是()A.A B.B C.C D.D11.下列实验方案和实验操作正确的是()A.A B.B C.C D.D 12.LiFePO4作为锂离子电池的正极材料,具有众多优点,工业上以废铁屑为原料制备LiFePO4的一种流程如下。