电解质
- 格式:ppt
- 大小:529.50 KB
- 文档页数:20

一、电解质与非电解质1、概念:1)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.2)非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物(蔗糖,酒精,甲烷),非金属氧化物(CO2,SO2)等.3)易错点:金属单质不属于化合物,因此既不是电解质,也不是非电解质;CO2、SO2等虽溶于水能导电,但导电实质是H2CO3和H2SO3,不属于电解质,H2CO3和H2SO3则是电解质.混合物不是电解质2、注意事项:①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质.②电解质必须是自身能直接电离出自由移动的离子的化合物.SO2、CO2③条件:水溶液或融化状态对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件.④难溶性化合物不一定就是弱电解质.例如:BaSO4、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质.⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸混合物,不是电解质);蔗糖、酒精为非电解质.⑥水时一种极弱的电解质典例1:下列叙述正确的是()A.液态HCl不导电,所以HCl是非电解质B.NH3的水溶液能够导电,所以NH3是电解质C.液态Cl2不导电,所以Cl2是非电解质D.BaSO4溶于水的部分能够电离,所以BaSO4是电解质在水溶液中或熔化状态下能导电的化合物为电解质,在水溶液中和熔化状态下都不能导电的化合物为非电解质,以此来解答.典例2:下列物质中,属于电解质的是()A.硫酸B.铜C.酒精D.蔗糖在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,注意电解质首先必须是化合物.二、强电解质和弱电解质1、强电解质:在水溶液或熔融状态下全部电离出离子的电解质。
强酸、强碱、大部分盐2、弱电解质:在水溶液或熔融状态下部分电离出离子的电解质。

电解质的四个要素
电解质的四个要素是:离子、溶解度、电离程度和电导率。
1. 离子:电解质是能在溶液中产生离子的物质。
它可以分为无机电解质和有机电解质。
无机电解质包括酸、碱和盐,它们在溶液中会分解成正、负离子。
有机电解质是一类含有离子化基团的有机物,如羧酸、胺等。
2. 溶解度:电解质的溶解度是指在一定温度下溶解在溶剂中的最大物质量。
它受温度、压力等因素的影响。
3. 电离程度:电解质的电离程度是指在溶液中溶解的电解质分子中有多少被电离成离子的比例。
电离程度越高,电解质的导电性越强。
4. 电导率:电导率是指电解质溶液中单位长度内单位横截面积的电流通过的大小。
它是用来表示电解质溶液的导电性强弱的量。
电导率与电解质的浓度、电离程度等因素有关。

什么是电解质电解质是指在溶液中能够导电的物质,其分子或离子具有电离能力。
电解质可以分为两类:强电解质和弱电解质。
在溶液中,强电解质完全电离,形成离子;而弱电解质只有部分电离,形成离子和未电离的分子。
一、电解质的分类电解质通常可以分为无机电解质和有机电解质两大类。
1. 无机电解质无机电解质是指由无机物质(不含碳元素)溶解在水或其他溶剂中而形成离子的物质。
常见的无机电解质包括盐类、酸、碱等。
- 盐类:包括金属盐和非金属盐。
金属盐一般由金属离子和非金属离子组成,如氯化钠(NaCl)、硫酸铜(CuSO4)等;非金属盐是由两种非金属离子组成,如硫酸(H2SO4)、硝酸(HNO3)等。
- 酸:是指能产生H+离子(质子)的物质,如盐酸(HCl)、硫酸(H2SO4)等。
- 碱:是指能产生OH-离子的物质,如氢氧化钠(NaOH)、氨水(NH3.H2O)等。
2. 有机电解质有机电解质是由碳元素和氢元素为主要组成成分的物质,通常能产生含有碳离子的溶液。
有机电解质广泛存在于生物体内,起着重要的生理功能。
二、电解质的特性和作用1. 导电性电解质的主要特点就是能够在溶液中导电。
当电解质溶解在水中时,其分子或离子与溶剂中的水分子进行相互作用,形成溶液中的电离体。
在导电过程中,正负电离体在溶液中通过水分子的吸引作用而进行运动,从而实现电流的传导。
2. 强度等级根据电解质的电离程度不同,可以将电解质分为强电解质和弱电解质。
强电解质在溶液中完全电离,形成大量的离子,溶液的电导率较高;而弱电解质只有一部分分子电离,溶液的电导率较低。
3. 在生物体内的作用电解质在生物体内起着重要的生理功能,维持了机体的平衡,保证了正常的生命活动。
- 电解质和水分共同维持着细胞的渗透压,保持细胞内外的正常水分平衡。
- 电解质在传递神经冲动、维持心肌收缩、调节骨骼和肌肉的收缩松弛等生理过程中发挥着重要作用。
例如,钠离子、钾离子和氯离子在神经元内外传递神经冲动时起到重要的作用。

①中强酸和弱酸:H3PO4、H2SO3、H2CO3、CH3COOH、HF、H2S等;②弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、Cu(OH)2等;③水及两性氢氧化物:H2O、Al(OH)3④少数盐,如AlCl3等。
(3)要区分好溶液的导电性强弱与电解质强弱的关系。
溶液的导电性强弱是由溶液中自由移动的离子浓度及离子所带电荷决定的,即离子浓度越大,离子所带电荷越多,则溶液的导电性越强,反之导电性弱。
因此,强电解质溶液的导电性不一定比弱电解质溶液的导电性强,如:BaSO4是强电解质,由于其溶液浓度小,溶液中离子浓度很小,几乎不导电,其溶液的导电性就比一定浓度的弱电解质CH3COOH溶液的导电性弱。
但同浓度、同温度时,强电解质溶液的导电性一定要比弱电解质溶液的导电性强。
而电解质的强弱是根据其在水溶液或熔化状态下电离程度决定的,在水中溶解的部分完全电离或熔化状态下完全电离,则这种化合物为强电解质,反之为弱电解质。
(4)电离方程式的书写:①强电解质:完全电离,用等号“=”,如:H2SO4=2H++SO42-Ba(OH)2=Ba2++2OH-CH3COONH4=CH3COO-+NH4+②弱电解质:部分电离,用可逆号“”,如:多元弱酸分步电离:多元弱碱也是分步电离,但书写时可一步写完:二、离子反应、离子方程式1、离子反应:离子反应是指有离子参加或有离子生成的化学反应。
2、离子方程式:用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式。
例如:在NaOH溶液中存在有Na+,OH-,而HCl溶液中有H+,Cl-,当向NaOH溶液中加入HCl发生下述反应:NaOH+HCl=NaCl+H2O,因为NaCl在水溶液中仍以离子形式存在,故实际上参加反应的离子只H+和OH-,故离子方程式为H++OH-=H2O。
又如:BaCl2+Na2SO4=BaSO4↓+2NaCl,其离子方程式为Ba2++SO42-=BaSO4↓。

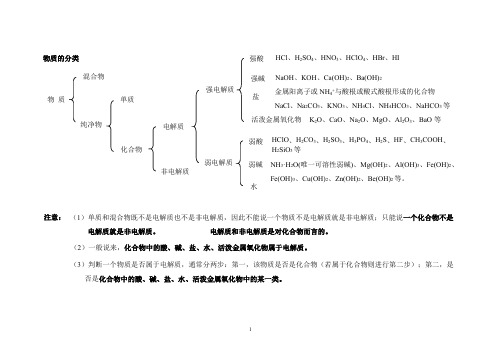

强电解质:
1、强酸:HCl H2SO4硫酸HNO3硝酸HBr氢溴酸HI氢碘酸HCLO4高氯酸
2、强碱:NaOH KOH Ba(OH)2氢氧化钡Ca(OH)2氢氧化钙
3、绝大多数盐:高中见到的盐全部是强的电解质
金属化合物:a、氧化物:氧化钙CaO 氧化钠Na2O 氧化镁MgO 氧化Al2O3 氧化锌ZnO 氧化盐铁FeO 氧化铁Fe2O3 氧化铜CuO 氧化汞HgO 氧化银Ag2O
b、过氧化合物:过氧化钠Na2O2
c、金属碳化物:碳化钙CaC2
d、金属硫化物:硫化钙CaS2 二硫化亚铁FeS2
弱电解质:
1、弱酸:碳酸H2CO3 亚硫酸H2SO3 醋酸CH3COOH 氢硫酸H2S 氢氟酸HF 硅酸H2SiO3 原硅酸H3SiO4 所有的有机酸
2、弱碱:一水合氨NH3.H2O 所有的除强碱的氢氧化金属R(OH)
3、水H2O也是弱电解质
非电解质:
1、非金属氧化物:二氧化碳二氧化硫一氧化碳三氧化硫二氧化氮一氧化氮
2、大多数有机物:甲烷乙醇蔗糖(有机酸和有机盐除外)
3、非金属化合物:氨气。


电解质是什么一、何为电解质?浅说什么是电解质:电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
根据其电离程度可分为强电解质和弱电解质,几乎全部电离的是强电解质,只有少部分电离的是弱电解质。
电解质都是以离子键或极性共价键结合的物质。
化合物在溶解于水中或受热状态下能够解离成自由移动的离子。
离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移。
二、电解质的种类1.强电解质强电解质一般包括:强酸、强碱、活性金属氧化物和大部分盐类,如硫酸、盐酸、碳酸钙、硫酸铜等。
2.强电解质强电解质一般有:弱酸、弱碱,少部分盐,如:醋酸、一水合氨(NH3·H2O)、醋酸铅、氯化汞。
另外,水是极弱电解质。
三、电池内的电解质种类1.蓄电池又名爱迪生电池铅电池是酸性电池,与其不同的是,铁镍电池的电解液是碱性氢氧化钾溶液,也就是碱性电池。
它的正极氧化镍,负极氧化铁。
化学反应的充放电电动势在1.3~1.4伏之间。
它的优点是重量轻,寿命长,易于维护,缺点是效率低。
2.镉镍蓄电池阳极氢氧化镍、阴极氢氧化镉和电解质是氢氧化钾溶液。
充放电化学反应具有重量轻、耐冲击、寿命长等优点,常用于小型电子设备。
3.银锌电池正极氧化银,负极锌,氢氧化钾溶液。
银锌电池比能量大,能大电流放电,抗震动,可作为宇宙飞船、卫星、火箭等的电源。
充放电次数可达到约100~150次循环。
它的缺点是成本高,使用寿命短。
4.锌锰干电池第一批仍在批量生产的原电池的制造。
结构可分为圆柱形结构和叠层结构。
具有使用方便、价格低廉、原料来源丰富、适合大规模自动化生产的特点。
但放电电压不够稳定,放电速率对容量影响较大。
适用于中小功率和间歇放电。
新型锌锰干电池采用高浓度氯化锌电解液,优良的二氧化锰粉末和纸板浆料结构,容量和寿命翻倍,密封性能提高。
5.碱锌锰电池锌锰电池采用碱性电解液代替中性电解液。
分为柱面和纽扣面。

电解质与非电解质的区别电解质和非电解质是化学领域中重要的概念,它们在物质的离子行为和溶解性质方面有着明显的差异。
本文将从分子结构、电离能力、导电性等方面对电解质和非电解质进行比较,以便更好地理解它们之间的区别。
一、分子结构电解质是指在溶液中能够电离生成离子的物质。
它可以分为无机电解质和有机电解质两种。
无机电解质主要是由金属离子和非金属离子组成的化合物,如氯化钠(NaCl)、硝酸铵(NH4NO3)等。
有机电解质则是由含有官能团的有机物所构成,如醋酸(CH3COOH)、硫酸(H2SO4)等。
而非电解质则是指在溶液中不会电离产生离子的物质。
非电解质通常是由非金属原子组成的化合物,如糖类(蔗糖、葡萄糖)和有机化合物(乙醇、乙醚)等。
二、电离能力电解质的一个显著特征是其具备较强的电离能力。
当电解质溶解在溶剂中时,其分子会发生电离,形成离子。
这是因为电解质的分子内部含有离子键或极性共价键,这使得其在溶液中易于分解。
非电解质的电离能力相对较弱,其分子内部通常不存在离子键或极性共价键。
因此,非电解质在溶液中往往不会电离,维持其原有的分子状态。
三、导电性由于电解质能够在溶液中电离生成离子,所以其具有很好的导电性。
当电解质溶解在水中时,离子与溶剂中的水分子进行相互作用,形成电解质溶液。
离子在溶液中具有自由运动的能力,能够携带电荷并传导电流。
相比之下,由于非电解质无法电离,它们在溶液中不会产生自由电荷。
因此,非电解质通常不具备导电性。
四、溶解性电解质的溶解性往往较好。
当电解质溶解在溶剂中时,溶剂的分子与电解质分子发生作用,并将其分子间的力破坏,从而使电解质分子解离为离子。
这种离子与溶剂中的分子形成溶液,电解质得以充分溶解。
相比之下,非电解质的溶解性一般较差。
非电解质分子通常是由共价键或非极性共价键所连接,这种化学键的强度较大,难以被溶剂的分子所破坏。
因此,非电解质的溶解度较低。
结论电解质和非电解质在分子结构、电离能力、导电性和溶解性方面存在明显的区别。

电解质知识点归纳电解质是指在溶液中能够离解成带电离子的物质。
电解质在身体的生理功能和平衡中起着重要的作用。
下面是一些关于电解质的知识点归纳:主要类型1. 阳离子:带正电荷的离子,如钠离子(Na+)、钾离子(K+)、铵离子(NH4+)等。
2. 阴离子:带负电荷的离子,如氯离子(Cl-)、碳酸根离子(CO32-)、磷酸根离子(PO43-)等。
功能1. 维持水的平衡:电解质通过调节体液的渗透压,控制体内水分的输送和平衡。
2. 帮助肌肉和神经功能:电解质参与肌肉的收缩和神经传递的过程。
3. 维持酸碱平衡:电解质调节体液的pH值,维持酸碱平衡。
4. 传递物质:电解质能帮助离子和其他物质在细胞间传递。
常见电解质1. 钠离子(Na+):主要存在于细胞外液中,调节细胞外液中的渗透压和酸碱平衡。
2. 钾离子(K+):主要存在于细胞内液中,维持神经肌肉的正常功能。
3. 钙离子(Ca2+):参与骨骼的形成和维持,调节神经肌肉的兴奋性。
4. 氯离子(Cl-):维持体液的渗透压和酸碱平衡。
5. 磷酸根离子(PO43-):参与骨骼和牙齿的形成,维持酸碱平衡和能量代谢。
6. 碳酸根离子(CO32-):参与酸碱平衡的调节。
电解质失衡1. 高钠血症:血液中钠离子浓度超过正常范围,可能导致脱水等问题。
2. 高钾血症:血液中钾离子浓度超过正常范围,可能引起心脏问题。
3. 高钙血症:血液中钙离子浓度超过正常范围,可能导致骨质疏松等问题。
4. 高氯血症:血液中氯离子浓度超过正常范围,可能与肾功能问题有关。
以上是关于电解质的一些基本知识点归纳,电解质在维持人体正常功能方面起着重要的作用。

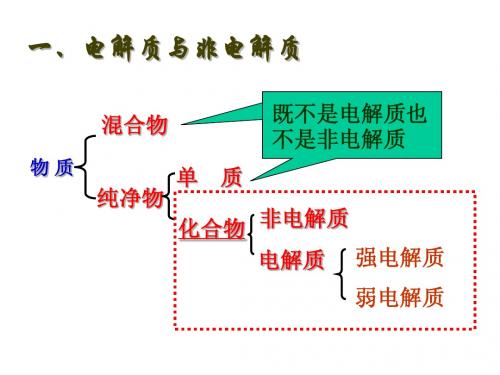
电解质1、电解质与非电解质在水溶液或熔化状态下能导电的化合物称为电解质:酸、碱、盐,金属氧化物,H2O在水溶液和熔化状态下都不能导电的化合物称为非电解质。
注意:(1)电解质和非电解质都是化合物,单质既不属于电解质,也不属于非电解质。
(2)电离是电解质溶液导电的前提。
(3)能导电的物质不一定是电解质,如石墨等;(4)电解质本身不一定能导电,如食盐晶体。
(5)有些化合物的水溶液能导电,但因为这些化合物在水中或熔化状态下本身不能电离,故也不是电解质.如SO2、SO3、NH3、CO2等,它们的水溶液都能导电,是因为跟水反应生成了电解质,它们本身都不是电解质。
(6)酸为共价化合物,只有在水中才导电,纯净的酸不导电。
(7)电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数是相等的,故显电中性,称电荷守恒。
2、强电解质与弱电解质根据电解质在水溶液里电离能力的大小又可将电解质分为强电解质和弱电解质:能完全电离的电解质叫做强电解质,如强酸、强碱、活泼金属氧化物、绝大多数盐(除HgCl2和(CHCOO)2Pb),只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等。
注意:(1)电解质的强弱与其在水溶液中的电离程度有关,与其溶解度的大小无关。
例如:难溶的BaS04、CaS03等和微溶的Ca(OH)2等在水中溶解的部分是完全电离的,故是强电解质。
而易溶于水的CH3COOH、H3P04等在水中只有部分电离,故归为弱电解质。
(2)电解质溶液的导电能力的强弱只与自由移动的离子浓度及离子所带的电荷数有关,而与电解质的强弱没有必然的联系。
例如:一定浓度的弱酸溶液的导电能力也可能比较稀的强酸溶液强。
15、现有以下物质:(1)NaCl晶体(2)液态SO3(3)液态醋酸(4)汞(5)BaSO4固体(6)蔗糖溶液(7)酒精(8)熔化KNO3(9)铝线(10)石墨(11)氯水(12)氢氧化钠溶液(13)纯硫酸(14)石灰水(15)盐酸(16)氨气(1)以上物质中能导电的是__________ (2)以上物质属于电解质的是_____________(3)以上物质中属于非电解质的是______________(4) 以上物质属于强电解质的是_____________(5)以上物质属于弱电解质的是_____________3、电离方程式(1)强电解质:用“=== ”如:H2SO4=== 2H+ + SO42—BaSO4=== Ba2+ + SO42—(2)弱电解质:用“”如:HF H+ + F—CH3COOH CH3COO— + H+NH3•H2O NH4+ + OH—(3)多元弱酸和多元弱碱的电离方程式(以第一步为主)H2CO3H+ + HCO3—HCO3—H+ + CO32—H2SO3H+ + HSO3—HSO3—H+ + SO32—H3PO4H+ + H2PO4—H2PO42—H+ +HPO42—HPO42—H+ +PO43—Cu(OH)2Cu2+ + 2OH—(不分步)Al(OH)3:两性按两种方法电离酸式电离:Al(OH)3AlO2— + H++ H2O碱式电离:Al(OH)3Al3+ + 3OH—(4)酸式盐的电离①强酸的酸式盐在熔化和溶解条件下的电离方程式不同熔化:NaHSO4=== Na+ + HSO4—溶液:NaHSO4=== Na+ + H+ + SO42—②弱酸的酸式盐受热易分解,一般没有熔化状态,在溶解中电离时强中有弱溶液中:NaHCO3=== Na+ + HCO3—HCO3—H+ + CO32—一般不写第二部的酸式根电离子反应1、离子方程式的书写(1)写:写出化学方程式(2)拆:把易溶于水、易电离的物质改写成离子形式(强酸、强碱、可溶性盐)不能拆:(1)气体、水、单质、金属氧化物、弱酸、弱碱、沉淀(包括微溶的)(2)固体之间的反应不能拆:2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2H2O+2NH3↑(3)浓硫酸与固体反应不能拆(4)微溶物质:Ca(OH)2等要注意:说是澄清溶液则要拆,石灰乳或者生成物不能拆。

电解质总结总结一电解质电解质是指在水溶液中或熔融状态下能够导电的化合物。
例如酸、碱和盐等。
凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等。
(注:能导电的化合物不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否。
单质、混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质。
)在水溶液中几乎完全发生电离的电解质叫做强电解质;反之为弱电解质。
导电的性质与溶解度无关,强电解质一般有:强酸强碱,大多数盐,如:硫酸、氢氧化钠、硫酸铜、硫酸钡;弱电解质(溶解的部分在水中只能部分电离的化合物)一般有:弱酸、弱碱,如;醋酸、一水合氨(NH3H2O),以及少数盐,如:醋酸铅、氯化汞。
另外,水是极弱电解质。
请注意:1氨气不是电解质(非电解质);氨水是混合物,也不是电解质(不能纳入电解质范畴),上面所说的是一水合氨。
2再如氯气水溶液能导电的原因是:氯气与水作用,生成HC 和HCO,而HC和HCO都是电解质,在水溶液中可以发生电离产生阴阳离子使溶液能导电。
其中HC可以完全电离,是强电解质,HCO只能部分电离,是弱电解质。
电离是本质,导电是现象3强电解质不一定都导电,如硫酸钡,由于几乎不溶于水,因此电离出的离子极少,因此可以近似看成不导电,同样的情况也适用于氯化银沉淀。
4硫酸钡难溶于水,溶液中离子浓度很小,其水溶液不导电,似乎为非电解质。
但熔融的硫酸钡却可以导电。
因此,硫酸钡是电解质。
碳酸钙和硫酸钡具有相类似的情况,也是电解质。
从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,但溶的那部分是完全电离的,所以也是电解质。
5SO2、SO3、gO,CaO,A2O3等是离子化合物,它们在熔融状态下能够导电,因此是电解质。
6有些能导电的物质,如所有的金属既不是电解质,也不是非电解质。
因它们并不是能导电的化合物,而是单质,不符合电解质的定义。
导电原因①室温下纯固体、纯液体是不导电的②电解质在水溶液或有的在熔化状态下才导电①强电解质强酸:H2SO4、HNO3、HC、HBr、HI等强碱:NaOH、KOH、BaOH2、CaOH2等大多数盐:BaSO4、AgC等活泼金属氧化物:Na2O②电解质:弱酸:H2CO3、CH3COOH、H3gCO3,Ag2CO3,FeS,CuSFeOH3,CuOH2,AOH3,MgOH2,NH3H2O,AgC,AgBr,AgI,CH3COOH,HF,HCO,H2CO3,H2S,H2SO3,MnO2,CuO,Fe2O3,A2O3,Na2O,Na2O2,HCO3-,HS-,HSO3-,H2PO4-,HPO42-三盐类的水解在溶液中,强碱弱酸盐,强酸弱碱盐或弱酸弱碱盐电离出来的离子与水电离出来的H与OH-生成弱电解质的过程叫做盐类水解。

高中常见电解质1. 什么是电解质?电解质是指能够在溶液中或熔融状态下导电的物质。
它们在水溶液中会分解成带电的离子,从而使溶液具有导电性质。
电解质的分解过程称为电离。
2. 电解质的分类电解质可以分为两类:强电解质和弱电解质。
2.1 强电解质强电解质是指在水溶液中完全电离的物质,能够产生大量的离子。
常见的强电解质包括:•酸:如盐酸(HCl)、硫酸(H2SO4)等;•碱:如氢氧化钠(NaOH)、氢氧化钾(KOH)等;•盐:如氯化钠(NaCl)、硝酸铵(NH4NO3)等。
2.2 弱电解质弱电解质是指在水溶液中只部分电离的物质,产生的离子数量较少。
常见的弱电解质包括:•部分电离的酸:如乙酸(CH3COOH)、碳酸(H2CO3)等;•部分电离的碱:如氨水(NH3·H2O)等。
3. 高中常见电解质3.1 酸酸是指能够产生氢离子(H+)的物质。
高中化学中常见的酸有:•盐酸(HCl):是一种无色、刺激性气味的强酸,可以与金属反应产生盐和氢气;•硫酸(H2SO4):是一种无色、有刺激性气味的强酸,可以与金属反应产生盐和氢气;•硝酸(HNO3):是一种无色、有刺激性气味的强酸,可以与金属反应产生盐和氢气;•醋酸(CH3COOH):是一种无色液体,呈醋味,属于弱酸。
3.2 碱碱是指能够产生氢氧根离子(OH-)的物质。
高中化学中常见的碱有:•氢氧化钠(NaOH):是一种无色晶体,易吸湿,能与酸反应生成盐和水;•氢氧化钾(KOH):是一种无色结晶或白色颗粒,能与酸反应生成盐和水;•氨水(NH3·H2O):是一种无色气味刺激的液体,是弱碱。
3.3 盐盐是由酸和碱反应生成的化合物,可以在水溶液中完全电离。
高中化学中常见的盐有:•氯化钠(NaCl):是一种无色结晶,是食盐的主要成分;•碳酸钠(Na2CO3):是一种无色结晶,常用于软化水和制备碱性溶液;•硝酸铵(NH4NO3):是一种无色结晶,常用作氮肥。
4. 电解质在生活中的应用4.1 电解质溶液的导电性电解质溶液的导电性是电解质重要的特性之一。

化学反应中的电解质酸碱电导率在化学反应中,电解质酸碱的电导率起着重要的作用。
电解质是指能够在溶液中电离成离子的物质,酸和碱都属于电解质。
一、电解质的定义和分类电解质是指在溶液中或熔融状态下能够电离成离子的物质。
根据电离度的不同,电解质可分为强电解质和弱电解质。
1. 强电解质:在溶液中完全电离,生成大量的离子。
常见的强电解质包括盐酸、硫酸、氢氧化钠等。
2. 弱电解质:在溶液中仅部分电离,生成少量的离子。
常见的弱电解质包括乙酸、氨水等。
二、酸碱电导率的原理当电解质溶液中存在酸或碱时,由于酸和碱的电离产生了带电的离子,因此溶液成为了导电性能良好的介质。
根据电解质溶液的电离程度,可以测定电解质酸碱的电导率。
酸碱的电导率可以通过电导仪进行测量。
电导仪通过测量电解质溶液中的电导率来判断酸碱的强度和浓度。
电导率越高,说明电解质酸碱的浓度越高或强度越强。
三、影响电解质酸碱电导率的因素1. 电解质浓度:电解质的浓度越高,电离度越高,电导率也会增加。
2. 温度:温度对电解质的电导率也有影响。
一般情况下,温度越高,分子运动越剧烈,电解质的电离度也会增加。
3. 溶剂:不同的溶剂对电解质的电导率也有影响。
例如,水是一种良好的溶剂,可以增加电解质的电离度和电导率,而非极性溶剂则相对较低。
四、应用举例1. 酸碱中和反应:在酸碱中和反应中,酸和碱反应后生成的盐是强电解质,在水中完全电离,导电性强。
2. 酸碱滴定:滴定过程中,利用电导仪可以测定酸碱的浓度和等当点的确定。
3. 电化学反应:在电化学反应中,电解质的电导率与电流密度相关,可以通过电导率的测量来研究电化学反应的速率和机理。
总结:在化学反应中,电解质酸碱的电导率对反应过程的理解和分析至关重要。
我们可以通过测量电导率来确定酸碱的浓度、强度和反应速率,进而更好地掌握化学反应的规律和机制。
了解电解质酸碱电导率的原理和影响因素,有助于学生们更好地理解化学知识,提高实验技能,为进一步的学习和研究打下坚实的基础。

电解质的成分
电解质是指在溶液中能够被电流分解的物质,它们是构成溶液的重要组成部分,可以改变溶液的电导率和pH值。
电解质可以分为两类:离子电解质和非离子电解质。
离子电解质是指在溶液中能够被电流分解的离子,它们可以分为正离子和负离子。
正离子是指在溶液中能够被电流分解的正离子,它们可以是金属离子,如钠离子、钙离子、铝离子等;也可以是非金属离子,如氯离子、氢离子、硫酸根离子等。
负离子是指在溶液中能够被电流分解的负离子,它们可以是氢氧根离子,如硫酸根离子、氯化物离子等;也可以是非氢氧根离子,如硝酸根离子、磷酸根离子等。
非离子电解质是指在溶液中能够被电流分解的非离子物质,它们可以是水分子,也可以是有机物质,如糖类、蛋白质、核酸等。
电解质的作用是改变溶液的电导率和pH值,它们可以把溶液中的正离子和负离子分离,从而改变溶液的电导率和pH值。
此外,电解质还可以把溶液中的有机物质分解,从而改变溶液的pH值。
电解质在生物体中也有重要作用,它们可以参与生物体的代谢过程,如维持细胞内外的电解质平衡,参与细胞内的能量代谢,参与细胞内的信号传导等。
电解质是构成溶液的重要组成部分,它们可以改变溶液的电导率和pH值,并参与生物体的代谢过程。
因此,电解质在生物体中具有重要的作用,是生命活动的重要组成部分。

什么是电解质电解质是生命活动过程中必不可少的物质,在人体机能的调节维持、体液的组成稳定中扮演着重要的角色。
本文将带领您了解关于电解质的成分、作用以及吸收等相关信息。
一、电解质的组成电解质是指溶液中可溶性的电荷离子,例如,氯离子、氢离子等众多离子物质,均属于电解质。
科学家们表示,电解质最常见的种类有氯化钠(NaCl)、氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、氢氧化镁(Mg(OH)2)等四类。
1. 氯化钠氯化钠是以氯和钠组成的电解质,又称食盐,是电解质中最稳定的离子有机化合物,是日常食物中的重要的物质。
2. 氢氧化钠氢氧化钠又称碱性氢氧化物,其离子结构中含有OH-离子,具有极强的碱性,是坚硬、洁白、不溶于水的碱性无机物,具有一定的热稳定性,并且极易溶解。
3. 氢氧化钙氢氧化钙是由钙离子和氢氧离子组成的复杂电解质,在物理性质上,是极具热量的离子,它具有良好的腐蚀性以及抗菌性,常被用于从水中去除金属离子。
4. 氢氧化镁氢氧化镁是由镁离子和氢氧离子组成的电解质,其物理性质很稳定,它具有高熔点、良好的使用性能和稳定性,常用来制备药物和食品行业中的葡萄糖、蔗糖、乳酸等,是公认的天然防腐剂。
二、电解质的作用1. 维持人体生理机能电解质可以与其他重要物质,如维生素、蛋白质等结合,参与储存、交换、代谢等重要的生理活动,帮助调节液体的PH值,调节温度,维持液质的稳定性以及调节水分和离子的平衡,在维持人体的正常生理机能中起着非常重要的作用。
2. 调节体液的组成电解质不仅在调节体液的PH值,也能调节体液中多种重要分子的比例,如盐分、磷酸、乳糖、葡萄糖等,在调节体液的组成上发挥重要作用。
3. 吸收电解质还可以表现出离子流动特性,可以对细胞外液、小肠细胞膜、血液膜和体细胞膜等脂质介质有一定的亲和力,促进细胞组成物的吸收。
三、电解质的吸收1. 被细胞外液直接吸收细胞外液中包含有电解质,细胞外液直接吸收了溶液中的电解质,然后将其传到细胞内。

电解质是什么
一、电解质是什么二、电解质紊乱的原因三、血液电解质检查的注意事项
电解质是什么1、电解质是什么
电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
可分为强电解质和弱电解质。
电解质不一定能导电,而只有在溶于水或熔融状态时电离出自由移动的离子后才能导电。
离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移。
2、电解质的分类
强电解质是在水溶液中或熔融状态中几乎完全发生电离的电解质,弱电解质是在水溶液中或熔融状态下不完全发生电离的电解质。
强弱电解质导电的性质与物质的溶解度无关。
2.1、强电解质:一般有:强酸强碱,活泼金属氧化物和大多数盐,如:碳酸钙、硫酸铜。
也有少部分盐不是强电解质。
2.2、弱电解质:(溶解的部分在水中只能部分电离的化合物,弱电解质是一些具有极性键的共价化合物)一般有:弱酸、弱碱,如;醋酸、一水合氨(NH3·H2O),以及少数盐,如:醋酸铅、氯化汞。
另外,水是极弱电解质。
3、电解质紊乱是什么
水和电解质广泛分布在细胞内外,参与体内许多重要的功能和代谢活动,对正常生命活动的维持起着非常重要的作用。
体内水和电解质的动态平衡是通过神经、体液的调节实现的。