3.2.2《金属晶体与离子晶体》学案(鲁科版选修3).
- 格式:doc
- 大小:117.00 KB
- 文档页数:3

鲁科版选修三《金属晶体与离子晶体》评课稿一、引言《金属晶体与离子晶体》是鲁科版高中选修三课程中的一门重要课程。
通过学习该课程,学生可以深入了解金属和离子晶体的结构和性质,并掌握相关的实验方法和技术。
本评课稿将对鲁科版选修三《金属晶体与离子晶体》进行细致的评价和分析,从多个角度对该课程的教学效果和内容进行评估。
二、课程概述1. 课程背景选修三《金属晶体与离子晶体》是高中化学选修课程中的一门重要课程,主要涵盖金属晶体和离子晶体的基本概念和性质。
在本门课程中,学生将学习金属晶体和离子晶体的结构、组成和性质、合成方法和应用等方面的知识。
2. 课程目标本课程旨在培养学生对金属晶体和离子晶体的理论知识和实验技能的掌握。
通过学习,学生应该能够:•理解金属晶体和离子晶体的基本概念和结构特点;•掌握金属晶体和离子晶体的性质和相互关系;•熟悉金属晶体和离子晶体的合成方法和应用领域;•培养实验能力,掌握制备和测定金属晶体和离子晶体的实验方法。
三、教学内容分析1. 课程大纲鲁科版选修三《金属晶体与离子晶体》的教学内容主要包括以下几个方面:•金属晶体的结构和性质–金属原子的排列方式和金属键的特点–金属晶体的晶格常数、密度和晶体缺陷–金属的导电性和热导性等性质•离子晶体的结构和性质–离子晶体的构成和电子结构–离子晶体的晶格常数、密度和晶体缺陷–离子晶体的溶解性、熔点和硬度等性质•金属晶体和离子晶体的合成方法和应用–金属晶体和离子晶体的制备方法和实验操作–金属晶体和离子晶体的应用领域和实际应用案例•实验技术与实验方法–金属晶体和离子晶体的制备实验–金属晶体和离子晶体性质的测试和测定方法2. 教学方法和手段在教学过程中,采用了多种多样的教学方法和手段,包括:•授课讲授:通过讲解课件、幻灯片等方式对知识点进行详细的讲解;•实验演示:通过实验演示来展示金属晶体和离子晶体的制备和性质;•课堂讨论:组织学生进行小组讨论,加强知识的理解和应用;•独立探究:引导学生进行课外实验和科研探究,加深对金属晶体和离子晶体的理解;•课后作业:布置对教学内容的延伸和拓展的作业,巩固学生的知识掌握程度。




第 2 节金属晶体与离子晶体第 1 课时金属晶体【教课目的】1.知道金属原子的三种常有聚积方式: A1、 A2、A3型密聚积2.能从构成金属晶体的微粒间的作使劲和微粒的密聚积出发解说金属晶体的延展性【教课重点】金属晶体内原子的空间摆列方式,【教课难点】金属晶体内原子的空间摆列方式。
【教课方法】借助模型课件教课【教师具备】制作课件【教课过程】【复习发问】1.如何用金属键解说金属的导热性、导电性?2.哪些因素会影响金属键的强弱呢?3.何谓金属键?成键微粒是什么?有何特色?4.A1型密聚积?何谓 A3型密聚积?【联想怀疑】经过上一节的学习,你已知道金属铜的晶体属于A1型密聚积,金属镁属于 A3型密聚积,那么,金属铁、钠、铝、金、银等属于哪一种种类的密堆积?除了 A1型和 A3型外,金属原子的密聚积还有哪些型式?【板书】一、金属晶体【议论】什么是金属晶体?它有何特色?【回答】【板书】1.定义:金属晶体是指金属原子经过金属键形成的晶体。
2.金属键的特色:因为自由电子为整个金属所共有,所以金属键没有方向性和饱和性。
【陈说】金属原子的外层电子数比较少,简单失掉电子变为金属离子和电子,金属离子间存在反性电荷的维系――带负电荷的自由挪动的电子(运动的电子使系统更稳固),这些电子不是专属于某几个特定的金属离子这就是金属晶体的形成的原由。
【练习】金属晶体的形成是因为晶体中存在()①金属原子②金属离子③自由电子④阴离子A.只有①B.只有③C.②③D.②④分析:金属晶体内存在的作使劲是金属键,应当从金属键的角度考虑,剖析金属键的构成和特色:由自由电子和离子构成,自由电子拥有优秀导电性,即金属晶体是金属离子和自由电子经过金属键形成的。
【过渡】金属原子的密聚积还有哪些型式【板书】3.金属晶体的构造型式:【思虑】假如把金属晶体中的原子当作直径相等的球体 ,把他们搁置在平面上 , 有几种方式 ?【学生活动】利用20 个大小同样的玻璃小球进行商讨?【思虑】上述两种方式中 ,与一个原子紧邻的原子数 (配位数 )分别是多少 ?哪一种搁置方式对空间的利用率较高 ?【思虑沟通】关于非密置层在三维空间有几种聚积方式?【叙述】一种:上下对齐的简单立方。

第2节金属晶体与离子晶体第1课时金属晶体【教学目标】1.知道金属原子的三种常见堆积方式:A1、A2、A3型密堆积2.能从构成金属晶体的微粒间的作用力和微粒的密堆积出发解释金属晶体的延展性【教学重点】金属晶体内原子的空间排列方式,【教学难点】金属晶体内原子的空间排列方式。
【教学方法】借助模型课件教学【教师具备】制作课件【教学过程】【复习提问】1.如何用金属键解释金属的导热性、导电性?2.哪些因素会影响金属键的强弱呢?3. 何谓金属键?成键微粒是什么?有何特征?4. A1型密堆积?何谓A3型密堆积?【联想质疑】通过上一节的学习,你已知道金属铜的晶体属于A1型密堆积,金属镁属于A3型密堆积,那么,金属铁、钠、铝、金、银等属于哪种类型的密堆积?除了A1型和A3型外,金属原子的密堆积还有哪些型式?【板书】一、金属晶体【讨论】什么是金属晶体?它有何特征?【回答】【板书】1.定义:金属晶体是指金属原子通过金属键形成的晶体。
2.金属键的特征:由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性。
【陈述】金属原子的外层电子数比较少,容易失去电子变成金属离子和电子,金属离子间存在反性电荷的维系――带负电荷的自由移动的电子(运动的电子使体系更稳定),这些电子不是专属于某几个特定的金属离子这就是金属晶体的形成的原因。
【练习】金属晶体的形成是因为晶体中存在( )①金属原子②金属离子③自由电子④阴离子A.只有①B.只有③C.②③D.②④解析:金属晶体内存在的作用力是金属键,应该从金属键的角度考虑,分析金属键的组成和特征:由自由电子和离子组成,自由电子具有良好导电性,即金属晶体是金属离子和自由电子通过金属键形成的。
【过渡】金属原子的密堆积还有哪些型式【板书】3.金属晶体的结构型式:【思考】如果把金属晶体中的原子看成直径相等的球体,把他们放置在平面上,有几种方式?【学生活动】利用20个大小相同的玻璃小球进行探讨?【思考】上述两种方式中,与一个原子紧邻的原子数(配位数)分别是多少?哪一种放置方式对空间的利用率较高?【思考交流】对于非密置层在三维空间有几种堆积方式?【讲述】一种:上下对齐的简单立方。

第2节金属晶体与离子晶体第2课时离子晶体【教学目标】1. 使学生认识几种常见的AB型离子晶体(NaCl、CsCl、ZnS)的结构,了解其配位数情况。
2. 能用“切割法”计算一个给定的简单离子晶体晶胞中实际拥有的阴、阳离子个数。
3. 了解晶格能的概念,知道离子晶体的熔、沸点等性质决定于晶格能的大小;知道晶格能的大小与离子晶体的结构型式和阴、阳离子所带电荷以及阴、阳离子的间距有关。
【教学重点、难点】离子晶体的空间堆积方式,离子晶体的结构特点。
【教学方法】借助模型课件教学【教师具备】制作课件【教学过程】【复习引入】1. 晶体有哪些类型?2. 什么叫离子晶体?【回答】1. 金属晶体,离子晶体,分子晶体和原子晶体。
2.离子晶体是阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
那么,离子晶体的结构是怎样的,有什么特点呢?我们这节课就来学习离子晶体的结构。
【板书】二、离子晶体我们先来探讨NaCl晶体的内部结构【提出问题】请同学们观察NaCl晶体的堆积模型,思考以下问题:1. NaCl晶体采取哪种堆积方式?2. 像NaCl这样的离子晶体采取密堆积的原因是什么?【回答】1. NaCl晶体中的Cl-采取A1型密堆积,Na+填在Cl-所形成的空隙中,整体是采取不等径圆球的密堆积。
2. 离子晶体微粒间的作用力为离子键,离子键无方向性和饱和性,因此离子晶体尽可能采取密堆积,以使得体系能量降低,达到稳定状态。
【过渡】我们知道晶体中最小的结构重复单元称为晶胞,将一个个晶胞上、下、前、后、左右并置起来,就构成整个晶体结构,那么NaCl晶胞是怎样的呢?【展示】NaCl的堆积模型请同学们观察NaCl晶胞,思考以下几个问题:1.NaCl晶体中Na+和Cl-的配位数分别为多少?2. NaCl晶体中在Na+周围与它最近且距离相等的Na+共有几个?3.一个NaCl晶胞中含有的Na+和Cl-各是多少?4.“NaCl”这一化学式表示什么含义?学生看到屏幕上NaCl晶胞中体心上的Na+,6个面心上的Cl-不停地闪烁【回答】1.在NaCl晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,所以Na+、Cl-配位数均为6。
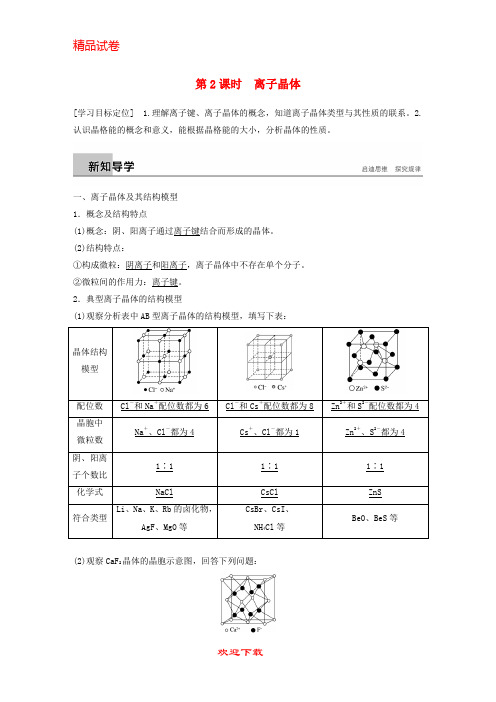
第2课时离子晶体[学习目标定位] 1.理解离子键、离子晶体的概念,知道离子晶体类型与其性质的联系。
2.认识晶格能的概念和意义,能根据晶格能的大小,分析晶体的性质。
一、离子晶体及其结构模型1.概念及结构特点(1)概念:阴、阳离子通过离子键结合而形成的晶体。
(2)结构特点:①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子。
②微粒间的作用力:离子键。
2.典型离子晶体的结构模型(1)观察分析表中AB型离子晶体的结构模型,填写下表:(2)观察CaF2晶体的晶胞示意图,回答下列问题:①该晶胞中含有的Ca 2+数目是4,F -数目是8。
②Ca 2+的配位数是8,F -的配位数是4。
(1)离子键无方向性和饱和性,在离子晶体中阴、阳离子与异电性离子接触尽可能采用最密堆积,可以看作是不等径圆球密堆积。
(2)影响离子晶体配位数的因素①离子半径因素:r +r -值的不同,晶体中离子的配位数不同,其晶体结构不同。
r+r -数值越大,离子的配位数越多。
②电荷因素: AB 型离子晶体的阴、阳离子的配位数相等;AB n 型A 、B 离子的配位数比值为n ∶1。
如CaF 2中Ca 2+的配位数是8,F -的配位数是4。
例1 下列说法中正确的是( ) A .固态能导电的晶体一定是金属晶体B .固态不能导电,水溶液能导电的晶体一定是离子晶体C .熔融状态能导电的晶体一定是离子晶体D .固态不导电而熔融态能导电的晶体一定是离子晶体 答案 D解析 固态时能导电的晶体不一定是金属晶体,如硅和石墨等不是金属晶体,A 不正确;固态不能导电,水溶液能导电的晶体不一定是离子晶体,如P 2O 5等不是离子晶体,B 不正确;金属熔融状态也能导电,C 不正确;离子晶体是阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,熔融状态时电离出自由移动的离子而导电。
方法规律——离子晶体的判断方法(1)依据组成晶体的微粒和微粒间的作用力判断。
(2)依据物质类别判断。

第2节金属晶体与离子晶体1.能用金属键和离子键的理论解释金属晶体和离子晶体的物理性质。
(重点) 2.了解金属晶体的三种原子堆积模型和几种典型离子晶体的晶胞结构。
(难点)3.了解晶格能的概念和意义。
1.概念金属键金属原子通过形成的晶体称为金属晶体。
2.特点由于金属键没有饱和性和方向性,从而导致金属晶体最常见的结构型式具密度大、堆积有高、能充分利用原子配位数等特点。
空间3.常见堆积方式4.物理通性导电有良好的,金属晶体具有金属光泽、。
导热延展性和1.金属在发生变形延展时,金属键断裂吗?【提示】不断裂。
2.金属在通常状况下都是晶体吗?金属晶体的性质与哪些因素有关?【提示】不是,如汞;金属键和金属原子的堆积方式决定金属的性质。
[核心·突破]1.金属物理通性的解释2.金属晶体熔点的影响因素同类型的金属晶体的熔点由金属阳离子半径、离子所带的电荷决定,阳离子半径越小,所带电荷越多,相互作用力就越强,熔点就越高。
例如熔点:Li>Na>K>Rb>Cs,Na<Mg<Al。
[题组·冲关]1.金属能导电的原因是( )A.金属晶体中金属阳离子与自由电子间的相互作用较弱B.金属晶体中的自由电子在外加电场作用下发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子【解析】金属原子失去电子后变为金属离子,失去的电子称为自由电子,自由电子可以在金属晶体中自由移动,在外加电场的作用下,自由电子就会定向移动而形成电流。
【答案】B 2.关于金属晶体的体心立方密堆积的结构型式的叙述中,正确的是( )A.晶胞是六棱柱B.属于A2型最密堆积C.每个晶胞中含4个原子D.配位数为12【解析】金属晶体的体心立方密堆积的晶胞是平行六面体,体心立方密堆积的堆积方式为立方体的顶点和体心各有1个原子,属于A2型最密堆积,每个晶胞中含有8×18+1=2个原子,A2型的配位数为8。

课堂互动三点剖析重点一:金属晶体1。
金属键(1)金属键:金属阳离子与自由电子之间的强烈的相互作用。
(2)成键粒子:金属阳离子和自由电子.(3)成键条件:金属单质或合金。
2。
金属晶体(1)构成:金属离子和自由电子之间通过金属键结合成的晶体。
(2)存在:金属单质及合金.(3)物理性质:熔沸点较高,硬度较大。
良好的导电性、导热性和延展性.(4)具有规则的几何外形。
3.晶胞的排列方式金属晶体是由若干个能够反映晶体结构特征的单元——晶胞排列形成的。
不同的金属,晶胞在其内部有不同的排列方式,大致可分为三类。
(1)六方最密堆积类型(A3).常见金属如:镁、锌、钛等。
(2)面心立方最密堆积类型(A1)。
常见金属如:金、银、铜、铝等.(3)体心立方密堆积类型(A2)。
常见金属如:锂、钠、钾等.4.金属晶体中晶胞所含金属原子数和计算(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞;(2)处于棱上的粒子,同时为4个晶胞所共有,每个粒子有1/4属于该晶胞;(3)处于面上的粒子,同时为2个晶胞所共有,每个粒子有1/2属于该晶胞;(4)处于晶胞内部的粒子,则完全属于该晶胞.5.合金(1)合金:两种或两种以上的金属(或金属与非金属)的融合体。
(2)合金的性质比单纯的金属更优越。
如:普通钢中加入15%铬和约0。
5%镍制不锈钢,铝中加入铜、镁等制成硬铝.重点二:离子晶体1.离子键:(1)定义:阴、阳离子之间强烈的电性作用。
(2)特征:无饱和性和方向性。
(3)本质:电性作用。
(4)存在:离子晶体中。
2。
离子晶体:(1)定义:阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
注意:离子晶体的构成粒子是阴、阳离子,所以在离子晶体中,无分子存在,也无原子存在。
如NaCl、CsCl只表示晶体中阴阳离子个数比,不表示分子式。
(2)常见的AB型离子晶体有NaCl型、CsCl型、ZnS型等。
(3)晶格能:①定义:1 mol离子化合物中阴、阳离子,由相互远离的气态结合成离子晶体所放出的能量;②表示意义:晶格能越大,表示离子键越强,离子晶体越稳定,熔、沸点越高.可借助库仑定律F=221 r qkq来比较;③晶格能的大小:晶格能与离子晶体中阴、阳离子所带电荷的乘积成正比,与阴、阴离子的距离成反比,数学表达式为:晶格能∝r qq21•。

高中化学学习材料金戈铁骑整理制作知能巩固提升一、选择题1.在金属晶体中,自由电子与金属离子碰撞时有能量传递,可以用此来解释的金属的物理性质是( )A.延展性B.导电性C.导热性D.还原性2.(2012·大连高二检测)离子晶体通常具有的性质是( )A.熔点、沸点都较高,难于挥发B.硬度很小,容易变形C.都能溶于有机溶剂而难溶于水D.密度很小3.(双选)有关晶格能的叙述中正确的是( )A.晶格能是气态原子形成1 mol离子晶体释放的能量B.晶格能通常取正值,但是有时也取负值C.晶格能越大,形成的离子晶体越稳定D.晶格能越大,物质的硬度越大4.下列说法中正确的是( )A.晶体是具有一定几何外形的,所以汞不属于金属晶体B.金属一般具有较高的硬度,而钠可以用小刀切割,但钠属于金属晶体C.塑料具有一定延展性,所以塑料属于金属晶体D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体5.离子化合物的熔点与离子的半径、离子所带的电荷数有关,离子的半径越小,离子所带的电荷数越高,则离子化合物的熔点就越高。
①、②、③均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序( )物质①②③离子电荷数 1 1 2键长(10-10 m) 2.31 3.18 2.10A.①>②>③B.③>①>②C.③>②>①D.②>①>③6.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式中正确的是( )A.ZXY3B.ZX2Y6C.ZX4Y8D.ZX8Y127.(2012·无锡高二检测)金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是( )A.金属原子的价电子数少B.金属晶体中有自由电子C.金属原子的原子半径大D.金属键没有饱和性和方向性8.氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,两者的离子间距离和晶体结构类似,有关它们的熔点差别较大的原因叙述中不正确的是( )A.氧化钙晶体中阴、阳离子所带的电荷数多B.氧化钙的晶格能比氯化钠的晶格能大C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定9.金属能导电的原因是( )A.金属晶体中金属阳离子与自由电子间的相互作用较弱B.金属晶体中的自由电子在外加电场作用下发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子10.科学家发现的钇钡铜氧化合物在90 K时具有超导性,若该化合物晶体的晶胞结构如图所示,则该化合物的化学式可能是( )A.YBa2Cu3O4B.YBa2Cu2O5C.YBa2Cu3O5D.YBaCu4O4二、非选择题11.NaCl晶体模型如图所示,(1)在NaCl晶体中,每个Na+周围同时吸引着个Cl-,每个Cl-周围也同时吸引着个 Na+;在NaCl晶胞中含有个Na+、个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有个。

第2节金属晶体与离子晶体名师导航知识梳理一、金属晶体1。
金属晶体是指__________________________________________________________ _____。
金属键起源于金属晶体中____________和____________之间的____________的相互作用,所以金属键没有____________性和____________性。
2。
金属晶体最常见的结构形式具有____________大,____________高,能充分利用空间等特点.Ca、Al、Cu、Ag、Au等金属晶体属于____________型最密堆积,Mg、Zn等金属晶体属于____________型最密堆积,A2型密堆积又称为____________,____________等金属晶体属于A2型密堆积。
A1型配位数为____________,A2型配位数为____________,A3型配位数为____________.3。
金属具有良好的延性、展性和可塑性的原因是____________________________________。
二、离子晶体1.离子晶体是__________________________________________________________ _________的晶体。
例如:____________、____________、____________等晶体都属于离子晶体。
常见的AB型离子晶体有____________型、____________型、____________型等多种类型。
2.氯化钠晶体可视为____________的密堆积.在NaCl晶胞中每个Na+周围有____________个Cl—,每个Cl-周围有____________个Na+。
在一个晶胞中实际拥有____________个Cl-,____________个Na+,“NaCl”代表的是____________________。
第2节金属晶体与离子晶体
(第2课时)
班级__________ 姓名__________
【学习目标】
1、认识离子晶体中微粒间的堆积方式。
2、从化学键和堆积方式这两个角度认识离子晶体熔点、沸点和硬度等性质的特点。
【学习重难点】
重点:离子晶体的堆积方式
难点:离子晶体的堆积方式
【学案导学过程】
NaCl晶体结构示意图
CsCl型
ZnS的晶体结构示意图
【当堂检测】
【基础达标】
1.离子晶体熔点高低决定于阴阳离子的核间距离.晶格能的大小,据所学知识,判断KCl、NaCl、CaO、BaO
四种晶体熔点的高低顺序是()
A. KCl>NaCl>BaO>CaO
B. NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl
D. CaO>BaO>NaCl>KCl
2.氧化钙在2973K时熔化,而氯化钠在1074K时熔化,两者的离子间距离和晶体结构都类似,有关它们熔
点差别较大的原因叙述不正确的是()
A.氧化钙晶体中阴阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型和氯化钠的结构类型不同
D.氧化钙与氯化钠的离子间距类似的情况下,晶格能主要由阴阳离子所带电荷多少决定
3.下列关于金属晶体和离子晶体的说法,错误的是()
A.受外力作用时都易发生形变而破裂
B.都含有离子
C.一般都具有较高的熔点和沸点
D.都可采取“紧密堆积”结构
4.下列离子晶体中,熔点最低的是()
A.NaCl
B.KCl
C.CaO
D.MgO
【综合提高】
5.碱金属和卤素形成的化合物大多具有的性质是()
①固态时不导电,熔化状态导电②能溶于水,其水溶液导电③低熔点④高沸点⑤易升华
A.①②③
B.①②④
C.①④⑤
D.②③④。