宁夏银川市名校化学高考易错100题综合题word含答案
- 格式:doc
- 大小:2.90 MB
- 文档页数:72

宁夏银川市名校化学高考易错100题流程题word含答案一、实验题1.已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2S n)。
回答下列问题:Ⅰ.在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子方程式表示)___________________________________________________。
Ⅱ.浓硫酸具有氧化性,不同浓度的硫酸氧化性不同。
为了探究浓度对硫酸氧化性的影响,某学习小组进行了如下探究:称取一定量无锈铁钉(碳素钢)放入一定体积浓硫酸中,加热,充分反应后得到溶液X 并收集到气体Y。
为了测定气体Y中SO2的含量,设计如下三种方案:方案①:取V mL(标准状况)气体Y通入足量氯水中,然后加入足量BaCl2溶液,经“适当操作”后得干燥固体m g。
方案②:向200.0 mL 0.200 mol/L酸性高锰酸钾溶液中缓慢通入2.24 L(标准状况)气体Y,之后取出20.00 ml溶液转入锥形瓶中加适量水稀释,用浓度为0.100 mol/L的KHC2O4标准液进行滴定,最终消耗标准液10.00ml。
(1)方案①中“适当操作”是指(填操作名称);检验所得固体是否洗涤干净的操作为;(2)已知室温下,0.1mol/L 的KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。
在方案②中,滴定操作过程中标准液应装在(填仪器名称);滴定至终点的现象为;(3)根据方案②计算气体Y中SO2的物质的量分数为;Ⅲ.分析上述实验中SO2体积分数的结果,某同学认为气体Y中还可能含有少量的H2和CO2。
为此设计了下列探究实验装置检验其中的杂质气体(夹持装置已略去)。
(1)仪器D的名称是;B中试剂的作用是;(2)简述确认气体Y中含有CO2的实验现象:________________________________。
(3)根据“F干燥管中无水硫酸铜是否变蓝色”确认气体Y中是否有氢气,你认为是否合理?______(填“合理”或“不合理”),简述理由:___________________________________。

2022届宁夏银川市高考化学100题流程题狂刷集锦word含答案一、实验题1.已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。
请完成下述探究混合物组成的实验。
限选的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
(一)初步探究取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。
用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验可以得到的初步结论是____________________________________________________________。
(二)进一步探究(2)请设计实验方案进一步确定该固体混合物的组成。
叙述实验操作、预期现象和结论。
2.某化学兴趣小组要用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液完成中和热的测定。
(l)实验桌上备有烧杯(大、小各一个)、泡沫塑料、泡沫塑料板、胶头滴管、硫酸、NaOH溶液,尚缺少的玻璃仪器是____________________________.(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.①请填写如表中的空白:②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则中和热△H=______(取小数点后一位).③上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.A.实验装置保温、隔热效果差B.量取NaOH溶液的体积时仰视读数C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.(3)已知:含1mol CH3COOH的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含1molHCl的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。

2020年银川市重点中学高考化学100题综合题狂刷集锦一、综合题1.对于三种气态烃甲烷、乙烷、乙烯,请回答下列问题:(1)等质量的三种烃在相同状况下体积最大的是________。
(2)等质量的三种烃完全燃烧时消耗氧气最多的是________。
(3)等质量的三种烃完全燃烧生成二氧化碳最多的是________,生成水最多的是________。
(4)在120 ℃、1.01×105Pa条件下,与足量的氧气混合点燃,完全燃烧前后气体体积没有变化的烃是________。
2.一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:回答下列问题:(1)步骤①焙烧的目的是_________________________________。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________(填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________。
3.处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)CO2(g)+N2(g)△H。

2020年宁夏银川市重点中学高考化学易错易混100题实验题精粹一、实验题1.某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(Fe x S y)的组成,并探究反应后D 装置所得溶液中含硫化合物的组成。
(一)硫化物(Fe x S y)的组成实验步骤:步骤Ⅰ如图连接装置,检査装置气密性,装入药品;步骤Ⅱ打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;步骤Ⅲ当硬质玻璃管中固体质量不再改变时,停止加热,继续通入—段时间的O2步骤Ⅳ实验结束后,将D中所得溶液加水配制成250 mL溶液;……请回答:⑴仪器a的作用为______________________。
(2)步骤Ⅲ中,停止加热后还需继续通入一段时间的O2,其目的为__________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________________。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。
则Fe x S y的化学式为___________________。
(5)问题讨论:有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。
你认为此方案________(填“是”或“否”)合理,原因为_______________________。
(二)探究反应后D装置所得溶液中含硫化合物的组成。
理论推测:溶液中除含有Na2SO4外,还可能含有Na2SO3。
实验探究:滴定法测定溶液中Na2SO3的含量。
可供选择的试剂:①0.10 mol • L-1 KmnO4酸性溶液②30%H2O2③0.10 mol • L-1 KI淀粉溶液(6)所选试剂为___________(填序号);所选试剂应装在_____________(填“酸式”或“碱式”)滴定管中。
⑦所利用的反应原理为__________________(用离子方程式表示)。

2020年宁夏重点中学高考化学易错100题实验题一、实验题1.某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。
A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4++ OH–= NH3•H2OC.可通过加热方法区别该试剂和(NH4)2SO4D.工业上用NH3等合成该物质的过程可称为氮的固定(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有_____________________________________________________________________________________________。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:___________________________________________________________________________________________ ______________________________________________________。

2022届银川市高考化学基础100题流程题狂练word含答案一、实验题1.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:已知:(1)“酸浸”后得到的残渣中主要含有的物质是.物质X的化学式为.(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)、.(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是.(4)Al(OH)3可添加到塑料中作阻燃剂的原因是.(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO (OH).该电池反应的化学方程式是.(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t 煤矸石中铝元素的回收率为.2.S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。
某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。
加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2S2Cl2。
反应涉及的几种物质的熔沸点如下:该小组设计的制备装置如下图(夹持仪器已略去)回答下列问题:(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是(填写字母)(3)装置B、C中的试剂分别是。
(4)装置D中仪器a的作用是。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。
用离子方程式表示产生该现象的原因____________。

宁夏银川市新高一下学期化学综合题大全本练习含答案有解析1.核安全与放射性污染防治已引起世界核大国的广泛重视。
在爆炸的核电站周围含有放射性物质碘一131和铯一 137。
碘—131—旦被人体吸入,可能会引发甲状腺等疾病。
(l)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种金属元素X、Y、Z 的电离能如下表元素代号X Y Z第一电离能(kJ·mol-1) 520 496 419上述三种元素X、Y、Z的元素符号分别为_________,基态Z原子的核外电子排布式为______,X形成的单质晶体中含有的化学键类型是_________________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为______、______,BeF2分子的立体构型是____________,H2O分子的立体构型是________________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。
BC13分子中B—C1键的键角为__________________。
(4) 131I2晶体的晶胞结构如图甲所示,该晶胞中含有____个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻______个I-。
(5)KI晶体的密度为ρg • cm 3,K和I的摩尔质量分别为M K g • mol-1和M I g • mol-1,原子半径分别为r K pm 和r I pm,阿伏加德罗常数值为N A,则KI晶胞中原子的体积占晶胞体积的百分率为_____________。
2.Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。
处理含镉废水可采用化学沉淀法。
试回答下列问题:(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式K sp=________。
(2)一定温度下,CdCO3的K sp=4.0 × 10-12,Cd(OH)2的K sp=3.2 × 10-14,那么它们在水中的溶解量________较大。

银川市名校新高一下学期化学易错综合题单选题有答案含解析1.以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示。
回答下列问题:(1)淀粉的组成可表示为___________,A分子中的官能团名称为__________。
(2)反应⑦中物质X的分子式为________,反应⑧的类型为______________。
(3)反应⑤的化学方程式为________________________________________________。
(4)反应⑥可用于实验室制乙烯,为除去其中可能混有的SO2,可选用的试剂是________。
A.溴水 B.酸性KMnO4溶液 C.NaOH溶液 D.浓硫酸(5)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为____________。
(6)为了证明反应①是否发生,可取①反应后的溶液2mL于一支试管中,用____调节溶液至中性,再向其中加入2 mL_____,再加入4~5滴_____(以上用如下所提供试剂的字母填空),加热一段时间,若有______________现象产生,则证明反应①已发生。
实验中可供选择的试剂:A.10%的NaOH溶液 B.2%的氨水 C.5%的CuSO4溶液 D.碘水2.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应率的影响。
设计实验如表(所取溶液体积均为5mL):实验编号实验温度/℃ c (Na2S2O3)/mol·L-1c(H2SO4)/mol·L-1①25 0.1 0.1②25 0.2 0.2③50 0.2 0.1④50 0.1 0.1(1)其他条件不变时:探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(2)Na2S2O3和H2SO4反应的离子方程式为__________。
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1__________t2(选填“>”、“<”或“=”)。
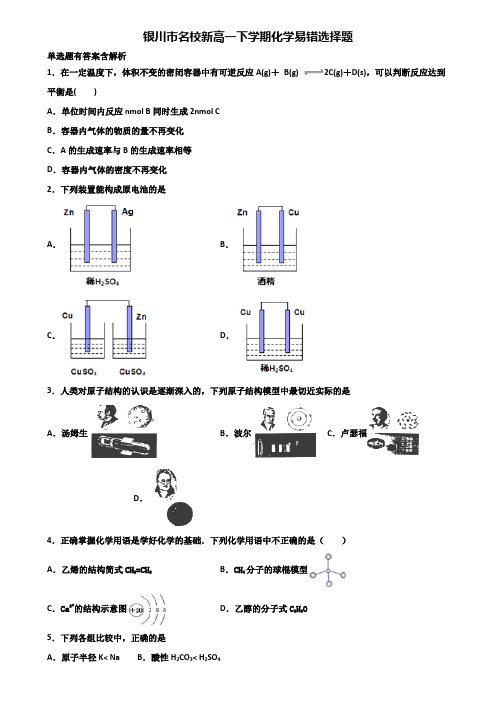
银川市名校新高一下学期化学易错选择题单选题有答案含解析1.在一定温度下,体积不变的密闭容器中有可逆反应A(g)+B(g) 2C(g)+D(s),可以判断反应达到平衡是()A.单位时间内反应nmol B同时生成2nmol CB.容器内气体的物质的量不再变化C.A的生成速率与B的生成速率相等D.容器内气体的密度不再变化2.下列装置能构成原电池的是A.B.C.D.3.人类对原子结构的认识是逐渐深入的,下列原子结构模型中最切近实际的是A.汤姆生B.波尔C.卢瑟福D.4.正确掌握化学用语是学好化学的基础.下列化学用语中不正确的是()A.乙烯的结构简式CH2=CH2B.CH4分子的球棍模型C.Ca2+的结构示意图D.乙醇的分子式C2H6O5.下列各组比较中,正确的是A.原子半径K< Na B.酸性H2CO3< H2SO4C .稳定性HF< HCID .碱性NaOH< Mg(OH)26.有关电化学知识的描述正确的是A .由于CaO+H 2O Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池B .当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快C .原电池的电极附近溶液pH 的变化可以用电池总反应式来判断D .铅蓄电池放电时的正极反应式为PbO 2 +4H + +2e -Pb 2+ +2H 2O7.某元素的原子的最外层电子数是次外层的a 倍(a>1),则该原子核内质子数是( )A .2aB .a+2C .2a+10D .2a+28.某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能是A .C 2H 6B .C 4H 10 C .C 5H 12D .C 8H 189.下列有关化学用语表示正确的是( )A .H 2O 2的电子式:H +[]2-H +B .Cl -的结构示意图:C .原子核中有10个中子的氧离子:188O 2—D .HClO 的结构式H-Cl-O 10.化学与环境、材料、信息、能源关系密切,下列说法正确的是( )A .绿色化学的核心是应用化学原理对环境污染进行治理B .蛋白质和油脂都属于高分子化合物,一定条件下都能水解C .PM2.5是指大气中直径接近2.5×10-6m 的颗粒物,分散在空气中形成胶体D .聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物11.医用生理盐水中氯化钠的质量分数为A .0.9%B .3%C .30%D .90%12.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A .B .C .D .13.在5mL0.1mol /LKI 溶液中滴加30.1mol /LFeCl 溶液56~滴后,再进行下列实验,其中可证明3FeCl溶液和KI 溶液的反应是可逆反应的实验是( )A .再滴加3AgNO 溶液,观察是否有AgI 沉淀产生B .加入4CCl 振荡后,观察下层液体颜色C .加入4CCl 振荡后,取上层清液,滴加KSCN 溶液,观察是否出现红色D .加入4CCl 振荡后,取上层清液,滴加3AgNO 溶液,观察是否有AgCl 沉淀产生14.实现下列变化的有机反应的类型,不正确的是A .CH 3CH 3 →CH 3CH 2Cl 取代反应B .CH 2==CH 2→CH 2BrCH 2Br 加成反应C .CH 2==CH 2→CH 3CH 2OH 取代反应D .CH≡CH→CHBr==CHBr 加成反应15.下列化学式只表示一种纯净物的是A .C 2H 6B .C 4H 10 C .C 2H 4Cl 2D .C 16.下列物质中,属于天然高分子化合物的是A .淀粉B .油脂C .葡萄糖D .聚乙烯17.下列有关氯元素及其化合物的表示正确的是( )A .质子数为17、中子数为20的氯原子:2017ClB .氯离子(Cl -)的结构示意图:C .氯分子的电子式:D .氯乙烯分子的结构简式:H 3C -CH 2Cl18.下列说法不正确...的是 A .CH 3COOH 与HCOOCH 3互为同分异构体B .3517Cl 与3717Cl 互为同位素 C .CH 2=CH 2与CH 2=CHCl 互为同系物 D .O 2与O 3互为同素异形体 19.(6分)锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。

银川市名校新高一下学期化学易错推断题填空题有答案含解析1.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 02 ①②③3 ④⑤⑥⑦⑧4 ⑨⑩(用元素符号或化学式回答下列问题)(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。
2.A、B、C、D、E、F是六种核电荷数依次增加的短周期元素,它们位于三个不同的周期,B原子的电子数是最内层电子数的三倍,C和E位于同一主族且它们可形成EC2、EC3两种常见化合物,D的最髙价氧化物对应的水化物是强碱,E和F相邻。
回答下列问题:(1)写出B在元素周期表中的位置___________;(2)写出A、C、F三种元素组成的一种弱电解质的结构式___________;(3)能说明非金属性F比E强的两个实例_______、___________;(4)化合物DA遇水会发生剧烈的化学变化,请写出该反应的化学方程式_____________;(5)金属镁在BC2中燃烧的化学方程式________________________。
3.烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:(1)写出决定B、D性质的重要原子团的名称:B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:①______________________,反应类型:_______;②_________________,反应类型:________。

银川市名校新高一下学期化学易错实验题本练习含答案有解析1.某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。
查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。
实验如下:(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。
取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。
实验序号反应前黑色固体质量/g 充分反应后黑色固体质量/gI 48.0 48.0Ⅱ48.0 44.0Ⅲ48.0 40.0根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。
2.在实验室里,常用如图所示装置制取并收集氨气。
请回答下列问题:(1)原理与方法①制取氨气的化学方程式为__________________________________;②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法(2)装置与操作按下图组装仪器,进行实验。
宁夏银川市名校化学高考易错100题综合题word含答案一、综合题1.有机物N()是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:已知:I.R-CH=CH2+HBr R-CH2CH2BrII.R-CH2-CN R-CH2-COOH请回答下列问题:(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
2.某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):已知:(a)(b) (苯胺易被氧化)请回答下列问题:(1)D的结构简式为____;烃A的分子式为________。
(2)反应②的反应类型是__________。
(3)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是_______;A.水溶性比苯酚好 B.能发生消去反应,也能发生聚合反应C.既有酸性又有碱性 D.1mol该物质最多可与4molH2发生反应②E 与足量NaOH 溶液反应的化学方程式为_______________。
(4)符合下列条件的抗结肠炎药物有效成分的同分异构体有____种。
A.遇FeCl3溶液发生显色反应B.分子中甲基与苯环直接相连C.苯环上共有三个取代基(5)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A 为原料合成邻氨基苯甲酸 ()合成路线中两种中间产物的结构简式(部分反应条件已略去)。
A→________→_________→____________3.肼(N2H4)与N2O4是火箭发射中最常用的燃料与助燃剂,回答下列问题:(1)T℃时,将一定量的NO2或N2O4充入一个容积为2L的恒容密闭容器中,发生反应2NO2(g)N2O4(g),保持温度不变,各物质的浓度随时间变化关系如下表:①c(Y)代表___________(填化学式)的浓度,20~40s内,用NO2表示的化学反应速率为___________。
②该反应的平衡常数K=___________。
③60s时容器内混合气体的密度为_____g·L-1。
④100s时改变的条件是___________,重新达到平衡时,与原平衡比较,NO2的体积分数将___________(填“增大”“减小”或“不变”)。
(2)①已知2N2H4(g)+N2O4(g)3N2(g)+4H2O(g) △H=-QkJ·mol-1,相关化学键的键能如表所示。
使 1molN2O4(g)完全分解成相应的原子时需要吸收的能量是___________kJ(用代数式表示)②相同温度下,向Ⅰ、Ⅱ、Ⅲ三个恒压密闭容器中均充入1molN2H4(g)和1molN2O4(g),三个容器的反应压强分别为p1、p2、p3。
在其它条件相同的情况下,反应进行到tmin时,N2的体积分数如图所示,此时容器I___________(填“处于”或“不处于”)化学平衡状态,原因是___________。
4.铜是人类最早发现并广泛使用的一种金属。
向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。
回答下列问题:(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。
Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)NH3中N原子的杂化方式是_________,乙醇分子中采用同样杂化方式的原子有_________________个。
(5)硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为_________。
(6)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是________。
若该晶体结构为长方体,其参数如图,阿伏加德罗常数为N A,则该氧化物的密度为_________g·cm-3。
5.据科技日报道南开大学科研团队借助镍和苯基硼酸共催化剂,实现丙烯醇绿色合成。
丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。
丙烯醇的结构简式为CH2=CH-CH2OH。
请回答下列问题:(1)基态镍原子的电子排布式为________。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为_____,丙烯醇分子中碳原子的杂化类型为_____。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。
羰基镍晶体类型是___________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。
[Ni(NH3)6]2+中心离子的配位数是______ ,与SCN-互为等电子体的分子为_______。
(6)“NiO”晶胞如图所示。
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为______。
②已知:氧化镍晶胞密度为dg/cm3,N A代表阿伏加德罗常数的值,则Ni2+半径为______nm(用代数式表示)。
(Ni的相对原子质量为59)6.锂离子蓄电池能量高、循环寿命长和对环境友好的显著优点,其含氟类锂化合物电解质的稳定性一直受业界高度重视。
LDFCB的结构如图所示:(1)基态F原子电子的电子排布图(轨道表达式)为_______,基态Li原子电子占据最高能级的电子云轮廓图为_______(2)LDFCB中的碳、硼杂化轨道类型为________,其负离子水溶性_______(填“较好”或“不好”),理由是_______。
(3)Li(CF3SO3)作为锂离子电池的电解质,在接收或失去Li+时形成新的正负离子而传递锂离子,新的正负离子化学式分别是_______、_______。
(4)锂晶体是体心立方结构(见图),中心点坐标是________,若晶胞边长为apm,则锂原子的半径r为_________pm。
7.核安全与放射性污染防治已引起广泛关注。
在爆炸的核电站周围含有放射性物质碘-131和钙-137。
碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:基态Z原子倒数第二层电子的排布式为______。
X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4 ,二者酸性强弱顺序为:H5IO6________HIO4(选填">"或"<"“=”)。
从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。
(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。
KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为r k cm和r I cm,阿伏加德罗常数的值为N A,则 KI晶胞中的空间利用率为_______.[空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]8.十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NO x为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:反应①2NO(g)+2CO(g)N2(g)+2CO2(g) △H1。
(1)已知:反应②N2(g)+O2(g)2NO(g) △H2=+180.5kJ·mol−1,CO的燃烧热为283.0kJ·mol−l,则△H1=___。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,下图为平衡时NO的体积分数与温度、压强的关系。
①温度:T1____T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。
将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。
若低于200℃,图2中曲线中脱氮率随温度升高而变化不大的主要原因为____;a点 ___(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:第一步I2(g)2I(g)(快反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述正确的是____。