化合价规律
- 格式:docx
- 大小:23.31 KB
- 文档页数:4

化合价的计算与规律给了化合式之后,若知道一个元素的化合价,可将其化合价与其分子中该元素的原子数相乘。
因化合价的电性为零,将零减去上一个化合价与该元素原子数的积再除以分子中另一元素的原子数,即得到另一元素化合价。
给了两元素的化合价,求出化合价的绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价的表示方法:正负化合价用+1,+2,+3,-1,-2……0等要标在元素符号的正上方。
确定化合物中元素的化合价,需注意∶(1)化合价有正价和负价;(2)氧元素通常显-2价。
(3)氢元素通常显+1价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同的化合价。
(6)在化合物里正负化合价的代数和为0.(7)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为0.初中化学确定元素化合价的方法一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能,现就其在初中范围内作一归纳,以期对同学们的学习有所帮助。
一、根据与其他元素组成的化合物化学式确定【例1】试确定化合物K2MnO4中Mn元素的化合价。
解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
二、根据元素的原子电子层结构特征确定【例2】元素X的原子最外层上有1个电子,元素Y的原子外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[ ]A.XY B.X2Y C.XY2 D.X3Y解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。
因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。

元素的化合价口诀
【最新版】
目录
1.引言:化合价的概念
2.化合价的规律
3.化合价的计算方法
4.化合价口诀的意义和应用
5.结论:化合价口诀的重要性
正文
1.引言:化合价的概念
化合价是化学中一个重要的概念,它表示一个原子在化学反应中能够与其他原子结合的数量。
化合价是元素化学性质的基础,对于理解和掌握化学反应具有重要意义。
2.化合价的规律
化合价的规律主要有以下几点:
(1)元素的化合价通常是一个整数,正负号表示化合价的性质,正值表示氧化性,负值表示还原性。
(2)元素的化合价具有周期性,即随着元素周期表中的原子序数的增加,化合价呈现出规律性的变化。
(3)化合物中正负化合价的代数和为零,这是由于化合物中电子的共享和转移导致的。
3.化合价的计算方法
计算化合价的方法有多种,常见的有以下几种:
(1)根据元素的电子层结构和最外层电子数计算。
(2)根据元素在化合物中的角色,如氧化剂或还原剂,判断其化合价。
(3)根据化合物的结构和性质,通过实验测定元素的化合价。
4.化合价口诀的意义和应用
化合价口诀是帮助我们记忆和快速计算元素化合价的一种方法。
它能够帮助我们快速掌握元素的化合价规律,提高化学反应的计算效率。
在实际应用中,化合价口诀对于解决化学反应方程式、判断化合物的稳定性等问题具有重要作用。
5.结论:化合价口诀的重要性
化合价口诀是化学学习中不可或缺的一部分,它能够帮助我们快速掌握元素的化合价规律,提高化学反应的计算效率。

化合价的一般规律(1)化合价有正价和负价之分(2)在化合物里氢元素通常显+1价、氧元素-2价。
(3)金属元素在化合物中通常显正价。
(4)非金属元素与氢元素和金属结合形成化合物时显负价、与氧元素结合时显正价。
(5)单质里元素的化合价为零。
(6)化合物里正负化合价的代数和为0(7)原子团的化合价在数值上等于原子团所带的电荷数(8)同一元素可以有不同的化合价十字交叉法书写化学式的步骤:一排顺序二标价. 价数交叉写右下.约简价数作角码. 总价为零去检查.化合价与离子符号表示方法的比较区别:位置不同,写法相反1.离子符号和化合价的表示方法不同:离子:数字在前,“+、-”号在后;写在右上角。
化合价:数字在后,“+、-”号在前;写头顶上2.离子符号中数字1可省略,化合价中数字1不能省略联系:同种元素的化合价与离子的电荷,通常数值相等,正负相同。
. 对化学式符号周围数字的探究①符号的前面的数字表示几个分子、原子或离子。
②符号的右下角的数字表示分子中的原子个数③符号顶上的数字表示元素的化合价④符号右上角的数字表示离子所带的电荷数有关化学式的计算1、计算物质的相对分子质量(Mr)相对分子质量=(相对原子质量×原子个数)之和2、计算化合物分子中原子个数比3、计算物质组成元素的质量比元素质量比=(相对原子质量×原子个数)之比4、计算物质中某一元素的质量分数变形:物质的相对分子质量该元素的相对原子质量×该元素的原子个数元素的质量分数×100% =5、元素质量与化合物质量的相互换算某元素的质量=化合物的质量×某元素的质量分数化合物的质量=某元素的质量÷某元素的质量分数6、依据化学式求不同物质中含相同元素的质量7、有关混合物中元素质量或元素质量分数的计算纯度:即混合物中某物质的质量分数纯净物的质量纯度= ×100%混合物的质量混合物中:元素的质量=混合物的质量×纯度×该元素的质量分数 ①该元素的质量元素的质量分数 = ×100% ② 混合物的质量把①代入②可得:元素的质量分数=纯度×该元素的质量分数解题要点:根据化学式的计算要注意:(1)正确书写化学式;(2)准确理解化学式中和式前数字的含义(3)元素符号之间用“+”号,元素符号与数字之间有“×”号。
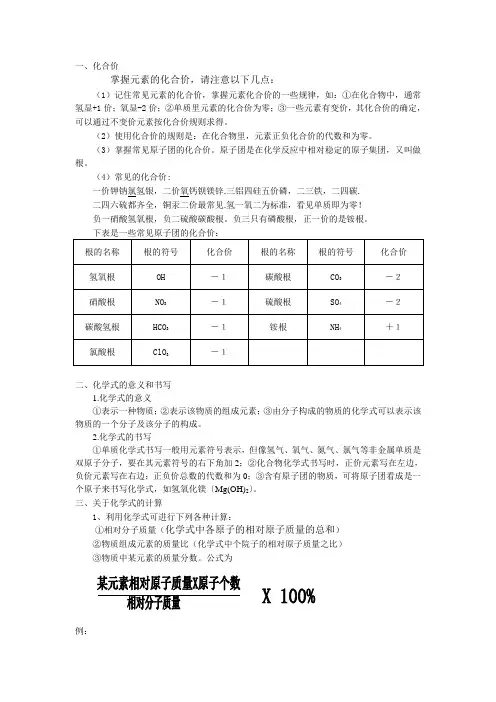
一、化合价掌握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,掌握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,可以通过不变价元素按化合价规则求得。
(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(3)掌握常见原子团的化合价。
原子团是在化学反应中相对稳定的原子集团,又叫做根。
(4)常见的化合价:一价钾钠氯氢银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁,二四碳.二四六硫都齐全,铜汞二价最常见.氢一氧二为标准,看见单质即为零!负一硝酸氢氧根,负二硫酸碳酸根。
负三只有磷酸根,正一价的是铵根。
下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH -1碳酸根CO3-2硝酸根NO3-1硫酸根SO4-2碳酸氢根HCO3-1铵根NH4+1氯酸根ClO3-1二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式可以表示该物质的一个分子及该分子的构成。
2.化学式的书写①单质化学式书写一般用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔Mg(OH)2〕。
三、关于化学式的计算1、利用化学式可进行下列各种计算:①相对分子质量(化学式中各原子的相对原子质量的总和)②物质组成元素的质量比(化学式中个院子的相对原子质量之比)③物质中某元素的质量分数。
公式为例:1.写出下列物质的化学式或名称:高锰酸钾;硫酸钾;碳酸钠;氯化钾;氯气;铁;氢气;氧化铜;水;二氧化碳;氩;四氧化三铁;氢氧化钙;硝酸铵;氯化镁;碳酸氢铵。
2.写出下列物质的名称Cu H2O Ne SiO2P2O5K2O AgCl ZnO NaCl K2MnO4Al2O3SO2NH4Cl CaCO3Mg(NO3)23.用化学符号表示:两个碳原子三个水分子四个氮分子一个二氧化硫分子三个氢原子一个钠原子两个铁原子两个氖分子四、根据化合价写化学式正价在左,负价在右1、交叉法:在元素上方标上化合价,先化简再交叉,如P为+5价,氧为-2价,交叉后为P2O52、最小公倍数法,选求出几种元素化合价的最小公倍数,再根据最小公倍数求各元素的原子数。

一、知识窗1、化合价的定义:元素的原子间相互形成化合物时表现出的数目关系,叫做化合价。
化合价是对元素而言。
2、化合价的表示方式:标在元素符号的正上方,正负号在前数字在后。
例:表示氧化铜中铜元素呈+2价化合价口诀:一价钾、钠、银、氢、氯,二价氧、镁、钙、钡、锌;三铝、四硅、铜正一、二,二、四、六硫二、四碳;三、五氮、磷,四、七锰;铁为二、三铜一、二;其实只要记住+1价:K、Na、H;+2价:Ca、Mg、Zn;-2价:O就行了。
一般:金属只有一种化合价;非金属有多种化合价3、化合价规律:化合物中,各种元素化合价的代数和为零;单质的化合价为零。
原子团中:正负化合价代数和等于其电荷数4、化学式:根据元素的化合价用元素符号表示物质组成的式子,叫化学式。
化学式表示意义:①表示该物质,②表示该物质的组成元素,③表示该物质的一个分子,④表示-个该分子由几个某原子组成。
3、化合价规律:化合物中,各种元素化合价的代数和为零;单质的化合价为零。
4、化学式:根据元素的化合价用元素符号表示物质组成的式子,叫化学式。
化学式表示意义:①表示该物质,②表示该物质的组成元素,③表示该物质的一个分子,④表示-个该分子由几个某原子组成。
练一练:1、请求KMnO4和K2MnO4中Mn元素的化合价。
请求HCl、Cl2、HClO、KClO3中Cl 元素的化合价。
2、请求下列原子团中元素的化合价:NO3-、ClO-、ClO3—、ClO4—、HCO3 -、CO3 2-、C2O42—、S2O32—、SO32—、SO42—、Cr2O42—、FeO42—3、求RO43-中和R2O72-申R的化合价。
4、请求下列原子团中元素的化合价:NH4、NO、NO2;SO2、SO42-、CO32-,PO43-。
5、下列五种物质按一定规律排列如下:①、KI ②、I2 ③、HIO ④、X ⑤、NaIO4,X 不可能的是()A、AgIB、I(IO3)2C、I2O4D、I2O5练习一、选择题(每小题有一个答案符合题意)1.下列化合物中,R元素的化合价为+1价的是()。

元素化合价规律及其应用一、元素化合价规律〔1〕化合价原则:在化合物里,元素正负化合价的代数和为零。
〔2〕在化合物里,氢通常显+1价,氧通常显-2价。
〔3〕金属元素通常显正价,非金属元素通常显负价〔但在非金属氧化物里,氧显负价,另一非金属元素显正价〕。
〔4〕单质分子里,元素的化合价为零。
〔5〕许多元素具有可变化合价。
例如:Fe有+2、+3价;Cl有-1、+1、+3、+5、+7价。
〔6〕原子团的化合价由构成元素原子的正负化合价的代数和算二、化合价规律的应用在化合物里,各元素正负化合价的代数和为零。
这一原则是计算化学式里元素化合价的根据,也是判断化学式是否正确的依据。
化合价规律的应用如下:〔1〕根据化合价原则,书写化学式。
例如:书写硫酸铝的化学式。
①正价左,负价右:Al〔SO4〕。
③写右下,验正误:Al2(SO4)3〔+3〕×2+〔-2〕×3=0〔2〕根据化合价原则,计算未知元素的化合价。
例如:计算H2RO3中R元素的化合价。
②列出式子求解:〔+1〕×2+〔+x〕×1+〔-2〕×3=0,X=+5。
〔3〕根据化合价原则,判断化学式的正误。
例如:判断碳酸钾〔KCO3〕的化学式是否正确。
②计算正负化合价代数和是否为零:〔+1〕×1+〔-2〕×1=-1≠0。
所以给出的化学式是错误的,正确的化学式应为K2CO3。
怎样确定化合价化合价由正、负和数值的两个方面来表示。
1.元素的化合价是元素的一种性质。
2.这种性质是不同元素的原子在相互化合时表现出来的。
3.什么性质呢?它就是一种元素一定数目的原子和其他元素一定数目的原子相化合即化合的各元素的原子个数比是确定的。
4.元素的这种性质是由其原子结构决定的。
还记得离子化合物和共价化合物是怎样形成的?离子化合物是由阴、阳离子相互作用而构成的。
共价化合物是以共用电子形成分子的。
由于形成方式不同,所以在离子化合物或共价化合物中元素化合价的实质是不同的。

化合价的计算与规律给了化合式之后,若知道一个元素的化合 中该元素的原子数相乘。
因化合价的电性为零 该元素原子数 的积再除以分子中另一元素的原 价。
给了两元 素的化合价,求出化合价的绝对公倍数除以化 合价绝对值即求出分子中原子数化合价的 表示方法:正负化合价用 +1, 元素符号的正上方。
确定化合物中元素的 化合价,需注意: (1) 化合价有正价和负价(2) 氧元素通常显-2价。
(3) 氢元素通常显+1价。
(4) 金属元素跟非金属元 素化合时,金属元素显正价,非金属元素显负中可显不同的化合价。
价的代数和为0. 的原子在形成化合物时表现出来 因此,在单质 分子里,元素的化合价 为0.初中化学确定元素化合价的方法一定数目 的一种元素的原子跟一定数目的 质,叫元素的 化合价。
它是元素的一个重要性 中生应掌握的 一种基本技能,现就其在初中范 们的学习有所帮助。
一、根据与其他元素组成的化合物化学式 【例1】试确定化 合物K2MnO4中Mn 元素的化合 价解析:设化合物中 Mn 元素化合价为+x 价,依化合物中 各元素化合价正 负代数和为零 的原则有2×( +1) +1×( +x ) +4×( -2 ) =0解之得x=6故K2Mn θ仲Mn 元素化合价为+6价。
、根据 兀素的原子电子层结构特征确定【例2】元素X 的原子最外层上 有1个电子,元素 Y 的原子外层上有 6个电子,则X 、Y 两元素可形 成的化合物的化学式为[] A. XY B . X2Y C . XY2 D . X3Y解析:本 题的关键可以说是首先得确定在 形成化合物时,X 、Y 两元素 所表现的化合价。
因X 最外层上只有1个电子,最高正价为+1价,Y 最外 层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X 、Y 所 形成化合物分子式为X2Y ,应选B O价,可将其化合价与其分子 ,将零减去上一个化合价与 子数,即得到另一元素化合 值之最小公倍数。

给了化合式之后,若知道一个元素得化合价,可将其化合价与其分子中该元素得原子数相乘。
因化合价得电性为零,将零减去上一个化合价与该元素原子数得积再除以分子中另一元素得原子数,即得到另一元素化合价。
给了两元素得化合价,求出化合价得绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价得表示方法:正负化合价用+1,+2,+3,-1,-2……0等要标在元素符号得正上方。
确定化合物中元素得化合价,需注意∶(1)化合价有正价与负价;(2)氧元素通常显-2价。
(3)氢元素通常显+1价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同得化合价。
(6)在化合物里正负化合价得代数与为0、(7)元素得化合价就是元素得原子在形成化合物时表现出来得一种性质,因此,在单质分子里,元素得化合价为0、初中化学确定元素化合价得方法一定数目得一种元素得原子跟一定数目得其她元素得原子化合得性质,叫元素得化合价。
它就是元素得一个重要性质,确定元素得化合价就是初中生应掌握得一种基本技能,现就其在初中范围内作一归纳,以期对同学们得学习有所帮助。
一、根据与其她元素组成得化合物化学式确定【例1】试确定化合物K2MnO4中Mn元素得化合价。
解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数与为零得原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6故K2MnO4中Mn元素化合价为+6价。
二、根据元素得原子电子层结构特征确定【例2】元素X得原子最外层上有1个电子,元素Y得原子外层上有6个电子,则X、Y两元素可形成得化合物得化学式为[]A.XY B.X2Y C.XY2 D.X3Y解析:本题得关键可以说就是首先得确定在形成化合物时,X、Y两元素所表现得化合价。
因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。

化合价的计算与规律给了化合式之后,若知道一个元素的化合中该元素的原子数相乘。
因化合价的电性为零该元素原子数的积再除以分子中另一元素的原价。
价,可将其化合价与其分子,将零减去上一个化合价与子数,即得到另一元素化合给了两元素的化合价,求出化合价的绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价的表示方法:正负化合价用+1, +2, +3,-1 ,- 2⋯⋯ 0 等要标在元素符号的正上方。
确定化合物中元素的化合价,需注意∶(1)化合价有正价和负价;(2)氧元素通常显 -2 价。
(3)氢元素通常显 +1 价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同的化合价。
(6)在化合物里正负化合价的代数和为 0.(7)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为 0.初中化学确定元素化合价的方法一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能,现就其在初中范围内作一归纳,以期对同学们的学习有所帮助。
一、根据与其他元素组成的化合物化学式确定【例 1】试确定化合物K2MnO4中Mn元素的化合价。
解析:设化合物中Mn元素化合价为+x 价,依化合物中各元素化合价正负代数和为零的原则有2×( +1) +1×( +x) +4×( -2 ) =0 解之得 x=6故K2MnO4中Mn元素化合价为+6 价。
二、根据元素的原子电子层结构特征确定【例 2】元素X 的原子最外层上有1个电子,元素Y 的原子外层上有6个电子,则 X、 Y 两元素可形成的化合物的化学式为[ ]A.XY B. X2Y C.XY2 D.X3Y解析:本题的关键可以说是首先得确定在形成化合物时,X、 Y 两元素所表现的化合价。

化合价的定义及计算规律是什么化合价的定义及计算规律是什么化合价是一种元素的一个原子与其他元素的原子化合{即构成化合物}时表现出来的性质。
下面是店铺给大家整理的化合价的定义及计算规律是什么,希望能帮到大家!化合价的定义中学是物质中的原子得失的电子数或共用电子对偏移的。
化合价表示原子之间互相化合时原子得失电子的数目。
化合价也是元素在形成化合物时表现出的一种性质。
元素在相互化合时,反应物原子的个数比并不是一定的,而是根据原子的最外层电子数决定的。
比如,一个钠离子(化合价为+1,失去一个电子)一定是和一个氯离子(化合价为-1,得到一个电子)结合。
而一个镁离子(化合价为+2,失去两个电子)一定是和2个氯离子结合。
如果形成的化合物的离子的化合价代数和不为零,就不能使构成离子化合物的阴阳离子和构成共价化合物分子的原子的最外电子层成为稳定结构。
也就不能形成稳定的化合物。
化合价的概念就由此而来,那么元素的核外电子相互化合的数目,就决定了这种元素的化合价,化合价就是为了方便表示原子相互化合的数目而设置的。
学习化合价时你应该了解化合物中元素化合价的规定。
另外,规定单质分子里,元素的化合价为零,不论离子化合物还是共价化合物,其组成的正、负离子的化合价的代数和均为零。
离子化合物,例:NaOH(钠化合价是正1价,氢氧根离子化合价是负1价,相互抵消为零价这样的化合物写法就成立)化合价——原子形成化学键的能力。
是形成稳定化合物中的彼此元素的化学性质。
(即达成各元素形成稳定结构的一种能力性质) 注意:元素的“化合价”是元素的'一种重要性质,这种性质只有跟其他元素相化合时才表现出来。
就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,因此单质元素的化合价为“0”。
比如铁等金属单质、碳等非金属单质、氦等稀有气体。
大学<大学里化合价和中学的化合价定义不一样,中学的化合价在大学被定义为氧化数>定义:某元素一个原子的表观电荷数,这个电荷数是假设把每一个化学键中的电子指定给电负性更大的原子而求得的。

给了化合式之后,若知道一个元素的化合价,可将其化合价与其分子中该元素的原子数相乘。
因化合价的电性为零,将零减去上一个化合价与该元素原子数的积再除以分子中另一元素的原子数,即得到另一元素化合价。
给了两元素的化合价,求出化合价的绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价的表示方法:正负化合价用+1,+2,+3,-1,—2……0等要标在元素符号的正上方。
确定化合物中元素的化合价,需注意∶(1)化合价有正价和负价;(2)氧元素通常显—2价。
(3)氢元素通常显+1价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同的化合价.(6)在化合物里正负化合价的代数和为0。
(7)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为0.初中化学确定元素化合价的方法一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能,现就其在初中范围内作一归纳,以期对同学们的学习有所帮助。
一、根据与其他元素组成的化合物化学式确定【例1】试确定化合物K2MnO4中Mn元素的化合价。
解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(—2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
二、根据元素的原子电子层结构特征确定【例2】元素X的原子最外层上有1个电子,元素Y的原子外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[]A.XY B.X2Y C.XY2 D.X3Y解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价.因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为—2价,则X、Y所形成化合物分子式为X2Y,应选B.三、根据相对原子质量及该元素在化合物中的质量分数或各元素间质量比确定【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[ ]A.+1 B.+2 C.+3 D.+4解析:设该元素的氧化物化学式为RxOy依题意有解得故化学式为R2O3,R化合价为+3价,选C.四、根据质量守恒定律确定【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是 [ ]A.+1 B.+2 C.+3 D.+4解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
给了化合式之后,若知道一个元素的化合价,可将其化合价与其分子中该元素的原子数相乘。
因化合价的电性为零,将零减去上一个化合价与该元素原子数的积再除以分子中另一元素的原子数,即得到另一元素化合价。
给了两元素的化合价,求出化合价的绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价的表示方法:正负化合价用+1,+2,+3,-1,-2……0等要标在元素符号的正上方。
确定化合物中元素的化合价,需注意∶(1)化合价有正价和负价;(2)氧元素通常显-2价。
(3)氢元素通常显+1价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同的化合价。
(6)在化合物里正负化合价的代数和为0.(7)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为0.初中化学确定元素化合价的方法一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能,现就其在初中范围内作一归纳,以期对同学们的学习有所帮助。
一、根据与其他元素组成的化合物化学式确定【例1】试确定化合物K2MnO4中Mn元素的化合价。
解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
二、根据元素的原子电子层结构特征确定【例2】元素X的原子最外层上有1个电子,元素Y的原子外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[ ]A.XY B.X2Y C.XY2 D.X3Y解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。
因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
化合价知识规律总结(一)1.元素化合价口诀:一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅五价磷;二三铁,二四碳;二四六硫都齐全,铜汞二价最常见;2.单质,化合物总价数都为零。
3.酸根化合价:一价硝铵氢氧根,二价硫碳酸根。
4.根据元素的化合价写化学式的一般规律(1)正价左,负价右,排好元素符号的顺序:AlO;(2)标出各元素的化合价:;(3)化合价交叉、约简:;(4)得化学式:Al2O3;(5)用化合价原则检查:(+3)×2+(-2)×3=0。
知识应用(一)1.标出下列加点元素的化合价:S.、S.O2、S.O3、H2S.O4、N.H4N.O3、NaC.l、C.12、2.已知铁为+3价,写出硫酸铁的化学式。
3.已知写出氯化钠的化学式。
4.石灰水是氢氧化钙溶于水得到的,写出氢氧化钙的化学式。
5.二氧化氯是一种新型的自来水消毒剂,该物质的化学式是,其中氯元素的化合价是。
6.许多元素在不同的化合物中会表现出不同的化合价,化学上通常把同一种元素的高价化合物按正常的方法命名,而把低价的化合物在命名时加上“亚”字,如铁的氧化物有以下几种:氧化铁、氧化亚铁、四氧化三铁,它们的化学式依次是、、。
氯化铁和氯化亚铁应分别写成和。
7.在NaNO3中N的化合价是___价;在NH4Cl中N的化合价是___价。
8.某化合物的化学式为HnRO2,它的式量为M,则R元素的化合价是____,R元素的原子量是____。
9.某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为_____,R元素的氢氧化物的化学式为____。
10.某元素R,它的氧化物的化学式为R2O3,则它的氯化物的化学式是____,它的硫酸盐化学式是_____。
11.X、Y 、Z三种元素组成的化合物里,Y为+2价,Z为+5价,X为-2价。
X、Z 两元素在化合物里组成的原子团为-3价,且有5个原子。
则此化合物的化学式为。
12.下列化学符号①2CO ②2Ag+③Mg ④2Ba O⑤H2O中的数字“2”表示(填序号)(1)离子个数的是;(2)离子所带电荷数值的是。