铁原子与氮分子间的相互作用——单端位构型
- 格式:pdf
- 大小:304.65 KB
- 文档页数:7

均一的氮配位单原子铁位点
氮配位单原子铁位点是指在催化剂或者材料中,氮原子与铁原
子形成化学键的位置。
这种结构在催化剂和电化学材料中具有重要
的应用。
从催化剂的角度来看,氮配位单原子铁位点可以作为高效
的氧还原反应(ORR)的活性位点,提高燃料电池和金属空气电极的
性能。
从材料科学的角度来看,氮配位单原子铁位点也被广泛用于
制备高效的电催化剂和电化学传感器。
在催化剂中,氮配位单原子铁位点可以通过各种方法来实现,
例如原位合成、原子层沉积等。
这些位点的形成可以显著提高催化
剂的活性和稳定性,因为氮原子可以改变铁的电子结构,从而调节
其催化性能。
此外,氮配位单原子铁位点还可以提高催化剂的选择性,降低其对昂贵金属的依赖性,从而降低成本并提高可持续性。
从材料科学的角度来看,氮配位单原子铁位点在电催化剂和电
化学传感器中具有重要的应用。
这些位点可以提高材料的电催化活性,例如在氧还原反应中,同时还可以提高材料的导电性和稳定性。
这些特性使得氮配位单原子铁位点成为制备高性能电催化剂和传感
器的重要策略之一。
总的来说,氮配位单原子铁位点在催化剂和材料科学中具有重要的应用前景,通过合理设计和控制氮配位单原子铁位点的结构和性质,可以实现催化剂和材料的性能优化,推动相关领域的发展。

氮原子的杂化轨道类型氮原子是一种常见的元素,它在自然界中广泛存在,并在许多重要的化学反应中发挥着关键作用。
氮原子的电子构型为1s2 2s2 2p3,它的5个电子分布在不同的轨道中,其中2个在2s轨道中,剩下的3个在2p轨道中。
在化学反应中,氮原子往往会形成共价键或离子键,而其杂化轨道的类型则在很大程度上决定了其反应行为和性质。
氮原子的杂化轨道类型主要包括sp、sp2和sp3。
在这些杂化轨道中,s轨道和p轨道中的电子进行混合,形成新的杂化轨道,从而使得原子可以更好地参与化学反应。
sp杂化轨道是s轨道和一个p轨道的混合,形成两个sp杂化轨道和一个剩余的p轨道。
sp2杂化轨道是s轨道和两个p轨道的混合,形成三个sp2杂化轨道。
而sp3杂化轨道则是s轨道和三个p轨道的混合,形成四个sp3杂化轨道。
这些杂化轨道类型的不同会导致氮原子在共价键形成时的几何构型和键角的差异,进而影响其分子的性质。
在sp杂化轨道中,氮原子的一个s轨道和一个p轨道发生混合,这种杂化轨道形成的分子通常呈线性结构。
这种线性结构的分子通常具有较高的对称性,稳定性较高。
例如,氮气中的两个氮原子之间的三重键即是通过sp杂化轨道形成的。
而在sp2杂化轨道中,氮原子的一个s轨道和两个p轨道混合,形成的分子通常呈三角形平面构型。
典型的例子是氨分子NH3,其中氮原子的三个sp2杂化轨道与3个氢原子形成三个σ键。
sp3杂化轨道则是最常见的一种类型,因为它可以形成四条σ键,使得分子可以形成更加稳定的结构。
在sp3杂化轨道中,氮原子的一个s轨道和三个p轨道混合,形成四个sp3杂化轨道,从而使氮原子可以与其他原子形成四条σ键。
例如,在氨基团NH2中,氮原子通过其三个sp3杂化轨道与三个水素原子形成三条σ键,而通过剩余的一个sp3杂化轨道与其他原子形成一条σ键。
除了以上提到的sp、sp2和sp3杂化轨道类型外,氮原子还可能存在其他类型的杂化轨道,如sp3d和sp3d2。

氮原子的杂化轨道类型氮原子是化学元素周期表中的第七号元素,其在化学反应中扮演着重要的角色。
在有机化学领域中,氮原子经常参与形成各种不同的化合物,其化学性质多样且复杂。
在分子中,氮原子经常以不同的方式与其他原子形成化学键,其中杂化轨道类型在氮原子化学性质研究中起着关键作用。
杂化轨道是指原子内部电子排布的方式,也可以理解为原子轨道之间的混合。
氮原子在分子中的杂化轨道类型包括sp杂化、sp2杂化和sp3杂化。
这些不同类型的杂化轨道决定了氮原子在分子中的空间排布以及化学键的形成方式。
首先,在sp杂化中,氮原子的一个2s轨道和一个2p轨道线性混合形成两个sp杂化轨道。
这种杂化轨道通常用于形成含有双键的分子,如氨气(NH3)和硝基(NO)。
在这些分子中,氮原子通过其sp杂化轨道与其他原子形成双键,使得分子具有较高的稳定性和反应活性。
其次,在sp2杂化中,氮原子的一个2s轨道和两个2p轨道线性混合形成三个sp2杂化轨道。
这种杂化轨道通常用于形成含有三角形结构的分子,如溴胺(NH2Br)和硝基(NO2)。
在这些分子中,氮原子通过其sp2杂化轨道与其他原子形成三角形结构的共价键,使得分子具有特定的空间构型和性质。
最后,在sp3杂化中,氮原子的一个2s轨道和三个2p轨道线性混合形成四个sp3杂化轨道。
这种杂化轨道通常用于形成含有四面体结构的分子,如氨(NH3)和三聚氮(N3)。
在这些分子中,氮原子通过其sp3杂化轨道与其他原子形成四面体结构的共价键,使得分子具有较高的稳定性和键能。
综上所述,氮原子的杂化轨道类型对其在分子中的化学性质和反应活性具有重要影响。
通过深入研究氮原子的杂化轨道类型,可以更好地理解氮原子在有机化学中的作用和应用。
希望未来能够进一步探索氮原子的杂化轨道类型在有机合成和催化反应中的应用,为化学领域的发展做出更大的贡献。


fe-n4配位结构Fe-N4配位结构是指铁原子与四个氮原子形成的一种化学结构。
这种结构在生物体内广泛存在,是一些重要的生物分子的组成部分,如铁硫蛋白和细胞色素c 等。
下面将对Fe-N4配位结构的历史、结构特点和应用进行介绍。
历史:Fe-N4配位结构最早是在20世纪初被发现的,当时科学家们对生物体内的铁硫蛋白进行了研究,发现其中铁原子与四个氮原子形成了一种稳定的结构,这种结构被称为Fe-N4配位结构。
随着科学技术的发展,人们对这种结构的研究越来越深入,不仅揭示了其在生物体内的重要作用,还发现了其在化学催化和电化学领域的广泛应用。
结构特点:Fe-N4配位结构的结构特点主要包括以下几个方面:1. 铁原子与四个氮原子形成一个四面体的结构,铁原子位于四面体的中心,四个氮原子位于四面体的顶点。
2. 铁原子与每个氮原子之间都存在一条共价键,这些共价键形成了一个稳定的化学结构。
3. Fe-N4配位结构具有良好的稳定性和催化活性,可以在生物体内发挥重要的作用,也可以应用于化学催化和电化学领域。
应用:Fe-N4配位结构在生物体内的应用主要包括以下几个方面:1. 铁硫蛋白:铁硫蛋白是一种重要的生物分子,其中铁原子与四个硫原子和一个氮原子形成了Fe-S4N配位结构,这种结构在电子传递和催化反应中发挥重要作用。
2. 细胞色素c:细胞色素c是一种重要的电子传递分子,其中铁原子与四个氮原子形成了Fe-N4配位结构,这种结构在电子传递过程中发挥重要作用。
3. 化学催化:Fe-N4配位结构在化学催化领域也有广泛的应用,可以用于催化氧还原反应、氮还原反应等。
4. 电化学:Fe-N4配位结构在电化学领域也有广泛的应用,可以用于制备电极材料、催化电化学反应等。
总之,Fe-N4配位结构是一种重要的化学结构,在生物体内和化学催化、电化学领域都有广泛的应用。
对于了解这种结构的结构特点和应用具有重要的意义。

绗?绔?鍗曞厓娴嬭瘯1銆佹弿杩颁竴纭畾鐨勫師瀛愯建閬擄紝闇€鐢ㄤ互涓嬪弬鏁帮紙锛夈€?绛旀锛歯,l,m2銆佷富閲忓瓙鏁颁负4鐨勭數瀛愬眰涓紝浜氬眰绉嶇被鏈€澶氬彲浠ユ湁锛?锛夌锛屽師瀛愯建閬撶殑鏈€澶氭暟鐩槸锛? 锛夈€?绛旀锛?3銆佸浜庡師瀛愪腑鐨勭數瀛愶紝閲忓瓙鏁版纭殑涓€缁勬槸锛?锛夈€?绛旀锛歯=3锛宭 =1锛宮=-14銆佷笅鍒楄娉曚笉姝g‘鐨勬槸锛氾紙锛? 銆?绛旀锛氳皟閰掓椂浣跨敤铔嬫竻鏄负浜嗛厭鍝佺殑鍛抽亾鏇存粦娑︼紱5銆佷笅鍒楀厓绱犱腑锛屼环灞傜數瀛愬叏涓烘垚瀵圭數瀛愮殑鍏冪礌鏄紙锛?绛旀锛歓n6銆侊紙锛夊彲浠ヨВ閲婅兘绾т氦閿欙紝鑰岃兘绾т氦閿欑幇璞″張鍙互瑙i噴锛? 锛夌幇璞°€?绛旀锛氥€婅璇€?7銆佸鐢靛瓙鍘熷瓙涓紝鍦ㄤ富閲忓瓙鏁颁负n锛岃閲忓瓙鏁颁负l鐨勫垎灞備笂锛屽師瀛愯建閬撴暟涓?绛旀锛?l+18銆佸師瀛愬簭鏁颁负33鐨勫厓绱狅紝鍏跺師瀛愬湪n=4锛宭 =1锛宮=0杞ㄩ亾涓殑鐢靛瓙鏁颁负锛?锛?绛旀锛?9銆佺數瀛愬叿鏈夋尝绮掍袱璞℃€э紝鍗冲畠涓€浼氬効鏄矑瀛愶紝涓€浼氬効鏄數纾佹尝绛旀锛氱涓€绌猴細鎴寸淮瀛欌€斺€旈潻鏈數瀛愭潫琛嶅皠瀹為獙10銆佸師瀛愯建閬撴寚鍘熷瓙杩愬姩鐨勮建杩广€?绛旀锛?38锛?211銆佸師瀛愬湪澶卞幓鐢靛瓙鏃讹紝鎬绘槸鍏堝け鍘绘渶澶栧眰鐢靛瓙銆?绛旀锛氱洿绾?12銆佺數瀛愪簯绀烘剰鍥句腑锛屽皬榛戠偣鐨勭枏瀵嗚〃绀虹數瀛愬嚭鐜板嚑鐜囧瘑搴︾殑澶у皬銆?绛旀锛氬13銆佷富閲忓瓙鏁皀涓? 鏃舵湁3s銆?p銆?d銆?f 鍥涙潯杞ㄩ亾銆?绛旀锛毭?14銆佷换浣曞厓绱犵殑绗竴鐢电鑳芥€绘槸鍚哥儹鐨?绛旀锛氭纭?15銆佺數璐熸€ф槸缁煎悎鑰冭檻鐢靛瓙浜插悎鑳藉拰鐢电鑳界殑閲忥紝鍚庝袱鑰呴兘鏄兘閲忓崟浣嶏紝鎵€浠ュ墠鑰呬篃鐢ㄨ兘閲忎綔鍗曚綅銆?绛旀锛氭纭?16銆佸崵绱犲師瀛愮殑鐢靛瓙浜插拰鑳芥寜F銆丆l銆丅r銆両鐨勯『搴忎緷娆″噺灏忋€?绛旀锛?绗?绔? 鍗曞厓娴嬭瘯1銆佹寜鐓т环閿悊璁?VB娉?锛屽叡浠烽敭涔嬫墍浠ュ瓨鍦ㄏ冨拰蟺閿紝鏄洜涓猴紙锛?绛旀锛氳嚜鏃嬫柟鍚戠浉鍙嶇殑涓や釜鎴愬崟鐢靛瓙鍘熷瓙杞ㄩ亾鏈€澶х▼搴﹂噸鍙犵殑缁撴灉2銆佷笅鍒楀垎瀛愮殑绌洪棿鏋勫瀷涓哄钩闈笁瑙掑舰鐨勬槸锛? 锛夈€?绛旀锛欱Cl33銆佺敤浠峰眰鐢靛瓙瀵逛簰鏂ョ悊璁烘帹娴婲F3鐨勫嚑浣曞舰鐘朵负锛? 锛?绛旀锛氫笁瑙掗敟4銆佹牴鎹垎瀛愯建閬撶悊璁猴紝涓嬪垪鍒嗗瓙鎴栫瀛愪笉鍙兘瀛樺湪鐨勬槸锛? 锛?绛旀锛欱e25銆佷笅鍒楀悇缁勫垎瀛愭垨绂诲瓙涓紝鍧囧憟椤虹鎬х殑鏄紙锛?绛旀锛欻e2+銆丅22銆丄:BO22-绛旀锛氱涓€绌猴細 A6銆佷笅鍒楁湁鍏冲垎瀛愰棿浣滅敤鍔涜娉曟纭殑鏄紙锛?绛旀锛氬彇鍚戝姏瀛樺湪浜庢瀬鎬у垎瀛愪笌鏋佹€у垎瀛愪箣闂?7銆佸彧鏈夌浉鍚岀殑鍘熷瓙杞ㄩ亾鎵嶈兘褰㈡垚鍏变环閿€?绛旀锛氶敊8銆丆O鍒嗗瓙鍚湁閰嶄綅閿€?绛旀锛氬9銆佺瀛愭櫠浣撲腑鐨勫寲瀛﹂敭閮芥槸绂诲瓙閿€?绛旀锛氶敊10銆佹潅鍖栬建閬撶殑鍑犱綍鏋勫瀷鍐冲畾浜嗗垎瀛愮殑鍑犱綍鏋勫瀷銆?绛旀锛氶敊11銆佷环灞傜數瀛愬浜掓枼鐞嗚鑳借В閲婂垎瀛愮殑鏋勫瀷銆?绛旀锛氶敊12銆佸湪鍏变环鍖栧悎鐗╀腑锛屽綋涓績鍘熷瓙閲囩敤鏉傚寲杞ㄩ亾鎴愰敭鏃讹紝鍏朵笌閰嶄綅鍘熷瓙褰㈡垚鐨勫寲瀛﹂敭鏃㈠彲浠ユ槸蟽閿紝涔熷彲浠ユ槸蟺閿€?绛旀锛氶敊13銆佸彧瑕佸垎瀛愪腑鍚湁姘㈠師瀛愶紝鍒欎竴瀹氬瓨鍦ㄦ阿閿?绛旀锛氶敊绗?绔? 鍗曞厓娴嬭瘯1銆佸湪娑叉€丠Cl涓紝鍒嗗瓙闂翠綔鐢ㄥ姏涓昏鏄紙锛夈€?绛旀锛氳壊鏁e姏2銆佺敱璇卞鍋舵瀬浜х敓鐨勫垎瀛愰棿鍔涘睘浜庯紙锛?绛旀锛氳寖寰峰崕鍔?4銆佷笅鍒楃墿璐ㄤ腑锛屽惈鏈夐潪鏋佹€ч敭鐨勬槸锛?锛?绛旀锛歄35銆佷笅鍒楃墿璐ㄤ腑锛屽惈鏈夋瀬鎬ч敭鐨勬槸锛? 锛?绛旀锛欱F3绗?绔?鍗曞厓娴嬭瘯1銆佸湪[Co(C2O4)2(en)]- 涓紝涓績绂诲瓙Co3+ 鐨勯厤浣嶆暟涓?绛旀锛?2銆佸浜庨厤鍚堢墿褰㈡垚浣撶殑閰嶄綅鏁帮紝涓嬪垪璇存硶涓嶆纭殑鏄?绛旀锛氱洿鎺ヤ笌褰㈡垚浣撻敭鍚堢殑閰嶄綅浣撶殑鏁扮洰3銆佷笅鍒楁湁鍏抽厤鍚堢墿鐗瑰緛鐨勫彊杩颁腑閿欒鐨勬槸绛旀锛氶噾灞炲師瀛愪笉鑳戒綔涓洪厤鍚堢墿鐨勫舰鎴愪綋4銆乕NiCl4]2-鏄『纾佹€у垎瀛愶紝鍒欏畠鐨勫嚑浣曞舰鐘朵负绛旀锛氭鍥涢潰浣?5銆侀厤鍚堢墿褰㈡垚浣撶殑閰嶄綅鏁版槸鎸囩洿鎺ュ拰涓績鍘熷瓙 (鎴栫瀛?鐩歌繛鐨勯厤浣撴€绘暟銆?绛旀锛氶敊6銆侀厤浣嶉吀銆侀厤浣嶇⒈浠ュ強閰嶄綅鐩愮殑澶栫晫绂诲瓙鎵€甯︾殑鐢佃嵎鎬绘暟涓庣浉搴旈厤绂诲瓙鐨勭數鑽锋€绘暟鍊肩浉绛夛紝绗﹀彿鐩稿弽銆?绛旀锛氬7銆佹寜鐓т环閿悊璁哄彲鎺ㄧ煡锛屼腑蹇冪瀛愮殑鐢佃嵎鏁颁綆鏃讹紝鍙兘褰㈡垚澶栬建鍨嬮厤鍚堢墿锛屼腑蹇冪瀛愮數鑽锋暟楂樻椂锛屾墠鑳藉舰鎴愬唴杞ㄥ瀷閰嶅悎鐗┿€?绛旀锛氶敊8銆佸嚒鏄厤浣嶆暟涓?鐨勫垎瀛愶紝鍏朵腑蹇冨師瀛愬潎閲囩敤sp3鏉傚寲杞ㄩ亾鎴愰敭銆?绛旀锛氶敊绗?绔? 鍗曞厓娴嬭瘯1銆佹煇鎭掑缁濈儹绠变腑鏈塁H4鍜孫2娣峰悎姘斾綋锛岄€氱數鐏姳浣垮叾鍙嶅簲锛堢數鐏姳鑳藉彲蹇界暐锛夛紝璇ュ彉鍖栬繃绋嬬殑锛?锛?绛旀锛毼擴=0 螖H<02銆佸皢鍥轰綋NH4NO3婧朵簬姘翠腑锛屾憾娑插彉鍐凤紝鍒欒杩囩▼鐨勎擥銆佄擧銆佄擲绗﹀彿渚濇涓猴紙锛?绛旀锛氣垝锛?锛?3銆佸湪娓╁害鐩稿悓銆佸绉浉绛夌殑涓や釜瀵嗛棴瀹瑰櫒涓紝鍒嗗埆鍏呮湁姘斾綋A 鍜?B 銆傝嫢姘斾綋 A 鐨勮川閲忎负姘斾綋 B 鐨勪簩鍊嶏紝姘斾綋 A 鐨勭浉瀵瑰垎瀛愯川閲忎负姘斾綋 B 鐨?0.5 鍊嶏紝鍒?p(A):p(B) =绛旀锛?4銆佸湪鎭掓俯銆佹亽鍘嬩笅锛屽垽鏂竴涓寲瀛﹀弽搴旀柟鍚戞墍鐢ㄧ殑鐑姏瀛﹀嚱鏁颁负锛? 锛?绛旀锛毼擥5銆佸敖绠鍜學閮芥槸閫斿緞鍑芥暟锛屼絾(Q+W)鐨勬暟鍊间笌閫斿緞鏃犲叧銆?绛旀锛氬6銆佸弽搴旇繘搴﹁〃绀哄寲瀛﹀弽搴旇繘琛岀殑绋嬪害锛?mol鍙嶅簲杩涘害鎸囨湁1mol 鍙嶅簲鐗╁彂鐢熶簡鍙嶅簲銆?绛旀锛氶敊7銆佸弽搴斾骇鐗╃殑鍒嗗瓙鏁版瘮鍙嶅簲鐗╁锛岃鍙嶅簲鐨勎擲>0绛旀锛氶敊绗?绔? 鍗曞厓娴嬭瘯1銆佹煇鍙嶅簲閫熺巼鏂圭▼鏄痸=kcx (A) cy(B)锛屽綋c(A)鍑忓皯50锛呮椂锛寁闄嶄綆鑷冲師鏉ョ殑1/4锛涘綋c(B)澧炲ぇ鑷冲師鏉ョ殑2鍊嶆椂锛寁澧炲ぇ鑷冲師鏉ョ殑1.41鍊嶏紝鍒檟銆亂鍒嗗埆涓猴紙銆€銆€銆€锛?绛旀锛歺=2锛寉锛?.52銆佷粠鍖栧鍔ㄥ姏瀛﹁搴︼紝闆剁骇鍙嶅簲褰撳弽搴旂墿娴撳害鍑忓皬鏃讹紝鍙嶅簲閫熺巼鏄紙銆€銆€銆€锛夈€?绛旀锛氫笉鍙楀弽搴旂墿娴撳害鐨勫奖鍝?3銆佸浜庡弽搴擧2(g)+I2(g)=2HI(g)锛屾祴寰楅€熺巼鏂圭▼涓簐=kc(H2)c(I2)锛屼笅鍒楀垽鏂彲鑳介敊璇殑鏄紙銆€銆€銆€锛夈€?绛旀锛氬弽搴斾竴瀹氭槸鍩哄厓鍙嶅簲2銆丄:鍙嶅簲瀵笻I2鏉ヨ鍧囨槸涓€绾у弽搴?绛旀锛欴4銆佹煇娓╁害鏃讹紝鍖栧鍙嶅簲A +1/2B =1/2A2B鐨勫钩琛″父鏁癒 = 1 麓 104锛岄偅涔堝湪鐩稿悓娓╁害涓嬶紝鍙嶅簲 A2B=2A +B 鐨勫钩琛″父鏁颁负锛堛€€銆€銆€锛夈€?绛旀锛? 麓 10-85銆佽川閲忎綔鐢ㄥ畾寰嬫槸涓€涓櫘閬嶇殑瑙勫緥锛岄€傜敤浜庝换浣曞寲瀛﹀弽搴斻€傦紙锛?绛旀锛氶敊6銆佸浜庡悓涓€鍖栧鍙嶅簲寮忥紝鍙嶅簲杩涘害鐨勫€间笌閫夌敤鍙嶅簲寮忎綍绉嶇墿璐ㄧ殑閲忓彉鍖栬繘琛岃绠楁棤鍏炽€傦紙锛?绛旀锛氬7銆佸澶х郴缁熷帇鍔涳紝鍙嶅簲閫熺巼涓€瀹氬澶с€?绛旀锛氶敊8銆佷换涓€鍖栧鍙嶅簲鐨勯€熺巼鏂圭▼锛岄兘鍙牴鎹寲瀛﹀弽搴旀柟绋嬪紡鐩存帴鍐欍€?绛旀锛氶敊9銆佸弽搴旂墿娴撳害澧炲ぇ锛屽弽搴旈€熺巼蹇呭畾澧炲ぇ銆?绛旀锛氶敊10銆佸偓鍖栧墏鍙兘鏀瑰彉鍙嶅簲鐨勬椿鍖栬兘锛岃€屼笉鑳芥敼鍙樜攔Hm胃銆傦紙锛?绛旀锛氬绗?绔? 鍗曞厓娴嬭瘯1銆佹牴鎹吀纰辫川瀛愮悊璁猴紝涓嬪垪鍚勭粍鐗╄川鍧囧彲涓洪吀鐨勬槸锛屽潎鍙负纰辩殑鏄紝鏃㈠潎鍙负閰搞€佸張鍧囧彲涓虹⒈鐨勬槸銆侫銆?HS-銆丠Ac銆丯H4+銆丯a+ B銆? HSO4-銆丠2O銆丠PO42-銆丠2PO4-C銆?HF銆丯H4+銆丠2SO4銆丠3O+ D銆?PO43- F-銆丆O32-銆丱H-绛旀锛歂H4+銆丠COOH銆丠Ac2銆佷笅鍒楀叧浜庣洂绫绘按瑙g殑璁鸿堪涓嶆纭殑鏄?绛旀锛氱洂婧舵恫鐨勯吀纰辨€т富瑕佸喅瀹氫簬褰㈡垚鐩愮殑閰稿拰纰辩殑鐩稿寮哄急3銆佺浉鍚屾祿搴︾殑涓嬪垪鐩愭憾娑茬殑pH鍊硷紝鐢卞皬鍒板ぇ鐨勯『搴忔槸NaA銆丯aB 銆丯aC銆丯aD (A銆丅銆丆銆丏閮戒负寮遍吀鏍?锛屽垯鍚勫搴旈吀鍦ㄥ悓c銆佸悓T 鏃讹紝绂昏В搴︽渶澶х殑閰告槸銆?绛旀锛欻A4銆佹閰嶅埗pH=6.50鐨勭紦鍐叉憾娑诧紝鏈€濂介€夌敤_ 绛旀锛?CH3)2AsO2H ( Ka螛=6.40脳10-7)5銆佷竴绉嶉吀鐨勯吀鎬ц秺寮猴紝鍏跺叡杞⒈鐨勭⒈鎬т篃瓒婂己绛旀锛氶敊6銆佹皑姘寸殑娴撳害瓒婂皬锛岃В绂诲害瓒婂ぇ锛屽洜姝ゆ憾娑蹭腑 OH- 娴撳害涔熻秺澶?绛旀锛氶敊7銆佹按婧舵恫鍛堜腑鎬х殑鐩愬繀涓哄己閰稿己纰辩洂銆?绛旀锛氶敊8銆佺洂鏁堝簲鏃讹紝鍥犲急鐢佃В璐ㄨВ绂诲钩琛″彸绉伙紝瑙g搴﹀澶э紝鍥犳瑙g骞宠甯告暟澧炲ぇ銆? )绛旀锛氶敊9銆佹湁涓€鐢盚AcAc-缁勬垚鐨勭紦鍐叉憾娑诧紝鑻ユ憾娑蹭腑c(HAc)锛瀋(Ac-)锛屽垯璇ョ紦鍐叉憾娑叉姷鎶楀鏉ラ吀鐨勮兘鍔涘ぇ浜庢姷鎶楀鏉ョ⒈鐨勮兘鍔?绛旀锛氶敊绗?绔? 鍗曞厓娴嬭瘯1銆佸悜AgCl楗卞拰婧舵恫涓姞姘达紝涓嬪垪鍙欒堪姝g‘鐨勬槸( )銆?绛旀锛欰gCl 鐨勬憾瑙e害銆並sp螛鍧囦笉鍙?2銆佸凡鐭?98K鏃讹紝Ksp螛 (SrF2)=2.5麓10-9锛屽垯姝ゆ椂SrF2楗卞拰婧舵恫涓紝c(F-)涓?( )銆?绛旀锛?.7麓10-3 mol路dm-33銆佷竴瀹氭俯搴︽椂Zn(OH)2楗卞悎婧舵恫鐨刾H涓?.3锛屽垯姝ゆ椂Zn(OH)2鐨凨sp螛涓? )銆?绛旀锛?.0脳10-184銆佹浣緾aCO3婧舵恫涓殑Ca2+娴撳害澧炲ぇ锛屽彲閲囩敤鐨勬柟娉曟槸( )绛旀锛氶檷浣庢憾娑茬殑pH鍊?5銆佺瀛愬垎姝ユ矇娣€鏃讹紝娌夋穩鍏堝悗椤哄簭涓? )銆?绛旀锛氭墍闇€娌夋穩鍓傛祿搴︽渶灏忚€呭厛娌夋穩6銆丳bSO4(s)鍦? dm3鍚湁鐩稿悓鎽╁皵鏁扮殑涓嬪垪鐗╄川婧舵恫涓憾瑙e害鏈€澶х殑鏄? )绛旀锛歂H4Ac7銆佹矇娣€婧惰В骞宠鎰忎负娌夋穩鍜屾憾瑙g殑閫熺巼鐩哥瓑銆? )绛旀锛氬8銆佹憾娑蹭腑澶氱绂诲瓙鍙敓鎴愭矇娣€鏃讹紝缂撴參鍔犲叆娌夋穩鍓傦紝娴撳害澶х殑绂诲瓙鍏堟矇娣€銆? )绛旀锛氶敊绗?绔?鍗曞厓娴嬭瘯1銆佷笅鍒楁按鍋氭哀鍖栧墏鐨勫崐鍙嶅簲涓猴紙锛?绛旀锛欻2O+e=1/2H2+OH-2銆佹爣鍑嗘阿鐢垫瀬鏄湪锛? 锛夋儏鍐典笅娴嬪畾鐨?绛旀锛歱(H2)=100kPa锛宲H=03銆佹煇鐢垫睜绗﹀彿涓猴紙-锛塒t鈹侫3+锛孉2+鈥朆4+锛孊3+鈹侾t锛?锛夛紝鍒欑數姹犲弽搴旂殑浜х墿涓猴紙锛夈€?绛旀锛欰3+锛孊3+4銆?5鈩冩椂锛屽師鐢垫睜绗﹀彿濡備笅锛岀浉搴斿師鐢垫睜鍙嶅簲鐨勫钩琛″父鏁癒胃涓猴紙锛夈€? (-)Ag鈹侫g+(0.1mol路dm-3)鈥朅g+(0.5mol路dm-3)鈹侫g (+)绛旀锛?5銆佸湪涓€涓哀鍖栬繕鍘熷弽搴斾腑锛岃嫢涓ょ數瀵圭殑鐢垫瀬鐢靛娍鍊肩浉宸緢澶э紝鍒欏彲鍒ゆ柇锛? 锛?绛旀锛氳鍙嶅簲鐨勫弽搴旇秼鍔垮緢澶?6銆佽兘缁勬垚鍘熺數姹犵殑鍙嶅簲閮芥槸姘у寲杩樺師鍙嶅簲銆傦紙锛?绛旀锛氶敊7銆佸浐浣撱€佺函娑蹭綋鍙婄█婧舵恫涓殑婧跺墏鍦∟ernst鏂圭▼琛ㄨ揪寮忎腑涓嶈鍑虹幇銆傦紙锛?绛旀锛氬8銆佺數鏋佺數鍔胯〃涓紝鐢靛鐨勬爣鍑嗙數鏋佺數鍔跨浉璺濊秺杩滐紝鍙嶅簲閫熺巼瓒婂揩銆傦紙锛?绛旀锛氶敊9銆佹祿宸數姹犵殑E姹?0V锛屛攆Gm胃= 0kJ螄mol-1銆傦紙锛?绛旀锛氶敊10銆佺敱浜嶦胃锛圕u2+/Cu+锛?0.152V锛孍胃锛圛2/I-锛?0.536V锛屾晠 I-鍜?Cu2+涓嶈兘鍙戠敓姘? 鍖栬繕鍘熷弽搴斻€傦紙锛?绛旀锛氶敊绗?0绔? 鍗曞厓娴嬭瘯1銆佷笅鍒楀弽搴旓紝鍏舵爣鍑嗗钩琛″父鏁板彲浣滀负[Zn(NH3)4]2+鐨勪笉绋冲畾甯告暟鐨勬槸锛?锛?绛旀锛歔Zn(NH3)4] 2+ + 4H2O = [Zn(H2O)4]2+ + 4NH32銆佹浣緾aCO3鍦ㄦ按婧舵恫涓殑婧惰В搴﹀澶э紝瀹滈噰鐢ㄧ殑鏂规硶鏄紙锛?宸茬煡Ca-EDTA鐨? Kf胃= 4.90脳1010绛旀锛氬姞鍏?.0 mol路dm-3 EDTA3銆佽嫢鐢靛鐨勬哀鍖栨€佸拰杩樺師鎬佸悓鏃剁敓鎴愰厤浣嶄綋鍜岄厤浣嶆暟鐩稿悓閰嶅悎鐗╋紝鍒欏叾 E胃锛? 锛?绛旀锛氱敱鍏蜂綋鎯呭喌纭畾4銆丆u(OH)2婧惰В鍦∟H4Cl锛峃H3路H2O缂撳啿婧舵恫涓敓鎴怺Cu(NH3)4]2+鏃讹紝绯荤粺鐨刾H鍊硷紙锛?绛旀锛氬彉澶?5銆佹墍鏈夐厤鍚堢墿鐢熸垚鍙嶅簲閮芥槸闈炴哀鍖栬繕鍘熷弽搴旓紝鍥犳锛岀敓鎴愰厤鍚堢墿鍚庣數瀵圭殑鐢垫瀬鐢靛娍涓嶅彉銆傦紙锛?绛旀锛氶敊6銆佸湪5.0 cm-30.10 mol路dm-3AgNO3婧舵恫涓紝鍔犲叆绛変綋绉瓑娴撳害鐨凬aCl 婧舵恫锛岀敓鎴怉gCl娌夋穩銆傚彧瑕佸姞鍏?.0 cm-30.10 mol路dm-3 NH3路H2O婧舵恫锛孉gCl灏卞洜鐢熸垚[Ag(NH3)2]+鑰屽叏閮ㄦ憾瑙c€傦紙锛?绛旀锛氶敊7銆佸惈鏈夐厤绂诲瓙鐨勯厤鍚堢墿锛屽叾甯﹀紓鍙风數鑽风瀛愮殑鍐呯晫鍜屽鐣屼箣闂翠互绂诲瓙閿粨鍚堬紝鍦ㄦ按涓嚑涔庡畬鍏ㄨВ绂绘垚鍐呯晫鍜屽鐣屻€傦紙锛?绛旀锛氬8銆侀厤绂诲瓙鐨勪笉绋冲畾甯告暟瓒婂ぇ锛岃〃鏄庤閰嶇瀛愬湪姘存憾娑蹭腑瑙g鐨勫€惧悜瓒婂皬銆傦紙锛?绛旀锛氶敊绗竴绔?1銆佹弿杩颁竴纭畾鐨勫師瀛愯建閬擄紝闇€鐢ㄤ互涓嬪弬鏁帮紙锛夈€?A: n锛宭B:n锛宭锛宮C:n锛宭锛宮锛宮sD:鍙渶n绛旀: n锛宭锛宮2銆佷富閲忓瓙鏁颁负4鐨勭數瀛愬眰涓紝浜氬眰绉嶇被鏈€澶氬彲浠ユ湁锛?锛夌锛屽師瀛愯建閬撶殑鏈€澶氭暟鐩槸锛? 锛夈€?A:1B:2C:3D:4E:8F:16G:32绛旀: 163銆佸浜庡師瀛愪腑鐨勭數瀛愶紝閲忓瓙鏁版纭殑涓€缁勬槸锛?锛夈€? A:n=3锛宭 =1锛宮=-1B: n=3锛宭 =1锛宮=2C: n=2锛宭 =2锛宮=-1D: n=6锛宭 =-1锛宮=0绛旀: n=3锛宭 =1锛宮=-14銆佷笅鍒楄娉曚笉姝g‘鐨勬槸锛? 锛夈€?A:姘㈠師瀛愪腑锛岀數瀛愮殑鑳介噺鍙彇鍐充簬涓婚噺瀛愭暟nB:娉㈠嚱鏁扮敱鍥涗釜閲忓瓙鏁扮‘瀹?C:澶氱數瀛愬師瀛愪腑锛岀數瀛愮殑鑳介噺涓嶄粎涓巒鏈夊叧锛岃繕涓巐鏈夊叧D:ms = 卤1/2琛ㄧず鐢靛瓙鐨勮嚜鏃嬫湁涓ょ鏂瑰紡绛旀: 娉㈠嚱鏁扮敱鍥涗釜閲忓瓙鏁扮‘瀹?5銆佷笅鍒楀厓绱犱腑锛屼环灞傜數瀛愬叏涓烘垚瀵圭數瀛愮殑鍏冪礌鏄紙锛? A:ZnB:TiC:FeD:S绛旀: Zn6銆侊紙锛夊彲浠ヨВ閲婅兘绾т氦閿欙紝鑰岃兘绾т氦閿欑幇璞″張鍙互瑙i噴锛? 锛夌幇璞°€?A:K鍘熷瓙4s杞ㄩ亾鐨勮兘閲忎綆浜?dB:绗笁鐢靛瓙灞傜殑鐢靛瓙瀹归噺涓?8C:灞忚斀鏁堝簲涓庨捇绌挎晥搴?D:鍘熷瓙鏈€澶栧眰鐢靛瓙鏁颁笉鑳借秴杩?涓?绛旀: 灞忚斀鏁堝簲涓庨捇绌挎晥搴?鍘熷瓙鏈€澶栧眰鐢靛瓙鏁颁笉鑳借秴杩?涓?7銆佸鐢靛瓙鍘熷瓙涓紝鍦ㄤ富閲忓瓙鏁颁负n锛岃閲忓瓙鏁颁负l鐨勫垎灞備笂锛屽師瀛愯建閬撴暟涓猴紙锛夈€?A:2l-1B:n-1C:n- l +1D:2 l +1绛旀: 2 l +18銆佸師瀛愬簭鏁颁负33鐨勫厓绱狅紝鍏跺師瀛愬湪n=4锛宭 =1锛宮=0杞ㄩ亾涓殑鐢靛瓙鏁颁负锛? 锛?A:1B:2C:3D:4绛旀: 19銆佺數瀛愬叿鏈夋尝绮掍袱璞℃€э紝鍗冲畠涓€浼氬効鏄矑瀛愶紝涓€浼氬効鏄數纾佹尝A:瀵?B:閿?绛旀: 閿?10銆佸師瀛愯建閬撴寚鍘熷瓙杩愬姩鐨勮建杩广€?A:瀵?B:閿?绛旀: 閿?11銆佸師瀛愬湪澶卞幓鐢靛瓙鏃讹紝鎬绘槸鍏堝け鍘绘渶澶栧眰鐢靛瓙銆?A:瀵?B:閿?绛旀: 瀵?12銆佺數瀛愪簯绀烘剰鍥句腑锛屽皬榛戠偣鐨勭枏瀵嗚〃绀虹數瀛愬嚭鐜板嚑鐜囧瘑搴︾殑澶у皬銆?A:瀵?B:閿?绛旀: 瀵?13銆佷富閲忓瓙鏁皀涓? 鏃舵湁3s銆?p銆?d銆?f 鍥涙潯杞ㄩ亾銆?A:瀵?B:閿?绛旀: 閿?14銆佷换浣曞厓绱犵殑绗竴鐢电鑳芥€绘槸鍚哥儹鐨?A:瀵?B:閿?绛旀: 瀵?15銆佺數璐熸€ф槸缁煎悎鑰冭檻鐢靛瓙浜插悎鑳藉拰鐢电鑳界殑閲忥紝鍚庝袱鑰呴兘鏄兘閲忓崟浣嶏紝鎵€浠ュ墠鑰呬篃鐢ㄨ兘閲忎綔鍗曚綅銆?A:瀵?B:閿?绛旀: 閿?16銆佸崵绱犲師瀛愮殑鐢靛瓙浜插拰鑳芥寜F銆丆l銆丅r銆両鐨勯『搴忎緷娆″噺灏忋€?A:瀵?B:閿?绛旀: 閿?绗簩绔?1銆佹寜鐓т环閿悊璁?VB娉?锛屽叡浠烽敭涔嬫墍浠ュ瓨鍦ㄏ冨拰蟺閿紝鏄洜涓猴紙锛?A:浠呮槸鑷棆鏂瑰悜鐩稿弽鐨勪袱涓垚鍗曠數瀛愰厤瀵规垚閿殑缁撴灉B:浠呮槸鍘熷瓙杞ㄩ亾鏈€澶х▼搴﹂噸鍙犵殑缁撴灉C:鑷棆鏂瑰悜鐩稿弽鐨勪袱涓垚鍗曠數瀛愬師瀛愯建閬撴渶澶х▼搴﹂噸鍙犵殑缁撴灉D:姝c€佽礋鐢佃嵎鍚稿紩鎺掓枼浣滅敤杈惧埌骞宠鐨勭粨鏋?绛旀: 鑷棆鏂瑰悜鐩稿弽鐨勪袱涓垚鍗曠數瀛愬師瀛愯建閬撴渶澶х▼搴﹂噸鍙犵殑缁撴灉2銆佷笅鍒楀垎瀛愮殑绌洪棿鏋勫瀷涓哄钩闈笁瑙掑舰鐨勬槸锛? 锛?A:NF3B:BCl3C:AsH3D:PCl3绛旀: BCl33銆佺敤浠峰眰鐢靛瓙瀵逛簰鏂ョ悊璁烘帹娴婲F3鐨勫嚑浣曞舰鐘朵负锛? 锛?A:骞抽潰涓夎褰?B:鐩寸嚎褰?C:涓夎閿?D:鈥淭鈥濆瓧褰?绛旀: 涓夎閿?4銆佹牴鎹垎瀛愯建閬撶悊璁猴紝涓嬪垪鍒嗗瓙鎴栫瀛愪笉鍙兘瀛樺湪鐨勬槸锛? 锛?A:B2B:He2+C:Be2D:O22+绛旀: Be25銆佷笅鍒楀悇缁勫垎瀛愭垨绂诲瓙涓紝鍧囧憟椤虹鎬х殑鏄紙锛?A:B2銆丱22-B:He2+銆丅2C:N22+銆丱2D:He2+銆丗2绛旀: He2+銆丅26銆佷笅鍒楁湁鍏冲垎瀛愰棿浣滅敤鍔涜娉曟纭殑鏄紙锛?A:鑹叉暎鍔涗粎瀛樺湪浜庨潪鏋佹€у垎瀛愪箣闂?B:鍒嗗瓙閲忓皬鐨勭墿璐紝鍏剁啍娌哥偣涔熼珮C:璇卞鍔涗粎瀛樺湪浜庢瀬鎬у垎瀛愪笌闈炴瀬鎬у垎瀛愪箣闂?D:鍙栧悜鍔涘瓨鍦ㄤ簬鏋佹€у垎瀛愪笌鏋佹€у垎瀛愪箣闂?绛旀: 鍙栧悜鍔涘瓨鍦ㄤ簬鏋佹€у垎瀛愪笌鏋佹€у垎瀛愪箣闂?7銆佸彧鏈夌浉鍚岀殑鍘熷瓙杞ㄩ亾鎵嶈兘褰㈡垚鍏变环閿€?A:瀵?B:閿?绛旀: 閿?8銆丆O鍒嗗瓙鍚湁閰嶄綅閿€?A:瀵?B:閿?绛旀: 瀵?9銆佺瀛愭櫠浣撲腑鐨勫寲瀛﹂敭閮芥槸绂诲瓙閿€?A:瀵?B:閿?绛旀: 閿?10銆佹潅鍖栬建閬撶殑鍑犱綍鏋勫瀷鍐冲畾浜嗗垎瀛愮殑鍑犱綍鏋勫瀷銆? A:瀵?B:閿?绛旀: 閿?11銆佷环灞傜數瀛愬浜掓枼鐞嗚鑳借В閲婂垎瀛愮殑鏋勫瀷銆?A:瀵?B:閿?绛旀: 閿?12銆佸湪鍏变环鍖栧悎鐗╀腑锛屽綋涓績鍘熷瓙閲囩敤鏉傚寲杞ㄩ亾鎴愰敭鏃讹紝鍏朵笌閰嶄綅鍘熷瓙褰㈡垚鐨勫寲瀛﹂敭鏃㈠彲浠ユ槸蟽閿紝涔熷彲浠ユ槸蟺閿€?A:瀵?B:閿?绛旀: 閿?13銆佸彧瑕佸垎瀛愪腑鍚湁姘㈠師瀛愶紝鍒欎竴瀹氬瓨鍦ㄦ阿閿?A:瀵?B:閿?绛旀: 閿?绗笁绔?1銆?鍦ㄦ恫鎬丠Cl涓紝鍒嗗瓙闂翠綔鐢ㄥ姏涓昏鏄紙锛夈€?A:鍙栧悜鍔?B:璇卞鍔?C:鑹叉暎鍔?D:姘㈤敭绛旀: 鏁寸悊涓?2銆佺敱璇卞鍋舵瀬浜х敓鐨勫垎瀛愰棿鍔涘睘浜庯紙锛?A:鑼冨痉鍗庡姏B:鍏变环閿?C:绂诲瓙閿?D:姘㈤敭绛旀: 鏁寸悊涓?4銆佷笅鍒楃墿璐ㄤ腑锛屽惈鏈夐潪鏋佹€ч敭鐨勬槸锛? 锛?A:BF3B:O3C:CO2D:H2S绛旀: 鏁寸悊涓?5銆佷笅鍒楃墿璐ㄤ腑锛屽惈鏈夋瀬鎬ч敭鐨勬槸锛? 锛?A:O3B:BF3C:I2D:S8绛旀: 鏁寸悊涓?绗洓绔?1銆佸湪[Co(C2O4)2(en)]- 涓紝涓績绂诲瓙Co3+ 鐨勯厤浣嶆暟涓?A:3B:4C:5D:6绛旀: 鏁寸悊涓?2銆佸浜庨厤鍚堢墿褰㈡垚浣撶殑閰嶄綅鏁帮紝涓嬪垪璇存硶涓嶆纭殑鏄? A:鐩存帴涓庡舰鎴愪綋閿悎鐨勯厤浣嶄綋鐨勬暟鐩?B:鐩存帴涓庡舰鎴愪綋閿悎鐨勯厤浣嶅師瀛愮殑鏁扮洰C:褰㈡垚浣撴帴鍙楅厤浣嶄綋鐨勫瀵圭數瀛愮殑瀵规暟D:褰㈡垚浣撲笌閰嶄綅浣撴墍褰㈡垚鐨勯厤浣嶉敭鏁?绛旀: 鏁寸悊涓?3銆佷笅鍒楁湁鍏抽厤鍚堢墿鐗瑰緛鐨勫彊杩颁腑閿欒鐨勬槸A:涓€鑸湴璇达紝鍐呰建鍨嬮厤鍚堢墿杈冨杞ㄥ瀷閰嶅悎鐗╃ǔ瀹?B:鈪鏃忓厓绱犳墍褰㈡垚鐨勫洓閰嶄綅閰嶅悎鐗╋紝鍑犱箮閮芥槸鍥涢潰浣撴瀯鍨?C:CN-鍜孋O浣滈厤浣撴椂锛岃秼浜庡舰鎴愬唴杞ㄥ瀷閰嶅悎鐗?D:閲戝睘鍘熷瓙涓嶈兘浣滀负閰嶅悎鐗╃殑褰㈡垚浣?绛旀: 鏁寸悊涓?4銆乕NiCl4]2-鏄『纾佹€у垎瀛愶紝鍒欏畠鐨勫嚑浣曞舰鐘朵负A:骞抽潰姝f柟褰?B:姝e洓闈綋C:姝e叓闈綋D:鍥涙柟閿?绛旀: 鏁寸悊涓?5銆侀厤鍚堢墿褰㈡垚浣撶殑閰嶄綅鏁版槸鎸囩洿鎺ュ拰涓績鍘熷瓙 (鎴栫瀛?鐩歌繛鐨勯厤浣撴€绘暟銆?A:瀵?B:閿?绛旀: 鏁寸悊涓?6銆侀厤浣嶉吀銆侀厤浣嶇⒈浠ュ強閰嶄綅鐩愮殑澶栫晫绂诲瓙鎵€甯︾殑鐢佃嵎鎬绘暟涓庣浉搴旈厤绂诲瓙鐨勭數鑽锋€绘暟鍊肩浉绛夛紝绗﹀彿鐩稿弽銆?A:瀵?B:閿?绛旀: 鏁寸悊涓?7銆佹寜鐓т环閿悊璁哄彲鎺ㄧ煡锛屼腑蹇冪瀛愮殑鐢佃嵎鏁颁綆鏃讹紝鍙兘褰㈡垚澶栬建鍨嬮厤鍚堢墿锛屼腑蹇冪瀛愮數鑽锋暟楂樻椂锛屾墠鑳藉舰鎴愬唴杞ㄥ瀷閰嶅悎鐗┿€?A:瀵?B:閿?绛旀: 鏁寸悊涓?8銆佸嚒鏄厤浣嶆暟涓?鐨勫垎瀛愶紝鍏朵腑蹇冨師瀛愬潎閲囩敤sp3鏉傚寲杞ㄩ亾鎴愰敭銆?A:瀵?B:閿?绛旀: 鏁寸悊涓?绗簲绔?1銆佹煇鎭掑缁濈儹绠变腑鏈塁H4鍜孫2娣峰悎姘斾綋锛岄€氱數鐏姳浣垮叾鍙嶅簲锛堢數鐏姳鑳藉彲蹇界暐锛夛紝璇ュ彉鍖栬繃绋嬬殑锛? 锛?A:螖U=0 螖H=0B:螖U=0 螖H>0C:螖U=0 螖H<0D:螖U<0 未h>0绛旀: 鏁寸悊涓?2銆佸皢鍥轰綋NH4NO3婧朵簬姘翠腑锛屾憾娑插彉鍐凤紝鍒欒杩囩▼鐨勎擥銆佄擧銆佄擲绗﹀彿渚濇涓猴紙锛?A:+锛屸垝锛屸垝B:+锛?锛屸垝C:鈭掞紝+锛屸垝D:鈭掞紝+锛?绛旀: 鏁寸悊涓?3銆佸湪娓╁害鐩稿悓銆佸绉浉绛夌殑涓や釜瀵嗛棴瀹瑰櫒涓紝鍒嗗埆鍏呮湁姘斾綋A鍜孊銆傝嫢姘斾綋A鐨勮川閲忎负姘斾綋B鐨勪簩鍊嶏紝姘斾綋A鐨勭浉瀵瑰垎瀛愯川閲忎负姘斾綋B鐨?.5鍊嶏紝鍒檖(A)锛歱(B)=锛? 锛夈€?A:1/4B:1/2C:2D:4绛旀: 鏁寸悊涓?4銆佸湪鎭掓俯銆佹亽鍘嬩笅锛屽垽鏂竴涓寲瀛﹀弽搴旀柟鍚戞墍鐢ㄧ殑鐑姏瀛﹀嚱鏁颁负锛? 锛?A:螖HB:螖GC:螖G胃D:螖H胃绛旀: 鏁寸悊涓?5銆佸敖绠鍜學閮芥槸閫斿緞鍑芥暟锛屼絾(Q+W)鐨勬暟鍊间笌閫斿緞鏃犲叧銆?A:瀵?B:閿?绛旀: 鏁寸悊涓?6銆佸弽搴旇繘搴﹁〃绀哄寲瀛﹀弽搴旇繘琛岀殑绋嬪害锛?mol鍙嶅簲杩涘害鎸囨湁1mol 鍙嶅簲鐗╁彂鐢熶簡鍙嶅簲銆?A:瀵?B:閿?绛旀: 鏁寸悊涓?7銆佸弽搴斾骇鐗╃殑鍒嗗瓙鏁版瘮鍙嶅簲鐗╁锛岃鍙嶅簲鐨勎擲>0A:瀵?B:閿?绛旀: 鏁寸悊涓?绗叚绔?1銆佹煇鍙嶅簲閫熺巼鏂圭▼鏄痸=kcx (A) cy(B)锛屽綋c(A)鍑忓皯50锛呮椂锛寁闄嶄綆鑷冲師鏉ョ殑1/4锛涘綋c(B)澧炲ぇ鑷冲師鏉ョ殑2鍊嶆椂锛寁澧炲ぇ鑷冲師鏉ョ殑1.41鍊嶏紝鍒檟銆亂鍒嗗埆涓猴紙锛?A:x=0.5锛寉=1B:x=2锛寉=0.7C:x=2锛寉锛?.5D:x=2锛寉=2绛旀: 鏁寸悊涓?2銆佷粠鍖栧鍔ㄥ姏瀛﹁搴︼紝闆剁骇鍙嶅簲褰撳弽搴旂墿娴撳害鍑忓皬鏃讹紝鍙嶅簲閫熺巼鏄紙锛夈€?A:涓庡弽搴旂墿鍘熷娴撳害鍛堢浉鍙嶇殑鍙樺寲B:闅忓弽搴旂墿鍘熷娴撳害鐨勫钩鏂规牴鑰屽彉鍖?C:闅忓弽搴旂墿鍘熷娴撳害鐨勫钩鏂硅€屽彉鍖?D:涓嶅彈鍙嶅簲鐗╂祿搴︾殑褰卞搷。

fe单原子no配位摘要:I.引言A.背景介绍B.fe 单原子no 配位的研究意义II.fe 单原子no 配位的结构特点A.fe 单原子的定义B.no 配位的形成过程C.结构特点及其对性能的影响III.fe 单原子no 配位的性能与应用A.磁性能B.电化学性能C.催化性能D.实际应用案例IV.研究现状与发展趋势A.国内外研究现状B.存在问题与挑战C.未来发展趋势V.结论正文:I.引言铁单原子在许多生物和化学过程中起着重要作用。
近年来,关于铁单原子与一氧化氮(NO)配位的研究引起了广泛关注。
本文旨在介绍铁单原子与NO 配位的结构特点、性能与应用,并探讨研究现状与发展趋势。
II.铁单原子NO 配位的结构特点铁单原子是指在晶体中仅与一个或几个原子相连的铁原子。
NO 配位是指一氧化氮分子与铁原子形成的化学键。
在fe 单原子no 配位结构中,铁原子与一氧化氮分子通过共价键结合,形成稳定的配合物。
这种结构具有独特的电子和磁性质,对材料的性能产生重要影响。
III.铁单原子NO 配位的性能与应用1.磁性能:铁单原子与NO 配位可以显著改变材料的磁性能。
例如,在磁性材料中引入这种结构可以调控磁性的大小和方向。
2.电化学性能:铁单原子与NO 配位对材料的电化学性能也有重要影响。
这种配位可以改变铁原子的氧化还原状态,从而影响电化学反应的活性和选择性。
3.催化性能:铁单原子与NO 配位在催化领域具有广泛应用。
例如,这种配位可以提高催化剂的活性和稳定性,从而提高催化效率。
4.实际应用案例:铁单原子与NO 配位在环境保护、能源转换等领域有实际应用。
例如,Fe-NOx 催化剂可以用于汽车尾气净化,降低氮氧化物排放。
IV.研究现状与发展趋势1.国内外研究现状:近年来,关于铁单原子与NO 配位的研究取得了一系列成果。
国内外许多研究团队已经成功合成了这种结构的材料,并研究了它们的性能。
2.存在问题与挑战:尽管研究取得了一定的进展,但仍存在一些问题,如铁单原子与NO 配位的合成方法仍有待优化,性能与应用研究还需深入。

金属氮宾的闭壳层单线态【金属氮宾的闭壳层单线态探究】导语:在化学领域中,金属氮宾的闭壳层单线态是一个备受关注的主题。
在本文中,我们将深入探讨这个概念,并从简单到复杂、由浅入深地介绍金属氮宾的性质、结构和应用。
通过本文的阅读,您将能够全面、深入地了解金属氮宾的闭壳层单线态,并对其在化学领域中的重要性有更深刻的理解。
一、金属氮宾的概述金属氮宾是一类具有重要化学性质的化合物,其核心结构由金属离子与氮原子形成配位键。
闭壳层单线态指的是金属氮宾分子的电子结构中,所有电子都处于闭合壳层中的单重态。
这种特殊的电子结构使得金属氮宾在催化、磁性材料和光学材料等领域具有广泛的应用前景。
二、金属氮宾的性质1. 稳定性:金属氮宾的闭壳层单线态通常具有较高的化学稳定性,这是由于闭壳层结构带来的电子填充。
这使得金属氮宾能够在多个反应条件下保持其结构完整性,从而成为一种理想的催化剂。
2. 磁性:由于闭壳层单线态的电子结构,金属氮宾通常表现出较强的磁性。
这使得金属氮宾可以被应用于磁性材料的制备,例如用于数据存储和磁共振成像。
3. 光学性质:金属氮宾的闭壳层单线态还表现出一系列引人注目的光学性质。
这包括荧光效应、非线性光学效应以及对各种光的吸收能力。
这些性质使得金属氮宾可以应用于光学器件和光电子学领域。
三、金属氮宾的结构金属氮宾的闭壳层单线态结构复杂而多样。
它们的结构由金属离子与配位基团之间的化学键决定。
这些配位基团可以是有机分子,也可以是无机阴离子。
金属氮宾的结构对其性质和应用具有重要影响,因此对其结构的研究至关重要。
四、金属氮宾的应用金属氮宾的闭壳层单线态在化学催化、磁性材料和光学材料等领域有广泛的应用。
在化学催化中,金属氮宾可以作为催化剂,参与催化反应并提高反应速度和选择性。
在磁性材料中,金属氮宾的磁性性质使其成为制备高性能磁性材料的理想选择。
在光学材料中,金属氮宾的光学性质被用于制备光学器件和光电子学器件。
五、个人观点和理解金属氮宾的闭壳层单线态作为一种特殊的化合物,在化学领域中具有广泛的应用前景。

金属氮宾的闭壳层单线态金属氮宾是一种由金属离子和氮配体组成的配合物,具有闭壳层单线态的特性。
它由金属中心离子与多个氮原子配体形成配位键,通过共价键或者离子键稳定其结构。
金属氮宾的闭壳层单线态使其具有一系列独特的性质和应用。
第一个具有闭壳层单线态的金属氮宾是铁氧还蛋白,也称为血红蛋白。
血红蛋白是一种含有铁离子的生物蛋白质,广泛存在于哺乳动物的血液中。
血红蛋白的铁离子与四个氮原子配体形成的配位键稳定了其结构。
铁氧还蛋白能够在氧、气体和电子传导等生物过程中发挥重要的作用。
其闭壳层单线态使其具有较好的电子传导性能,使得铁氧还蛋白成为电子传感器和电子器件中的重要材料。
另一个具有闭壳层单线态的金属氮宾是铂氰化物,即一种由铂中心离子和氰配体组成的配合物。
氰配体通过提供电子形成了与铂离子之间的配位键,稳定了铂氰化物的结构。
铂氰化物具有良好的光电催化性能,被广泛应用于光电电池、光催化等领域。
其闭壳层单线态使得铂氰化物对光吸收和电荷分离有更高的效率,提高了光电催化反应的效果。
金属氮宾的闭壳层单线态还广泛应用于杂化材料和光磁性材料中。
通过在金属氮宾中引入其他元素的原子,可以实现不同材料的高度定制化。
这种特性使得金属氮宾成为制备高性能电池、储能材料以及信息记录材料的重要组成部分。
闭壳层单线态的特性还使得金属氮宾在光学和电子器件中具有较好的性能,例如顺磁共振成像和场效应晶体管等技术。
总之,金属氮宾的闭壳层单线态具有独特的性质和应用。
铁氧还蛋白和铂氰化物是两个常见的具有闭壳层单线态的金属氮宾。
这些金属氮宾广泛应用于生物医学、能源储存和光学电子等领域。
随着对金属氮宾研究的不断深入,相信未来会有更多的金属氮宾被发现,并应用于更多的领域。

mn配合物自旋状态判断自旋状态是指配合物中金属离子的电子自旋的状态,主要有单态、三重态和五重态等。
在配合物化合物中的金属离子,其电子会占据不同的轨道,其中包括两个主要的类型:d轨道和p轨道。
根据量子力学理论的规定,每个轨道上可以容纳一定数量的电子,并且每个电子都有自旋(spin)状态,可以是自旋向上(↑)或向下(↓)。
在确定配合物中金属离子自旋状态的方法中,较为常用的有以下几种:1.适用于d轨道占据的金属离子的斯特克效应(Stark effect):当外加电场作用于金属离子时,电子的自旋状态会发生改变。
通过测量电场引起的能级移动,可以得知自旋状态的改变。
2.适用于p轨道占据的金属离子的磁共振方法(Magnetic Resonance):通过外加磁场作用下的核磁共振,可以观察到电子磁矩的性质,从而确定自旋状态。
3.根据配合物的性质来判断:例如,当配合物中存在没有配位位点的孤对电子时,其自旋状态往往会是三重态;当存在多个孤对电子时,其自旋状态往往会是五重态。
需要注意的是,以上方法只能提供配合物中金属离子自旋状态的初步判断,具体的判断还需要通过实验数据和计算结果进行进一步的确认。
此外,由于自旋是量子力学中的现象,其性质比较复杂,不同的自旋状态之间存在一系列的相互作用,需要进行深入的研究才能完全理解。
在实际应用中,对配合物的自旋状态的判断具有重要的意义。
例如,在催化反应中,金属离子的自旋状态将直接影响反应的速率和产物的构型。
因此,研究和理解金属离子的自旋状态是进行高效催化剂设计和优化的重要一步。
总结起来,配合物中金属离子的自旋状态是指其电子自旋的状态。
确定其自旋状态有多种方法,包括斯特克效应、磁共振方法以及根据配合物的性质进行初步判断。
对于配合物的自旋状态的研究有助于深入理解金属离子的性质,并在催化反应等领域中发挥重要作用。

昆明一中2024届高三第3次联考化学参考答案7.【答案】C【解析】青铜是铜、锡、铅等金属的合金,属于金属材料,A 项不符合题意;20882Pb含有的中子数为(208-82)=126,0.01 mol 208Pb 含中子数为1.26 N A ,B 项不符合题意;23592U 与20782Pb 的质量比为235:207时,两者的物质的量之比为1:1,电子数之差为n ×10 N A ,由于物质的量n 不确定,相差的电子数亦不能确定,仅当n =1 mol 时,电子数相差10 N A 才成立,C 项符合题意;核反应23892U →842He +601 e+20682Pb 遵循质量数和电荷数守恒,D 项不符合题意。
8.【答案】D【解析】紫草素和阿卡宁结构中均含一个手性碳,且互为镜像,两者互为手性异构体,A 项不符合题意;紫草素、阿卡宁侧链上的一个双键碳同时连接两个甲基,不存在顺反异构体,B 项不符合题意;紫草素和阿卡宁都含有酚羟基,能与氢氧化钠溶液反应,C 项不符合题意;酮羰基能与氢气加成,紫草素与氢气完全加成的物质的量之比应为1:7,D 项符合题意。
9.【答案】B【解析】据图可知,反应过程中有Fe —O 键的断裂和形成,A 项不符合题意;反应过程中O 2获得4e −,两个二价Fe 共失去4e −,变为+4价,循环往复,B 项符合题意;根据图中物料的进入和产出,反应方程式为CH 4+O 2+2H ++2e −酶CH 3OH+H 2O ,于100%,D 项不符合题意。
10.【答案】C【解析】侯氏制碱法需要制备氨气、二氧化碳并通入饱和食盐水中反应析出碳酸氢钠沉淀,过滤后使碳酸氢钠受热分解,同时生成的二氧化碳可循环利用,需要用到制气(氨气、二氧化碳)、过滤和受热分解装置,不需要用到蒸发装置,故选C 。
11.【答案】A【解析】碳化钙水解生成氢氧化钙和乙炔,化学方程式错误,A 项符合题意;碘化钾被空气中的氧气氧化为碘单质,溶液变黄,化学方程式无误,B 项不符合题意;硝酸银分解生成的黑色固体为银单质,化学方程式无误,C 项不符合题意;铜在潮湿空气中久置生成碱式碳酸铜,化学方程式无误,D 项不符合题意。


唐山一中2016年12月份高三调研考试理科综合能力测试注意事项:1. 本试卷分第I卷(选择题)和第n卷(非选择题)两部分。
2. 答题前,考生务必将自己的姓名、准考证号填写在答题卡上。
3. 全部答案在答题卡上完成,答在本试题上无效。
4. 考试结束后,将本试题和答题卡一并交回。
可能用到的相对原子质量:H:1 C:12 O:16 N:14 S:32 Na:23 K : 39 Cu :64 Fe:56Zn:65 Pb: 207第I卷(选择题共126分)一、选择题:本大题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1 .下列有关细胞内物质含量比值的关系,正确的是A. 细胞内结合水/自由水的比值,种子萌发时比休眠时高B. 人体细胞内CO/O2的比值,线粒体内比细胞质基质高C. 神经纤维膜内《/ Na+的比值,动作电位时比静息电位高D. 适宜条件下光合作用过程中C/C5的比值,停止供应CO后比停止前的高2. 在培养人食管癌细胞的实验中,加入青蒿琥酯(Art ),随着其浓度升高,凋亡蛋白表达量增多,癌细胞凋亡率升高。
下列叙述错误的是A. 为初步了解Art对癌细胞的影响,可用显微镜观察癌细胞的形态变化B. 在癌细胞培养液中加入用放射性同位素标记的Art,可确定Art能否进入细胞C. 为检测Art对凋亡蛋白Q表达的影响,须设置不含Art的对照实验D. 用凋亡蛋白Q饲喂患癌鼠,可确定该蛋白能否在动物体内诱导癌细胞凋亡3 .某哺乳动物棒状尾(A)对正常尾(a)为显性;黄色毛(Y)对白色毛(y)为显性,但是雌性个体无论毛色基因型如何,均表现为白色毛。
两对基因均位于常染色体上并遵循基因的自由组合定律。
下列叙述正确的是A. A与a、Y与y两对等位基因位于同一对同源染色体上B. 若想依据子代的表现型判断出性别能满足要求的交配组合有两组3:5 C. 基因型为Yy的雌雄个体杂交,子代黄色毛和白色毛的比例为D. 若黄色与白色两个体交配,生出一只白色雄性个体,则母本的因型是Yy4. 下列过程不会导致生物进化的是A. 在红眼果蝇的群体中,出现了白眼突变个体B. 小麦Aa连续自交,后代个体中AA所占比例越来越髙C. 濒临灭绝的江豚,有些个体得不到交配机会使部分基因消失D. 森林公园不断有灰喜鹊迁入从而引起基因频率的改变5. 用不同浓度的某种生长素类似物对植物进行插条生根的研究,其实验结果如下图。

fe单原子no配位Fe单原子No配位是指铁原子(Fe)与氮氧原子(No)之间形成配位键的化学反应。
在这种反应中,铁原子的外层电子与氮氧原子的电子互相吸引,并形成稳定的化学键。
Fe单原子No配位在生物化学、材料科学和催化化学等领域都有重要的应用。
在生物化学中,Fe单原子No配位在生物体内起着关键的作用。
铁离子是人体内许多重要酶的辅助因子,它在氧气传递、氧气储存和氧气激活等过程中起着重要的催化作用。
Fe单原子No配位能够稳定铁离子的电子结构,并提高其催化活性。
这对于人体内的氧气转运和呼吸过程至关重要。
在材料科学中,Fe单原子No配位也具有广泛的应用。
由于Fe单原子No配位的稳定性和活性,它被广泛应用于催化剂的设计和合成中。
催化剂是许多化学反应的关键,通过调控Fe单原子No配位的结构和电子状态,可以提高催化剂的活性和选择性。
例如,Fe单原子No 配位可以用于制备高效的催化剂,用于二氧化碳还原、氮气还原和氢氧化物电化学合成等重要反应。
在催化化学中,Fe单原子No配位还可以用于有机合成和氧化反应。
通过调控Fe单原子No配位的配位环境和配体结构,可以实现高效的氧化反应和有机合成反应。
例如,Fe单原子No配位可以用于高效催化的有机氧化反应,将有机物转化为对应的醛、酮或酸。
同时,Fe单原子No配位还可以用于不对称合成,通过控制配体的手性,可以得到具有高立体选择性的有机产物。
Fe单原子No配位在生物化学、材料科学和催化化学中具有重要的应用。
它可以稳定铁离子的电子结构,并提高其催化活性。
通过调控配位环境和配体结构,可以实现高效的氧化反应和有机合成反应。
Fe单原子No配位的研究对于开发高效催化剂和实现可持续发展具有重要意义。

fe单原子no配位NO分子是由氮和氧两个原子组成的,化学式为NO。
它是一种无色、无味且具有高度活性的气体。
在自然界中,NO分子广泛存在于大气中,是大气污染物的重要成分之一。
然而,在配位化学中,NO分子具有独特的性质和应用。
NO分子可以通过与金属原子形成配位键来参与化学反应。
在配位化学中,金属离子通常作为配体的中心原子,而NO分子则通过氮原子与金属形成配位键。
NO分子可以以多种形式与金属配位,例如以氮原子或氧原子与金属形成配位键,或者通过氮和氧原子同时与金属形成配位键。
这种特殊的配位方式使得NO分子在配位化学中具有独特的性质和反应。
NO分子的配位性质使其在金属催化反应中发挥重要作用。
以NO为配体的金属配合物可以作为催化剂,参与多种有机合成反应。
例如,Rh(NO)(PPh3)3是一种常用的催化剂,可以催化碳氢键活化反应和碳碳键形成反应。
另外,NO分子也可以与金属配合物形成稳定的配位化合物,这些化合物在医学和药物领域有着广泛的应用。
例如,金属配合物NO-donor可以通过释放NO分子来具有抗炎和抗肿瘤的作用。
NO分子还可以通过与金属离子形成配位键来调控金属离子的性质和反应。
例如,NO分子可以与铁离子形成配位键,从而改变铁离子的氧化态和磁性。
这种配位作用对于铁离子在生物体内的功能至关重要,例如血红蛋白中的铁离子可以通过与NO分子形成配位键来调控氧的输送和释放。
这种调控机制对于人体的正常代谢和健康至关重要。
FE单原子NO配位在配位化学中具有重要的意义和应用。
NO分子可以通过与金属离子形成配位键来参与各种化学反应,同时也可以通过与金属离子形成配位键来调控金属离子的性质和反应。
这些特性使得NO分子在催化剂设计、药物研发和生物学研究中具有广泛的应用前景。
我们相信,随着对NO分子配位化学的深入研究,我们将能够更好地利用NO分子的特性,开发出更多有益于人类和环境的新材料和新技术。

氮原子在铁低指数面上的吸附位和吸附态
丰慧;刁兆玉;王泽新;贾红英
【期刊名称】《化学学报》
【年(卷),期】2005(063)020
【摘要】应用原子和表面簇合物相互作用的5参数Morse势方法(5-MP)对N-Fe 低指数表面体系进行了系统的研究,并获得了全部临界点特性,如吸附位、吸附几何、结合能、正则振动频率等.计算结果表明:在Fe(100)面,N原子吸附在四重洞位;在
Fe(110)表面,趋向于吸附在膺式三重位;而在Fe(111)表面最稳定的吸附位是近似桥位.
【总页数】6页(P1889-1894)
【作者】丰慧;刁兆玉;王泽新;贾红英
【作者单位】山东师范大学化学院,济南,250014;山东师范大学化学院,济
南,250014;山东师范大学化学院,济南,250014;山东师范大学化学院,济南,250014【正文语种】中文
【中图分类】O6
【相关文献】
1.H原子在Ru(11-21)台阶面上的吸附位和吸附态 [J], 王泽新;庞雪辉;张晓明
2.氮原子在钨低指数表面上的吸附和振动 [J], 王重阳;冷冰;孙绍鹏;郝策;王泽新
3.H原子在W低指数面上的吸附位和吸附态 [J], 张静;于艳杰;王泽新;秦伟娜;刁兆玉;郝策
4.氯原子在Ag低指数面上的吸附位和吸附态 [J], 张静;刁兆玉;王泽新;丰慧;郝策
5.分子态氧在Ag(110)面上的吸附构型,吸附态和吸附能的CM和DAM从… [J], 王文宁;范康年
因版权原因,仅展示原文概要,查看原文内容请购买。
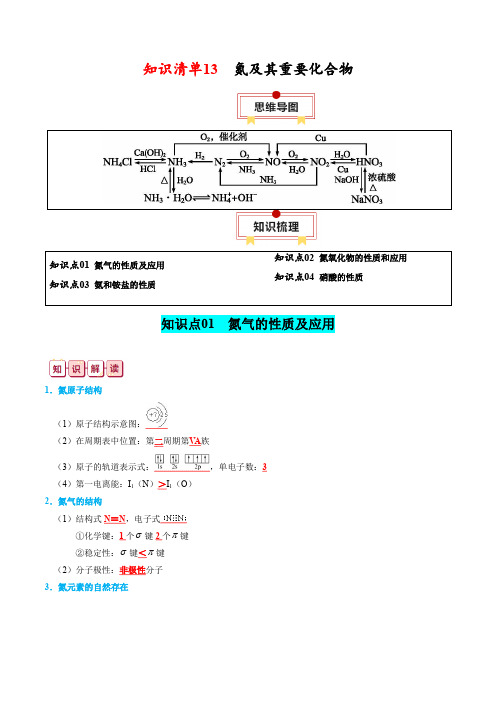
知识清单13氮及其重要化合物知识点01 氮气的性质及应用知识点03 氨和铵盐的性质知识点02 氮氧化物的性质和应用知识点04 硝酸的性质知识点01 氮气的性质及应用1.氮原子结构(1)原子结构示意图:(2)在周期表中位置:第二周期第V A族(3)原子的轨道表示式:,单电子数:3(4)第一电离能:I1(N)>I1(O)2.氮气的结构(1)结构式N≡N,电子式①化学键:1个σ键2个π键②稳定性:σ键<π键(2)分子极性:非极性分子3.氮元素的自然存在4.自然界中氮的循环5.氮气的物理性质(1)色味态:无色无味气体 (2)密度:在标准状况下ρ(N 2)=22.4L/mol28g/mol =1.25g•L -1,比空气的小(极为接近)(3)溶解性:难溶于水(4)收集方法:只能用排水法(密度与空气接近,不能用排空气法) 6.氮气的化学性质(1)稳定性:N ≡N 键能很大,通常情况下很难发生反应 (2)氧化性:N 2+3H 22NH 3(工业固氮反应)(3)还原性①除去中H 2的N 2:3Mg+N 2Mg 3N 2②高能固氮反应:N 2+O 22NO7.氮化镁 (1)电子式:(2)与水反应:Mg 3N 2+6H 2O3Mg (OH )2↓+2NH 3↑(3)与过量盐酸反应:Mg 3N 2+8HCl 3MgCl 2+2NH 4Cl 8、氮气的用途(1)工业上合成氨,制硝酸(2)代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化 (3)在灯泡中填充氮气以防止钨丝被氧化或挥发 (4)保存粮食、水果等食品,以防止腐烂(5)医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术(6)高科技利用液氮制造低温环境,使某些超导材料获得超导性能(1)氮元素在自然界中主要以N 2的形式存在于大气中,在空气中占体积分数约为0.78,N 2的相对分子质量与空气接近,故N 2的密度与空气接近,实验室只能用排水法收集。
(2)N 2化学性质不活泼,在一般条件下不与氧气反应,经常作为食品包装袋的填充剂隔绝空气,避免食品被氧化变质。

价层电子对互斥理论一、选择题1.下列物质中既有极性键,又有非极性键的直线形分子的是()A.CS2 B.CH4C.CH3CH2Cl D.HC≡CH答案D解析CS2和HC≡CH为直线形分子,但CS2中只有极性键。
2.下列分子中,所有原子不可能共处在同一平面上的是()A.C2H2 B.CS2 C.NH3 D.C6H6答案C解析C2H2、CS2为直线形分子,NH3为三角锥形分子,C6H6为平面正六边形分子。
3.下列分子的立体构型为平面正三角形的是()A.PCl3 B.BCl3 C.NH3 D.CH2O答案B解析PCl3、NH3中的中心原子—-P、N原子各有1对孤电子对,跟周围的3个σ键相互排斥,所以这两个分子都为三角锥形,A、C错误;CH2O的立体构型虽为平面三角形,但不是正三角形,D错误。
4.下列分子或离子中,不含孤电子对的是( )A.H2O B.H3O+ C.NH3 D.NH错误!答案D解析四种微粒的电子式H错误!错误!错误!、[H错误!O错误!,·×错误!H]+、错误!N错误!,错误!错误!H、H错误!N错误!,错误!错误!H+,D正确。
5.根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是()A.PCl3 B.H3O+ C.HCHO D.PH3答案C解析确定ABm型分子或离子立体构型的思路σ键电子对数+中心原子上的孤电子对数=中心原子上的价层电子对数错误!VSEPR模型错误!分子或离子的立体构型。
6.由VSEPR理论推断下列微粒呈正四面体形的是( )A.SO2 B.O3 C.NO错误! D.SO错误!答案D解析符合题意的微粒应满足AB4型结构,中心原子无孤电子对,其空间构型为正四面体形。
7.甲烷和白磷均为正四面体结构,判断甲烷和白磷分子中化学键的键角关系()A.前者大于后者 B.前者小于后者C.二者相等 D.无法判断答案A解析甲烷分子中化学键的键角为109°28′。