高中化学 第1 章复习与测评 新人教版必修2
- 格式:ppt
- 大小:1.85 MB
- 文档页数:26

高中化学第一章章末小结与测评讲义(含解析)新人教版必修2考纲要求1.了解原子的组成,了解构成原子的各微粒之间的关系。
2.了解元素、核素和同位素的含义。
3.了解原子核外电子排布,掌握分子、原子、离子及原子团等微粒核外电子数的比较。
4.了解化学键、离子键、共价键的概念,了解离子键、共价键的形成过程。
考纲说明该类题目在高考中常以选择题或填空题的形式呈现。
对于原子结构常常结合诺贝尔奖,性能优异的元素等最新科技成果进行考查,主要考查核素和同位素的概念辨析、原子中各微粒数目之间的关系等。
对于化学键的考查,主要涉及化学用语的正确使用、离子键和共价键的存在以及离子化合物和共价化合物的判断等。
顺利解答该类题目需要透彻理解概念,把握概念的内涵和外延,明确概念的区别和联系,同时还要认真审题,正确使用化学用语。
子的电子层结构相同,d和b同族。
下列叙述错误的是( )A.a与其他三种元素形成的二元化合物中其化合价均为+1B.b与其他三种元素均可形成至少两种二元化合物C.c的原子半径是这些元素中最大的D.d与a形成的化合物的溶液呈弱酸性解析:选A 由题中所给的信息可知,a为H,b为O,c 为Na,d为S。
A项中,H与Na可以形成化合物NaH,H的化合价为-1;B项中,O与其他三种元素可以形成H2O、H2O2、Na2O、Na2O2、SO2、SO3等二元化合物;C项中,四种元素原子半径大小顺序为Na>S>O>H; D 项中,H与S形成化合物H2S,其水溶液呈弱酸性。
2.(2016·浙江高考)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。
W-的最外层为8电子结构。
金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。
下列说法正确的是( ) A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应B.原子半径大小:X<Y,Z>WC.化合物Z2Y和ZWY3都只存在离子键D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂解析:选D 短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X是C,由题意推知Y的核电荷数是8,则Y是O,Z的单质在氧气中燃烧生成的化合物可与水发生氧化还原反应,则Z是Na,W-最外层为8电子结构,且X、Y、Z、W的原子序数依次增大,则W是Cl。

第一章综合练习第Ⅰ卷(选择题共46分)一、选择题(本题包括8小题,每小题2分,共16分。
每小题只有一个选项符合题意。
)1.下列物质中既能和浓硫酸反应,又能和烧碱反应的是A. H2B. Cl2C. H3PO4D. (NH4)2SO42.将氨气通过灼热的氧化铜后,发现氧化铜变红色,此外还收集到一种单质气体,这种气体估计应是A. O2B. H2OC. NOD. N23.(01北京春季高考)关于氮族元素(用R代表)的下列叙述正确的是A. 最高化合价是5B. 氢化物的通式为RH5C. 非金属性由上到下递增D. 其含氧酸均为一元强酸4.(01全国高考)NO3-+Zn+OH-+H2O—→NH3+Zn(OH)4-配平后,离子方程式中H2O的系数是A. 2B. 4C. 6D. 85.起固定氮作用的化学反应是A. N2与H2在一定条件下反应生成NH3B. NO与O2反应生成NO2C. NH3经催化氧化生成NOD. 由NH3制碳酸氢铵和硝酸铵固体6.(99全国高考)Murad等三位教学最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖。
关于NO的下列叙述不正确的是A. NO可以是某些含低价N物质氧化的产物B. NO不是亚硝酸酐C. NO可以是某些含高价N物质还原的产物D. NO是红棕色气体7.环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息,这些污染物是A. 二氧化硫、氮氧化物、一氧化碳、悬浮微粒B. 二氧化硫、氮氧化物、二氧化碳、悬浮微粒C. 稀有气体、氮氧化物、一氧化碳、悬浮微粒D. 稀有气体、氮氢化物、一氧化碳、悬浮微粒8.农业及城市生活污水中含磷,家用洗涤剂就是污水中磷的一个重要来源(洗涤剂中含有磷酸钠)。
处理污水时要不要除去磷,有以下几种意见,你认为正确的是A. 磷是生物的营养元素,不必除去B. 含磷的污水是很好的肥料,不必处理C. 含磷的污水排放至自然水体中能引起藻类增殖,使水变质,必须除去D. 磷对人无毒,除去与否都无关紧要二、选择题(本题包括10小题,每小题3分,共30分。

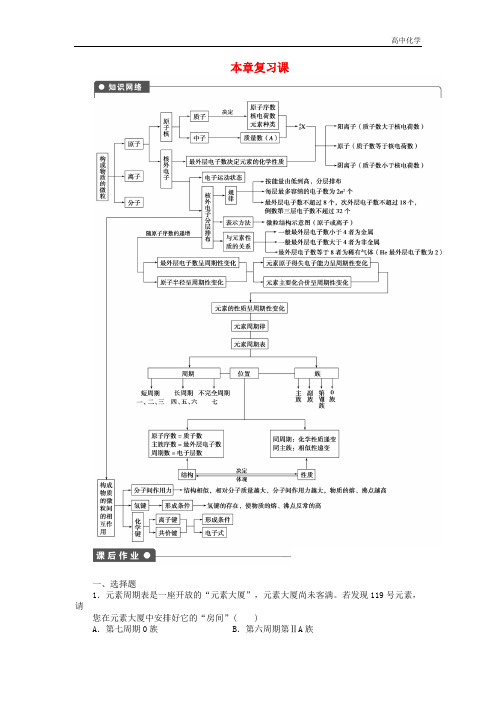
本章重点掌握以下几点:1.元素周期表的结构;2.元素、核素、同位素的辨别;3.核外电子排布规律;4.原子、离子、分子中基本构成微粒间的关系;5.元素周期律及其实质;6.化学键中的相关概念;7.电子式的书写。
要点一、元素周期表1.元素周期表的结构(“七横十八纵”)2.几种关系(1)电子层数=周期数(2)最外层电子数=主族序数=最高正化合价(除F、O)(3)质子数=原子序数(4)∣最高正价∣+∣最低负价∣=8(对非金属元素而言,但对H不适用)注意:O无最高正价(+6),F无正价例题:原子序数为x的元素位于周期表中的ⅡA族,则原子序数为x+1的元素不可能为() A.ⅢA族B.IA族C.镧系元素D.ⅢB族要点二、元素、核素、同位素例题: 是( ) A .氢的五种同位素 B .五种氢元素C .氢的五种同素异形体D .氢元素的五种不同微粒 要点三、原子核外电子排布规律 1.在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层。
2.原子核外各电子层最多容纳2n 2个电子。
3.原子最外层电子数目不超过8个(K 层为最外层时不能超过2个电子)。
4.次外层电子数目不能超过18个(K 层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
注意:以上规律既相互联系,又互相制约,不能孤立片面的理解。
如M 层为最外层的时候,最多为8个,而不是18个。
H 2H +H 112H 13H 1、、、、要点四、核外电子数相等的微粒例题:两种微粒的质子数和电子数均相等,下列关于两种微粒间关系的说法错误的是( ) A .它们可能是不同的分子 B .它们可能是不同的离子 C .它们可能互为同位素D .它们可能是分子和离子 要点五、元素周期律元素周期表中主族元素性质的递变规律要点六、比较元素的金属性强弱和非金属性强弱的一般方法金属性比较本质原子越易失电子、金属性越强判断依据1.在金属活动顺序表中越靠前,金属性越强。

……名:____……人教版高中化学必修2第一章单元测试题(含解析) 第I 卷(选择题) 一、单选题 1.下列物质中既有离子键又有共价键的是 A .HNO 3 B .NH 4Cl C .Na 2S D .Al 2O 3 2.R 、W 、X 、Y 、Z 五种短周期元素在周期表中的相对位置如图所示,W 的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知 A .R 、W 、Y 的原子半径依次增大 B .R 、X 、Y 的简单氢化物的稳定性依次增强 C .W 、Y 、Z 形成的单核阴离子还原性依次增强 D .X 、Y 、Z 的最高价氧化物对应水化物的酸性依次增强 3.3.可用于治疗甲亢,有关的说法正确的是 A .中子数为131 B .质子数为131 C .电子数53 D .质量数53 4.X 、Y 、Z 均是短周期元素,X 、Y 处于同一周期,X 、Z 的最低价离子分别为X 2-和Z -,Y +和Z -离子具有相同的电子层结构。
下列说法正确的是 A .原子半径:X >Y >Z B .单质沸点:X >Y >Z C .原子最外层电子数:X >Y >Z D .原子序数:X >Y >Z 5.Q 、W 、X 、Y 、Z 是原子序数依次增大的短周期元素,X 的焰色反应呈黄色,Q 元素的原子最外层电子数是其内层电子数的2倍,W 、Z 原子最外层电子数相同,Z 的核电荷数是W 的2倍,元素Y 的合金是日常生活中使用最广泛的金属材料之一。
下列说法正确的是( ) A .简单离子半径的大小顺序:r X >r Y >r Z >r W B .元素Q 和Z 能形成QZ 2型的共价化合物…………:_________…………C .Z 元素氢化物的沸点高于W 元素氢化物的沸点 D .X 、Y 、Z 最高价氧化物的水化物之间两两不能发生反应 6.下下下下下下下下下下下下下下下下下下下下下 下 A .下下下下下下下下下下ⅥA下 B .下下下下下下下下下下下下下下下下下下IV A下 C .下下下下18下下 D .ⅠA下下下下下下下下 7.短周期元素X 、Y 、Z 、W 的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y 原子的电子层数和最外层电子数相同,Z 单质可制成半导体材料,W 与X 属于同一主族。

第一章第二节第1课时一、选择题1.(2014·黄山高一检测)短周期相邻的三种元素,它们的最外层电子数之和为16,电子层数之和为7。
不属于这三种元素的是()A.S B.OC.N D.P答案:A点拨:由于是短周期三种相邻的元素且电子层数之和为7,所以这三种元素只能是两种位于第2周期,一种位于第3周期;所以三种元素的排列方式可能是再根据最外层电子数之和为16得:若是第一种情况,假设1的最外层电子数为x,可得3x+1=16,则x=5,所以1、2、3分别是N、O、P,若是第二种情况,假设2的最外层电子数为x,则可得3x-1=16,则x=17/3,不符合题意。
2.(2014·黄梅一中高一期中)A,B为短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A、B两元素形成的化合物可表示为()A.BA2B.BA3C.B3A2D.A3B2答案:C点拨:由题意知A为第二周期,B为第三周期,则A的L层有5个电子,A为N,B为Mg,二者可组成Mg3N2的化合物,C项正确。
3.(2014·经典习题选萃)下列叙述中正确的是()A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同B.具有相同电子数的两种微粒一定具有相同的化学性质C.两原子,如果核外电子排布相同,则一定属于同种元素D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同答案:C点拨:A中核外电子排布相同的粒子性质不一定相同,如Na+和Ne。
B中电子数相同的微粒化学性质也不一定相同,如H2O与Ne都具有10个电子,但其化学性质不同。
D中阴离子的核外电子排布一定与本周期稀有气体元素原子的核外电子排布相同,而不是上一周期。
4.下列说法中正确的是()A.锂的原子结构示意图是B.某原子M层电子数为L层电子数的4倍C.某离子M层和L层电子数均为K层的4倍D.离子的核电荷数一定等于其核外电子数答案:C点拨:K层电子数最多是2,故锂原子的原子结构示意图是,A错误;元素M层有电子,其L层一定有8个电子,M层上电子数为L层上电子数的4倍,则M层上电子数为32,而M层最多容纳18个电子,B项错误;K层电子数填满是2,某离子M层和L层电子数均为K层的4倍,即均是8,故该离子的核外电子数是18,C正确;原子得失电子后成为离子,因此该离子的核外电子数一定不等于其核电荷数,D错误。

第一章测评(时间:90分钟满分:100分)可能用到的相对原子质量:H 1 C 12Si 28P 31Cl 35.5一、选择题(本题包括10个小题,每小题只有一个选项符合题意。
每小题2分,共20分)1.对充有氖气的霓虹灯管通电,灯管发出红色光。
产生这一现象的主要原因是()A.电子由激发态向基态跃迁时以红光的形式释放能量B.电子由基态向激发态跃迁时吸收除红光以外的光线C.氖原子获得电子后转变成发出红光的物质D.在电流的作用下,氖原子与构成灯管的物质发生反应,灯管发出红色光的原因是电子从激发态(高能量态)跃迁到基态(低能量态)时释放的能量以红光的形式表现出来。
2.在学习核外电子排布的知识时,甲、乙两小组对多电子原子能级的有关知识产生了分歧:甲组认为第三周期元素的基态原子中不可能出现d电子,而乙组认为第三周期元素基态原子中一定有d电子。
下列可作为甲组论据的是()A.能量守恒原理B.泡利原理C.洪特规则D.3d能级能量比4s能级高3个电子层,因为3d能级能量比4s能级高,3d能级中的电子必然在4s 能级填满电子后才能填充,故当填充3d能级时电子层已变为了4层。
3.下列原子的价层电子排布式或价层电子轨道表示式中,①②两种状态的能量符合E(①)>E(②)的是()A.氮原子:B.钠原子:①3s1②3p1C.铬原子:①3d54s1②3d44s2D.碳原子:项中,状态②的2p能级半充满,能量相对较低。
4.原子序数为83的元素位于:①第五周期②第六周期③第ⅣA族④第ⅤA族⑤第ⅡB族,其中正确的组合是()A.①④B.②③C.②④D.①⑤,可以依据其原子结构示意图或电子排布式,根据电子层数确定其所在周期,根据最外层电子数确定其所在族。
另外用0族元素定位法更为方便,即根据与该元素原子序数最接近的0族元素的位置来确定。
与83号元素最邻近的0族元素为86号元素氡,83号元素比氡的原子序数小3,故该元素在周期表中的位置应该是氡左移3个格,即第六周期第ⅤA族。
本章复习课一、选择题1.元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。
若发现119号元素,请您在元素大厦中安排好它的“房间”()A.第七周期0族B.第六周期第ⅡA族C.第八周期第ⅠA族D.第七周期第ⅦA族2.下图形象地表示了氯化钠的形成过程。
下列相关叙述中不正确的是( )A.钠原子易失去一个电子,氯原子易得到一个电子B.钠离子与钠原子有相似的化学性质C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强D.氯化钠是离子化合物3.A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:A B C D E下列说法中正确的是(A.E元素的最高化合价为+7时,D元素的负化合价可为-2价B.A(OH)n为强碱时,B(OH)m也一定为强碱C.H n DO m为强酸时,E的非金属性一定很强D.H n CO m为强酸时,E的单质可能有强还原性4.下列关于碱金属元素和卤素的说法中,错误的是( )A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强C.钾与水的反应比钠与水的反应更剧烈D.溴单质与水的反应比氯单质与水的反应更剧烈5.下面是用电子式表示某些物质的形成过程,其中正确的是( )6.下面是一些常见分子的比例模型。
其中1个分子中含有共用电子对最多的是( )7金属试验G L M R和冷水反应无反应慢慢反应未试验未试验和2 mol·L-1盐酸反应溶解并放出气体溶解并放出气体无反应无反应和R n+的水溶溶解并形未试验溶解并未试验) A.L、G、R、M B.G、L、M、RC.L、G、M、R D.L、R、G、M8.A+、B2+、C-、D2-4种离子具有相同的电子层结构。
现有以下排列顺序:①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )9. 写出下列各粒子的化学式:(1)由2个原子组成的具有10个电子的分子是________,阴离子是________。


第一章综合能力测试(本试卷满分100分,测试时间90分钟)一、选择题(每小题3分,共51分)1.下列关于观或研究方法的叙述中,错误的是( ) A.在工生产中应遵循“绿色”的思想B.在过渡元素中寻找优良的催剂.在元素周期表的金属和非金属分界线附近寻找半导体材料D.根据元素周期律,由HO4可以类推出氟元素也存在最高价氧物的水物HFO4【答案】 D【点拨】由于F元素的非金属性很强,故其没有正合价,故类推的思想对于F元素不适合。
所以D项错误。
2.已知A、B、、D、E是短周期中原子序依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子是其电子层的2倍,元素在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。
下列说法正确的是( )A.元素A、B组成的合物常温下一定呈气态B.一定条件下,元素、D的最高价氧物对应的水物之间能发生反应.工业上常用电解法制备元素、D、E的单质D.合物AE与E含有相同类型的键【答案】 B【点拨】最外层电子是其电子层2倍的元素有和S,原子序比元素B大的短周期元素还有、D、E,所以元素B只能是;元素为第三周期中原子半径最大的元素,为N,元素D为A,元素A为H,元素E为。
A项,碳氢合物随碳原子的增加,状态由气态到液态,再到固态;B项,NOH+A(OH)3===NAO2+2H2O;项,N、A均为活泼金属,用电解法冶炼,电解饱和N溶液可得2;D项,H中含有共价键,N中含有离子键。
3.某元素的一种同位素的原子质量为A,含N个中子,它与1H原子组成H分子。
在gH中所含质子的物质的量是( )A错误!未定义书签。
(A-N+)B错误!未定义书签。
(A-N)错误!未定义书签。
(A-N)D错误!未定义书签。
(A-N+)【答案】 A【点拨】原子的质子为A-N,1个H分子中所含质子为+(A-N)个,则gH 中所含质子的物质的量为:错误!未定义书签。
×[+(A-N)]=错误!未定义书签。

第一章综合检测(90分钟,100分)一、选择题(此题包括18个小题,每题3分,共54分)1.(2014·汶山一中5月质检)关于199F-微粒表达正确的选项是()A.质量数为19,电子数为9B.质子数为9,中子数为10C.质子数为9,电子数为9D.中子数为10,电子数为8答案:B2.(2014·北京六十六中高一下学期期末)下表符号中“2”的含义正确的一组是()答案:B3.(2014·灌云县四中高检测)原子核外电子是有规律地进行排布的,它们分层排布在K、L、M、N、O……层上,以下表达正确的选项是()A.K层上容纳的电子数只能是2个B.K层上容纳的电子数可以超过2个C.L层上最多只能容纳8个电子D.最外层上容纳的电子数可以超过8个答案:C点拨:K层容纳的电子数最多为2个,也可能容纳1个,A、B两项不正确;除了K层,不管是哪个电子层,当其为最外层时,容纳的电子数最多为8个,不能超过8个,D项不正确。
4.(2014·泰州市姜堰区高一期中)关于元素周期表和元素周期律的应用有如下表达:①元素周期表是同学们学习化学知识的一种重要工具;②利用元素周期表可以预测新元素的原子结构和性质;③利用元素周期表和元素周期律可以预言新元素;④利用元素周期表可以指导寻找某些特殊的材料。
其中正确的选项是()A.①②③④B.②③④C.③④D.②③答案:A5.(2014·北京六十六中高一下学期期末)以下各项中表达正确的选项是()A.H、D、T表示同一种核素B.F-离子结构示意图C.用电子式表示HCl形成过程D.次氯酸电子式答案:B点拨:H、D、T互为同位素,它们是氢元素的三种核素,A项不正确;HCl为共价化合物,书写电子式时不用加中括号,B项不正确;次氯酸的电子式应为,D项不正确。
6.(2014·泰州市姜堰区高一期中)以下分子中所有原子都满足最外层8电子稳定结构的是() A.六氟化氙(XeF6)B.次氯酸(HClO)C.二氧化碳(CO2)D.三氟化硼(BF3)答案:C点拨:Xe最外层有8个电子,又和6个F形成6个共用电子对,在XeF6中Xe最外层有14个电子,A项不正确;HClO中的H只能形成2个电子的稳定结构,B项不正确;BF3的电子式为,B原子最外层为6个电子,D项不正确。

第一章原子结构与性质过关测试基础卷(时间:90分钟)一、选择题(每小题3分,共54分)1.下列关于能层与能级的说法中正确的是()A.能层就是电子层,每个能层最多可容纳的电子数为n2B.同是p能级,在不同的能层中所能容纳的最多电子数是相同的C.任一能层的能级总是从s能级开始至f能级结束D.能级能量4s > 3d【答案】B【解析】A.能层就是电子层,每个能层最多可容纳的电子数是2n2个,故A错误;B.p能级最多容纳6个电子,即p能级在不同的能层中所能容纳的最多电子数是相同的,故B正确;C.第一能层只有s能级,所以任一能层的能级总是从s能级开始,但不是到f能级结束,有的能层没有f能级,故C错误;D.根据构造原理可知,能量由低到高的顺序为:1s、2s、2p、3s、3p、4s、3d、4p…,则能级能量:3d>4s,故D错误;答案选B。
2.下列关于能层与能级的说法中正确的是()A.原子核外每一个能层最多可容纳的电子数为n2B.不同能层中s能级的原子轨道半径相同C.不同能层中p能级的原子轨道能量相同D.任一能层的能级总是从s能级开始,而且能级数等于该能层序数【答案】D【解析】A.按照原子核外电子排布规律:各电子层最多容纳的电子数为2n2(n为电子层数,其中最外层电子数不超过8个,次外层不超过18个),故A错误;B.能层序数越大,s原子轨道的能量越高,轨道的半径越大,故B错误;C.离原子核越远的电子,其能量越大,所以p原子轨道电子的平均能量随能层的增大而增加,故C错误;D.任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即原子轨道类型数目等于该电子层序数,如第一层(K层)上只有1S亚层,第二电子层(L层)只有2s和2p亚层,第三电子层(M层)只有3s、3p和3d亚层,第四电子层(N层)只有4s、4p、4d和4f亚层,故D正确;答案为D。
3.下列关于能层与能级的说法中不正确的是()A.原子核外电子的每一个能层最多可容纳的电子数为2n2B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数C.同是s能级,在不同的能层中所能容纳的最多电子数相同D.1个原子轨道里最多只能容纳2个电子,且自旋状态相同【答案】D【解析】A.按照原子核外电子排布规律:各电子层最多容纳的电子数为2n2(n为电子层数,其中最外层电子数不超过8个,次外层不超过18个),故A正确;B.能层含有的能级数等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,所以任一能层的能级总是从s能级开始,而且能级数等于该能层序数,故B正确;C.同是s能级,在不同的能层中所能容纳的最多电子数都是2个,故C正确;D.泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,故D错误;答案选D。

第一章检测题(时间: 90 分钟分值:100分)一、选择题 (此题包含 15 个小题,每题 3 分,共 45 分。
每小题仅有一个选项切合题意)1.中国科学技术名词鉴定委员会已确立第116 号元素 Lv 的名称为。
对于116293Lv 的表达错误的选项是()A.原子序数 116B.中子数 177C.核外电子数 116D.相对原子质量 293分析:A.元素符号左下角表示的是原子核内的质子数,原子核内的质子数等于该元素的原子序数,所以该元素的原子序数是116,正确;B.在原子符号的左上角表示的是该元素原子的质量数,质量数就是质子数与中子数的和,所以该原子的中子数是293-116=177,正确;C.对于元素的原子来说,原子核内的质子数等于原子核外的电子数,等于元素的原子序数,所以该原子的原子核外电子数是116,正确;D.293 只表示该元素的一种原子的质量数,因为不知道该元素有几种原子,各样原子的含量是多少,所以不可以确立该元素的相对原子质量,错误。
答案: D2.以下相关化学用语表示正确的选项是()A.CO 2的比率模型:B.氢氧根离子的电子式:C.氯原子的构造表示图:D.中子数为 146、质子数为 92 的铀 (U)原子:14692U分析: CO 2分子中,碳原子半径大于氧原子半径,所以CO 2的比率模型中球应当是一大二小, A 错误; OH -为阴离子,故其电子式应加“[] ”带上电荷,B正确;氯原子最外层有7 个电子,即,C 错误;铀原子的质量数为146+92=238,故原子符号为23892U,D 错误。
答案: B3.以下表示物质的化学用语正确的选项是()A.8 此中子的碳原子的核素符号:12C+··-B.HF 的电子式: H [∶F∶ ]··C.Cl -的构造表示图:D.CO 2的构造式: O===C===O分析:碳元素的核电荷数为6,含 8 此中子的核素符号为14C;··HF 是共价化合物,电子式为H ∶F∶,Cl 的核电荷数为 17。

2023-2024学年人教版高中化学单元测试学校:__________ 班级:__________ 姓名:__________ 考号:__________注意事项:1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上;一、选择题(本大题共计14小题,每题3分,共计42分)1.下列事实不能说明元素的金属性或非金属性相对强弱的是()A. 氧化性:\ Cu^2+ gt Fe^2+B. 酸性:\ HIgt HClC. 共用电子对偏移程度:\ N-H键\ gt C-H键D. 碱性:\ NaOHgt Al(OH)_3【答案】B【解析】 A、氧化性: Cu^2+ \gt Fe^2+ ,说明金属性铁强于铜,可以说明金属性相对强弱,故 A正确;B、氢化物对应水化物的酸性强弱不能说明非金属性强弱,应最高价氧化物对应水化物酸性强弱,才能说明非金属性强弱,故 B错误;C、共用电子对偏移程度: N-H键 \gt C-H键,说明氮的非金属强于碳,故 C正确;D、最高价氧化物对水化物的碱性越强对应元素的金属性越强,碱性: NaOH\gtAl(OH)_3,所以钠的金属性强于铝,故 D正确;2.主族元素 X 、 Y、 Z、 W、 R的原子序数依次增大,且它们的原子序数均不超过 20。
已知 X 元素原子最外层电子数是其电子层数的 2倍, Y与 W同主族且 W的核电荷数是 Y的 2倍, Z的最高正化合价为 +2价, R的最外层电子数是其最内层电子数的一半。
下列说法正确的是()A. 原子半径的大小顺序:\ rleft( Xright) lt rleft( Yright) lt rleft(Zright)B. 气态氢化物的稳定性: \ Xlt WC. 最高价氧化物对应的水化物的碱性\ Zgt RD. \ Z、\ R分别与\ W形成的化合物中均只有离子键【答案】B【解析】 X元素原子最外层电子数是其电子层数的 2倍, X 为 C或 S,因为原子序数依次增大,且原子序数不超过 20,则 X为 C, Z的最高正化合价为 +2价, Z位于 IIA族,Z为 Mg, R的最外层电子数是其最内层电子数的一半, R的最外层电子数为 1, R为K, Y与 W同主族且 W的核电荷数是 Y的 2倍,故 Y为 O, W为 S。

2023-2024学年人教版高中化学单元测试学校:__________ 班级:__________ 姓名:__________ 考号:__________注意事项:1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上;一、选择题(本大题共计12小题,每题3分,共计36分)1.氰酸铵 (NH_4OCN)与尿素 CO(NH_2)_2\, ( )A. 都是共价化合物B. 都是离子化合物C. 互为同分异构体D. 互为同素异形体【答案】C【解析】 A.氰酸铵 (NH_4OCN)属于铵盐,是离子化合物,故 A错误;B.尿素 CO(NH_2)_2中只含共价键,属于共价化合物,故 B错误;C.氰酸铵 (NH_4OCN)与尿素 CO(NH_2)_2的化学式相同但结构不同,所以属于同分异构体,故 C正确;D.同素异形体是单质,氰酸铵 (NH_4OCN)与尿素 CO(NH_2)_2都是化合物,所以不是同素异形体,故 D错误;2.下列说法不正确的是()A. 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性B. 常压下,\ 0\^circ C 时冰的密度比水的密度小,水在\ 4\^circ C 时密度最大,这些都与分子间的氢键有关C. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化D. 燃料的脱硫脱氮、\ SO_2的回收利用和\ NO_x的催化转化都是减少酸雨产生的措施【答案】C【解析】 A、液晶态是指介于晶体和液体之间的物质状态,像液体具有流动性,像固体具有晶体的有序性,故 A正确;B、冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故 B正确;C、石油裂解、煤的干馏、玉米制醇、均有新物质生成,属于化学变化,但是纳米银粒子的聚集属于小颗粒的胶体离子变成大颗粒聚成下来,没有新物质生成,故 C错误;D、采用燃料脱硫技术可以减少二氧化硫的产生,从而防止出现酸雨, NO_x的催化转化生成无污染的氮气也是减少酸雨的有效措施,故 D正确,3.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前 10号元素中,满足上述关系的元素共有()A. \ 1对B. \ 2对C. \ 3对D. \ 4对【答案】B【解析】题中的两种元素不可能在同一周期,前 10号元素只在前两个周期中,符合条件的只有 2对。

2023-2024学年人教版高中化学单元测试学校:__________ 班级:__________ 姓名:__________ 考号:__________注意事项:1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上;一、选择题(本大题共计23小题,每题3分,共计69分)1.工业焊接钢管时需进行“无损探伤”,常借助 _55^137Cs进行,有关 _55^137Cs的说法不正确的是()A. \ _55^137Cs的质量数为\ 137B. \ _55^137Cs的质子数为\ 55C. \ _55^137Cs^+ 的核外电子数为\ 55D. \ _55^137Cs的中子数为\ 82【答案】C【解析】 A.有关 _55^137Cs质量数 137,故 A正确;B.有关 _55^137Cs的质子数为 55,故 B正确;C._55^137Cs^+ 的核外电子数为 54,故 C错误;D._55^137Cs的中子数= 137-55= 82,故 D正确;2.已知 A^n+ 、 B^(n-1)+ 、 C^(n+ 1)+ 、 D^(n+ 1)-都有相同的电子层结构, A、B、 C、 D的原子半径由小到大的顺序是()A. \ Cgt Dgt Bgt AB. \ Dgt Cgt Agt BC. \ Bgt Agt Cgt DD. \ Agt Bgt Dgt C【答案】C【解析】解: A^n+ 、 B^(n-1)+ 、 C^(n+ 1)+ 、 D^(n+ 1)-都有相同的电子层结构,则 A、 B、 C在下一周期,电荷数多,则原子序数大,同周期从左向右原子半径逐渐减小,即原子半径 B\gt A\gt C, D在上一周期, A、 B、 C的电子层数比 D的电子层多,则 D的原子半径最小,所以原子半径为 B\gt A\gt C\gt D,故选C。
3.下列化学用语和化学符号使用正确的是()A. 次氯酸的结构式可以表示为:\ H—O—ClB. 正丙醇的结构简式为:\ C_3H_7OHC. 含\ 58个质子和\ 82个中子的铈(\ Ce)原子符号为:\ ^82_58CeD. 过氧化氢的电子式为:【答案】A【解析】 A.次氯酸的结构式为 H—O—Cl, A项正确;B.正丙醇的结构简式为 CH_3CH_2CH_2OH,而 C_3H_7OH可以表示 CH_3CH_2CH_2OH或, B项错误;C.含 58个质子和 82个中子的 Ce原子符号为 ^140_\ \ 58Ce, C项错误;D.过氧化氢为共价化合物,电子式为, D项错误。