德式乳酸杆菌百替生物
- 格式:pdf
- 大小:506.85 KB
- 文档页数:6

乳酸菌生存条件乳酸菌是一种常见的益生菌,它们对于人体的健康具有重要的作用。
为了保证乳酸菌能够正常生存和发挥作用,需要提供适宜的生存环境。
本文将从温度、酸碱度、营养物质和氧气需求等方面介绍乳酸菌的生存条件。
一、温度条件乳酸菌对温度有一定的适应范围。
一般来说,乳酸菌的最适生长温度在30℃左右,但不同种类的乳酸菌对温度的要求有所差异。
例如,某些乳酸菌在25℃以下也能良好生长,而另一些乳酸菌则对高温更为适应。
因此,在培养乳酸菌时,需要根据不同菌株的特性选择适宜的温度条件。
二、酸碱度条件乳酸菌是一类耐酸菌,对酸度有较强的适应能力。
一般来说,乳酸菌对于PH值在4.0-6.5之间的环境较为适宜。
这是因为乳酸菌能够利用碳源来产生乳酸,从而降低周围环境的酸碱度。
当环境酸度过高时,乳酸菌的生存和繁殖能力会受到一定的影响。
三、营养物质条件乳酸菌的生存和繁殖需要适宜的营养物质供给。
乳酸菌主要靠碳源来进行能量代谢和生长,常见的碳源包括葡萄糖、乳糖、果糖等。
此外,乳酸菌还需要适量的氮源、无机盐和维生素等营养物质来维持其正常的生理功能。
在培养乳酸菌时,可以通过添加适宜的营养物质来提供所需的养分。
四、氧气需求乳酸菌属于厌氧菌,对氧气的需求较低。
乳酸菌在缺氧条件下能够进行正常的代谢和生长。
相反,氧气的存在会对乳酸菌的生存和繁殖产生不利影响。
因此,在培养乳酸菌时,需要采取相应的措施,如使用密闭容器或添加抗氧化剂等,以减少氧气的接触。
乳酸菌的生存和繁殖受到温度、酸碱度、营养物质和氧气需求等因素的影响。
为了保证乳酸菌能够正常生长和发挥其益生作用,需要提供适宜的生存环境。
通过控制温度、调节酸碱度、提供适宜的营养物质和限制氧气接触,可以为乳酸菌提供一个良好的生存条件。
这对于乳酸菌的培养和应用具有重要的意义,也有助于人们更好地利用乳酸菌来改善健康。

引言概述乳酸菌是一类广泛存在于自然界中的细菌,其能力包括发酵和产生乳酸。
乳酸菌不仅具有益生菌的作用,还对人体健康有着多种积极影响。
本文将对乳酸菌的概述及其应用进行详细阐述。
正文内容1.乳酸菌的分类及特点乳酸菌属于革兰氏阳性菌,可以根据其形态和生理特性进行分类。
常见的乳酸菌种类有乳酸杆菌、嗜热链球菌、纤维链球菌等。
乳酸菌通常具有产酸能力,能够将碳水化合物通过发酵代谢产生乳酸。
2.乳酸菌的功效及机制乳酸菌具有多种益生功效,包括调节肠道菌群平衡、增强肠道屏障功能、促进营养物质吸收等。
乳酸菌可以通过产生抗菌物质、调节免疫系统等机制来实现这些功效。
乳酸菌可以产生抗菌物质,如乳酸、双歧杆菌素等,具有抑制有害菌生长的作用。
乳酸菌能够调节宿主免疫系统,增强机体的免疫力。
乳酸菌能够降低肠道内毒素的,保护肠道黏膜免受损伤。
3.乳酸菌在食品工业中的应用乳酸菌在食品工业中有着广泛的应用。
乳酸菌能够促进食品发酵过程,改善食品的品质和口感。
乳酸菌还可以用于制作乳酸饮料、酸奶、奶酪等乳制品,并能提高这些产品的保质期。
乳酸菌在酸奶制作中起到重要作用,可以通过发酵代谢产生乳酸,使酸奶呈现出酸味和特殊的口感。
乳酸菌还可以用于面包发酵,能够增加面包的松软度和口感。
乳酸菌能够改善肉制品的质地和风味,提高食品的营养价值。
4.乳酸菌在保健品和医药领域中的应用乳酸菌在保健品和医药领域中具有重要的应用前景。
乳酸菌作为一种益生菌,可以改善人体肠道菌群的平衡,提高人体的免疫力。
因此,乳酸菌常被应用于保健品的生产。
乳酸菌可以调节人体肠道菌群,预防和缓解腹泻等肠道疾病。
乳酸菌可以促进食物消化和营养吸收,有助于改善消化系统功能。
乳酸菌还可以预防和缓解女性尿路感染和阴道感染等问题。
5.乳酸菌在环境修复中的应用除了在食品工业和医药领域中的应用,乳酸菌还可以用于环境修复。
乳酸菌具有一定的降解能力,能够降解有机废弃物,并减少环境污染。
因此,乳酸菌在废水处理、土壤修复等领域中具有潜在的应用价值。

乳酸菌生长条件
乳酸菌是一种古老的微生物,早在几千年前,人们就开始利用乳酸菌
制作食品,如酸奶、奶酪等。
乳酸菌广泛存在于人体内和环境中,是
一种重要的益生菌。
那么,乳酸菌适宜的生长条件是什么呢?下面将分点分别介绍。
1. 适宜的温度是什么?
乳酸菌的最适生长温度在一定范围内,一般在25-45℃之间,最适温度为35℃左右。
温度过低或过高都会影响乳酸菌的生长和代谢。
同时,
不同种类的乳酸菌对温度的适应能力也不同。
2. pH值的影响
乳酸菌对pH值的适应范围较窄,通常在4.5左右为最适pH值。
当pH
值过低或过高,都会影响到乳酸菌的生长繁殖。
在酸奶制作中,通常
会加入适量的乳酸菌来控制pH值,使其适宜生长。
3. 氧气的含量
乳酸菌是一种厌氧菌,对氧气的含量敏感,高氧气含量会对其生长和
代谢产生不利影响。
因此,乳酸菌最好能在无氧或微氧条件下生长。
4. 适宜的营养成分
乳酸菌需要适宜的营养成分才能正常生长,如碳源、氮源、矿物质等。
一些特定种类的乳酸菌会需要额外添加一些酸、碱或其他营养物质。
5. 相应的菌株
不同的乳酸菌菌株,其适应不同的生长条件。
因此,选择相应合适的乳酸菌菌株很重要。
综上所述,乳酸菌的生长条件包括适宜的温度、pH值、氧气含量、营养成分和相应的菌株等。
熟练掌握这些知识点,可以更好地利用和生产乳酸菌相关产品。

乳酸菌繁殖的基本条件乳酸菌是一类常见的益生菌,它们在人体内起着重要的调节作用。
要让乳酸菌能够充分繁殖,就需要提供适宜的环境条件。
本文将从温度、pH值、营养物质和氧气含量四个方面探讨乳酸菌繁殖的基本条件。
适宜的温度是乳酸菌繁殖的基本条件之一。
乳酸菌对温度的要求较为特殊,一般在30℃左右的温度下繁殖最为适宜。
过高或过低的温度都会对乳酸菌的繁殖产生不利影响。
过高的温度会导致乳酸菌代谢过于活跃,耗尽营养物质而无法繁殖;过低的温度则会抑制乳酸菌的生长,使其无法正常繁殖。
因此,在培养乳酸菌时,需要控制好温度,保持在适宜的范围内。
pH值也是乳酸菌繁殖的重要条件之一。
乳酸菌对酸碱度有一定的要求,一般在pH值为4.5-5.5的酸性环境下繁殖最为适宜。
过高或过低的pH值都会抑制乳酸菌的繁殖。
过高的pH值会破坏乳酸菌细胞膜的完整性,影响其正常代谢;过低的pH值则会使乳酸菌无法正常进行酸奶发酵等活动。
因此,在培养乳酸菌时,需要调整培养基的pH值,使其保持在适宜的范围内。
营养物质也是乳酸菌繁殖的必要条件。
乳酸菌需要一定的营养物质才能正常生长和繁殖。
常见的营养物质包括碳源、氮源、矿物质等。
碳源主要提供能量,常见的有葡萄糖、乳糖等;氮源则提供氨基酸等有机氮化合物,常见的有酵母浸出物、胨类等;矿物质则提供微量元素,常见的有钙、镁、铁等。
适当提供这些营养物质,可以促进乳酸菌的繁殖。
氧气含量也会影响乳酸菌的繁殖。
乳酸菌属于厌氧菌,不需要氧气参与其代谢过程。
因此,在培养乳酸菌时需要控制好氧气含量,避免外界氧气的进入。
一般采用密封的培养容器,或者在培养基中添加还原剂等方式,保持培养环境的低氧气含量。
乳酸菌繁殖的基本条件包括适宜的温度、pH值、营养物质和氧气含量。
合理调控这些条件,可以为乳酸菌的繁殖提供良好的环境。
同时,在实际的乳酸菌繁殖过程中,不同的乳酸菌株对这些条件的要求可能会有所差异,需要根据具体情况进行调整。
希望通过对乳酸菌繁殖基本条件的了解,能够更好地培养和利用乳酸菌,提高其在食品工业和健康领域的应用价值。

乳酸菌包括哪些菌(一)引言概述:乳酸菌是一类广泛存在于自然界的菌种,对人体健康具有重要的益处。
本文将对乳酸菌的分类进行详细介绍,包括其常见的菌种和其益处。
通过了解乳酸菌的种类,我们可以更好地选择适合自己的乳酸菌产品来改善健康。
一、乳酸菌的Lactobacillus属1. Lactobacillus acidophilus- 产生亚醛酸,帮助维持肠道酸度- 改善消化系统,缓解腹泻等肠胃问题- 强化免疫力,抑制有害细菌的生长2. Lactobacillus reuteri- 促进健康肠道微生物群的平衡- 改善宿便问题,防止便秘- 提高口腔健康,减少牙菌斑的形成二、乳酸菌的Bifidobacterium属1. Bifidobacterium animalis- 改善腹泻和胃肠道不适- 强化免疫系统,预防感冒和过敏- 促进钙和钠的吸收,增强骨骼健康2. Bifidobacterium breve- 缓解肠胃不适和肠道发炎- 减少食物过敏反应,保护肠道屏障功能- 降低胆固醇和血压,预防心血管疾病三、乳酸菌的Streptococcus属1. Streptococcus thermophilus- 产生乳酸,增强肠道酸度,抑制有害细菌的繁殖- 刺激肠道蠕动,缓解便秘- 提供肠道免疫支持,减少感染概率2. Streptococcus salivarius- 促进口腔健康,预防口腔问题- 提高免疫力,减少感染风险- 支持消化系统,改善肠道环境四、乳酸菌的Leuconostoc属1. Leuconostoc lactis- 帮助消化乳糖,改善乳糖不耐症- 促进肠道益生菌的生长- 改善肠胃不适,缓解腹泻和便秘2. Leuconostoc mesenteroides- 产生抗菌物质,抑制有害菌的繁殖- 增强肠道免疫力,减少肠道感染风险- 改善肠胃问题,促进肠道健康五、乳酸菌的Lactococcus属1. Lactococcus lactis- 促进肠道健康,增强肠道屏障功能- 提高免疫力,预防肠道感染- 改善消化问题,缓解腹泻和便秘2. Lactococcus garvieae- 帮助肠道微生态平衡,改善消化问题- 增强免疫力,预防感染和过敏- 提供抗氧化物质,保护细胞健康总结:乳酸菌是一类对人体健康有益的菌种,包括Lactobacillus属、Bifidobacterium属、Streptococcus属、Leuconostoc属和Lactococcus属等多个属。

德氏乳杆菌保加利亚亚种培养基及培养条件的优化姜庆玲;丛美楠;陈海生;黄颖渟;鄢庆枇【摘要】为了降低德氏乳杆菌保加利亚亚种的工业生产成本和提高发酵液的菌浓度,通过单因素试验和旋转中心组合设计(central composite design,CCD)相结合的方法优化培养基的组分和培养条件.优化后的培养基成分为:葡萄糖30 g/L、豆粕28 g/L、玉米粉14 g/L、乳清粉28 g/L、K2 HPO4 3.0 g/L、柠檬酸三铵2.5 g/L、乙酸钠5g/L、吐温-80 1.25 mL/L、MgSO4·7H2O 0.2g/L、MnSO4·4H2O 0.0625 g/L;培养条件为:初始pH值7.1,温度37℃,接种量4%(体积分数),静置培养.经优化后活菌数达到6.07×109CFU/mL,明显高于原MRS培养基(5.8×108 CFU/mL),且其成本较原MRS培养基的成本降低了4000元/t.【期刊名称】《集美大学学报(自然科学版)》【年(卷),期】2016(021)006【总页数】9页(P401-409)【关键词】德氏乳杆菌保加利亚亚种;培养基;培养条件;优化;响应面法【作者】姜庆玲;丛美楠;陈海生;黄颖渟;鄢庆枇【作者单位】集美大学水产学院,福建厦门361021;农业部东海海水健康养殖重点实验室,福建厦门361021;集美大学水产学院,福建厦门361021;农业部东海海水健康养殖重点实验室,福建厦门361021;集美大学水产学院,福建厦门361021;农业部东海海水健康养殖重点实验室,福建厦门361021;集美大学水产学院,福建厦门361021;农业部东海海水健康养殖重点实验室,福建厦门361021;集美大学水产学院,福建厦门361021;农业部东海海水健康养殖重点实验室,福建厦门361021【正文语种】中文【中图分类】S963.73[中国分类号]S 963.73乳酸菌是目前水产养殖上使用最为广泛的一种益生菌。
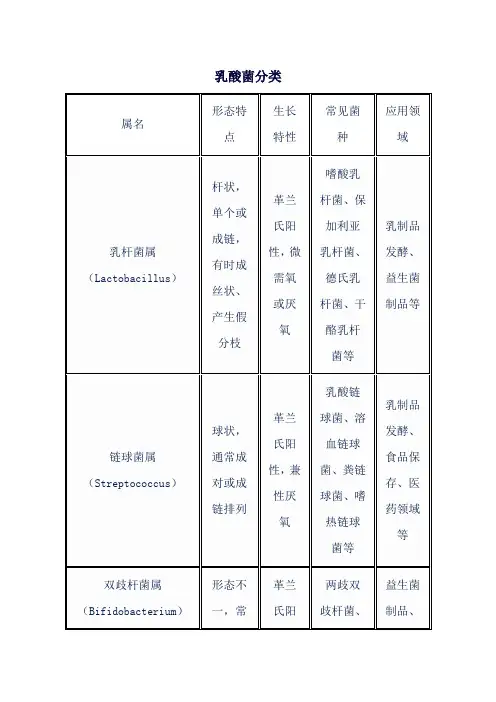
乳酸菌分类
属名
形态特点 生长特性 常见菌种 应用领
域
乳杆菌属(Lactobacillus) 杆状,单个或成链,有时成丝状、产生假分枝 革兰氏阳性,微需氧或厌氧 嗜酸乳杆菌、保加利亚乳杆菌、德氏乳杆菌、干酪乳杆菌等 乳制品发酵、
益生菌
制品等
链球菌属(Streptococcus) 球状,通常成对或成链排列 革兰氏阳性,兼性厌氧 乳酸链球菌、溶血链球菌、粪链球菌、嗜热链球菌等 乳制品发酵、食品保
存、医
药领域
等
双歧杆菌属(Bifidobacterium) 形态不一,常革兰氏阳两歧双歧杆菌、益生菌
制品、
呈弯、棒状和分支状 性,专性厌氧 长双歧杆菌、婴儿双歧杆菌等 婴幼儿
食品等
明串珠菌属(Leuconostoc) 球形或豆状,成对或成链排列 革兰氏阳性,兼性厌氧 肠膜明串珠菌、乳酸明串珠菌等 乳制品发酵、
果蔬发
酵等
片球菌属(Pediococcus) 球形,细胞排列呈四联状 革兰氏阳性,兼性厌氧 乳酸片球菌、戊糖片球菌等 乳制品发酵、
酒类发
酵等

各种乳杆菌的培养条件
1、适宜温度:乳酸菌通常在相对较温暖的环境下生长,最适宜的温度范围一般在30°C到40°C之间。
当然,不同种类的乳酸菌对温度的要求也会有所不同。
2、适宜pH值:乳酸菌对pH值也比较敏感,它们喜欢在酸性环境中生长。
一般来说,pH值在4.0到5.0之间是乳酸菌生长的理想范围。
3、低氧环境:乳酸菌是厌氧菌,也就是说它们喜欢在低氧环境下生长。
这意味着在培养乳酸菌时,要尽量减少氧气的接触。
4、适当营养:乳酸菌需要一些营养物质来生长,比如碳源和氮源。
常见的碳源包括葡萄糖、果糖等,而氮源可以是氨基酸、蛋白质等。
5、适宜湿度:乳酸菌对湿度也有一定的要求,一般来说,适宜的湿度范围在50%到70%之间。

乳酸菌的培养方法
乳酸菌的培养方法包括以下几个步骤:
1. 选择培养基:常用的乳酸菌培养基包括罗格萨乳杆菌培养基、LM17培养基和De Man-Rogosa-Sharpe(MRS)培养基等。
这些培养基中含有适合乳酸菌生长和繁殖所需的营养成分。
2. 准备培养基:按照培养基说明书的要求,将培养基加入适量的蒸馏水中,并进行搅拌混匀。
3. 放热杀菌:将培养基装入试管或培养瓶中,用高压灭菌器或自动热压灭菌器进行高温高压灭菌,一般温度为121,压力为15 psi,时间为15-20分钟。
4. 接种菌株:将乳酸菌菌株接种于无菌条件下,可以选择斜面接种、液体悬浮接种或凝胶块接种等方法。
5. 培养条件:将接种的培养基培养瓶放入恒温培养箱中,温度一般为30-40,pH一般为
6.0-
7.0,培养时间根据所选菌株的生长速率而定,一般为24-48小时。
6. 培养结果观察:观察培养物的外观、菌落形态和颜色等,以判断菌株的生长情况和纯度。
除了以上基本的培养方法,还可以根据乳酸菌的特性进行不同的培养改进,如以实时荧光定量PCR检测菌株的生长情况、利用pH指示染料测定产酸量等。
德氏乳杆菌保加利亚亚种的电转化条件优化食品科学与工程学院:张旭指导教师:崔艳华摘要:德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)是最具经济价值的乳酸菌之一,在世界上广泛应用于酸奶和其它发酵乳的生产。
当前对该菌的代谢机制等方面研究甚少。
外源基因的转化效率是制约其分子代谢机制研究的重要因素。
本研究以pMG36c为材料,对L. delbrueckii subsp. bulgaricus进行电转化条件研究。
结果表明,在电转化过程中,电场强度、质粒的浓度、细胞生长状态均对转化效率有明显影响。
本研究得到该菌株的最适电转化条件为:对数初期的细胞,质粒浓度为100 ng加入到50 μl OD600为45的样品中,在10 kV/cm电场强度下电转化,转化后细胞在复壮培养液中培养3h后涂布选择性培养基,转化效率可达2.6×103 CFU/µg DNA。
关键词:德氏乳杆菌保加利亚亚种;电转化;生长时期;转化效率Abstract:Lactobacillus delbrueckii subsp. bulgaricus is a kind of Gram-positive bacteria, has been widely used in yogurt and other fermentation milk in the world, is recognized as the higher economic value of microorganism. The genetic transformation of L. delbrueckii subsp. bulgaricus is a key factor which restricts its genetic manipulation. The method of electrotransformation of L. delbrueckii subsp. bulgaricus CH3 was constructed by means of plasmid pMG36c. The factors were evaluated, including electric field strength,concentration of plasmid and cell growth phage. The optimum factors are the cell harvested at the early exponential growth phase, electrotransformation at the 10 kV/cm, with 100 ng plasmid per 50 μl sample, and 3h cell incubation time. The transformation efficiency is 2.6×103 CFU/µg DNA at the optimum conditions.Key words:Lactobacillus delbrueckii subsp. bulgaricus electrotransformation growth phage transformation efficiency1 引言乳酸菌是一群微好氧、大多数G+C含量较低、能够发酵碳水化合物产生乳酸的革兰氏阳性菌。
除部分病原菌外,大部分乳酸菌是有益菌。
其中部分乳酸菌具有调节机体胃肠道微生态平衡,降低血清胆固醇、控制内毒素、抑制病原菌、调节免疫能力等诸多益生功能,是重要的益生菌。
目前,乳酸菌已广泛应用于食品、轻工业、医药、饲料等多个领域[1-2]。
德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)是最具经济价值的乳酸菌之一,在世界上广泛应用于酸奶和其它发酵乳的生产。
尽管研究者对其进行了大量研究,但主要集中在发酵性能和应用研究。
而对该菌的代谢机制等方面研究甚少,主要原因是该菌的遗传转化较为困难。
本研究拟从德氏乳杆菌保加利亚亚种的生长时期、外源质粒浓度和电转化参数等几个因素着手,优化该菌的电转化操作,建立最佳的电转化平台,为今后该菌的重要基因功能鉴定和分子代谢机制的研究奠定基础。
2 实验材料与方法2.1 实验材料和仪器2.1.1 宿主菌和载体质粒大肠杆菌JM109、德氏乳杆菌保加利亚亚种由本实验室保存。
质粒pMG36c是长度大约为3.7kb,带有氯霉素抗性的大肠杆菌乳酸菌穿梭质粒,由本实验室保存。
2.1.2 试剂DL15000Marker、DL2000Marker购自TaKaRa公司。
Tris饱和酚购自上海生工生物公司。
二硫苏糖醇(DTT)、吐温80、K2HPO4、NaAc、C6H6O7 (NH4)2、MgSO4·7H2O、MnSO4·4H2O等试剂均为国产分析纯试剂。
2.2 实验方法2.2.1 DNA浓度和纯度的测定取DNA样品,稀释1000倍,测定并记录样品液在280 nm和260 nm处的吸光度值。
质粒DNA浓度=50 µg/ml×A280×稀释倍数2.2.2大肠杆菌质粒DNA制备采用碱裂解法提取,方法参见《分子克隆》。
2.2.3电脉冲转化德氏乳杆菌保加利亚亚种采用文献[3]中方法,有修改。
步骤如下:(1)挑取平板上的单菌落接种于MRS液体培养基中培养过夜。
(2)将2 ml新鲜菌液接种到100 ml新鲜的MRS培养基中,37 ℃静止培养。
根据之前绘制的生长曲线确定培养时间,并测定OD600值以确认。
(3)用1.5 ml离心管4 ℃以6000 g离心5 min/收集菌体,弃上清每管用1 ml预冷的ElectroporationBuffer重悬菌体,然后离心。
(4)再用1 ml 冰预冷的Electroporation Buffer 洗两次,将菌体重悬在Electroporation Buffer中并使OD达到45,分装到离心管中,每管50 μl。
(5)菌悬液在45 ℃温育20 min,然后在冰上放置10 min。
(6)将50 μl菌悬液和1.0 μg的DNA混合,转入0.2 cm的电转杯。
(7)设置电转参数:电压实验具体情况设定,800 Ω,25 μF,电击。
(8)立即加入950 μl的milk medium,置于37 ℃静止培养复壮3 h。
(9)将复壮后的菌液梯度稀释,涂布在含有合适抗生素浓度(Cm 3.5 μg/ml)的MRS平板上,每板涂布100 μl,置于37 ℃静止培养2-3天。
(10)平板计数,计算转化效率。
2.2.4测定德氏乳杆菌对氯霉素的耐受程度液体培养基中确定:从实验室保存的-70℃的甘油菌中活化出德氏乳杆菌保加利亚亚种,挑取单菌落分别接种于含有不同浓度氯霉素的液体MRS培养基中培养,1号至6号试管中氯霉素浓度分别是1 μg/ml、2 μg/ml、3 μg/ml、4 μg/ml、5 μg/ml、6 μg/ml。
7号试管中不加氯霉素。
将这7支试管放于培养箱中37 ℃静止培养。
固体培养基中确定:挑取平板上活化的菌落,在含有不同浓度氯霉素的固体MRS培养基上划线培养,1号至3号平板上氯霉素浓度分别是3 μg/ml、4 μg/ml、5 μg/ml。
4号平板上不加氯霉素。
将这4个平板置于37 ℃静止培养。
2.2.5质粒酶切将水、Buffer、质粒依次加入Ep管中,混合均匀,37℃温育2-3小时,然后取出进行凝胶电泳。
3结果与分析3.1 质粒提取与鉴定3.1.1 质粒提取与酶切鉴定用实验室保存的pMG36c转化大肠杆菌JM109,提取质粒,结果如图3-1,从质粒位置和marker及阳性对照比较,可见转化成功并得到所需质粒。
将质粒酶切后进行凝胶电泳,从图3-2上可以看出所得质粒和阳性对照相符合。
图3-1质粒的琼脂糖电泳图图3-2 质粒的酶切检测1:marker 2~ 3:pMG36c 1:marker 2~3:pMG36c4:pMG36c 5:pMG36cL 4:pMG36c/Eco RI 5:pMG36cL/Eco RI3.1.2 质粒浓度和纯度的测定RNA酶处理提取的质粒,电泳检测结果。
将质粒稀释测定260 nm和280 nm处吸光值。
OD260=0.340 OD280=0.173 1.8<OD260/ OD280=1.96<2.0,表明RNA和蛋白质污染在可接受范围内,计算得出质粒浓度为17 μg/μl。
图3-3 质粒去RNA1: marker 2: pMG36c/去RNA3.2 德氏乳杆菌保加利亚亚种生长曲线的测定根据图3-4划分生长时期:0-4 h停滞期,4-16 h对数期(4-6 h对数早期,8-12 h对数中期,14-16 h对数后期),16-20 h稳定期。
实验中选取4 h、8 h、12 h、16 h和20 h五个水平。
图3-4 德氏乳杆菌保加利亚亚种生长曲线3.3 氯霉素最佳选择浓度的确定培养基中氯霉素浓度的确定:本研究选取了1-6 μg/ml的氯霉素筛选浓度,发现氯霉素浓度在3 μg/ml以下时,德氏乳杆菌能继续生长,而浓度大于4 μg/ml时,德氏乳杆菌无法生长,所以最终氯霉素筛选浓度确定为4 μg/ml。
3.4 电场强度对转化效率的影响本实验选取了15 kV/cm 、12.5 kV/cm、10 kV/cm和7.50 kV/cm四个电压强度水平。
实验结果表明,电场强度对电转化效率影响明显。
由图3-5可见在电场强度为10 kV/cm时得到最高转化效率,当电场强度达到15 kV/cm时,细胞被击穿,没有获得转化子。
图3-5 不同电场强度对电转化效率的影响3.5 质粒浓度对转化效率的影响本研究选取了50 ng、100 ng、125 ng、250 ng、375 ng等5个质粒用量,分别加入到50 μl OD值为45的菌液中,检测质粒浓度对转化效率的影响。
图3-6 不同质粒DNA用量对电转化效率的影响由图3-6可见,开始转化效率随质粒的加入量的增加而增加,在向样品中加入100 ng外源质粒DNA时候获得最高转化效率。
随后转化效率下降,这与文献报道的结果是一致的[3-5],即质粒含量达到饱和前,转化效率随质粒用量增加而升高,质粒用量达到饱和后,转化效率随质粒用量增加而下降。
3.6 生长时期对转化效率的影响生长时期是影响电转化效率的重要因素之一。
根据本实验前期测定德氏乳杆菌保加利亚亚种生长曲线,选取了对数早期(4 h)、对数中期(8 h)、对数后期(12 h)、稳定期(16 h)及稳定后期(20 h)等五个水平,探讨细菌生长状态对其电转化效率的影响。