部分药品名称变更表
- 格式:pdf
- 大小:122.81 KB
- 文档页数:1

福建省食品药品监督管理局关于印发部分药品补充申请申报资料及技术要求的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 福建省食品药品监督管理局关于印发部分药品补充申请申报资料及技术要求的通知各设区市食品药品监督管理局,福州市、厦门市、平潭综合实验区市场监管局:根据《药品注册管理办法》的规定,为进一步规范“变更直接接触药品的包装材料或容器”及“改变国内生产药品的有效期”补充申请的申报资料和技术要求,我局组织制定了《部分药品补充申请申报资料及技术要求》,现予印发,请转发给辖区内各生产企业,并遵照执行。
福建省食品药品监督管理局2015年3月17日部分药品补充申请申报资料及技术要求变更直接接触药品的包装材料或者容器《药品注册管理办法》附件4补充申请注册事项:21.变更直接接触药品的包装材料或者容器(除第10事项外,即除注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂,使用新型直接接触药品的包装材料或者容器外)一、申报资料项目及其说明(一)药品批准证明文件及其附件的复印件包括与申请事项有关的本品各种批准文件,如药品注册批件、补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、《新药证书》等。
附件包括上述批件的附件,如原药品标准、说明书、标签样稿及其他附件。
(二)证明性文件1.申请人是药品生产企业的,应当提供《药品生产许可证》及其变更记录页、营业执照、《药品生产质量管理规范》认证证书复印件。
2.变更后包装材料的药包材注册证复印件。
(三)修订的药品说明书样稿,并附详细修订说明。
(四)修订的药品标签样稿,并附详细修订说明。
(五)药学研究资料按相应研究验证工作提交研究资料,具体研究验证工作详见技术要求1.以文字或列表方式说明变更前包装材料和容器、变更后包装材料和容器,主要变化及原因。









麻醉药品、第一类精神药品购用印鉴卡变更登记申请表
说明:1、当《麻醉药品、第一类精神药品购用印鉴卡》中医疗机构名称、地址、医疗机构法人代表(负责人)、医疗管理部门负责人、药学部门负责人、采购人员等项目发生变更时,医疗机构应当在变更发生之日起3日内到我局办理变更手续。
2、变更上述项目时,请在相应的表格里填写有关内容。
变更医疗机构名称、地址及医疗机构法人代表(负责人)需提交卫生行政部门核发的医疗机构执业许可证副本复印件;变更医疗机构法人代表(负责人)、医疗管理部门负责人、药学部门负责人及采购人员尚需本人签名、印章,并提交身份证、职称证复印件及人员任免文件。
3、变更事项办理后,本表抄送市药监局、公安局,并报省卫生厅备案。
温州市卫生局制。


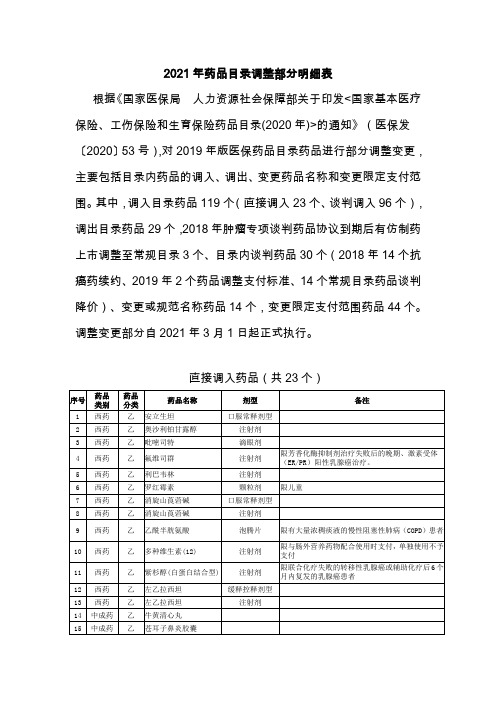
2021年药品目录调整部分明细表
根据《国家医保局人力资源社会保障部关于印发<国家基本医疗保险、工伤保险和生育保险药品目录(2020年)>的通知》(医保发〔2020〕53号),对2019年版医保药品目录药品进行部分调整变更,主要包括目录内药品的调入、调出、变更药品名称和变更限定支付范围。
其中,调入目录药品119个(直接调入23个、谈判调入96个),调出目录药品29个,2018年肿瘤专项谈判药品协议到期后有仿制药上市调整至常规目录3个、目录内谈判药品30个(2018年14个抗癌药续约、2019年2个药品调整支付标准、14个常规目录药品谈判降价)、变更或规范名称药品14个,变更限定支付范围药品44个。
调整变更部分自2021年3月1日起正式执行。
直接调入药品(共23个)
谈判调入药品(共96个)
调出药品(共29个)
2018年肿瘤专项谈判药品协议到期后有仿制药上市调整至常规目录(共3个)
目录内谈判药品(共30个,其中包括2018年14个抗癌药续约、2019年2个药品调整支付标准、
14个常规目录药品谈判降价)
变更或规范名称(共14个)
限定支付范围修订(共44个)。

