第二讲氧化还原反应
- 格式:ppt
- 大小:190.00 KB
- 文档页数:21

第2讲 氧化还原反应【考点透视】1. 理解氧化还原反应的本质。
2. 了解氧化还原反应在生产、生活中的应用。
【知识网络】一、 氧化还原反应的判断及与四种基本反应类型的关系【例1】下列类型的反应,一定发生电子转移的是A .化合反应B .分解反应C .置换反应D .复分解反应二、 氧化还原反应的相关概念、电子转移表示法 1.相关概念在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中________是氧化剂,________是还原剂;________元素被氧化,________元素被还原;Fe 2O 3具有 ,CO 具有 ;________是氧化产物,________是还原产物。
【例2】被称为万能还原剂的NaBH 4溶于水并和水反应:NaBH 4+2H 2O===NaBO 2+4H 2↑,下列说法中准确的是(NaBH 4中H 为-1价)A .NaBH 4既是氧化剂又是还原剂B .NaBH 4是氧化剂,H 2O 是还原剂C .硼元素被氧化,氢元素被还原D .被氧化的元素与被还原的元素质量之比为1∶1【例3】标出下列反应中电子转移的方向和数目(1)2KClO 3=====MnO 2△2KCl +3O 2↑ (2)Cl 2+2NaOH===NaCl +NaClO +H 2O(3) 2FeI 2+3Cl 2 ===2FeCl 3+2I 2 (4)4HCl(浓)+MnO 2=====△MnCl 2+Cl 2↑+2H 2O氧化 还 原 反 应实质 有电子转移,且转移电子数相等 特征化合价有升有降,且升降总值相等基本概念 反应规律 ①优先反应原理;②强弱原理;③价态原理(邻位转化规律、歧化规律、归中规律)原则:①电子守恒;②电荷守恒(离子方程式);③原子守恒 方法:化合价升降法依据:电子守恒①部分氧化还原计算;②推断产物化合价; ③求氧化剂、还原剂或氧化产物、还原产物质量比氧化剂 + 还原剂 === 还原产物 + 氧化产物(强氧化性) (强还原性) (弱还原性) (弱氧化性)化合价降低,+ne -,被还原化合价升高,-ne -,被氧化单线桥法; 双线桥法。

氧化还原反应1. 氧化还原反应的概念氧化还原反应是化学反应中最常见的一种类型。
在氧化还原反应中,某些物质失去电子,被氧化为较高的化合价态,同时其他物质得到电子,被还原为较低的化合价态。
这些电子的转移导致了物质的氧化和还原。
氧化还原反应也可以称为电子转移反应。
2. 氧化还原反应的特征氧化还原反应有以下几个特征:•电子转移:在氧化还原反应中,电子从一个物质转移到另一个物质。
这个过程涉及到自氧化还原反应的两个半反应,一个是氧化半反应,一个是还原半反应。
•氧化与还原:氧化还原反应中,发生氧化的物质失去电子,还原的物质得到电子。
这个过程中,氧化剂接受电子,被还原,而还原剂失去电子,被氧化。
•氧化态与还原态:氧化还原反应中,氧化剂的氧化态减小,还原剂的还原态增大。
3. 氧化还原反应的常见类型3.1 燃烧反应燃烧反应属于氧化还原反应的一种特殊类型。
在燃烧反应中,燃料物质与氧气反应,产生二氧化碳、水等产物,释放出能量。
在这个过程中,燃料物质失去电子,被氧化,氧气得到电子,被还原。
3.2 金属与酸反应金属与酸反应也属于氧化还原反应。
在金属与酸反应中,金属失去电子,被氧化,同时酸接受电子,被还原。
这个反应会产生金属盐和氢气。
3.3 元素的氧化与还原许多元素可以氧化或还原,这也是氧化还原反应的一种常见类型。
例如,氧的氧化态为-2,但在氯气中,氧可以被氧化为氯气中的+2态。
同时,氯气可以还原氧,使其氧化态下降。
3.4 单质与化合物的反应氧化还原反应中,单质与化合物的反应也是常见的类型。
在这种反应中,单质可以被氧化为化合物,化合物也可以被还原成单质。
4. 氧化还原反应的重要性氧化还原反应在生活和工业中都有重要的应用。
以下是一些例子:•铁的氧化还原反应导致了铁的生锈,这是日常生活中经常遇到的一个问题。
•电池中的化学反应就是氧化还原反应。
电池的作用是将化学能转化为电能。
•氧化还原反应在许多工业过程中起着关键作用,例如金属的提取和水的电解。


第二讲氧化还原反应及其应用主讲人车琳高考考点1,理解氧化还原反应,了解氧化剂和还原剂等概念2,掌握重要氧化剂、还原剂之间的常见反应3,熟练掌握氧化性和还原性强弱4,能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式5,能运用元素守恒、电子守恒、电荷守恒,进行氧化还原反应计算6、掌握原电池、电解池原理,能熟练书写电极反应式和电池总反应式。
7、理解化学腐蚀和电化腐蚀原理。
本讲序列【阅读议点】一、氧化还原反应的基本概念(请研读教材,梳理以下概念)1、什么是氧化还原反应?2、什么是氧化剂?什么是还原剂?什么是氧化产物?什么是还原产物?3、氧化还原的实质是:4、氧化还原反应的特征是:5、电子转移的表示方法有:二、如何比较氧化性和还原性的相对强弱?⒈同一氧化还原反应中,氧化性:氧化剂>氧化产物(当然的,氧化剂>还原剂)还原性:还原剂>还原产物(当然的,还原剂>氧化剂)⒉根据元素周期表,同周期元素的单质(或原子)从左到右还原性渐弱,氧化性渐强(稀有气体元素除外),同主族元素单质(或原子)从上到下还原性渐强,氧化性渐弱。
例如,氧化性:F2>Cl2>Br2>I2>S(含常识性知识)还原性:Na<K<Rb<Cs相应简单离子的还原性:F-<Cl-<Br-<I-<S2-氧化性:Na+>K+>Rb+>Cs+⒊根据金属活动顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au还原性渐弱K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu2+ Fe3+ Ag+氧化性渐强⒋据原电池电极:负极金属一般比正极金属活泼(还原性强)。
思考:有没有例外情况?请举例,并画出装置图?⒌同种元素价态越高,氧化性越强(如Fe3+>Fe2+),但例外地,氧化性:HClO>HClO2>HClO3>HClO4,元素化合价处于最高价态时只有氧化性;价态越低,还原性越强(如S2->S>SO2),最低价态只有还原性;中间价态兼具氧化性和还原性。

第2讲氧化还原反应学习目标1.掌握氧化反应、还原反应、氧化还原反应、氧化剂、还原剂等基本概念。
2.能用化合价升降和电子转移的观点熟练判断和分析氧化还原反应,掌握分析氧化还原反应的两种方法。
3.了解氧化还原反应的应用。
命题趋势氧化还原反应是贯穿高中阶段化学学习的重要内容,也是高考、竞赛的常考点。
主要考查氧化还原反应的几个基本概念,二卷多考查氧化还原反应的配平,特别是有的配平难度较大,需要考生有较高的熟练程度,平时考生多加练习,力求又快又对,以防高考时出现手足无措。
课前训练1.氧化还原反应的本质是表现为反应前后某些元素的发生变化。
2.在氧化还原反应中,氧化剂电子,发生的是反应;还原剂电子,发生的是反应。
铁与氯气反应的化学方程式为,生成物中铁是价;铁与盐酸反应的化学方程式为,生成物中铁是价。
事实证明氯气的氧化性比盐酸的氧化性(填“强”或“弱”)。
3.在四种基本反应类型中(1)都是氧化还原反应,复分解反应都是非氧化还原反应;(2)有单质参加的和有单质生成的均为氧化还原反应。
4.铁钉在氯气中被绣蚀成棕褐色的FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。
则氯气分子、氯离子、氢离子中具有氧化性,氧化性最强。
5.现有微粒:①S、②S2-、③Na+、④Fe2+、⑤H+、⑥Cu、⑦O2、⑧HCl、⑨H2O,其中在反应中只有还原性的是只有氧化性的是既有氧化性又有还原性的是(填序号)。
6.在氧化还原反应 KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O中,当生成0.5 mol Cl2时,氧化产物和还原产物的物质的量之比为。
7.K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O(1)元素被氧化,是氧化剂。
是氧化产物。
(2)参加反应的盐酸中,起还原剂作用的盐酸与起酸性作用的盐酸的质量比为。
知识梳理一、氧化还原反应的判断氧化还原反应的本质特征:反应过程中电子转移(得失或偏移);判断依据:凡是化合价升降的反应就是氧化还原反应,没有化合价发生变化的反应就是非氧化还原反应。



第2讲氧化还原反应氧化还原反应的基本概念及其规律1. (2021·启东一检)下列颜色变化与氧化还原反应有关的是()A. 无水硫酸铜遇水变为蓝色B. 金属铝放置在空气中失去光泽C. 澄清石灰水遇到二氧化碳变浑浊D. 棕黄色的氯化铁溶液滴入沸水中变成红褐色2. (2021·连云港期中)古典文献《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成丹砂”。
关于该记载下列说法正确的是()A. 水银泄露可撒硫黄粉覆盖B. 丹砂中Hg元素的化合价为+1C. 两个反应中硫元素都被还原D. 两个反应互为可逆反应3. (2021·如东一检)已知反应:3Fe3O4+28HNO3===9Fe(NO3)x+NO↑+14H2O。
下列对该反应的判断合理的是()A. Fe(NO3)x中的x为3B. 稀硝酸在反应中只作氧化剂C. 磁性氧化铁中的铁元素全部被氧化D. 常温下产生4.48 L NO,就有0.6 mol电子转移4. (2021·连云港期中)黄铁矿在潮湿空气中会被缓慢氧化,发生的主要反应如下(未配平):a. FeS2+O2+H2O―→SO2-4+Fe2++H+b. Fe2++H++O2―→Fe3++H2Oc. Fe3++FeS2+H2O―→Fe2++SO2-4+H+下列说法正确的是()A. 反应a中氧化产物只有FeSO4B. 为了验证反应b后溶液中含Fe2+,可选用KSCN溶液和氯水C. 反应c中每生成1 mol Fe2+转移1 mol电子D. 长期盛放黄铁矿的纸箱会被腐蚀而发黑5. (2021·如东一检)下列有关H2O2的说法正确的是()A. H2O2是非极性分子B. H2O2中氧原子的杂化轨道类型为spC. H 2O 2能使酸性高锰酸钾溶液褪色,说明具有漂白性D. 酸性H 2O 2氧化废蚀刻液的离子方程式:H 2O 2+2Fe 2++2H +===2Fe 3++2H 2O6. (2021·湖南卷)KIO 3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I 2+11KClO 3+3H 2O=====△6KH(IO 3)2+5KCl +3Cl 2↑。

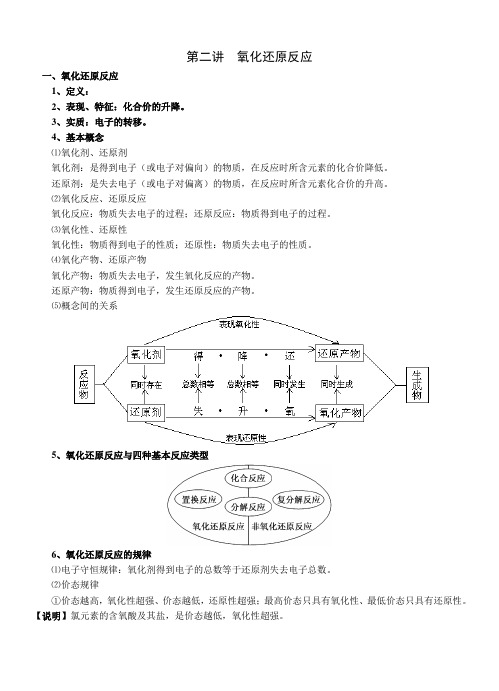
第二讲氧化还原反应一、氧化还原反应1、定义:2、表现、特征:化合价的升降。
3、实质:电子的转移。
4、基本概念⑴氧化剂、还原剂氧化剂:是得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
还原剂:是失去电子(或电子对偏离)的物质,在反应时所含元素化合价的升高。
⑵氧化反应、还原反应氧化反应:物质失去电子的过程;还原反应:物质得到电子的过程。
⑶氧化性、还原性氧化性:物质得到电子的性质;还原性:物质失去电子的性质。
⑷氧化产物、还原产物氧化产物:物质失去电子,发生氧化反应的产物。
还原产物:物质得到电子,发生还原反应的产物。
⑸概念间的关系5、氧化还原反应与四种基本反应类型6、氧化还原反应的规律⑴电子守恒规律:氧化剂得到电子的总数等于还原剂失去电子总数。
⑵价态规律①价态越高,氧化性超强、价态越低,还原性超强;最高价态只具有氧化性、最低价态只具有还原性。
【说明】氯元素的含氧酸及其盐,是价态越低,氧化性超强。
②歧化规律:元素中间价态的物质能发生歧化反应,生成高价态和低价态物质。
③归中规律:同一元素高价态和低价态物质,发生反应生成中间价态的物质。
④同一元素相邻价态不发生氧化还原反应。
⑶强弱规律:在氧化还原中如有如下关系氧化性:氧化剂强于氧化产物还原性:还原剂强于还原产物⑷优先规律:氧化性强的物质优先被还原,还原性强的物质优先被氧化。
【例题1】同浓度的FeCl 3、CuCl 2、HCl 溶液中加入一定的铁粉,观察到无气体生成,则可能发生的反应是 。
解析:因为氧化性强弱顺序是Fe 3+>Cu 2+>H +,所以,可能发生的反应是2Fe 3++Fe =3Fe 2+或2Fe 3++Fe =3Fe 2+和Cu 2++Fe =Fe 2++Cu【注意】氧化还原反应中的不一定:⑴含有最高价态元素的化合物不一定具有强氧化性。
如前述的氯元素的含氧酸及其盐,是价态越低,氧化性越强。
H 3PO 4中+5价的P 无强氧化性。
⑵有单质参加的反应不一定是氧化还原反应。

第二讲 氧化还原反应基本知识考点一 氧化还原反应与四种基本反应类型1.氧化还原反应的本质和特征2.氧化还原反应与四种基本反应类型间的关系图示例1:判断(1)有单质参加或单质生成的化学反应一定是氧化还原反应( )(2)无单质参加的化合反应一定不是氧化还原反应( )(3)Na 2O 2和SO 2的反应是氧化还原反应( )例2:下列颜色变化与氧化还原反应有关的是( )A .氨气遇到HCl 气体后产生白烟B .品红溶液通入SO 2气体后褪色C .湿润的淀粉碘化钾试纸遇Cl 2变蓝D .在无色火焰上灼烧NaCl 火焰呈黄色例3:下列化学反应属于区域3的是( )A .4Fe(OH)2+O 2+2H 2O===4Fe(OH)3B .2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑C .4NH 3+5O 2=====催化剂△4NO +6H 2O D .Zn +H 2SO 4===ZnSO 4+H 2↑考点二氧化还原反应的概念1.氧化剂还原剂的概念氧化剂:氧化还原反应中,反应物获得电子的物质称作氧化剂还原剂:氧化还原反应中,反应物失去电子的物质称作还原剂氧化产物:氧化还原反应中的还原剂失去电子,化合价升高的产物还原产物:氧化还原反应中的氧化剂得到电子,化合价降低的产物2.常见的氧化剂和还原剂(1)常见氧化剂(2)常见还原剂(3)元素化合价处于中间价态的物质既有氧化性,又有还原性例1:判断(1)金属阳离子一定只具有氧化性(×)(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原(×)(3)氧化还原反应中的反应物,不是氧化剂就是还原剂(×)(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原(√)(5)CaO2与水发生氧化还原反应时,CaO2只作氧化剂(×)例2.下列所加物质的作用与其还原性有关的是()腌咸菜加氯化钠食用盐中加碘酸钾红酒中添加SO生活用水消毒加入次氯酸钙例3.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是()A.溴发生了还原反应B.二氧化硫在反应中被还原C.溴在反应中失去电子D.该反应既是化合反应又是氧化还原反应例4.制取新型水处理剂ClO2的化学方程式为2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。