20123188 实验一
- 格式:doc
- 大小:4.27 MB
- 文档页数:10

2012级基础化学实验(综合)安排2014学年春季学期2014.2.24---2014.5.28注:学时数:72学时学分:2学分人数:357人,(化学A 43,B44,C42,D46,E44,F44,2+2班49,临床29,交换生,16)时间:每次14.5学时,周三8:30-19:00点;1-5组:178人,A(43人)、B(44人)、C(42人),2+2(49人);6-10组:179人,D(46人)、E(44人)、F(44人)、交换(16人)2012级基础化学实验(综合)分组名单2014.2.24---2014.5.28第1组:A 30人奥斯曼·麦麦提图尔荪、白惠珍、蔡鸿韵、蔡菁菁、蔡思颖、曹陈陈、曹振坤、陈包棋、陈保利、陈丹丹、陈冠任、陈浩聪、陈娟、陈开乾、陈坤宇、陈敏鹏、陈少敏、陈世杆、陈伟宾、陈伟亮、陈晓、陈笑、陈咏林、陈镇豪、陈智鹏、程映艺、崔伟强、邓才栋、邓海权、邓杰仁第2组:A 13人+ B 17人=30邓智容、迪力亚尔·肉孜、董嘉乐、杜诚、杜飞、杜钊夷、范志颖、方博馨、方栩岸、封亮廷、冯凌宇、冯伟仪、高苏、龚浩、龚恒业;关玉婷、郭锦轩、何杨鹏、赫兰齐、洪尧舜、胡庆坤、胡雅洁、胡亦清、胡瑜雯、胡禹、胡志涛、黄发文、黄海燕、黄浩然、黄佳楠第3组:B 27人+C 3人黄嘉琛、黄健、黄靖雯、黄俊健、黄礼博、黄宁宇、黄倩、黄秋忆、黄森传、黄文俊、黄智翔、简郸、简俊华、姜沛林、姜语嫣、揭丽萍、柯曙昶、孔莉、寇俊玮、旷实、赖嘉俊、赖鹏、赖欣宜、雷皓宇、黎海波、黎嘉成、李博;李超、李传发、李浩强第4组:C 30人李洪顺、李锦胜、李镜聪、李凯婷、李康华、李鹏日、李奇连、李倩茹、李松、李瑜、李朕、李子程、练宇飞、梁豪、梁婷钰、梁炎君、梁志樵、梁紫薇、廖海焜、廖焕妍、廖天华、林佳盛、林景、林俊轩、林霖活、林锐燕、林淑玲、林艳铃、林致远、刘虎城第5组:C 9人+(2+2)21=30刘嘉豪、刘俊杰、刘乃嘉、刘瑞、刘小珍、刘衍溢、刘逸章、刘勇江、刘昱;柏慧、曹灿、曹露露、陈斯杰、陈雨豪、邓儒、付子恩、傅占鳌、郭美杉、何子睿、贺一鸣、黄俊彦、黄颖妍、江佳骏、黎思远、李健斌、李垚、梁邦、廖蕾、廖明慧、林嘉芬第六组:(2+2)28人刘若辰、龙映汐、马晓江、潘筱琳、彭俊琦、邱瑞鑫、邱宇恒、石宸宇、宋冠和、覃诗薇、涂于洁、王晨雅、王岩琦、夏永祥、杨盛祚、杨星云、曾芯祎、张涵、张鸣桐、张小平蓉、张孝静、张子寒、周健航、庄浩彬、陈瀚、左嘉睿、王戈夫、龚豪第七组:D 30人刘远红、卢莉丽、陆如岚、陆志涛、吕飞逸、罗柏彬、罗美嫦、骆嘉莹、马奇柠、马文杰、玛依拉·贾尔肯、毛润东、毛旭宏、孟珊、缪泳锋、潘东优、潘辉、秦何荣、区绮雯、饶梦华、饶子龙、沈长宇、舒欣、宋雯雯、苏权飞、苏伟庆、粟梦琪、孙林颖、孙若邻、孙帅第八组:D 16人+E14人=30孙仪玮、孙正、覃玉莲、滕军、田毅、万里祺、汪玉好、王家强、王建雄、王剑儒、王莉、王珊珊、王沈晗、王帅、王烁宇、王潇洋、王晓建、王筱湛、王益辰、韦彪、魏佳良、魏永锋、温家熙、文思嘉、巫珊珊、巫意婷、吴豪忠、吴金伦、吴韶桐、吴思贤第九组:E 30人吴炜臻、吴文林、吴文清、吴小锋、吴颖楠、伍泽雄、奚亚男、肖华、谢思颖、谢政、辛芳园、熊凯、徐丽容、徐雅伦、徐颖、许汉健、许文涵、许晓瑾、鄢慈航、颜世超、颜星、杨慕紫、杨祎然、杨毅杰、杨湛、叶惠婷、叶慧桐、叶立志、易孔阳、易秘第十组:F 30人易鹏晖、游凤仪、余贵成、俞勇、郁瑾、袁博、曾鹏坤、曾茜子、曾伟振、曾宪文、詹梦怡、张杰、张靖雯、张妹三、张民康、张熙悦、张轩赫、张雅琪、张运发、张湛垚、张昭、张志华、张志铭、赵锦德、赵鹏钰、赵曦、赵勇、郑炳坤、郑皓翔、郑嘉颖第十一组:F 14人+交换16人=30郑亮、郑雨涵、钟振鹏、周晗、周嘉泓、周略、周宁、周瑞飞、周伟、周文凯、周止若、朱休明、朱益昆、曾俊钊、彭棵、周昊宇、麦嘉华、张璐、张廉昌、袁李怡文、蒋志、钟天立、刘寅可、栾自鸿、耿朔天、巫尚杰、翟河科、张之涵、方正松、方日华第十二组:临床29人陈柏林、陈斌锋、陈东亮、陈志宏、邓茜文、郭少燕、何炎炯、黎坚德、李姝翮、梁玮昊、廖舒敏、林藩雄、刘铭杰、刘瑶、陆思多、庞立春、石益、孙旭琪、王昕、吴锦杰、伍明劲、谢鸿玉、张浩培、张汝思、章颖、郑瑞映、郑杏芳、钟娴、周华强。

一.填空题(共3小题)3.(2012•淮安)在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.(1)贝壳高温煅烧时,发生反应的化学方程式是_________;(2)操作Ⅰ中用到的玻璃仪器有烧杯、_________、玻璃棒;(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是_________;【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:甲:纯净的NaOH乙:NaOH和Na2CO3的混合物丙:NaOH和Ca(OH)2的混合物【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,验流程对甲同学设计的方案进行合理的评价:_________.二.解答题(共17小题)4.请你参与下列探究:【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:(1)甲同学认为是O2,则检验方法是_________.(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式_________.(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.如果放出的是O2和H2,你认为方案中的安全隐患是_________.丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指_________,若不发出_________,方可采用上面的装置进行实验.【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.结论:铁粉与硫酸铜溶液反应时,产生的气体是_________.【思维拓展】(1)由上述实验可以推出,硫酸铜溶液中可能含有_________物质.(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是_________.要得到科学严谨的结论,仍利用该装置,补做的实验是_________.CuSO4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:(1)清你帮助他们完成实验报告:(2)已知FeCl3在水中可分离出Fe和Cl,同学们提出以下猜想:①甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;②乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;③丙同学的猜想:真正催华分解H2O2的是FeCl3溶液中的Cl﹣;你认为最不可能的是_________同学的猜想,理由是_________.A.100ml量筒B.托盘天平C.玻璃棒 D.50ml容量瓶E.10ml量筒F.胶头滴管G.50ml烧杯H.100ml容量瓶(1)实验时应选用仪器的先后顺序是(填入编号)_________.(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)_________.A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm﹣2cm 处,用滴管滴加蒸馏水到标线.D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm﹣2cm处,用滴管加入蒸馏水到标线.E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.5.过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有_________、_________的性质.(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:_________、b:_________两个条件.[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?[查阅资料]:(1)在常温下Na2O2能和CO2发生化学反应.(2)在常温下Na2O2能和水发生反应:2Na2O2+2H2O═4NaOH+O2↑(3)无水硫酸铜为白色固体,吸水后变为蓝色.[设计实验]:经过讨论后,小组同学设计了如图2的实验进行探究.[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和的澄清石灰水变浑浊.[实验分析]:①检查整套装置的气密性的方法:__________________.②C装置无水硫酸铜的作用是_________.③D装置的烧杯内饱和的澄清石灰水的作用是_________.[得出结论]:(1)①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②_________(填装置出现的现象)说明Na2O2和CO2反应使图1中的棉花满足了燃烧的另一个条件.(2)Na2O2和CO2反应除生成一种气体外,还生成了一种固体,甲认为生成的固体是NaOH,乙认为是Na2CO3,同学们经过思考后认为甲同学的猜想是错误的,理由是:_________.(3)Na2O2和CO2反应的化学方程式是_________.[拓展提高]:现有一包保存不当的过氧化钠粉末,已证明其已完全变质.为探究其成分,有同学设计了以下定性和定量两种实验方案,请你帮助完成下列实验报告.一、定性方案:二、定量方案:称取39.8g样品于一只质量为45g的锥形瓶中,一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,逐滴滴加溶质质量分数为9.8%的稀硫酸,观察显示数字的变化,并绘制出混合溶液的质量与所滴入稀硫酸溶液的质量关系曲线(如图);请你根据曲线计算出粉末中各成分的质量.6.小伟生日,妈妈做了很多菜,小伟发现妈妈将拌了“安多夫”粉的肉类加入食醋腌制时产生大量气泡,引发了极大的兴趣.【查阅资料】“安多夫”是一种嫩肉粉,可破坏肉质纤维结构,使肉质松软,其成分中含有碳酸氢钠(NaHCO3).小伟联想已经学过的碳酸钠(Na2CO3),其与碳酸氢钠比较,组成元素只相差一种元素氢元素,决定与化学兴趣小组的同学一道对碳酸钠和碳酸氢钠的性质的异同点进行初步探究.【提出问题】碳酸钠和碳酸氢钠的性质有哪些相同点和不同点?【探究活动一】探究碳酸氢钠溶液的酸碱性?【猜想1】碳酸氢钠溶液与碳酸钠溶液相似显碱性.【探究活动二】探究碳酸氢钠能否与酸反应?【猜想2】碳酸氢钠与碳酸钠相似都能与稀盐酸反应【进行实验2】将气球中的碳酸氢钠粉末、碳酸钠粉末分别加入试管中(如图1),气球迅速胀大,说明碳酸氢钠能与稀盐酸发生化学反应.联想到已学过的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,请写出碳酸氢钠与稀盐酸反应的化学反应方程式:_________.【探究活动三】探究NaHCO3与Na2CO3的热稳定性【猜想3】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应.【进行实验3】为验证猜想,同学们设计并进行以下甲、乙两个对比实验,实验装置如图2所示,请你参与,完成下想的主要依据是 _________ .(2)为了进一步确定反应后白色固体粉末的成分,同学们设计如下两个验证猜想的实验方案:方案1:取少量该反应后的白色固体粉末于试管中,加水溶解,并滴加酚酞试液,发现溶液变红,于是他们认为该白色固体粉末是氢氧化钠.但同学们经过反复交流讨论后,一致认为方案1得出的结论是不正确的,理由是: _________ .方案2:同学们取少量该反应后的白色固体粉末于试管中,进行如下实验:由此,同学们推断出该残留的白色固体粉末是 _________ (填化学式),请写出上述实验涉及到的反应化学方程式: _________ 、 _________ .(3)有同学认为还可以用一种常见的碱溶液来验证残留的白色固体粉,那么它是 _________ 溶液.【交流与讨论】(1)根据实验甲及其探究活动的结果,请写出碳酸氢钠受热分解的化学方程式: _________ .(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质 _________ 的重要因素之一.(3)“安多夫”在使用和贮存过程中应注意哪些问题 _________ (至少说出一点).7.化学是一门以实验为基础的学科,通过一年的学习,相信你的实验能力一定有了很大提高,请你一同参与回答以下问题.(一)某实验小组设计了图1所示的实验装置.(1)写出仪器A 的名称 _________ .(2)甲同学认为打开K1、关闭K2时,利用I 、Ⅱ装置,可以制取并收集氧气,该化学反应方程式为: _________ .(3)乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量.关闭K 、K1、K2,用凸透镜引燃B 中的白磷,待冷却后打开K2,整个实验过程中能观察到的现象是:①_________ ;② _________ .(4)丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳能与氢氧化钠溶液发生反应.他在广口瓶B 中预先收集满二氧化碳气体,在仪器A 中盛放氢氧化钠浓溶液,烧杯中盛放稀盐酸,K1关闭、K2打开,然后打开K 将氢氧化钠浓溶液滴入广口瓶中,关闭K ,依据 _________ 现象,可以证明二氧化碳能与氢氧化钠溶液发生化学反应.(二)甲、乙两同学对有关镁与盐酸的反应进行了系列研究(如图2)探究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:(1)实验时需将镁条进行打磨,其目的是 _________ .(2)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,化学方程式为 _________ .(3)实验测得镁片产生气体的速率(v )与时间(t )的关系如图3所示,你认为在t1~t2时间内反应速率逐渐加快的主要原因是: _________ .探究二:.反应后所得溶液的酸碱性探究【发现问题】(1)反应后甲同学用pH 试纸测定试管中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈 _________ 性,(选填“酸”“碱”或“中”).(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红.【查阅资料】氢氧化镁微溶于热水,且溶解度随温度升高而增大.【提出猜想】甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7.乙同学:猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色.【实验与思考】(1)为验证猜想,甲、乙两同学均需测定_________溶液的酸碱性,实验表明该溶液显弱酸性.(2)乙同学为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧,请根据以上现象写出镁与热水反应的化学方程式_________;(3)乙同学在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失,于是他猜想可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉了,但甲同学猜想可能是水温逐渐降低,导致_________,请你设计一个简单的实验方案验证甲或乙的猜想是否成立(写出相应的操作、现象和结论):_________.【结论】镁与稀盐酸反应,若镁反应完全后所得溶液显酸性,若镁过量时所得溶液显碱性.8.我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气反应方程式为:2Na2O2+2CO2═2Na2CO3+O2(1)你认为用这种方法制氧气的优点是_________;(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:①简述检查装置气密性的方法_________;②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量_________;③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应_________(填“吸热”或“放热”)同时还可以观察到固体粉末发生变化的现象是_________;④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在_________mL处.(不考虑实验带来的误差)(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论._________变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:i写出盛放稀硫酸的实验仪器名称_________;ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度_________(填“偏大”或“偏小”).iii鼓入空气的目的是_________,装置A中试剂X应选用_________;ivE装置的作用是_________;(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mLii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.9.某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:①如图所示,连接仪器,检查装置的气密性.发现装置的气密性良好.②在集气瓶里装进适量a 体积的水,燃烧匙里放一块白磷(其着火点是40℃),并在酒精灯上把玻璃棒下端加热,按图示装置把集气瓶中的空气密封起来,把长导管的另一端放入盛有足量水的烧杯中.(注:集气瓶内的长导管已伸到了瓶底)③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,产生大量白烟,同时放出大量的热.(注:白磷与红磷燃烧的产物相同)④待白磷燃烧熄灭后,稍加振荡,白烟消失.⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c.⑥根据a、b、c三个数据,计算出空气中氧气的体积分数.根据以上信息,回答下列问题.(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是_________.(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系式:_________.(3)组内成员小葛为了证明实验完成后的集气瓶内是否还有氧气剩余,他没有利用其它的仪器和药品,仍是利用了上述实验涉及的仪器和药品,设计了一个实验,最后得出了瓶内一定没有氧气剩余的结论.你知道他是如何实验他终于明白“a 体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二则主要是_________.(5)组内成员小杭性格好动,无意间他发现向⑤步骤集气瓶内的水中滴加几滴紫色石蕊试液,水会变红.这一现象使组内成员积极地展开了讨论,成员小葛是由于二氧化碳溶于水,使溶液显酸性而导致的,但小明马上作出反对,原因是空气中二氧化碳的含量极少,而实验过程中又没有产生二氧化碳,短时间内不可能会使溶液显酸性.你认为谁的观点正确?_________.若你认为小明的观点正确,那么请你对“变红”现象提出大胆地猜想:_________.(若你认为小葛的观点正确,此空不填)(6)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是_________ A.装置气密性不好B.实验前集气瓶里没有装a 体积的水C.集气瓶没有冷却到室温D.用红磷代替白磷(红磷的着火点在240℃左右)10.(2011•德州)请你参与某学习小组研究性学习的过程,并协助完成相关任务.【研究课题】探究水壶内部水垢的主要成分【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下和_________.【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置.取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无_________(填化学式).(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.其主要实验步骤如下:①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸.若D瓶增重22g,则水垢全部是CaCO3.②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;③称量D瓶内物质增加的质量;④重复②和③的操作,直至D瓶内物质质量不变.测量滴加稀盐酸体积与D瓶内物质增加质量的关系如右图曲线所示;【评价】(1)A瓶中的NaOH溶液起到_________作用.若A瓶中无NaOH溶液,D瓶中的质量将_________(填“增大”、“不变”或“减小”).(2)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多.分析曲线图可知:水垢中一定含有_________(化学式),理由是_________.(3)装置图中“?”所指处有三根导管同时穿过橡胶塞,已知:导管的直径为8mm,橡胶塞细段直径为3cm.从坚固和美观的角度考虑,请你在由图中标出应在哪三点打孔为好(用圆圈“○”表示打孔位置).以上实验_________(填“能够”或“不能”)检测出水垢中含有Mg(OH)2.11.下面是实验室制取气体的装置图,结合图回答下列问题:(1)写出装置图中标有①②序号的仪器名称:①_________②_________(2)实验室用氯酸钾制取氧气时的化学反应表达式_________,若要收集较纯净的氧气可选用的装置组合是_________(写出装置代号,下同);若用高锰酸钾制取氧气,此发生装置应做如何改进_________,目的是_________.在实验过程中,如果发现试管破裂,可能的原因有_________.用氯酸钾制取氧气时若忘记加入二氧化锰,其结果是_________.A.不能产生氧气B.产生氧气的速率慢C.产生氧气的总量减少D.没有氯化钾生成(3)实验室若选用B装置作为制取氧气的发生装置,某同学在观察到锥形瓶内有大量气泡时,就开始用C装置进行收集,一段时间后,用带火星的木条伸入瓶口、瓶中、瓶底,都没见木条复燃,其原因可能是_________.改进实验后检验氧气已集满的方法是_________;若实验室用此法代替KMnO4加热制取O2,其优点是_________;实验中发现装置B中反应很剧烈,据此提出实验安全注意事项是_________.①控制液体的加入速度②用体积较小的锥形瓶③加热反应物(4)通过查阅资料得知:①氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液称为氨水;②氨水能使无色酚酞试液变红;③氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.实验室用氯化铵(NH4Cl)和熟石灰两种固体反应物混合加热可制取氨气,同时生成氯化钙和水.①实验室制取氨气的发生装置应选用_________,若使用装置G收集氨气,则气体应从_________(填“d”或“e”)通入.②请写出氨气和氧化铜反应的符号或文字表达式_________;③小芳将收满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是_________、_________(5)F装置可以用来收集和储备气体.当装置中收集满氧气后,如果需要排出氧气,则可使用水排法.水应从(填“b”或“c”)_________端通入.12.CO2可用于制备碳酸饮料,人饮后有清凉感.某同学设计如下实验,测定某品牌碳酸饮料中的CO2的含量.实验方案一:①将250mL瓶装碳酸饮料放在冰箱中冷冻至刚好结冰;②将饮料从冰箱内取出,迅速加入质量分数为50%NaOH溶液5mL;倒转饮料瓶,轻轻震荡,然后放置恢复至室温,待测定;③称得装置C的质量为x g,按图1连接实验装置.取50mL待测液至仪器②中,关闭开关a,打开仪器①的活塞,向仪器②中注入稀盐酸,至不再产生气泡,关闭仪器①的活塞;④打开开关a,向装置中鼓入空气,一段时间后,称量C装置质量为y g.注:实验中各种溶液的密度都视为1g/mL.碱石灰是CaO与NaOH的固体混合物.(1)上述装置中,仪器①的名称为_________,仪器②的名称为_________.(2)装置A的目的是_________,装置D的目的是_________.(3)步骤①冷冻碳酸饮料的目的是_________.步骤②中反应的化学方程式为_________,加入NaOH溶液的目的是_________.(4)步骤④鼓入空气的目的是_________.(5)根据题中提供的数据计算此品牌碳酸饮料中CO2的含量为_________g/L.(6)若没有B装置,则测得CO2含量会_________.(填“偏大”或“偏小”)实验方案二:①②与方案一相同;③按图2连接实验装置.称得整个装置(含药品)的质量,打开活塞注入足量稀盐酸,间隔10s 连续称量整个装置的质量,直到整个装置的质量不变为止.(1)注入足量稀盐酸后发生的化学反应方程式为_________.(2)该实验中称量操作至少进行_________次.(3)装置B的目的是_________.(4)有同学提出该方案测得CO2含量会偏小,该同学的理由除了可能是空气中水蒸气对实验结果的影响外,还可能是_________.13.实验室提供了以下仪器,请你随某兴趣小组的同学一起来参加实验探究活动:(1)若用氯酸钾和二氧化锰来制取氧气,你认为除需要用到上面的⑥⑦⑩仪器外,还需上面的仪器有_________(填序号).选择这些仪器的依据是_________(填字母).A、属于固体与固体加热的反应;B、属于固体与液体不加热的反应;C、制取的气体难溶于水;D、制取的气体密度比空气大(2)实验室制取CO2的发生装置可选用③④和⑧组装,仪器④的名称为_________.若要得到干燥的CO2,制出的气体还需要经过一个干燥装置.下列装置(含试剂)中适合干燥CO2的装置为________(填装置下字母),气体流向为从________(填接口字母)流入.(3)晴晴同学用A、B两只塑料瓶集满CO2,分别倒入一定量的水和氢氧化钠溶液,盖严瓶盖,充分振荡,塑料瓶都变瘪,如图所示.兴趣小组的同学对此现象进行了讨论.有一部分同学(下称①组同学)认为,两个瓶中都有水,是因为发生了水与CO2的反应,才导致塑料瓶变瘪.若在试管中加入少许A瓶中的液体,滴入数滴紫色石蕊溶液,产生的现象为_________,其原因是水与CO2反应生成了_________(填化学式).另一部分同学(下称②组同学)分析认为,加氢氧化钠溶液的塑料瓶中发生了另一个反应,该反应的化学方程式为_________.为证明本组观点正确,②组同学设计了以下实验方案:取B中溶液少量,滴入无色酚酞溶液,若溶液变为无色,说明CO2与氢氧化钠发生了反应,若仍为红色,说明CO2未与氢氧化钠反应.你认为②组同学的实验方案正确?_________(填“正确”或“不正确”),原因_________.参考20℃时,部分物质的溶解性表.晴晴同学认为选用某些酸或盐溶液与B瓶中的溶液反应,根据现象能判断出②组同学观点是否正确,晴晴同学的说法得到了老师的肯定.下表为该同学的实验操作、现象和结论.14.如图是几种常见的实验装置:(1)指出仪器名称:甲。

辽宁沈阳市2012年普通高中学生学业水平考试生物实验操作考查内容实验一检测生物组织中的还原糖、脂肪和蛋白质学校:考号:姓名:考查项目考查要点与要求满分得分(一)检测生物组织中的还原性糖 1.取待测组织样液向试管中加入2mL待测的组织样液 52.配制斐林试剂用量筒量取斐林试剂甲液和乙液各1mL加入同一试管中,摇匀 53.加入斐林试剂向盛有组织样液的试管中加入1mL新配制的斐林试剂,轻轻振荡,混合均匀 54.加热将试管放入盛有50-65℃温水的烧杯中水浴中加热2min 105.观察在对试管加热煮沸过程中,溶液颜色变化为:浅蓝色→棕红色→砖红色(沉淀) 10 (二)检测生物组织中的脂肪 1.取材、切片取一粒浸泡过的花生种子,去掉种皮,用刀片在花生子叶的横切面上平行切下若干薄片。
放入盛有清水的培养皿中。
要求操作安全、正确。
52.染色用毛笔将最薄的切片移至洁净的载玻片上。
在花生子叶薄片上加2~3滴苏丹Ⅲ染液,染色3min,用吸水纸吸去染液。
再用1~2滴体积分数为50%的酒精洗去浮色。
103.制作临时装片用吸水纸吸去花生子叶薄片周围的酒精,滴1~2滴蒸馏水,盖上盖玻片。
要求操作正确,装片中无气泡。
104.观察正确使用显微镜。
先用低倍镜观察,找出细胞中被染成橘黄色的圆形颗粒,再转换高倍镜观察,脂肪颗粒清晰。
10(三)检测生物组织中的蛋白质 1.取待测组织样液向试管中加入2mL待检测的组织样液 5 2.加入双缩脲试剂向试管内加入双缩脲试剂A液1mL,摇匀 5向试管内滴入双缩脲试剂B液4滴,摇匀 53.观察组织样液变成紫色 10整理实验结束后,洗刷试管、玻片,整理显微镜、实验台。
5成绩总分:等级:监考教师:实验二观察植物细胞的质壁分离和复原学校:班级:姓名:考查项目考查要点与要求满分得分(一)制作洋葱表皮细胞临时装片 1.取材撕取紫色洋葱鳞片叶外表皮,大小适中,肉眼观察不带叶肉。
102.制作装片在载玻片中央滴1滴水,洋葱表皮平展于水滴中,不折叠。

哈工大化工原理实验思考题答案及哈工大仪器分析实验思考题答案哈工大化工原理实验思考题答案及试题答案哈工大仪器分析实验思考题答案(此版答案由前版整理更正而来,但仍有错误之处,请谨慎参考)化工原理实验实验一伯努利实验1.为什么实验要保持在恒水位条件下进行?因为水箱水位高度代表管中位能。
当流速改变时,只有位能保持不变才能使用伯努利方程进行变量计算。
2.从实验中,你能从观察现象中解释流体在直管内流动的速度与阻力损失的变化关系吗?流速增加阻力损失增加3.操作过程中为什么要排气泡?气泡会影响到水位高度或者管路压强实验三管路流体阻力的测定1. 为什么测定数据前首先要赶尽设备和测压管中的空气?怎样赶走?影响管内压力排气方法:先将转换阀组中被检测一组侧压口旋塞打开,再打开倒置U形水柱压差计顶部的放空阀,通过调整流量大小使气泡排出,若止水夹附近有气泡可打开止水夹排除。
若仍存在气泡,抬高一端,轻轻震动,排除气泡。
2.用什么办法检测系统中的气是否排净?判断方法:关闭阀门,压差计两侧读数相平则证明气泡排净。
若不相平则仍有气泡存留。
3.以水为工作流体所测得的λ- Re曲线能否应用与空气,如何应用?空气为牛顿型流体,且雷诺数是无量纲数,故可以应用。
4.不同管径,不同水温下测定的λ- Re能否关联在同一条曲线上?不一定,因为λ和Re相对粗糙度有关,所以不一定能关联到同一条曲线上。
5.如果测压口、孔边缘有毛刺或安装不正,对静压的测量有何影响?没有影响。
所测静压表现在上液面和下液面的垂直高度差。
只要静压一定.高度差就一定.实验四流体流动形态及临界雷诺数的测定1.研究流体流动形态有何意义?一、判断流动型态,进而通过改变流速、管径等改善传质、传热效果。
二、形态确定后传质传热边界层存在的影响传质传热机理也确定。
2.判断流体流动类型的主要依据是什么?影响Re的因素是什么?怎样才能改变流体流动类型?改变流体流动类型对化工单元操作的强化有何作用?判断流体流动类型的主要依据是雷诺数。

课题:DNA提取与鉴定一、实验目的1. 学习DNA提取的基本原理和方法。
2. 掌握从动植物细胞中提取DNA的操作步骤。
3. 学习DNA的鉴定方法,包括观察DNA的紫外光吸收特性。
二、实验原理DNA是生物体内的遗传物质,存在于细胞核、线粒体等细胞器中。
DNA提取是将细胞内的DNA与其他成分分离的过程。
本实验采用酚-氯仿法提取DNA,该方法利用酚和氯仿的相容性将蛋白质等杂质去除,从而获得纯净的DNA。
三、实验材料1. 材料:新鲜鸡血、小麦种子、苹果等。
2. 试剂:酚-氯仿混合液、NaCl溶液、75%乙醇、蒸馏水、10×TE缓冲液、二苯胺试剂。
3. 仪器:研钵、离心机、移液枪、微量离心管、紫外可见分光光度计、显微镜。
四、实验步骤1. 材料准备:取新鲜鸡血、小麦种子、苹果等,分别研磨成匀浆。
2. 细胞裂解:将匀浆加入1.5倍体积的酚-氯仿混合液,剧烈振荡,静置10分钟。
3. 去除杂质:将混合液转移至新的离心管中,12000 rpm离心10分钟,弃去上层酚-氯仿层,保留下层水相。
4. DNA纯化:将水相中加入等体积的75%乙醇,混匀后静置10分钟,12000 rpm离心5分钟,弃去上清液,将沉淀用70%乙醇洗涤一次,12000 rpm离心5分钟,弃去上清液。
5. DNA溶解:将沉淀溶于适量的10×TE缓冲液中。
6. DNA鉴定:a. 取少量DNA溶液,加入二苯胺试剂,观察颜色变化。
b. 使用紫外可见分光光度计测定DNA溶液在260 nm处的吸光度值。
五、实验结果1. DNA鉴定:通过二苯胺试剂,DNA溶液呈现蓝色,证明DNA提取成功。
2. 紫外可见分光光度计测定:DNA溶液在260 nm处的吸光度值为0.45,表明DNA 纯度较高。
六、实验讨论1. DNA提取过程中,酚-氯仿法的操作较为复杂,需要严格控制实验条件,以保证DNA的纯度。
2. 在DNA纯化过程中,乙醇沉淀法是一种常用的方法,可以有效地去除蛋白质等杂质。

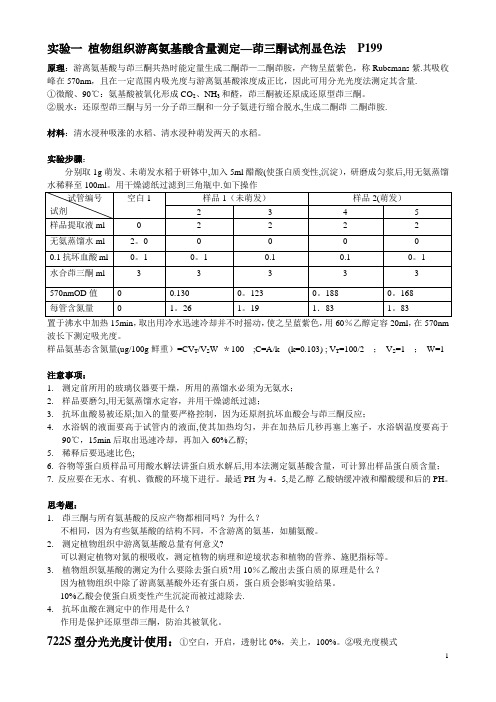
实验一植物组织游离氨基酸含量测定—茚三酮试剂显色法P199原理:游离氨基酸与茚三酮共热时能定量生成二酮茚—二酮茚胺,产物呈蓝紫色,称Rubemans紫.其吸收峰在570nm,且在一定范围内吸光度与游离氨基酸浓度成正比,因此可用分光光度法测定其含量.①微酸、90℃:氨基酸被氧化形成CO2、NH3和醛,茚三酮被还原成还原型茚三酮。
②脱水:还原型茚三酮与另一分子茚三酮和一分子氨进行缩合脱水,生成二酮茚-二酮茚胺.材料:清水浸种吸涨的水稻、清水浸种萌发两天的水稻。
实验步骤:分别取1g萌发、未萌发水稻于研钵中,加入5ml醋酸(使蛋白质变性,沉淀),研磨成匀浆后,用无氨蒸馏置于沸水中加热15min,取出用冷水迅速冷却并不时摇动,使之呈蓝紫色,用60%乙醇定容20ml,在570nm 波长下测定吸光度。
样品氨基态含氮量(ug/100g鲜重)=CV T/V S W *100 ;C=A/k (k=0.103) ; V T=100/2 ;V S=1 ;W=1注意事项:1.测定前所用的玻璃仪器要干燥,所用的蒸馏水必须为无氨水;2.样品要磨匀,用无氨蒸馏水定容,并用干燥滤纸过滤;3.抗坏血酸易被还原;加入的量要严格控制,因为还原剂抗坏血酸会与茚三酮反应;4.水浴锅的液面要高于试管内的液面,使其加热均匀,并在加热后几秒再塞上塞子,水浴锅温度要高于90℃,15min后取出迅速冷却,再加入60%乙醇;5.稀释后要迅速比色;6. 谷物等蛋白质样品可用酸水解法讲蛋白质水解后,用本法测定氨基酸含量,可计算出样品蛋白质含量;7. 反应要在无水、有机、微酸的环境下进行。
最适PH为4。
5,是乙醇-乙酸钠缓冲液和醋酸缓和后的PH。
思考题:1.茚三酮与所有氨基酸的反应产物都相同吗?为什么?不相同,因为有些氨基酸的结构不同,不含游离的氨基,如脯氨酸。
2.测定植物组织中游离氨基酸总量有何意义?可以测定植物对氮的根吸收,测定植物的病理和逆境状态和植物的营养、施肥指标等。

2012海淀区九年级第二学期期中练习初三化学2012.5 可能用到的相对原子质量:H—1C—12O—16Na—23Mg—24S—32Cl—35.5Ca—40Fe—56Zn—65一、选择题(每小题只有1个选项符合题意,共25个小题,每小题1分,共25分。
)1.下列变化中,属于化学变化的是A.矿石粉碎B.纸张燃烧C.酒精挥发D.冰雪融化2.下列物质中,属于纯净物的是3.钾肥能增强作物对病虫害和倒伏的抵抗能力。
下列属于钾肥的是A.KCl B.Na2SO4C.NH4HCO3D.Ca(H2PO4)24.2012年2月,国务院发布空气质量新标准,下列项目没有列入空气质量监测的是A.二氧化氮 B.氮气 C.一氧化碳 D.PM2.55.下列物质在氧气中燃烧,火星四射的是A.红磷B.铁丝C.木炭D.氢气6.能保持氧气化学性质的粒子是A.O B.2ºC.O2D.O2-7.决定元素种类的是原子的A.质子数B.中子数C.电子数D.最外层电子数8.下列实验操作中,正确的是9.日常生活中加碘食盐的“碘”是指A.单质B.分子C.原子D.元素10.下图是某些食物的近似pH,呈碱性的是11.下列做法中,不利于...保护水资源的是A.使用节水型马桶B.合理使用农药和化肥C.生活污水任意排放D.工业废水处理达标后排放12.水果散发出诱人的香味,你能闻到香味的原因是 A .分子在不断运动 B .分子的质量很小 C .分子之间有间隔D .分子的体积很小 13.下列物质放在敞口容器中一段时间后,质量明显减少的是A .浓硫酸B .浓盐酸C .氢氧化钠D .氯化钠14.现代社会的生产和生活需要消耗大量能量。
下列活动中,通过化学反应提供能量的是15.下列化学方程式书写不正确...的是 A .2254P 5O 2P O +点燃B .2442Zn H SO ZnSO H ++↑C .4222CH O CO H O ++点燃D .22222H O O 2H O ↑+催化剂16.下列物质的用途主要与它的物理性质有关的是A .氧气用于炼钢B .干冰用于人工降雨C .熟石灰用于改良酸性土壤D .天然气用作清洁燃料17.已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为 A .2 B .6 C .8 D .14 18.右图是元素周期表中硫元素的信息示意图,对图中信息解释不正确...的是A .质子数为16B .原子序数为16C .属于金属元素D .相对原子质量为32.06 19.鉴别一瓶气体是否为氧气,下列操作正确的是A .观察气体颜色B .闻气体的气味C .插入带火星的木条D .倒入澄清的石灰水20. 下图所示的一组实验可用于研究燃烧条件。

一、实验目的1. 了解恐龙的生物学特征,为生物科学研究提供依据。
2. 掌握恐龙实验的基本方法,提高实验技能。
3. 通过实验,探讨恐龙在生物进化过程中的地位和作用。
二、实验原理恐龙是一类已经灭绝的爬行动物,曾统治地球长达1.6亿年。
通过对恐龙的研究,可以了解生物进化的规律,揭示生命起源和发展的奥秘。
本实验通过模拟恐龙的生活环境和生理特点,探讨恐龙在生物进化过程中的地位和作用。
三、实验材料1. 恐龙化石:选取具有代表性的恐龙化石,如霸王龙、翼龙等。
2. 实验试剂:磷酸盐缓冲液、生理盐水、酶制剂等。
3. 实验仪器:显微镜、离心机、培养箱等。
四、实验方法1. 恐龙化石处理(1)将恐龙化石用稀盐酸清洗,去除表面的泥土和杂质。
(2)将清洗后的化石浸泡在磷酸盐缓冲液中,去除有机物质。
(3)将处理后的化石进行研磨,得到恐龙化石粉末。
2. 恐龙化石成分分析(1)将恐龙化石粉末进行化学成分分析,检测其中的无机元素和有机物质。
(2)通过酶解法提取恐龙化石中的蛋白质,进行电泳分析。
3. 恐龙生理实验(1)将恐龙化石粉末制成悬浊液,模拟恐龙的消化系统。
(2)在模拟消化系统中加入酶制剂,观察恐龙化石粉末的消化情况。
(3)通过检测消化液中的成分,了解恐龙的生理特点。
五、实验结果与分析1. 恐龙化石成分分析通过化学成分分析,发现恐龙化石中含有大量的钙、磷、碳、氢、氧等元素,以及少量的氮、硫、铁等元素。
这些元素构成了恐龙的骨骼、牙齿、肌肉等组织。
2. 恐龙蛋白质提取与电泳分析通过酶解法提取恐龙化石中的蛋白质,进行电泳分析,发现恐龙蛋白质具有以下特点:(1)蛋白质分子量较大,属于高分子量蛋白质。
(2)蛋白质种类丰富,包括酶、抗体、激素等。
(3)蛋白质具有一定的空间结构,具有生物活性。
3. 恐龙生理实验在模拟消化系统中加入酶制剂,观察恐龙化石粉末的消化情况。
结果显示,恐龙化石粉末在消化过程中,蛋白质、脂肪、碳水化合物等营养物质得到有效分解。



2012年8月理科综合化学实验部分(1)1.(15分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)I.按照乙同学的观点,请写出Na2CO3溶液和CuSO4溶液反应的离子方程式:____________________________________________.Ⅱ.在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是。
并用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)装置B中所装试剂是________ ____________。
(2)能证明乙同学观点正确的实验现象是__________________________。
Ⅲ.若CuCO3和Cu(OH)2两种沉淀都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
(3)各装置连接顺序为__________接________接________接_______接_________。
(4)装置C中碱石灰的作用是______ __________,实验开始时和实验结束时都要通入过量的空气,其作用分别是________ ___。
(5)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为_________。
2.25.(15分)铜在潮湿空气中会产生铜绿,铜绿的主要成分是碱式碳酸铜,其化学式为Cu2(OH)2CO3。
(1)现用下列仪器(除铁架台等夹持仪器外)验证碱式碳酸铜分解的非固体产物,仪器接口顺序是(填字母),仍需补充的玻璃仪器是,实验过程中甲装置内盛放的物质是(填化学式,下同),乙装置内盛放的是。
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:①所得滤液中各种离子的物质的量浓度由大到小的顺序是。

2012毕业论文实验记录合成BMI一.二氨基二苯甲烷双马来酰亚胺实验步骤A组分(顺丁烯二酸酐10.25g 丙酮50ml 水0.5ml)B组分(二氨基二苯甲烷9.9g 丙酮25ml)C组分(乙酸酐15g约14ml 三乙胺 1.75g约2.4ml 乙酸镍0.1g)D组分(水62.5ml)1.在三口瓶中加入A组分(室温)待顺丁烯二酸酐完全溶解加入B组分,2.B组分分0.5h-0.75h滴加到三口烧瓶中去3.继续搅拌0.5h后将C组分逐个加入到反应容器中去4.继续升温至60-65℃保温回流2h5.冷水浴5℃以下后将62.5ml水用15min中滴加到容器中去6.继续搅拌0.5h过滤水洗俩次加入到5%NaHCO3(100ml-150ml)7.放置过夜得BMI水洗至中性于烘箱中80℃烘干实验过程及现象2011.10.2410:10 开始反应10.25g顺丁烯二酸酐+50ml丙酮+0.5ml的水10:44 组分B滴加完毕,继续搅拌0.5h11:12 依次加入乙酸镍(0.1g)三乙胺(2.4ml)乙酸酐(14ml)11:53 物料完全透明,保温回流2h16:00 62.5ml水滴加完毕,温度维持5℃左右此时BMI呈黄色颗粒析出,继续搅拌0.5h 过滤水洗两次后加入到200ml 5%NaHCO3溶液中放置过夜2011.10.25过滤水洗至中性得到BMI M=359 理论产量17.9g 实际产量14.5g 产率为81%二.己二胺双马丙酮法A组分(顺丁烯二酸酐10.25g 丙酮50ml 水0.5ml)B组分(己二胺 5.8g 丙酮5. 25ml)C组分(乙酸酐15g约14ml 三乙胺 1.75g约2.4ml 乙酸镍0.1g)D组分(水62.5ml)1.在三口瓶中加入A组分(室温)待顺丁烯二酸酐完全溶解加入B组分,2.B组分分0.5h-0.75h滴加到三口烧瓶中去3.继续搅拌0.5h后将C组分逐个加入到反应容器中去4.继续升温至60-65℃保温回流2h5.冷水浴5℃以下后将62.5ml水用15min中滴加到容器中去6.继续搅拌0.5h过滤水洗俩次加入到5%NaHCO3(100ml-150ml)7.放置过夜得BMI水洗至中性于烘箱中80℃烘干实验过程及现象2011.10.2510:55 开始滴加B组分(己二胺+丙酮)11:30 结束滴加B组分12:00 加入C组分升温至60℃-65℃,有大量的浅黄色浑浊12:15 变透明呈咖啡色继续回流保温2h14:19 开始冰水浴,至5℃以下,开始滴加62.5ml水,此时有少量的深褐色的颗粒析出14:50 滴加水结束过滤得到少量固体碱洗产物溶解理论产物M=276 理论产量13.8g改进方案1.改用水洗 2.增加乙酸酐、乙酸镍、反应时间(无产物)2011.10.2810:10 将组分A(顺丁烯二酸酐10.25g+丙酮50ml+水0.5ml)加入到250ml三口烧瓶中10:30 开始滴加B组分(5.8g己二胺+25ml丙酮)在0.5h~1h内滴加到烧瓶中去11:00 滴加完成继续搅拌0.5h11:30 依次加入C组分到反应容器中去升温至60~65℃11:50 反应物呈透明状开始保温回流2h反应物呈咖啡色13:50 用冰水浴冷却至5℃以下,于20min内将62.5ml水滴加到瓶内,有少量深褐色的颗粒状物体析出,继续搅拌0.5h15:00 过滤水洗,干燥,得到BMI(粘稠状深褐色)增加三乙胺的用量(原始用量的3倍)得到深褐色粉末状产物均相法(己二胺)2011.11.22药品:M(结晶乙酸钠)=136 乙酸酐密度=o.9279g/cm3己二胺116 0.25mol 29g乙酸钠136 0.275mol 37.4gDMF 100ml乙酸酐102 0.5mol 51g(55ml)顺丁烯二酸酐98 0.5mol 49g实验过程及现象9:45 将0.25ml己二胺和0.275mol乙酸钠放入100ml的DMF溶剂中进行反应,缓慢加入0.5mol的顺丁烯二酸酐(每10min加入1分约10g左右)11:00 加入0.5mol 乙酸酐随着乙酸酐的加入颜色呈深褐色反应1h12:00 将上述混合物水洗,抽滤(3次) 干燥得到BMI2011.11.26(同上)二氨基二苯醚双马来酰亚胺实验步骤2011.11.01药品:A组分(顺丁烯二酸酐 4.1g 丙酮20ml 水0.2ml)B组分(二氨基二苯醚4g 丙酮100ml)C组分(乙酸酐6g约5.6ml 三乙胺0.7g约0.96ml 乙酸镍0.1g)D组分(水99.6ml)步骤:10:22 开始滴加B组分11:05 搅拌0.5h,添加C组分11:36 升温至60~65℃12:50 透明,开始搅拌2h,维持温度60—65℃15:00 冷水浴至5℃以下,开始滴加99.6ml的水在20min内滴完,产物成黄色颗粒析出,继续搅拌0.5h15:40 过滤,水洗俩次后,加入200ml 5%的NaHCO3溶液,放置过夜过滤水洗至中性得到产物在80℃烘箱里烘干一次性加入固体二苯醚药品:A组分(顺丁烯二酸酐 4.1g 丙酮120ml 水0.2ml)B组分(二氨基二苯醚4g )C组分(乙酸酐6g约5.6ml 三乙胺0.7g约0.96ml 乙酸镍0.1g)D组分(水99.6ml)步骤:10:22 依次性加入B组分11:05 搅拌0.5h,添加C组分11:36 升温至60~65℃12:50 透明,开始搅拌2h,维持温度60—65℃15:00 冷水浴至5℃以下,开始滴加99.6ml的水在20min内滴完,产物成黄色颗粒析出,继续搅拌0.5h15:40 过滤,水洗俩次后,加入200ml 5%的NaHCO3溶液,放置过夜过滤水洗至中性得到产物在80℃烘箱里烘干扩链二胺合成双马来酰亚胺树脂DMF法药品扩链二胺(自制) 6.7g 0.0185mol乙酸钠 1.64g 0.020mol顺丁烯二酸酐 3.626g 0.037mol乙酸酐 3.774g 0.037mol9:45 将0.0185mol扩链二胺和0.02mol乙酸钠放入100ml的DMF溶剂中进行反应,缓慢加入0.3.626g的顺丁烯二酸酐(每10min加入1分约10g左右)11:00 加入0.037mol 乙酸酐反应1h12:00 将上述混合物水洗,抽滤(3次) 干燥得到白色BMI固体酸度测定1g的二氨基二苯甲烷双马溶于10ml NN-二甲基乙酰胺中起始滴定刻度结束滴定刻度0.15ml 0.45ml3.55ml 3.75ml3.80ml4.00ml4.20ml 4.40ml空白实验1滴1g的己二胺双马溶于10ml NN-二甲基乙酰胺中空白1g的二氨基二苯醚双马溶于10ml NN-二甲基乙酰胺中起始滴定刻度结束滴定刻度17.60ml 17.85ml17.85ml 18.10ml18.10ml 18.35ml1g的二氨基二苯甲烷(提纯)双马溶于10ml NN-二甲基乙酰胺中起始滴定刻度结束滴定刻度0.35ml 0.53ml0.60ml 0.80ml0.80ml 1.00ml1g的二氨基二苯醚(提纯)双马溶于10ml NN-二甲基乙酰胺中起始滴定刻度结束滴定刻度1.45ml 1.68ml1.70ml 1.95ml2.00ml 2.25ml0.4g的己二胺双马溶于40ml NN-二甲基乙酰胺中空白熔点测试二苯醚(未提纯)162℃-173℃二苯醚(提纯)171℃-180℃二苯甲烷(未提纯)170℃-175℃二苯甲烷(提纯)166℃-170℃己二胺(均相、提纯)186℃-188℃己二胺(均相、未提纯)186℃-189℃己二胺(丙酮法、三乙胺4倍量)147℃-151℃己二胺(丙酮法、三乙胺4倍量、提纯)144℃-149℃己二胺(丙酮法、氯化铝作用提纯)199℃-202℃己二胺(丙酮法、氯化铝作用未提纯)205℃-207℃乙二胺双马(均相法)205℃-207℃内扩链二胺双马180℃-194℃。

化学实验1实验报告实验目的通过本次实验,了解常见的化学实验仪器,如试管、滴定管等的使用方法,以及掌握化学反应条件下实验数据处理方法。
实验原理本次实验使用到的是化学反应中的“酸碱反应”,是一种常见的中和反应,反应的基本方程式如下:`酸 + 碱→ 盐 + 水`其中,酸和碱的作用是互相中和,并产生相应的产物,即盐和水。
本次实验主要使用滴定法测量稀盐酸中氢离子的浓度。
具体步骤如下:1. 将稀盐酸放入试管中;2. 加入苯酚指示剂;3. 用钠氢氧化物(NaOH)溶液滴定试管中的稀盐酸,直到出现颜色转变,记录所滴加的NaOH溶液体积;4. 根据酸-碱滴定反应的化学方程式,计算稀盐酸中氢离子的质量浓度。
实验步骤1. 取一定量的稀盐酸样品,加入试管中;2. 在稀盐酸中加入少量苯酚指示剂,搅拌均匀;3. 向滴定管中加入一定量的NaOH溶液,并记录滴加的体积数值,直到试管中颜色发生改变。
实验数据处理在实验过程中,我们记录下了所滴加NaOH溶液的体积数值,通过化学方程式的计算,我们得到了稀盐酸中氢离子的浓度。
具体结果如下:稀盐酸中氢离子的浓度:0.10mol/L实验结论通过本次实验,我们掌握了酸-碱滴定的基本原理和操作方法,并成功完成了稀盐酸中氢离子浓度的测定。
同时,也通过数据处理和计算,深入理解了化学反应中的重要概念和方法。
实验总结在实验过程中,我们需要注意以下几点:1. 实验操作需细心,加入药品量应该准确;2. 滴加NaOH溶液时需慢慢滴加,避免出现溢出的情况;3. 安全第一,实验过程中应戴上手套和护目镜。
总的来说,本次实验让我们对化学实验的基本知识和操作技能有了更深入的了解,也为我们今后的学习和实践奠定了扎实的基础。

2012年3月理科综合生物实验部分(1)1.(11分)将新鲜萝卜磨碎、过滤得到提取液。
在温度30℃的条件下,取等量提取液分别加到四个盛有pH 分别为3、5、7、9的100mL 体积分数为3%的过氧化氢溶液的烧杯中,结果每一个烧杯都产生气体,然后,将加入四个烧杯中提取液的量减半,重复上述实验。
在相同时间内,分别测得两次实验中过氧化氢的含量变化并绘制成图1所示曲线,请回答:(1)该实验的目的是 。
(2)该实验中的自变量是 和 ,因变量是 。
(3)曲线A 和B 中,过氧化氢含量的最低点位于横坐标同一位置的原因是 。
(4)曲线A 是第_______次实验的结果,原因最可能是 (5HCl 2.(12(1)科研人员分别给三只大白鼠注射了A 、B 、C 三种激素后,观察到的相应反应是:A可引起低血糖,甚至昏迷;B 促进蛋白质的合成,并使软骨生长明显;C 使呼吸、心率加快,体内产热量增加,行为亢奋,据此判断激素A 、B 、C 的化学名称依次是 。
将正常大白鼠从室温移至低温环境中,其血糖浓度会升高,原因是在低温刺激下,下丘脑通过相关神经促进 的分泌,进而主要促进 ,使血糖升高.(2)用去除脑但保留脊髓的蛙(称脊蛙)为材料,进行脊蛙反射实验,实验前将蛙头部剪去,其目的是 ,将浸有0.5%硫酸溶液的小纸片贴在脊蛙右后肢下端的皮肤上,可看到 现象,在此反射活动中,兴奋以__ __形式从上一个神经元传到下一个神经元。
若破坏蛙的脊髓,再重复上述实验操作,上述实验现象不出现,其原因是。
(3)右图为用猴进行的科学实验,实验中头部电极刺激大脑皮层某区域引起猴右手运动。
在此反应过程中建立的突触结构类型有神经—神经突触和突触,兴奋在后一突触处传导的机理及效应是。
3.(12分)下图是对一位具有食道完全狭窄的妇女所进行的实验结果。
实验一:让妇女吃下400克麦片粥,但该妇女明显对燕麦粥厌恶;实验二:让该妇女吃下自选的喜爱的食物,如新鲜蔬菜、沙拉、牛奶、土豆、炸鸡腿、烤肉、鸡蛋、蛋糕等。

压力蒸汽灭菌器生物指示剂法验证记录
验证对象 设备编号 安置位置 验证起止日期
生物指示剂菌种 含菌量 供应单位 实验记录:
设备装载内容 生物指示剂放置位置说明:用量 支/次,编号
上
中
下
灭菌条件:温度 ,时间
将生物指示剂取出,直接置于50~60℃培养24~48小时,同时取一支未经灭菌生物指示剂一起培养,作为阳性对照。
培养结果: 培养温度 ℃,培养时间
判定标准:培养后1) 对照管指示剂由紫色变为黄色则本次实验结果有效; 2) 全部保持紫色即灭菌合格;
3) 实验用指示剂由紫色变为黄色判为灭菌不合格。
结论:
操作人 复核人。
西南科技大学
实验报告
课程名称:网络攻防对抗
实验题目: windows网络输入命令
专业班级:
学生姓名:
学生学号:
实验时间: 2015.09.20 指导教师:黄晓芳
1实验目的
(1)了解网络命令的功能、掌握常用网络命令的使用方法(2)能够使用Windows网络命令进行网络故障分析
(3)能够较熟练地使用命令
2 实验原理
(1)命令行就是在Windows操作系统中打开命令提示符窗口,以字符串的形式执行Windows管理程序。
不同的操作系统要用不同的命令进入命令行界面。
(2)在Win8的微软菜单中的查找及选择中键入"cmd"命令,可进入命令行界面。
(3)在Windows的命令行提示符窗口下,可以使用命令后门加上参数“/?”查看该命令的详细说明。
如:“ping /?”命令就可以查看ping命令的详细介绍
3实验步骤
(1)Ping
a.ping –a 10.11.5.62
(图一)
b.ping –n 50 10.11.5.62
c.ping –l 1024 10.11.5.62
(图三)(2)ipconfig
d.ipconfig
e.ipconfig -all
(图五)
(3)net :用于管理网络环境、服务、用户、登陆。
等
本地信息
view
<1>(键入不带参数的net view显示当前域的计算机列表)
<2>net view 10.11.5.62 指定要查看其共享资源的计算机。
(图七)
user 添加或更改用户帐号或显示用户帐号信息。
该
命令也可以写为 net users。
(图八)
send (net send 10.11.5.62 guagua)(打开message
服务,使其自启动)
(图九)
(4)Arp 是一个重要的TCP/IP协议,并且用于确定对应IP 地址的网卡物理地址。
使用arp命令,我们能够查看本地计算机或另一台计算机的ARP高速缓存中的当前内容。
此外,使用arp命令,也可以用人工方式输入静态的网卡物理/IP地址对,
使用这种方式为缺省网关和本地服务器等常用主机进行这项操作,有助于减少网络上的信息量。
(图十)
(5)Netstat 用于显示与IP、TCP、UDP和ICMP协议相关的统计数据,一般用于检验本机各端口的网络连接情况。
(图十一)
(6)Tracert 互联网中,信息的传送是通过网中许多段的传输介质和设备(路由器,交换机,服务器,网关等等)从一端到达另一端。
每一个连接在Internet上的设备,如主机、路由器、接入服务器等一般情况下都会有一个独立的IP地址。
通过Traceroute我们可以知道信息从你的计算机到互联网另
一端的主机是走的什么路径。
(图十二)
(7)Nslookup 是一个监测网络中DNS服务器是否能正确实现域名解析的命令行工具。
(图十三)
4 实验分析
(1)对cmd命令行的使用时,如果有什么不清楚的命令参数可以使用“?”来对命令进行帮助查看
(2)一般涉及到tracert命令的都可以直接访问一个网站,如。
(3)tracert和ping的区别
ping和tracert使用方法都一样,在命令后面加IP地址或者域名。
ping 主要是用来查看到目的地址的时延和丢包情况,tracert是用来查看所经过的每一跳路由,可以具体判断时延变大或者丢包的点
5总结
我们在学习使用简单的windows命令时,应该仔细的研究他每一条命令对于我们学习网络的攻防对抗时的作用,学会使用简单的命令检查本地主机和可访问主机的内容,学会使用简单的命令对计算机进行学习性地网络攻击和防御。