铝钠铁铜方程式框图
- 格式:ppt
- 大小:153.50 KB
- 文档页数:4
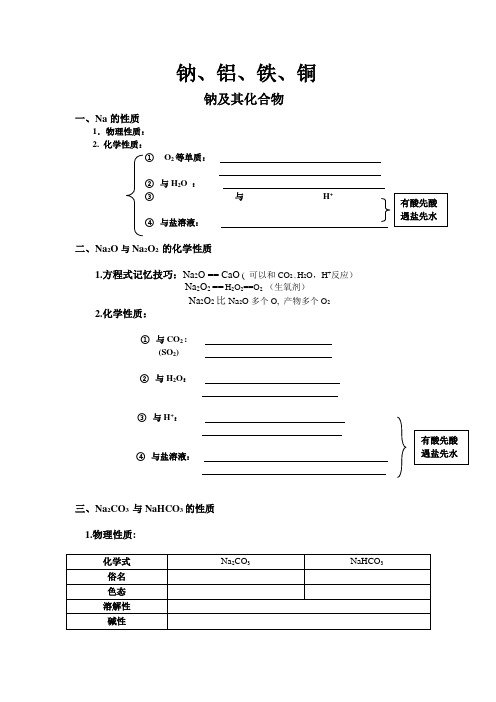
钠、铝、铁、铜 钠及其化合物一、Na 的性质1.物理性质:2. 化学性质:①O 2等单质:② 与H 2O : ③ 与H + :④ 与盐溶液:二、Na 2O 与Na 2O 2 的化学性质1.方程式记忆技巧:Na 2O == CaO ( 可以和CO 2 , H 2O ,H +反应) Na 2O 2 == H 2O 2==O 2 (生氧剂)Na 2O 2比Na 2O 多个O, 产物多个O 2 2.化学性质:① 与CO 2 : (SO 2)② 与H 2O :③ 与H +: ④ 与盐溶液:三、Na 2CO 3 与NaHCO 3的性质1.物理性质:化学式 Na 2CO 3NaHCO 3俗名 色态溶解性 碱性有酸先酸遇盐先水有酸先酸 遇盐先水2. 化学性质:①热稳定性:Na2CO3 >NaHCO3不分解②与H+:③与NaOH:Na2CO3 NaHCO3不反应④与Ca(OH)2:或Ba(OH)2⑤与可溶性Ca盐或Ba盐:NaHCO3Na2CO3不反应3. 两者的鉴别:CO3①NaNaHCO3②Na2CO3 过量酸NaHCO3③Na2CO3 逐滴酸NaHCO3④可溶性Ca盐或Ba盐:Na2CO3 盐溶液NaHCO34. 两者的相互转化Na2CO3 NaHCO3四、焰色反应(物理方法)Na+ 黄K+ (紫--蓝色钴玻璃)(1)待测液:含有某元素的溶液(不能判别是分子,原子还是离子,只能判断元素种类)(2)金属丝:铂丝(铁丝、镍丝、钨丝等来熔点高金属丝代替).但不能用铜丝(绿色火焰干扰).(3)盐酸:去除金属丝表面的氧化物.(4)蓝色的钴玻璃:观察钾的焰色(因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰)(5)操作过程:洗烧蘸烧金属丝金属丝至无色待测液金属丝,看颜色习题1. (2009·浙江)用N A表示阿伏加德罗常数的值,下列说法正确的是()A. 标准状况下,5.6L一氧化氮和5.6L氧气混合后的分子总数为0.5N AB. 1mol乙烷分子含有8N A个共价键C. 58.5g的氯化钠固体中含有N A个氯化钠分子D. 在1L 0.1mol/L碳酸钠溶液中,阴离子总数大于0.1N A2. 下列反应中,Na 2O 2只表现强氧化性的是( ) A. 2Na 2O 2+2CO 2===2Na 2CO 3+O 2 B. Na 2O 2+MnO 2===Na 2MnO 4C. 5Na 2O 2+2MnO 4-+16H +===10Na ++2Mn 2++5O 2↑+8H 2OD. 2Na 2O 2+2H 2SO 4===2Na 2SO 4+O 2↑+2H 2O3. 将a 1gNa 2O 溶于b 1g 水中,a 2gNa 2O 2溶于b 2g 水中,均得到溶质质量分数为8%的溶液,若a 1:a 2=31:39,则b 1:b 2为( )A. 1:1B. 1:2C. 2:3D.1:34. 将钠、钾分别投入相同质量的稀H 2SO 4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为( )A.2338:2239 B. 2238:2339 C. 11:2339 D. 2339:22385. 把2.1g 的CO 与H 2组成的混合气体与足量的O 2充分燃烧后,立即通入足量的Na 2O 2固体中,固体的质量增加( )A. 2.1gB. 3.6gC. 7.2gD. 无法确定6. 碱金属氢化物为白色晶体,其中H -有很强的还原性,因此常用氢化钠在高温下将TiCl 4还原为Ti ,写出其化学方程式 ;MH 能与水剧烈反应MH+H 2O=MOH+H 2↑,MH 与液氨也有类似反应,写出反应方程式。

初中化学下册各单元知识网络结构图金属和金属材料纯金属金属材料(铝、铁铜银等)合金与纯金属相比较优点是:定义合金生铁和钢。
常见铜锌合金物性:有光泽,质地,导电性,延展性,导热性。
金金属与氧气反应:性质化性:与酸反应:属于置换反应与盐反应:反应的依据:。
①可判断金属的化学活动性;属金属活动顺序②可判断金属能否与酸反应生成氢气;和(应用) ③可判断金属能否与盐溶液反应;金湿法炼铜原理:CuSO4 + Fe == FeSO4 + Cu属原料:材金属原理:(用方程式表示).料冶炼铁的冶炼设备:产品:铁生锈的条件:铁与空气中的、等物质发生反应化学反应而生锈。
铁锈主要成分是:Fe2O3金属资防止铁生锈措施:①保持铁制品表面的干燥和洁净;②源保护溶液特征:、;组成:由溶质和溶剂组成。
体积:溶质和溶剂的体积之和,其质量溶质和溶剂质量之和。
浓溶液粗略(不限定条件)稀溶液分类饱和溶液: 给定温度条件下不饱和溶液:。
溶比较其它混合液乳浊液乳化现象.放热现象:例NaOH固体、浓H2SO4等溶于水.溶解时现象吸热现象:例NH4NO3固体溶于水.液概念:溶质溶解性固体溶解度影响因素:温度、溶质和溶剂的性质.能的量度溶解度曲线.概念:量度气体溶解度影响因素温度:随温度而。
压强:随压强而。
含溶质的浓度溶质的质量分数的计算式:。
量的量度配制时用到仪器:烧杯、量筒、托盘天平、玻璃棒、胶头滴管等.配制质量分数一定溶液骤:、、、。
液体+ 固体(不溶于水)过滤混合物分离固体+ 固体(其一可溶)①液体 + 固体(可溶于水)结晶②KNO3 + NaCl 分离出NaCl采用蒸发结晶。
③KNO3 + NaCl 分离出KNO3采用冷却结晶。
常见的酸和碱,易挥发.酸浓硫酸常用作干燥剂。
酸使紫色石蕊试液变色。
酸使无色的酚酞试液色。
氢气例:;属氧化物→盐+ 水水例:;⑤酸 + 盐→新盐 + 新酸例:;氢氧化钠NaOH 物性:白色固体、极易溶于水(放热)、易潮解。
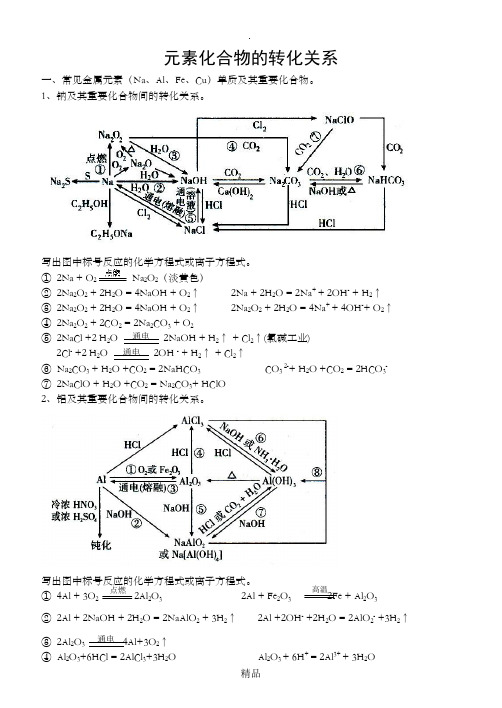
元素化合物的转化关系一、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
① 2Na + O 2 Na 2O 2(淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2↑ ③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na + + 4OH -+ O 2↑ ④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 2NaOH + H 2↑ + Cl 2↑(氯碱工业)2Cl - +2 H 2O 2OH - + H 2↑ + Cl 2↑⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3 CO 3 2-+ H 2O +CO 2 = 2HCO 3- ⑦ 2NaClO + H 2O +CO 2 = Na 2CO 3+ HClO2、铝及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
① 4Al + 3O 2 2Al 2O 3 2Al + Fe 2O 3 2Fe + Al 2O 3 ② 2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑ 2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑③ 2Al 2O 3 4Al+3O 2↑④ Al 2O 3+6HCl = 2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O通电 通电 通电 点燃 高温⑤ Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH - = 2AlO 2- + H 2O ⑥ AlCl 3 +3NH 3·H 2O = Al(OH)3↓+ 3NH 4Cl Al 3+ + 3 NH 3·H 2O = Al(OH)3↓+ 3NH 4+ AlCl 3 +3Na OH = Al(OH)3↓+ 3NaCl Al 3+ + 3OH - = Al(OH)3↓ ⑦ Al(OH)3 + NaOH =NaAlO 2 +2 H 2O Al(OH)3 + OH - = AlO 2- +2H 2O ⑧ Al 3+ +3 AlO 2- +6H 2O = 4Al(OH)3↓3、铁及其重要化合物间的转化关系。

知识归纳:高中化学钠铝铁及化合物思维导图与化学方程式总结今天给大家分享钠、铝、铁的化合物相关知识~一、钠的化合物1. Na2O(1)Na2O与水的反应Na2O+H2O==2NaOH(2)Na2O与CO2的反应Na2O+CO2==Na2CO3(3)Na2O + SO2= Na2SO3(4)与酸发生反应Na2O+2HCl==2NaCl+H2O2. Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。
(1)过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O==4NaOH+O2↑NaOH溶液反应HCO3-+OH-==H2O+CO32-与Ca(OH)2溶液反应Ca(OH)2+Na2CO3==CaCO3↓+2NaOH也能反应生成CaCO3沉淀Ca2++CO32-==CaCO3↓与CaCl2溶液反应不反应有CaCO3沉淀用途发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)相互转化Na2CO3+CO2+H2O==2NaHCO32NaHCO3==Na2CO3+H2O+CO2↑NaHCO3+NaOH==Na2CO3+H2ONaHCO3+NaOH==Na2CO3+H2O附:钠及其化合物思维导图二、铝的化合物1.Al2O3的性质Al2O3俗名矾土,氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。
Al2O3是两性氧化物,既能与强酸反应,又能与强碱反应Al2O3+ 6HCl====2AlCl3+3H2O(Al2O3+6H+====2Al3++3H2O)Al2O3+ 2NaOH====2NaAlO2+H2O(Al2O3+2OH-====2AlO2-+H2O)2. 氢氧化铝 Al(OH)3氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。

钠的有关反应方程式、1、Na+O 2常温:4Na+O 2==2Na 2O2、Na+O 2加热:2Na+O 2==Na 2O 23、Na 与Cl 2反应:2Na +Cl 2===2NaCl4、Na 与S 反应:2Na+S=== Na 2S5、Na 与水反应:2Na+ 2H 2O== 2NaOH+H 2↑6、Na 与HCl 反应: △点燃2Na+2HCl==2NaCl+H 2↑7、Na 与CuSO 4溶液反应:2Na+ 2H 2O+ CuSO 4==Cu (OH )2↓+Na 2SO 4+ H 2↑8、Na 与FeCl 3溶液反应:6Na+ 6H 2O+2FeCl 3==2Fe (OH )3↓+6NaCl+ 3H 2↑ 9、Na 2O 与H 2O 反应:Na 2O+H 2O==2NaOH10、Na 2O 与CO 2反应:Na 2O+CO 2== Na 2CO 311、Na 2O 在空气中加热 :2Na 2O + O 2== 2Na 2O 2 △△12、Na2O2与H2O反应:2Na2O2+2H2O==4NaOH+O2↑13、Na2O2与CO2反应:2Na2O2+2CO2== 2Na2CO3+ O2↑14、Na2CO3溶液与少量HCl溶液反应:Na2CO3+HCl(少量)=NaCl+ NaHCO315、Na2CO3溶液与过量HCl溶液反应:Na2CO3+2HCl(过量)=2NaCl+ H2O+CO2↑16、Na2CO3溶液中通过量CO2气体:Na2CO3 +CO2+H2O=2NaHCO317、Na2CO3溶液与CaCl2溶液:Na2CO3+ CaCl2=CaCO3↓+2NaCl18、Na2CO3溶液与Ba(OH)2溶液反应:Na2CO3+ Ba(OH)2= BaCO3↓+2NaOH19、NaHCO3溶液与HCl溶液反应:HCO3-+H+=CO2↑+H2O20、NaHCO3溶液与NaOH溶液:NaHCO3+NaOH= Na2CO3+ H2O21、NaHCO3溶液与少量Ba(OH)2溶液反应:2NaHCO3+ Ba(OH)2少=Na2CO3+BaCO3↓+2H2O 22、NaHCO3与过量Ba(OH)2溶液:NaHCO3+ Ba(OH)2过=NaOH+BaCO3↓+H2O23、NaHCO 3受热分解:2NaHCO 3=== Na 2CO 3 +CO 2↑+H 2O24、Ca (HCO 3)2与少量NaOH 溶液反应:Ca (HCO 3)2+NaOH (少)=CaCO 3↓+NaHCO 3+H 2O25、Ca (HCO 3)2与过量NaOH 溶液反应:Ca (HCO 3)2+2NaOH (多)=CaCO 3↓+Na 2CO 3+2H 2O26、Mg 在CO 2气体中燃烧:2Mg+ CO 2==== C+2MgO27、Mg 与沸水反应:Mg+2H 2O=== Mg (OH )2+H 2↑铝及其化合物的反应方程式: △点燃 △1、Al 与O 2反应:4Al +3O 2=2Al 2O 32、Al 与Cl 2反应:2Al +3Cl 2==2AlCl 33、Al 与Fe 3O 4高温下反应:8Al+3 Fe 3O 4===9 Fe+4Al 2O 34、Al 与沸水反应: 2Al +6H 2O===2 Al (OH )3+3H 2↑5、Al 与盐酸反应:2Al +6HCl==2AlCl 3+3H 2↑6、Al 与NaOH 溶液反应2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑7、Al 与Ba (OH )2溶液:2Al+ Ba (OH )2 +2H 2O=Ba (AlO 2)2 +3H 2↑8、Al 2O 3与盐酸反应:Al 2O 3+6HCl=2AlCl 3+ 3H 2O9、Al 2O 3与NaOH 溶液反应:高温 点燃 △Al2O3+2NaOH=2NaAlO2+ H2O10、Al2O3与Ba(OH)2溶液反应:Al2O3+ Ba(OH)2=Ba(AlO2)2+ H2O 11、Al(OH)3与盐酸溶液反应:Al(OH)3+3H+=Al3++ 3H2O12、Al(OH)3与NaOH溶液反应:Al(OH)3+OH-=AlO2-+2H2O13、Al(OH)3受热分解:△2Al(OH)3=== Al2O3+ 3H2O14、AlCl3溶液与少量的NaOH溶液:Al3++3OH-(少量)=Al(OH)3↓15、AlCl3溶液与过量NaOH溶液反应:Al3++4OH-(过量)== AlO2-+2H2O16、Al2(SO4)3与过量氨水:Al3++3NH3·H2O =Al(OH)3↓+3NH4+17、Al2(SO4)3溶液与少量的Ba(OH)2溶液反应:Al2(SO4)3+3Ba(OH)2(少量)= 2Al(OH)3↓+3BaSO4↓18、Al2(SO4)3溶液与过量的Ba(OH)2溶液反应Al2(SO4)3+4Ba(OH)2(过量)= Ba(AlO2)2+3 BaSO4↓+4H2O 19、KAl(SO4)2溶液与少量的Ba(OH)2溶液反应2KAl(SO4)2+3Ba (OH)2(少量)=K2SO4+3BaSO4↓+2Al(OH)3↓20、KAl(SO4)2溶液与过量的Ba(OH)2溶液反应KAl(SO4)2+2Ba(OH)2(过量)=KAlO2+2BaSO4↓+2H2O铁及其化合物的有关化学方程式:1、Fe 在O 2中燃烧:3Fe+2O 2====Fe 3O 42、Fe 在Cl 2中燃烧:2Fe+3Cl 2====2FeCl 33、Fe 与S 反应:Fe+S===FeS4、Fe 与高温水蒸气反应:3Fe+4H 2O(g)====Fe 3O 4+4H 25、Fe 与盐酸溶液反应:Fe+2HCl=FeCl+H 2↑6、Fe 与CuSO 4溶液反应: 点燃点燃 高温Fe+CuSO 4=FeSO 4+Cu7、Fe 与AgNO 3溶液反应:Fe+2AgNO 3 =Fe (NO 3)2+2Ag8、Fe 与FeCl 3溶液反应: Fe+2FeCl 3=3FeCl 29、FeO 在空气中受热发生反应:6FeO+O 2===2Fe 3O 410、FeO 与CO 高温加热:FeO+CO====Fe+CO 2↑11、FeO 与H 2高温加热:FeO+H 2==== Fe+H 2O12、FeO 与Al 高温加热: △ △高温 高温3FeO+2Al====Al 2O 3+3Fe13、Fe 2O 3与CO 高温加热14、Fe 2O 3与H 2高温加热15、Fe 2O 3与Al 高温加热16、Fe 3O 4与CO 高温加热17、Fe 3O 4与H 2高温加热18、Fe 3O 4与Al 高温加热:3Fe 3O 4+8Al====4Al 2O 3+9Fe19、FeO 与盐酸溶液反应:FeO+2HCl==FeCl 2+H 2O20、Fe 2O 3与盐酸溶液反应: 高温 高温Fe2O3+6H+==2Fe3++3H2O21、Fe(OH)2在空气中被氧化:4Fe(OH)2+O2+2H2O===4Fe(OH)322、Fe(OH)3受热分解:△2Fe(OH)3=== Fe2O3+3H2O23、Fe(OH)3与盐酸反应:Fe(OH)3+3H+==Fe3++3H2O24、FeCl3溶液与NH3·H2O溶液反应:Fe3++3NH3·H2O== Fe(OH)3↓+3NH4+25、Fe2(SO4)3溶液与NaOH溶液反应:Fe2(SO4)3+6 NaOH==2Fe(OH)3↓+3Na2SO426、FeCl3溶液与氢硫酸(H2S水溶液)的反应:2FeCl3+H2S==2FeCl2+2HCl+S↓27、FeCl3溶液与KI溶液反应:2FeCl3+2KI==2FeCl2+2KCl+I228、Fe2(SO4)3溶液与Na2SO3溶液反应:Fe2(SO4)3+ Na2SO3+ H2O==2FeSO4+ Na2SO4+ H2SO4 29、FeCl3溶液与Fe粉反应:2FeCl3+Fe== 3FeCl230、Fe2(SO4)3溶液与过量的Cu粉反应:Fe2(SO4)3+Cu==2FeSO4+CuSO431、FeCl3溶液与过量的Zn粒反应:2FeCl3+3Zn===3ZnCl2+2Fe32、Fe2(SO4)3溶液与金属Na的反应:Fe2(SO4)3+6Na+ 6H2O == 2Fe(OH)3↓+ 3Na2SO4+3 H2↑33、FeCl3溶液与KSCN溶液的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl34、FeCl2溶液与过量的NaOH溶液反应:FeCl2+2NaOH== Fe(OH)2↓+2NaCl35、FeSO4溶液与过量的氨水反应:FeSO4+2NH3·H2O== Fe(OH)2↓+(NH4)2 SO437、FeCl2溶液中滴加氯水(Cl2的水溶液):2FeCl2+ Cl2===2FeCl3。

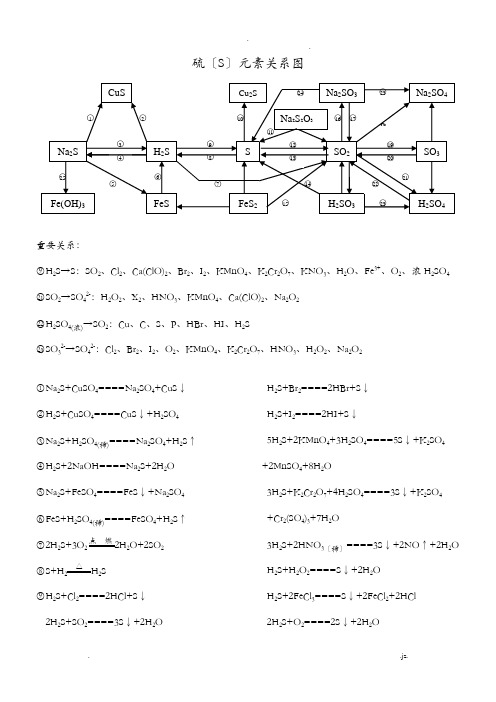
硫〔S〕元素关系图重要关系:○9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4 ○21SO2→SO42-:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2○22H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S○23SO32-→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2○1Na2S+CuSO4====Na2SO4+CuS↓○2H2S+CuSO4====CuS↓+H2SO4○3Na2S+H2SO4(稀)====Na2SO4+H2S↑○4H2S+2NaOH====Na2S+2H2O○5Na2S+FeSO4====FeS↓+Na2SO4○6FeS+H2SO4(稀)====FeSO4+H2S↑○72H2S+3O点燃2H2O+2SO2○8S+H2△ H2S○9H2S+Cl2====2HCl+S↓2H2S+SO2====3S↓+2H2OH2S+Br2====2HBr+S↓H2S+I2====2HI+S↓5H2S+2KMnO4+3H2SO4====5S↓+K2SO4+2MnSO4+8H2O3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO4+Cr2(SO4)3+7H2O3H2S+2HNO3〔稀〕====3S↓+2NO↑+2H2O H2S+H2O2====S↓+2H2OH2S+2FeCl3====S↓+2FeCl2+2HCl2H2S+O2====2S↓+2H2OH2S+H2SO4〔浓〕====SO2↑+S↓+2H2O2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl○10S+2Cu△Cu2S○11Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O ○12S+O点燃SO2○133SO2+2Na2S====3S↓+2Na2SO3○14H2SO3+2H2S====3H2O+3S↓○154FeS2+11O2Fe2O3+8SO2○16SO2+2NaOH====Na2SO3+H2OH2O+2Na2CO3+SO2〔少量〕====Na2SO3+2NaHCO3Na2CO3+SO2〔适量〕====Ma2SO3+CO2○17Na2SO3〔s〕+H2SO4(浓)====Na2SO4+SO2↑+H2O○18SO2+Na2O2====Na2SO4SO2+2NaClO+H2O====Na2SO4+2HCl○192SO2+O催化剂450℃2SO3○205SO3+2P△P2O5+5SO2○21SO2+H2O2====H2SO4SO2+X2+2H2O====H2SO4+2HX(X=Cl、Br、I)2SO2+O2+2H2O====2H2SO43SO2+2HNO3〔稀〕+2H2O====2NO+3H2SO4 5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4○222H2SO4(浓)+Cu====CuSO4+SO2↑+2H2O2P+5H2SO4〔浓〕2H3PO4+5SO2↑+2H2OC+2H2SO4〔浓〕CO2↑+2SO2↑+2H2OS+2H2SO4〔浓〕3SO2↑+2H2O2HBr+H2SO4〔浓〕====Br2+SO2+2H2O2HI+H2SO4〔浓〕====I2+SO2+2H2O○23SO32-+Cl2+H2O====SO42-+2Cl-+2H+2H2SO3+O2====2H2SO42Na2SO3+O2====2Na2SO4○24Na2SO3+2Na2S+3H2SO4====3S↓+3Na2SO4 +3H2O○253Na2S+2FeCl3+H2O====6NaCl+3H2S↑+2Fe(OH)3↓氯〔Cl〕元素关系图重要关系:○12HCl→Cl2:MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2 Cl2→Cl-:H2S、SO2、SO42-、Br-、I-、Fe2+○1Cl2+2FeCl2====2FeCl32Fe+3Cl2FeCl3〔冒棕褐色烟〕○2Cl2+Cu CuCl2〔冒棕黄色烟〕○3Cl2+2I-====I2+2Cl-○4Cl2+2Br-====Br2+2Cl-○5Cl2+SO2+2H2O====2HCl+H2SO4○63Cl2+6KOH KClO3+5KCl+H2O○7Cl2+2NaOH====NaCl+NaClO+H2O○8NaClO+HCl(浓)====Cl2↑+NaOHNaClO+NaCl+H2SO4====Na2SO4+Cl2↑+H2O ○9Cl2+H2O====HCl+HClO○102NaCl+2H2O Cl2↑+H2↑+2NaOH2NaCl+MnO2+3H2SO42NaHSO4+MnSO4+Cl2↑+2H2O○112Na+Cl2NaCl 〔冒白烟〕H2O+Cl2+Na2CO3〔足量〕====NaCl+NaClO+ 2NaHCO3Na2CO3+H2O+2Cl2〔足量〕====2NaCl+2HClO +CO2↑○124HCl〔浓〕+MnO2MnCl2+2H2O+Cl2↑2KMnO4+16HCl〔浓〕====2KCl+2MnCl2+5Cl2↑+8H2OKCr2O7+14HCl〔浓〕====2KCl+2CrCl3+3Cl2↑+2H2OKClO3+6HCl〔浓〕====KCl+3Cl2↑+3H2OCa(ClO)2+4HCl〔浓〕====CaCl2+2Cl2↑+2H2O ○13Cl2+H点燃2HClH2S+Cl2====2HCl+SH2+Cl2HClNa2SO3+Cl2+H2O====Na2SO4+2HCl2FeCl2+Cl2====2FeCl3○14HCl+NH3====NH4Cl 〔冒白烟〕○15NH4Cl NH3↑+HCl↑○16HCl+AgNO3====HNO3+AgCl↓○17HCl+NaOH====NaCl+H2OHCl+NaHCO3====NaCl+CO2↑+H2O○182HClO光照2HCl↑+O2↑○19Ca(ClO)2+2HCl====CaCl2+2HClOCa(ClO)2+CO2+H2O====CaCO3+2HClO ○20NaOH+HClO====NaClO+H2OHClO+Na2CO3====NaClO+2NaHCO3○212Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O 5Cl2+I2+6H2O====2HIO3+10HCl○223Cl2+8NH3====N2+6NH4Cl氧〔O〕元素关系图○12O3====3O2O3+2KI+H2O====2KOH+I2+O2○23O放电2O3○3O3+H2S====H2O+O2+S↓○42H2O2H2↑+O2↑2H2O+2F2====4HF+O2○5O2+2H点燃2H2OO2+2Cu+2H2SO4====2CuSO4+2H2O O2+2H2S====2S↓+2H2O○62H2O2MnO2 2H2O+O2↑重要关系:○4H2O→O2:F2、电解○6H2O2→O2:KMnO4、MnO2○7H2O2→H2O:I-、S2-、SO42-、Fe2+ 85H2O2+2KMnO4+3H2SO4====K2SO4+2MnSO4+5O2↑+8H2O○72H2O2MnO22H2O+O2↑H2O2+H2S====S↓+2H2OH2O2+2KI+H2SO4====K2SO4+I2+2H2OH2O2+Na2SO3====Na2SO4+H2OH2O2+2FeSO4+H2SO4====Fe2(SO4)3+2H2O ○82H2O+Na2O2====2NaOH+H2O2BaO2+H2SO4〔稀〕低温H2O2+BaSO4↓○9O2+2Na点燃Na2O2○102Na2O2+2CO2====2Na2CO3+O2↑2Na2O2+2H2O====4NaOH+O2↑○11Na2O2+H2SO4(稀)====Na2SO4+H2O2 Na2O2+2H2O低温2NaOH+H2O2○12H2O2+SO2====H2SO4○13Na2O2+SO2====Na2SO4氮(N)元素关系图重要关系:○20HNO3(稀)→NO:HBr、HI、H2S、SO2、SO32-、Fe2+、Fe、Cu、Ag○26HNO3(浓)→NO2:HBr、HI、H2S、SO2、SO32-、Fe2+、S、C、P、Cu、Ag○1Mg3N2+8HCl====3MgCl2+2NH4Cl○22NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2O NH4Cl△NH3↑+HCl↑2NH4Cl+CaO△CaCl2+2NH3↑+H2O ○3NH3+HCl====NH4Cl○4NH3·H2O+HCl====NH4Cl+H2O3NH3·H2O+FeCl3====Fe(OH)3↓+3NH4Cl ○5NH4Cl+H2O====NH3·H2O+H2ONH4Cl+NaOH====NH3·H2O+NaCl○6NH3+H2O====NH3·H2O○7NH3·H2O△NH3↑+H2O○8N2+3H2NH3○94NH3+3O2〔纯〕点燃2N2+6H2O2NH3+3CuO△N2+3Cu+3H2O○10Mg3N2+6H2O====2NH3↑+3Mg(OH)2○113Mg+N Mg3N2○12NaNO2+NH4Cl N2↑+NaCl+2H2O○13N2+O NO○146NO+4NH3△5N2+6H2O○156NO2+8NH3△7N2+12H2O○16NO+NO2+2NaOH====2NaNO2+H2O○172NaNO2+2NaI+2H2SO4====2NO↑+I2+2H2O +2Na2SO42NaNO2+2HCl====2NaCl+NO↑+NO2↑+H2 O○182NO+O2====2NO2○193NO2+H2O====2HNO3+NONO2+2KI+H2O====I2+NO+2KOH○208HNO3〔稀〕+3Cu====3Cu(NO3)2+2NO↑+4H2OFe+2HNO3〔稀〕====Fe(NO3)3+NO↑+4H2O 2HNO3〔稀〕+3H2S====3S↓+2NO↑+4H2O 3Na2SO3+2HNO3〔稀〕====3NaSO4+2NO↑+4H2O2H2O+3SO2+2HNO3〔稀〕====3H2SO4+2NO 6KI+8HNO3〔稀〕====6KNO3+3I2+2NO↑+4H2O3FeCl2+4HNO3====2FeCl3+NO↑+Fe(NO3)2 +2H2O○212HNO2====H2O+NO↑+NO2↑○225NaNO2+2KMnO4+3H2SO4====5NaNO3+K2SO4+2MnSO4+3H2O○232NaNO32NaNO2+O2↑○242NO2+2NaOH====NaNO3+NaNO2+H2O○253NO2+H2O====2HNO3+NO○264HNO3〔浓〕+Cu====Cu(NO3)2+2NO2+2H2O C+4HNO3〔浓〕△CO2↑+4NO2↑+2H2OS+6HNO3〔浓〕△H2SO4+6NO2↑+2H2OP+5HNO3〔浓〕H3PO4+5NO2↑+H2O4HNO见光或受热2H2O+4NO2↑+O2↑○272Cu(NO3)2△2CuO+4NO2↑+O2↑○28HNO3+NaOH====NaNO3+H2O○29NaNO3+H2SO4(浓)微热NaHSO4+HNO3↑○302HNO3+Cu(OH)2====Cu(NO3)2+2H2O○312HNO3〔浓〕+Ag====AgNO3+NO2↑+H2O3Ag+4HNO3〔稀〕====3AgNO3+NO↑+2H2O ○322AgNO3+Cu====Cu(NO3)2+2Ag磷(P)元素关系图○14P+5O点燃2P2O5○22P+3Cl点燃2PCl3○3PCl3+Cl2====PCl5○4PCl3+3H2O====H3PO3+3HCl○52P+3Ca Ca3P2○62P+3H2△2PH3○7Ca3P2+6H2O====3Ca(OH)2+3PH3↑○8PCl5+4H2O====H3PO4+5HCl○9P2O5+3H2O====2H3PO4 ○10Ca(H2PO4)2+H2SO4====2H3PO4+CaSO4○112H3PO4+Ca(OH)2====Ca(H2PO4)2+2H2O ○12Ca(H2PO4)2+Ca(OH)2====2CaHPO4+2H2O ○132CaHPO4+H3PO4====Ca(H2PO4)2○142CaHPO4+Ca(OH)2====Ca3(PO4)2+2H2O ○15Ca3(PO4)2+H3PO4====3CaHPO4○16Ca3(PO4)2+3H2SO4====3CaSO4+2H3PO4 ○172H3PO4+3Ca(OH)2====Ca3(PO4)2+3H2O碳(C)元素、硅(Si)元素关系图○15○1C+2H高温CH4○2CH C+2H2○3CH4+2O CO2+2H2O ○42C+O2COC+CO高温2CO2C+SiO高温Si+2CO↑3C+CaO3000℃CaC2+CO↑C+H2O H2↑+CO↑C+ZnO Zn+CO↑○5C+O点燃CO2C+2CuO△2Cu+CO2↑○6CO2+2Mg点燃2MgO+C ○72C+SiO2高温Si+2CO↑○82CO+O2CO2CO+CuO△Cu+CO2CO+H2O催化剂、△CO2+H2 2CO+Fe2O高温2Fe+3CO2 ○9CO2+C高温2CO○10CO2+Ca(OH)2====CaCO3↓+H2O○11CaCO CaO+CO2↑CaCO3+2HCl====CaCl2+CO2↑+H2O○12CO2+2NaOH====Na2CO3+H2O○13Na2CO3+2H+====2Na++CO2↑○14Na2CO3+Ca(OH)2====CaCO3↓+2NaOH ○15CaCO3+CO2+H2O====Ca(HCO3)2○16Ca(HCO3)2CaCO3↓+CO2↑+H2OCa(HCO3)2+Ca(OH)2====2CaCO3↓+2H2O ○17Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3 +2H2O○18Na2CO3+H2O+CO2====2NaHCO3Na2CO3+HCl====NaHCO3+NaCl○192NaHCO3△Na2CO3+H2O+CO2↑○20Na2CO3+SiO高温Na2SiO3+CO2↑○21Si+2NaOH+H2O====Na2SiO3+2H2↑○22Si+O 2△SiO 2 ○23SiO 2+2C 高温Si+2CO ↑○24Si+2F 2====SiF 4 Si+4HF====SiF 4+2H 2↑○25SiO 2+2NaOH====Na 2SiO 3+H 2O ○26H 2SiO 3△H 2O+SiO 2 ○27Na 2SiO 3+6HF====2NaF+SiF 4+3H 2O ○28Na 2SiO 3+2HCl+H 2O====2NaCl+H 4SiO 4↓ ○29H 4SiO 4====H 2SiO 3+H 2O ○30SiO 2+4HF====SiF 4↑+2H 2O钠(Na)元素关系图○12Na+S Na2S○22Na+O 点 燃Na 2O 2○32Na+2H 2O====2NaOH+H 2↑ ○44Na+O 2====2Na 2O ○52Na+H 2高温2NaH○62NaCl(熔融)2Na+Cl 2↑○72Na+Cl 点 燃2NaCl○8 +H 2O+H 2↑○9NaH+H 2O====NaOH+H 2↑ ○10Na 2O+H 2O====2NaOH ○112Na 2O+O 2△2Na 2O 2○122Na2O2+2H2O====4NaOH+O2↑○132Na2O2+2CO2====2Na2CO3+O2↑○142NaOH+CO2====Na2CO3+H2O○15Na2CO3+Ca(OH)2====2NaOH+CaCO3↓○16Na2CO3+2HCl====2NaCl+H2O+CO2↑○17NaOH+CO2====NaHCO3○182NaCl+2H2O电解2NaOH+H2↑+Cl2↑○19NaOH+HCl====NaCl+H2O○20NaCl+NH3+CO2=H2O====NH4Cl+NaHCO3○21NaHCO3+HCl====NaCl+H2O+CO2↑○22NaHCO3+NaOH====Na2CO3+H2O○23Na2CO3+CO2+H2O====2NaHCO3铝〔Al〕元素关系图○12Al2O3〔熔融〕4Al+3O2↑○24Al+3O2====2Al2O32Al+Fe2O高温2Fe+2Al2O34Al+3MnO高温3Mn+2Al2O32Al+WO W+Al2O3○32Al+6H+====2Al3++3H2↑2Al+3Hg2+====2Al3++3Hg○4Al2O3+6H+====2Al3++3H2O重要关系:○6Al3+→Al(OH)3:OH-、NH3·H2O、CO32-、HCO3-、S2-、HS-、ClO-、AlO2-○11AlO2-→Al(OH)3:H+、CO2、Al3+、Fe3+、HCO3-、NH4+、HSO3-、H2PO4-、Cl2、NO2○5Al(OH)3+3H+====Al3++3H2O○6Al3++3OH-====Al(OH)3↓Al3++3NH3·H2O====Al(OH)3↓+3NH4+2Al3++3CO32-+3H2O====2Al(OH)3↓+3CO2↑Al3++3HCO3-====Al(OH)3↓+3CO2↑2Al3++3S2-+6H2O====2Al(OH)3↓+3H2S↑Al3++3HS-3H2O====Al(OH)3↓+3H2S↑Al3++3ClO-+3H2O====Al(OH)3↓+3HClO Al3++3AlO2-+6H2O====4Al(OH)3↓○7AlO2-+4H+====Al3++2H2O○8Al3++4OH-====AlO2-+2H2O○92Al+2OH-+2H2O====2AlO2-+3H2↑○10Al(OH)3+OH-====AlO2-+2H2O○11AlO2-+H++H2O====Al(OH)3↓2AlO2-+CO2〔少量〕+3H2O====2Al(OH)3↓+CO32-AlO2-+CO2〔足量〕+2H2O====Al(OH)3↓+HCO3-3AlO2-+Fe3++6H2O====3Al(OH)3↓+Fe(OH)3↓AlO2-+HCO3-+H2O====Al(OH)3↓+CO32-AlO2-+NH4++2H2O====Al(OH)3↓+NH3·H2O AlO2-+HSO3-+H2O====Al(OH)3↓+SO32-2AlO2-+Cl2+3H2O====2Al(OH)3↓+Cl-+ClO- 2AlO2-\+3NO2+3H2O====2Al(OH)3↓+NO +2NO3-AlO2-H2PO4-+H2O====Al(OH)3↓+HPO42-○122Al(OH)3Al2O3+3H2O○13Al2O3+2OH-====2AlO2-+H2O铁〔Fe〕元素关系图重要关系:○2Fe→Fe2+:Fe3+、Cu2+、H+、I2○3Fe2+→Fe3+:Cl2、Br2、O2、H2O2、HNO3、MnO4-○4Fe3+→Fe2+:Zn、Fe、Cu、I-、H2S、SO2○6Fe→Fe3+:Cl2、Br2、HNO3、H2SO4〔浓〕△○13Fe3+→Fe(O H)3:OH-、S2-、HS-、CO32-、HCO3-、AlO2-、ClO-○1Fe2++Zn====Fe+Zn2+○2Fe+Cu2+====Cu+Fe2+ Fe+2Fe3+====3Fe2+Fe+2H+====Fe2++H2 Fe+I2====Fe2++2I-○32Fe2++Cl2====2Fe3++2Cl-2Fe2++Br2====2Fe3++2Br-4Fe2++O2+4H+====4Fe3++2H2O2Fe2++H2O2+2H+====2Fe3++2H2O5Fe2++MnO4-+8H+====5Fe3++Mn2++4H2O 3Fe2++NO3-+4H+====3Fe3++NO↑+2H2O ○42Fe3++Zn====2Fe2++Zn2+2Fe3++Cu====2Fe2++Cu2+2Fe3++2I-====2Fe2++I22Fe3++H2S====2Fe2++S↓+2H+2Fe3++SO2+2H2O====SO42-+2Fe2++4H+○52Fe3++3Zn====2Fe+3Zn2+○6Fe+NO3-+4H+====Fe3++NO↑+2H2OFe+6H2SO4〔浓〕△Fe2(SO4)3+3SO2↑+6H2O ○7FeO+2H+====Fe2++H2O○8Fe(OH)2+2H+====Fe2++2H2O○9Fe2++2OH-====Fe(OH)2↓○10Fe3O4+8H+====Fe2++2Fe3++4H2OFe3O4+8HI====3FeI2+I2+4H2O○114Fe(OH)2+O2+2H2O====4Fe(OH)3○123Fe3O4+28HNO3====9Fe(NO3)3+NO↑+14H2 O○13Fe3++3NH3·H2O====Fe(OH)3↓+3NH4+○14Fe(OH)3+3H+====Fe3++3H2O○15Fe2O3+6H+====2Fe3++3H2O○16Fe3++3S-====Fe(S)3○17Fe(OH)隔绝空气、△FeO+H2O○182Fe(OH)3△FeO+H2O○19Fe2O3+3CO高温2Fe+3CO23Fe3O4+8Al9Fe+4Al2O32FeO+Si高温2Fe+SiO2○206FeO+O2△2Fe3O4○213Fe+2O点燃Fe3O43Fe+4H2O(g)Fe3O4+4H2○222Fe〔过量〕+O2FeO 〔炼钢炉中的反响〕○23Fe+S FeS○24FeS2△FeS+S○254FeS2+11O高温2Fe2O3+8SO2○262Fe2++5ClO-+5H2O====2Fe(OH)3↓+4HClO +Cl-6Fe2++3ClO-+3H2O====2Fe(OH)3↓+4Fe3++3Cl-4Fe2++4Na2O2+6H2O====4Fe(OH)3↓+8Na+ +O26Fe2++3Na2O2+6H2O====4Fe(OH)3↓+2Fe3+ +6Na+铜〔Cu〕元素关系图重要关系:○4CuO→Cu:H2、CO、NH3、C、CH3CH2OH○7Cu→Cu2+:O2、HNO3、H2SO4〔浓〕、H2O2、Fe3+ ○16Cu(OH)2→Cu2O:CH3CHO、HCHO、H—COOH○1Cu2(OH)2CO3+4H+====2Cu2++CO2↑+3H2O ○22Cu+S Cu2S○32Cu+O2+CO2+H2O====Cu2(OH)2CO3○4CuO+H2Cu+H2O3CuO+2NH3N2+3Cu+3H2OCuO+CO△Cu+CO2CuO+CH3CH2OH−→−∆Cu+CH3CHO+H2O ○52Cu+O2△2CuO4Cu+2NO24CuO+N2○6Cu2++Zn====Zn2++Cu○72Cu+O2+2H2SO4〔稀〕△2CuSO4+2H2O3Cu+8HNO3〔稀〕====3Cu(NO3)2+2NO↑+4H2OCu+2H2SO4△CuSO4+SO2↑+2H2OCu+H2O2+H2SO4〔稀〕====CuSO4+2H2O 2FeCl3+Cu====CuCl2+2FeCl2○8Cu2(OH)2CO3△2CuO+H2O+CO2↑○94CuO高温2Cu2O+O2↑○10Cu(OH)2△CuO+H2O○11CuO+2H+====Cu2++H2O○12Cu2+H2S====CuS↓+2H+○133CuS+8HNO3〔稀〕====3Cu(NO3)2+3S↓+2NO↑+4H2O○14Cu(OH)2+2H+====Cu2++2H2O○15Cu2++2OH-====Cu(OH)2↓○162Cu(OH)2+R—CHO+NaOH−→−∆R—COONa +Cu2O↓+3H2O2Cu(OH)2+H—COOH+2NaOH−→−∆Na2CO3 +Cu2O↓+4H2O4Cu(OH)2+H—CHO+2NaOH−→−∆Na2CO3 +2Cu2O↓+6H2O○17Cu(OH)2+4NH3====[Cu(NH3)4](OH)2○18Cu2O+2H+====Cu+Cu2++H2O高中化学17≡≡种常见气体的实验室制法Cl2:4HCl+MnO2Cl2+MnCl2+2H2OHCl:2NaCl+H2SO4△Na2SO4+2HClHBr:NaBr+H3PO4△NaH2PO4+HBrHI:KI+H3PO4△KH2PO4+HIO2:2KMnO4K2MnO4+MnO2+O2SO2:Na2SO3+H2SO4====Na2SO4+H2O+SO2 H2S:FeS+H2SO4====FeSO4+H2SNH3:2NH4Cl+Ca(OH)2△2NH3+CaCl2+2H2O N2:NH4NO2△N2+2H2O NO:3Cu+8HNO3====3Cu(NO3)2+2NO+4H2O NO2:Cu+4HNO3====Cu(NO3)2+2NO2+2H2O CO2:CaCO3+2HCl====CaCl2+CO2+H2O CO:HCOOH CO+H2OCH4:CH2COONa+NaOH Na2CO3+CH4 CH2=CH2:C2H5OH浓硫酸、170℃CH2=CH2+H2O CH≡CH:CaC2+2H2O−→−Ca(OH)2+CH≡CH H2:Zn+H2SO4====ZnSO4+H2。

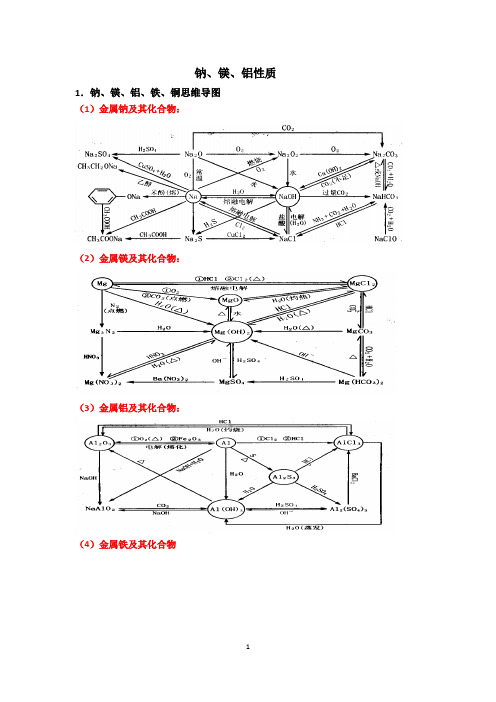
钠、镁、铝性质1.钠、镁、铝、铁、铜思维导图(1)金属钠及其化合物:(2)金属镁及其化合物:(3)金属铝及其化合物:(4)金属铁及其化合物(5写出图中有关反应的化学方程式或离子方程式:2. “铝三角”的图像分析及计算(1)【图像分析】AlCl3溶液中滴加NaOH溶液NaOH溶液中滴加AlCl3溶液AlCl3溶液中滴加氨水NaAlO 2溶液中滴加盐酸 盐酸中滴加NaAlO 2溶液 向NaAlO 2溶液中通CO 2气体(2)【典型例题】向20mL 某物质的量浓度的AlCl 3溶液中滴入2mol/LNaOH 溶液时,得到的Al(OH)3沉淀质量与所加NaOH 溶液体积(mL )的关系如图所示,试回答下列问题:(1)图中A 点表示的意义是(2)图中B 点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g ,则此时用去NaOH溶液的体积为 。
【变式训练1】Al 2(SO 4)3和MgSO 4混和,加适量水溶解,再加入KOH 溶液,析出的沉淀量(W)与KOH 溶液体积(V)的关系如图,则Al 2(SO 4)3和MgSO 4的物质的量之比是A . 2:1B . 1:2C . 1:1D . 1:3【变式训练2】将一定质量的镁铝合金全部溶解在200mL 盐酸中(体积变化不计),取10mL 反应后的溶液,用1mol/LNaOH 溶液滴定得下图关系(1)求Mg 、Al 的质量各是多少?(2)求盐酸的物质的量浓度为多少?【延伸·拓展】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。
现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液中逐滴加入4mol/L NaOH 溶液,所加的NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
⑴图中OC 段没有沉淀生成,此阶段发生反应的离子方程式为: ⑵在DE 段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_________________________。


苏教版高中化学必修一铝铁铜知识点总结文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]一、铝教学目标1.认识铝既能与盐酸反应,又能与氢氧化钠溶液反应。
2.通过比较归纳,使学生了解金属的一般化学性质和特性,从而对金属的化学性质有一个整体的认识。
3、氢氧化亚铁的制法。
教学重点、难点重点:铝与NaOH 溶液的反应,氢氧化亚铁的制法 难点:铝与NaOH 溶液的反应一、金属与合金常温下,除汞外是液体外,其余的均为固体。
大多数金属呈银白色,不透明,有金属光泽,有延展性,均为电和热的良导体。
二、铝(1)铝在常温下能很快被氧化,形成致密的氧化膜,因而具有一定的抗腐蚀性。
(2)跟酸的反应非氧化性酸:2Al + 6HCl = 2AlCl 3 + 3H 2↑强氧化性酸:常温下铝遇浓硫酸或浓硝酸,会在铝表面生成致密的氧化膜而发生钝化。
(3)跟碱的反应铝能和强碱溶液反应。
该反应可理解为铝先和强碱溶液中的水反应生成氢氧化铝,氢氧化铝再和强碱反应生成偏铝酸盐:2Al + 6H 2O = 2Al(OH)3 + 3H 2↑ Al(OH)3 + NaOH = NaAlO 2 + 2H 2O 简写为:2Al + 2H 2O + 2NaOH = 2NaAlO 2 + 3H 2↑高高(4)与氧化物的反应:铝热反应:2Al + Fe 2O 3 ==== Al 2O 3 + 2Fe 2Al + Cr 2O 3 ==== Al 2O 3 + 2Cr 特点: 放出大量热,使生成的金属呈液态。
本质:铝从金属氧化物中夺取氧,表现出很强的还原性。
应用:焊接钢轨和冶炼某些难熔金属(如V 、Cr 、Mn 等)。
(5)制法1)铝土矿制备铝的步骤和原理:步骤:铝土矿 溶解 过滤 酸化 过滤 (NaAlO 2) (Al(OH)3 ) 灼烧 电解 铝 (Al 2O 3 ) ( Al ) 有关反应方程式:溶解:Al 2O 3+2NaOH====2NaAlO 2+H 2O 酸化:NaAlO 2+CO 2+2H 2O=Al(OH)3↓+NaHCO 3 灼烧:2Al(OH)3灼烧Al 2O 3+3H 2O 电解:2Al 2O 3通电4Al+3O 2↑2)实验室制法Al3+跟氨水反应;AlO2+与二氧化碳和水反应 (6)Al 2O 3的两性Al 2O 3+3H 2SO 4====Al 2(SO 4)3+3H 2O Al 2O 3+2NaOH====2NaAlO 2+H 2O (7)铝的氢氧化物Al(OH)3的两性:溶于过量的强酸和强碱 Al(OH)3+NaOH====NaAlO 2+2H 2OAl(OH)3+3HCl====AlCl3+3H2O用途:(1)耐火材料(Al2O3熔点高)(2)冶炼金属铝【例题解析】:例1.(1)100 mL 1 mol·L-1的AlCl3溶液与60 mL 6 mol·L-1的KOH溶液混合后,生成沉淀的质量是_______g。

钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O2HClO NaO6NaClO NaAlO4Na2HClCu(OH)2Al(OH)NaAlO三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑6NaOH2NaO Na2NaOH2NaAlOCO2Na22NaHSONaNO223215、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH↓+NaNO3Fe(OH)3NaOH Al(OH)4NaOH NaAlONaOH NaClNaOH NaHCO2NaOH NaNaCaCOCaCOMg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOH2HCl2NaClCOOH2CHO2NaHCOO2NaHCOO2Al(OH)O2Fe(OH)HNaClCOOH CHAl(OH)33326、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O铝及其化合物的化学方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 3 2、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3SAl 2S 3 4、铝与稀硫酸反应:2Al +3H 2SO4Al 2(SO 4)3+3H 2↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O2NaAlO 2+3H 2↑33AgNO 3Al(NO 3CuSO 4Al O 3Al 4Al 3CuO2Al 2NaAlO 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H 2SO 4Al 2(SO 4)3+6H 2O 2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO 2+2H 2O3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O四、硫酸铝 1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3+3BaCl 22AlCl 3+3BaSO 4↓ 2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3+3H 2SO 43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al(OH)KAlOO2Al(OH)O2Al(OH)6NaHCO32Al(OH)2Al(OH)2Al(OH)Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaClFe2FeClO2[FeO22FeOS FeS44Fe43Fe(NO3Fe(NO333213、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O3O44Al4CO3Fe8HCl FeClSO43Fe3Fe(NO33FeI33CO23324、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4Fe2(SO4)3+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3Fe(NO3)3+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O2FeI3Fe3FeCl22AlClFeCl2ZnClO8FeCl4HCl4FeCl2Fe(OH)Fe(OH)Fe(OH)2222311、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3Fe(NO3)3+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO33ZnCl2FeCl33FeCl2FeCl32FeClO2FeClO Fe(OH)Fe(OH)Fe(OH)2Fe(OH)Fe(OH)Fe(OH)12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+Fe(NO3)319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl20、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)3-来源网络,仅供个人学习参考。

铁铜钠镁铝及其重要化合物的相互转化关系铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O 2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2 Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 =△Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl332、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃CuCl234、氯气与金属钠反应:2Na + Cl2 点燃2NaCl35、氯气与水反应:Cl2 + H2O = HCl + HClO ↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO36、次氯酸光照分解:2HClO 光照2HCl + O2 41、二氧化硫与水反应:SO2 + H2O ≈ H2SO343、一氧化氮与氧气反应:2NO + O2 = 2NO244、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO 46、三氧化硫与水反应:SO3 + H2O = H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) △CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3•H2O △NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl = NH4Cl53、氯化铵受热分解:NH4Cl △NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2 点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO = CaSO360、SO2 + Na2O = NaSO361、SO2 + 2NaOH = Na2SO3 + H2O62、SO2 + Ca(OH)2 = CaSO3↓ + H2O63、SO2 + Cl2 + 2H2O = 2HCl + H2SO464、SO2 + 2H2S = 3S + 2H2O65、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O。