16-17版 第1部分 专题4 突破点17 物质的检验、分离与提纯
- 格式:ppt
- 大小:2.57 MB
- 文档页数:47

【深度探究】【典例】(2015·天津高考)下列关于物质或离子检验的叙述正确的是( )A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【答案】B【名师在线】D项中的气体如果是SO2,观察到的现象和CO2相同,写出其变化的相应化学方程式。
题组1—离子的检验1.(2016·西安八校联考)下列关于离子检验的说法中正确的是( )A.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl-B.向某溶液中加入稀盐酸,产生无色气体,则该溶液中一定含有CO错误!C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中一定含有SO错误!D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,则该溶液中一定含有Fe2+【答案】D【解析】该白色沉淀还可以是Ag2SO4,因此溶液中含有SO错误!时也会出现题述现象,A项错误;该气体可以是CO2或SO2等,因此该溶液中含有CO2-,3、HCO错误!、SO错误!或HSO错误!等时均会出现题述现象,B项错误;加入盐酸酸化的BaCl2溶液,产生的白色沉淀可能为BaSO4或AgCl,因此溶液中含有SO错误!或Ag+时均会出现题述现象,C项错误;加入KSCN溶液,溶液不显红色,说明无Fe3+,加入氯水后溶液变红色,说明生成了Fe3+,因此原溶液中含有Fe2+,D项正确。
2.(2016·山东实验诊断)下列实验操作与预期实验目的或所得实验结论一致的是( )项A 将NaOH溶液滴入某溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝证明溶液中有NH错误!B 向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊证明该溶液中存在SO错误!C 将Cl2通入品红溶液中,品红溶液褪色证明Cl2的还原性D将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色证明氧化性:H2O2比Fe3+强【答案】A3.(2016·黄山质检)某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH错误!、K+、Mg2+、Cu2+、Br-、AlO错误!、Cl-、SO错误!、CO错误!。

第四讲物质的分离、提纯和检验1.混合物的分离与提纯2.常见离子的检验方法分离是指将混合物中各组分分离,提纯是指除去杂质,留下需要的组分。
混合物分离和提纯的化学方法有:(1) 基本原则。
不增(不引入新杂质)、不减(不减少被提纯物)、易分离(被提纯物与杂质易分离)、易复原(被提纯物易复原)。
(2) 注意事项。
除杂试剂需过量,过量试剂需除尽,欲除多种杂质需考虑加入顺序,除杂途径选最佳。
如粗盐(含Ca2+、Mg2+、SO2-4)提纯,除杂试剂及添加顺序:BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl或BaCl2、Na2CO3、NaOH、HCl。
(3) 常用方法。
生成沉淀法[如将海水引入石灰水中获得Mg(OH)2]、生成气体法(如除去Na2SO4中的Na2CO3用H2SO4)、氧化还原法(如除去Na2SO4中的Na2SO3通入O2)、溶液或固体吸收法(如除去H2中的HCl和H2O可通过碱石灰)。
【例1】(2016届南京市模拟) 下列鉴别物质的方法能达到目的的是()A. 用氨水鉴别MgCl2溶液和AlCl3溶液B. 用焰色反应鉴别Na2CO3固体和NaHCO3固体C. 用BaCl2溶液鉴别AgNO3溶液和Na2SO4溶液D. 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体解析:A选项,氨水与MgCl2溶液和AlCl3溶液反应都生成白色沉淀;B选项,Na2CO3固体和NaHCO3固体焰色反应都呈黄色;C选项,BaCl2溶液与AgNO3溶液和Na2SO4溶液反应都生成白色沉淀。
答案:D点拨导引:利用焰色反应检验是否有钾元素,应透过钴玻璃观察是否显紫色。
【例2】(2016届南师附中模拟)甲烷中混有乙烯,欲除乙烯得到纯净干燥的甲烷,可依次将其通过下列试剂的洗气瓶的是()A. 澄清石灰水、浓H2SO4B. 溴水、浓H2SO4C. 酸性高锰酸钾溶液、浓H2SO4D. 浓H2SO4、酸性高锰酸钾溶液解析:溴水和酸性高锰酸钾溶液都能与乙烯反应,但酸性高锰酸钾溶液与乙烯反应有二氧化碳气体产生而混入甲烷中。

一、考纲要求1. 掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
2. 能对常见的物质进行检验、分离和提纯,能根据要求配制溶液。
二、考题规律物质的分离、提纯与检验是高考常考的知识,在选择和综合实验中都有所涉及。
近几年主要考查了:1. 常见气体的制法,包括仪器的选择组装等。
2. 物质的分离、提纯、检验的基本操作。
三、考向预测该专题知识是高考考查的热点,判断操作的正确与错误,根据要求选择实验仪器,选择适当的试剂进行分离、提纯、鉴别仍然是今后高考考查的重点内容。
另外将物质的分离、提纯与物质的制备、混合物成分的鉴定等内容融合在化工流程中,形成综合实验题也是未来高考的方向。
一、物质的分离、提纯与检验知识体系鉴定:是指通过一定的方法将物质组成成分一一检验出来主要鉴别:是指有若干种物质,需根据物质各自不同特性或离类型子的特征反应把有关物质一一区分开来推断:是通过已知实验事实,根据性质分析推理出被检验物的组成或名称物质①充分利用物质(或离子)的特征反应的基本原则②确定检验操作顺序要“先简后繁”检③确定物质检出顺序要“先活后惰”验物注①选择合适的试剂、试纸,要求选择操作简单、反应灵敏、现象明显的方法和途径质意的事②不能向待检物中直接加入试剂,必须另取试样。
一般来说,固体物质的检验常先加检项水配成溶液验③一种溶液需要进行两次以上实验时:一般应分别取样,不能在同一试液中重复操作、④叙述时要先说明现象再得出结论分离①物质的分离是将两种或多种物质的混合物彼此分开,得到几种纯净物的过程与二者比较②物质的提纯是除去物质中混有少量杂质而得到纯净的物质提物③物质的分离与提纯目的不同,但所遵循的原则与实际操作却非常相似纯质的①不增(不引入新杂质)分基本原则②不减(不减少被提纯物)离③易分离(被提纯物与杂质易分离)与④易复原(被提纯物易复原)提纯①除杂试剂需过量注意事项②过量试剂需除尽③去除多种杂质时要考虑加入试剂的顺序④选择最佳的除杂途径二、常见气体的制备、收集和尾气处理1. 制备气体一般原则:(1)反应物容易获得;(2)反应条件容易达到;(3)反应容易控制;(4)生成的气体容易分离2. 气体的制备、收集和尾气装置制取气体的装置收集尾气吸收O2O2NH3NH3H2CO2、NO2H2NO2NO Cl2、SO2Cl2、SO2HCl3. 气体的干燥一般净化气体时,除去水蒸气的干燥装置放在最后。

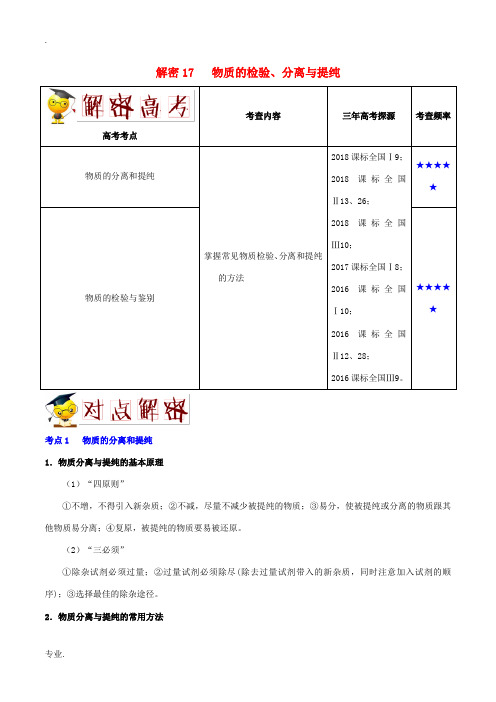
解密17 物质的检验、分离与提纯高考考点考查内容三年高考探源考查频率物质的分离和提纯掌握常见物质检验、分离和提纯的方法2018课标全国Ⅰ9;2018课标全国Ⅱ13、26;2018课标全国Ⅲ10;2017课标全国Ⅰ8;2016课标全国Ⅰ10;2016课标全国Ⅱ12、28;2016课标全国Ⅲ9。
★★★★★物质的检验与鉴别★★★★★考点1 物质的分离和提纯1.物质分离与提纯的基本原理(1)“四原则”①不增,不得引入新杂质;②不减,尽量不减少被提纯的物质;③易分,使被提纯或分离的物质跟其他物质易分离;④复原,被提纯的物质要易被还原。
(2)“三必须”①除杂试剂必须过量;②过量试剂必须除尽(除去过量试剂带入的新杂质,同时注意加入试剂的顺序);③选择最佳的除杂途径。
2.物质分离与提纯的常用方法(1)升华法;(2)过滤法;(3)蒸馏法;(4)萃取分液法;(5)洗气法;(6)燃烧法。
3.物质的分离与提纯的化学方法4.常见混合物的除杂举例(1)常见固体混合物的除杂(2)常见混合气体的除杂酸性高锰酸钾和石灰乳调研1 下列装置应用于实验室从CuI、SiO2(催化剂)中提取碘的实验,不能达到实验目的的是A.用装置甲加稀H2SO4及H2O2氧化并用CCl4萃取B.用装置乙过滤分离固体和溶液C.用装置丙分离得到I2的CCl4溶液D.用装置丁分离萃取液中单质I2和CCl4【答案】D【解析】蒸馏时,温度计的水银球应置于蒸馏烧瓶的支管口处,D项错误。
调研2 下表中除去物质中杂质选用的试剂或操作方法正确的一组是序号物质杂质除去杂质选用的试剂或操作方法①KNO3溶液KOH 加入适量FeCl3溶液,并过滤②FeSO4溶液CuSO4加入过量铁粉,并过滤通过盛有足量NaOH溶液的洗气瓶,再通过盛③H2CO2有浓硫酸的洗气瓶④NaNO3CaCO3溶解、过滤、蒸发A.①②③B.①③④C.②③④D.①②④【答案】C【解析】加入氯化铁会引入杂质Cl-。




物质的检验、分离与提纯主要考查物质的检验方法和原理、混合物的分离与提纯方法、相关实验操作及其注意事项等。
1.【2020年全国卷2】某白色固体混合物由NaCl 、KCl 、MgSO 4、CaCO 3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。
根据实验现象可判断其组成为( ) A .KCl 、NaCl B .KCl 、MgSO 4 C .KCl 、CaCO 3 D .MgSO 4、NaCl【答案】B【解析】①混合物溶于水,得到澄清透明溶液,则不含CaCO 3,排除C 选项;②做焰色反应,通过钴玻璃可观察到紫色,可确定含有钾元素,即含有KCl ;③向溶液中加碱,产生白色沉淀,则应含有MgSO 4,综合以上分析,混合物由KCl 和MgSO 4两种物质组成,选B 。
【点睛】常用焰色反应来检验钠元素和钾元素。
2.【2020年山东卷】实验室分离Fe 3+和Al 3+的流程如下:知Fe 3+在浓盐酸中生成黄色配离子[FeCl 4]−,该配离子在乙醚(Et 2O ,沸点34.6℃)中生成缔合物+-24Et O H FeCl ﹒﹒[]。
下列说法错误的是( )A .萃取振荡时,分液漏斗下口应倾斜向下B .分液时,应先将下层液体由分液漏斗下口放出C .分液后水相为无色,说明已达到分离目的D .蒸馏时选用直形冷凝管【答案】A【解析】A .萃取振荡时,分液漏斗下口应倾斜向上,A 错误;B .分液时,密度大的液体在下层,密度小的液体在上层,下层液体由分液漏斗下口放出,下层液体放完后,密度小的上层液体从分液漏斗上口倒出,B正确;C.Fe3+在浓盐酸中生成黄色配离子,该离子在乙醚中生成缔合物,乙醚与水不互溶,故分液后水相为无色,则水相中不再含有Fe3+,说明已经达到分离目的,C正确;D.蒸馏时选用直形冷凝管,能使馏分全部转移到锥形瓶中,而不会残留在冷凝管中,D正确;答案选A。