临床试验资料递交函及回执单CTI-A-00A0V0
- 格式:doc
- 大小:87.00 KB
- 文档页数:1

药物临床试验资料递交信尊敬的桂林医学院附属医院教授:公司申办的临床试验(CFDA临床试验批件号:)已获贵院药物临床试验伦理委员会批准,贵中心将参加本临床试验,现递交如下材料:1.研究者手册(版本号:日期:)2.临床试验方案(方案编号:版本号:日期:)3.研究病历(样表)(版本号:日期:)4.病例报告表(样表)(版本号:日期:)5.受试者卡片(样表)(版本号:日期:)6.受试者日记卡(样表)(版本号:日期:)7.知情同意书(样稿)(版本号:日期:)8.受试者招募广告(样稿)(版本号:日期:)9.伦理委员会批件及成员表(组长单位)10.伦理委员会备案回执(组长单位)11.伦理委员会批件及成员表(本中心)12.伦理委员会备案回执(本中心)13.临床试验责任保险保单14.国家食品药品监督管理局批件(批件号:)或药物临床试验审评审批受理通知书及相关文件15.人类遗传资源采集、收集、买卖、出口、出境行政许可批件16.药物临床试验登记与信息公示平台备案证明17.药物临床试验公共信息平台备案证明18.**公司(申办者)资质证明性文件包括:药品生产许可证、GMP证书、营业执照、申办者联系方式表、申办者对其提交材料的声明等19.**公司(CRO)资质证明性文件包括:营业执照、CRO联系方式表、CRO者对其提交材料的声明明等20.**公司(SMO)资质证明性文件包括:营业执照、SMO联系方式表、SMO与申办者及CRO无隶属控股关系的声明、SMO 对其提交材料的声明等21.**公司(中心实验室)资质证明性文件包括:营业执照、实验室质评证书等22.**公司(其他供应商)资质证明性文件包括:营业执照、资质证书等23.委托书申办者至CRO委托书申办者/CRO至SMO委托书申办者/CRO至中心实验室委托书申办者/CRO至其他供应商委托书申办者/CRO至CRA委托书、CRA资质证明性文件、保密声明SMO至CRC委托书、CRC资质证明性文件、保密声明24.试验药物的药检证明(包括:试验药物、对照药物、安慰剂、基础用药、辅助用药等)25.试验药物保存温湿度超限处理流程26.试验药物的说明书(包括:试验药物、对照药物、安慰剂、基础用药、辅助用药等)27.试验药物标签28.试验用设备的合格证、说明书、检定证书、校准证书(包括:温湿度记录仪、医用冷藏箱、医用阴凉箱、离心机等)29.临床试验有关的实验室检测正常值范围(中心试验室)30.设盲试验的破盲规程31.其他请您将上述资料递交至药物临床试验机构办公室,上述资料及安全性资料如有更新我们将及时递交。
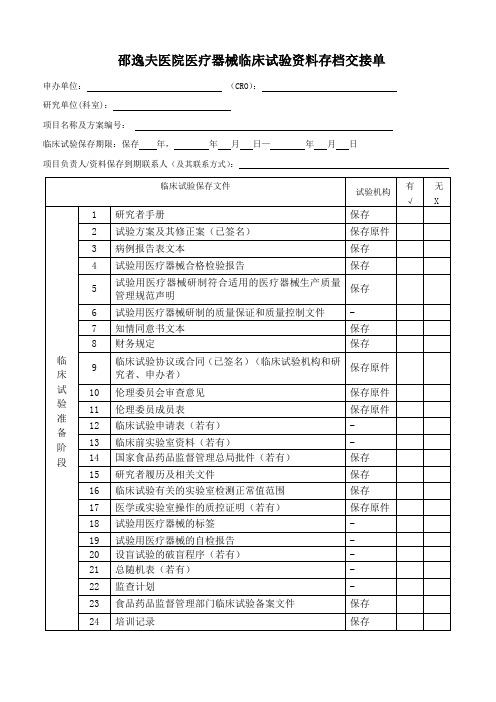
邵逸夫医院医疗器械临床试验资料存档交接单申办单位:(CRO):研究单位(科室):项目名称及方案编号:临床试验保存期限:保存年,年月日—年月日项目负责人/资料保存到期联系人(及其联系方式):临床试验保存文件试验机构有√无X临床试验准备阶段1 研究者手册保存2 试验方案及其修正案(已签名)保存原件3 病例报告表文本保存4 试验用医疗器械合格检验报告保存5试验用医疗器械研制符合适用的医疗器械生产质量管理规范声明保存6 试验用医疗器械研制的质量保证和质量控制文件-7 知情同意书文本保存8 财务规定保存9临床试验协议或合同(已签名)(临床试验机构和研究者、申办者)保存原件10 伦理委员会审查意见保存原件11 伦理委员成员表保存原件12 临床试验申请表(若有)-13 临床前实验室资料(若有)-14 国家食品药品监督管理总局批件(若有)保存15 研究者履历及相关文件保存16 临床试验有关的实验室检测正常值范围保存17 医学或实验室操作的质控证明(若有)保存原件18 试验用医疗器械的标签-19 试验用医疗器械的自检报告-20 设盲试验的破盲程序(若有)-21 总随机表(若有)-22 监查计划-23 食品药品监督管理部门临床试验备案文件保存24 培训记录保存临床试验保存文件试验机构有√无X临床试验进行阶段25 研究者手册更新件(若有)保存26其他文件(方案、病例报告表、知情同意书、书面情况通知)的更新(若有)保存27 医学、实验室检查,操作的正常值范围更新(若有)保存28 试验用医疗器械与试验相关物资的交接单保存29 监查员访视报告保存30 已签名的知情同意书保存原件31 原始医疗文件保存原件32 病例报告表(已填写,签名,注明日期)保存原件33 研究者对严重不良事件的报告(若有)保存原件34申办者对严重不良事件和可能导致严重不良事件的器械缺陷的报告(若有)保存35 受试者鉴认代码表保存原件36 受试者筛选表与入选表保存37 研究者签名样张及研究者授权表保存临床试验终止或完成后38 试验用医疗器械处理记录保存39 完成试验受试者代码目录保存40 监查、核查、检查记录保存41 最终监查报告-42 治疗分配记录保存43 破盲证明(若有)保存44 临床试验小结或临床试验报告保存原件45 其他:保存监查员:负责项目协调研究者签名:监查员联系方式:临床试验机构办公室签名:档案室接收员签名:档案移交日期:年月日。



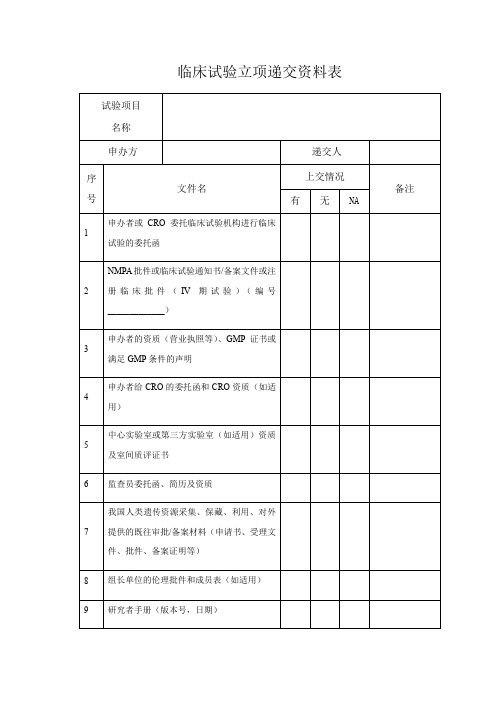
体外诊断试剂临床试验立项递交资料目录
30 其他
※过程文件记录表(样表):包括并不限于1 .物资运输及交接记录表;2.冰箱温度记录;3. 样本筛选与入选表;4.样本信息登记表;5.试剂出入库记录表;6.样本出入库记录表;7. 质量控制记录表;8.实验记录表;9.样本销毁记录表;10.试验物资回收记录表;11.编盲记录表;12.任务授权表;13 .医疗器械仪器维护使用记录表。
资料说明:
1.电子版上传机构管理系统()。
机构审核通过后预约时间提交1份纸质版资料至机构办公
室,以隔页纸按目录顺序排放,用拉杆文件夹装订好装入蓝色档案盒内。
2.编号10-29的资料需盖中办方公章及骑缝章。

深圳大学总医院药物临床试验报送资料列表请主要研究者按照下表要求,将资料由本人或授权代表交至临床试验机构。
深圳大学总医院药物临床试验资料递交回执单我院机构已收到___________________ 公司申请的项目_______________________________________________ 的送报资料,现正式受理该项目,予以受理编号 ________________________ O接收人:接收时间:药物临床试验信息简表填表时间:年月日临床试验立项审议表方案名称:申办者/CRO:| PI科室及姓名:项目联系人/电话:试验性质:口药物口医疗器械□体外诊断试剂备注:递交立项文件清单(根据提交的文件自行填写):主要研究者承诺:我己审阅该临床试验相关资料,经伦理委员会审核批准后同意在本专业进行临床试验,并保证在临床试验实施过程中,严格执行GCP,充分保障受试者合法权益,按要求完成临床试验任务。
签名:日期:核心小组立项审核评估:1.申办者是否具备相应的资格申报临床试验:是口,否口2.主要研究者是否具备相应的资格实施临床试验:是口,否口3.研究团队结构是否合理:是口,否口4.研究者是否具备足够的试验时间:是口,否口5.研究科室是否具备相应的仪器设备和其他技术条件:是口,否口6.试验内容、方案设计等是否符合法规和临床试验基本要求:是口,否口7.临床前研究资料是否齐全:是口,否口8.是否能保证招募足够的受试人群:是口,否口9.是否符合相关法律法规及规章相关规定是:是口,否口10.是否符合伦理原则或科研诚信原则:是口,否口11.相关药物/医疗器械/体外诊断试剂是否存在质量缺陷:是口,否口12.临床试验安全风险超过可控范围:是口,否口13.主要研究者是否与研究成果有直接利益关系:是口,否口14.是否可能存在商业贿赂或其他不正当利益关系:是口,否口15.可能侵犯他人知识产权:是口,否口药物临床试验委托书项目名称:委托方(甲方):委托方(乙方):深圳大学总医院药物临床试验机构依据《中华人民共和国合同法》、《药物临床试验质量管理规范》、《药品注册管理办法》、等法律法规的有关规定,经双方友好协商,________________________ 公司委托深圳市深圳大学总医院药物临床试验机构负责实施_______________________________________________________ 临床试验,申办方/CRO负责派出合格的监查员并为研究者所接受。

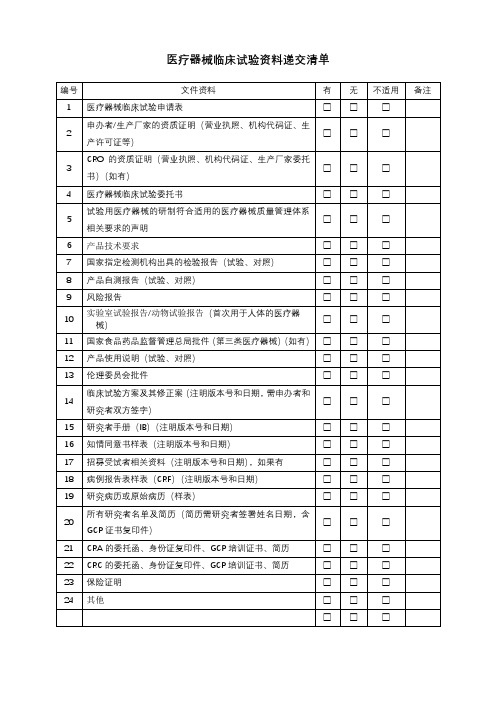
26 申办方/CRO营业执照□是□否
27 申办方对CRO的委托书或协议(如有)□是□否
28 申办方/CRO对CRA的委托书□是□否
□是□否29 CRA的派遣函、身份证复印件、学历证书、个人简历、GCP证
书等
30 无需办理“人类遗传资源审批申请书”承诺书(如适用)□是□否
31 方案讨论会的会议纪要□是□否31 其他与立项审查相关的材料□是□否
□是□否32 提供给受试者的文件,如调查问卷病、受试者日记卡等(如
适用)
备注:
1、以上所有材料需加盖红章,一式两份;装订要求:每一小
项放在一份文件保护袋中,再按照目录顺序要求放入三孔
文件夹中,用索引纸分开(参考如下:齐心TC530AB 文
件夹A4打孔夹背宽40mm 1.5寸3孔O型档案夹,蓝
色天猫
+%BF%D7+o%D0%CD%BC%D0+%C6%EB%D0%C4 。
3孔O
型夹齐心蓝色)。
2、将电子档或扫描件发邮箱:.。


机构表格类文件
第 1 页 共 1 页
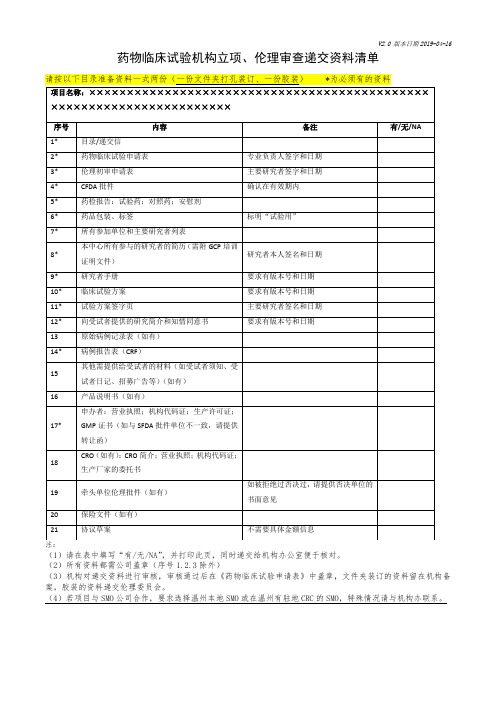
临床试验资料递交函及回执单(CTI-A-001-A06-V2.0)
临床试验资料递交函及回执单
项目名称 研究类别 申办方 递交日期 联系人 联系方式 承担科室 主要研究者 科室联系人
联系方式
药物临床试验机构办公室:
按机构办公室要求,本研究现提供以下资料,请机构办公室审阅,
□临床试验立项申请审批表(申请者签名、盖章并签署日期); □国家食品药品监督管理总局《药物临床试验批件》;
□申办者资质证明及委托函; □试验用药物检验合格报告;
□临床试验方案摘要; □临床试验方案(注明版本号和日期); □病例报告表(注明版本号和日期); □知情同意书(注明版本号和日期); □研究者手册(注明版本号和日期); □多中心研究单位一览表(如有); □研究者履历;
□所有以前其他机构、伦理委员会或管理部门对申请研究项目的重要决定的说明,应提供以前否定结论的理由;
□其他资料(如受试者须知、受试者日记、紧急联系卡、招募广告、保险声明等)。
递交人(签字): 日期:
… … … … … … … … … … … … … … … … … … …
资料递交回执单
项目名称 项目编号
:
药物临床试验机构办公室已收到上述研究项目的递交函。
机构办公室受理人签字: 日期
(盖章)。