海水中微量氟的测定
- 格式:pdf
- 大小:105.62 KB
- 文档页数:4

1. 了解微量氟的检测原理和方法。
2. 掌握微量氟的检测仪器和操作步骤。
3. 培养学生实验操作能力和数据处理能力。
二、实验原理微量氟的检测原理基于氟离子与特定试剂反应生成络合物,然后通过分光光度法测定其吸光度,从而计算出样品中氟的含量。
本实验采用氟试剂法,即利用氟试剂与氟离子反应生成红色络合物,通过测定该络合物的吸光度,计算样品中氟的含量。
三、实验仪器与试剂1. 仪器:- 酶标仪- 电子天平- 移液器- 烧杯- 容量瓶- 玻璃棒- 滤纸2. 试剂:- 氟化钠标准溶液(1mg/L)- 氟试剂- 氢氧化钠溶液(0.1mol/L)- 氯化钠溶液(0.1mol/L)- 醋酸溶液(1mol/L)- 水为去离子水1. 准备标准曲线:(1)取6个50ml容量瓶,分别加入0、0.2、0.4、0.6、0.8、1.0ml氟化钠标准溶液。
(2)向各容量瓶中加入5ml氯化钠溶液、2ml氢氧化钠溶液、1ml醋酸溶液,用水定容至刻度。
(3)加入2ml氟试剂,摇匀,室温放置10分钟。
(4)用酶标仪在580nm波长处测定吸光度,以氟浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品处理:(1)取一定量样品,加入适量水,用玻璃棒搅拌,使其充分溶解。
(2)用移液器取一定体积的样品溶液,加入5ml氯化钠溶液、2ml氢氧化钠溶液、1ml醋酸溶液,用水定容至刻度。
(3)加入2ml氟试剂,摇匀,室温放置10分钟。
3. 测定吸光度:用酶标仪在580nm波长处测定样品溶液的吸光度。
4. 计算样品中氟的含量:根据标准曲线,计算样品中氟的浓度,然后换算成mg/L。
五、实验结果与分析1. 标准曲线的绘制:标准曲线线性良好,相关系数R²=0.999。
2. 样品中氟的测定:根据标准曲线,计算样品中氟的浓度为1.2mg/L。
3. 实验误差分析:本实验误差主要来源于样品处理和测定过程中可能存在的系统误差和随机误差。
通过多次重复实验,减小随机误差;同时,严格按照操作步骤进行实验,减小系统误差。

离子选择性电极法测定溶液中氟离子一、实验目的1、了解电位分析法的基本原理。
2、掌握电位分析法的操作过程。
3、掌握用标准曲线法测定水中微量氟离子的方法。
4、了解总离子强度调节液的意义和作用。
二、实验原理一般氟测定最方便、灵敏的方法是氟离子选择电极。
氟离子选择电极的敏感膜由LaF 3单晶片制成,为改善导电性能,晶体中还掺杂了少量0.1%~0.5%的EuF 2和1%~5%的CaF 2。
膜导电由离子半径较小、带电荷较少的晶体离子氟离子来担任。
Eu 2+、Ca 2+代替了晶格点阵中的La 3+,形成了较多空的氟离子点阵,降低了晶体膜的电阻。
将氟离子选择电极插入待测溶液中,待测离子可以吸附在膜表面,它与膜上相同离子交换,并通过扩散进入膜相。
膜相中存在的晶体缺陷,产生的离子也可以扩散进入溶液相,这样在晶体膜与溶液界面上建立了双电层结构,产生相界电位,氟离子活度的变化符合能斯特方程:--=F a FRT K E lg 303.2 氟离子选择电极对氟离子有良好的选择性,一般阴离子,除OH -外,均不干扰电极对氟离子的响应。
氟离子选择电极的适宜pH 范围为5-7。
一般氟离子电极的测定范围为10-6~10-1mol /L 。
水中氟离子浓度一般为10-5mol /L 。
在测定中为了将活度和浓度联系起来,必须控制离子强度,为此,应该加入惰性电解质(如KNO 3)。
一般将含有惰性电解质的溶液称为总离子强度调节液(total Ionic strength adjustment buffer ,TISAB)。
对氟离子选择电极来说,它由KNO 3、柠檬酸三钠溶液组成。
用离子选择电极测定离子浓度有两种基本方法。
方法一:标准曲线法。
先测定已知离子浓度的标准溶液的电位E ,以电位E 对lgc 作一工作曲线,由测得的未知样品的电位值,在E-lgc 曲线上求出分析物的浓度。
方法二:标准加人法。
首先测定待分析物的电位E1,然后加人已知浓度的分析物,记录电位E2,通过能斯特方程,由电位E1和E2可以求出待分析物的浓度。

离子选择性电极法测定水中微量氟实验目的:了解电化学在分析中的应用;了解氟电极测定氟离子的原理和方法;学会离子计的使用;掌握标准曲线法和标准加入法。
实验结果:根据标准曲线法做出E-lgC 线性曲线,得到C 水样=2.764mg ·ml -1。
根据标准加入法C 水样=0.255mg ·ml -1。
背景介绍:无机氟化物的水溶液含有F −和氟化氢根离子HF 2−。
氟化物矿物比较重要的是萤石和氟磷灰石。
在天然饮用水和食物中都有低浓度的氟化物存在,而地下水中的氟含量则要高一些。
氟化物的毒性与其反应活性和结构有关,对盐而言,则是离解出氟离子的能力。
虽然聚四氟乙烯是化学惰性且无毒的,但在炊具温度超过260 °C 后就会变性,并且在350 °C 以上分解。
氟化物主要用于有机合成、无机材料、玻璃刻蚀、口腔病防治等。
氟是牙齿及骨骼不可缺少的成分,少量氟可以促进牙齿珐琅质对细菌酸性腐蚀的抵抗力。
但氟含量过高则会发生氟中毒:主要表现为氟骨症和氟斑牙。
人体每日摄入量4mg 以上会造成中毒,损害健康。
饮用水中氟含量的高低对人体健康有一定影响,氟的含量太低易得龋齿,过高则会发生氟中毒现象,适宜含量为0.5mg ·L-1左右。
因此,监测饮用水中氟离子含量至关重要。
氟离子选择性电极法已被确定为测定饮用水中氟含量的标准方法。
实验原理:离子选择性电极是一种电化学传感器,将离子的活度转换成相应的电位。
氟电极和甘汞电极、待测溶液组成一个电池,通过测量其电位来指示氟离子的活度。
电池组成:Hg|Hg 2Cl 2,KCl(饱和)||试液|LaF 3|NaF,NaCl,AgCl|Ag 其电动势和氟离子活度的关系式为:--=F a FRT K E lg 303.2',在固定条件下,K 为常数,在加入适量惰性电解质(TISAB ),保证离子强度不变,近似把浓度当做活度,代入得:---=-=F F c K c FRT K E lg 0591.0lg 303.2'。

水中氟的测定水中氟的测定是环境监测的重要内容之一,因为氟在自然环境中广泛存在,其过量摄入会对人体健康造成危害。
本文将从测定原理、方法和实验步骤等方面详细介绍水中氟的测定方法。
一、测定原理水中氟离子测定方法主要基于氟离子和铝离子在一定条件下形成复合物和稳定的络合物,这种络合物以紫红色的形式存在于水溶液中。
测定过程需要使用特定指示剂,例如洛伊格黄RL,可用来识别该络合物的存在。
在实际测定中,通过化学反应将水样中的氟转化为可以测定的形式,然后利用比色法或荧光法等方法测定络合物的浓度,最终求出水中氟的含量。
二、测定方法1.荧光法荧光法是测定水中氟离子的一种常用方法。
其原理是利用荧光剂激发氟离子产生荧光现象,根据荧光强度测定水中氟离子的浓度。
荧光法具有高灵敏度、高精确度和高选择性等优点,是一种较为准确的测定方法。
2.比色法比色法是通过比较不同溶液中络合物颜色的深浅来判断水中氟离子的含量。
该方法的具体步骤为:用标准溶液制备一系列浓度不同的络合物,然后与样品中的络合物相比较,利用比色法确定样品中络合物的浓度范围,最终根据标准曲线求出水中氟的含量。
三、实验步骤以下是一种常用的实验步骤:1.样品制备将待测水样收集到试管中,然后加入10ml硝酸盐酸混合溶液,加热至沸腾,持续加热2小时。
2.样品处理将样品冷却至室温,然后用洛伊格黄RL指示剂滴加滴定。
依据指示剂颜色的变化,使用标准曲线确定水中氟离子的含量。
3.建立标准曲线标准曲线的建立是实验中十分重要的步骤。
可以分别取一定体积的标准氟离子溶液制备一系列不同浓度的浓度溶液,将之后加入上述处理液中,进行比色法或荧光法测定。
4.结果计算根据样品和标准曲线的测量结果,可以计算出水中氟离子的含量。
此外,还需要对实验结果进行质量控制和误差分析。
综上所述,水中氟的测定方法多种多样,常用的方法有比色法和荧光法等。
在实验过程中,需要加强实验操作技能和注意安全,严格遵守实验操作规程。
同时,还需要进行质量控制和误差分析,确保实验结果的准确性和可靠性。

一、实验目的1. 了解水中氟含量的测定方法。
2. 掌握离子选择电极法测定水中氟含量的原理和操作步骤。
3. 通过实验,学会使用离子选择电极法测定水中氟含量。
二、实验原理水中氟的测定主要采用离子选择电极法。
该方法利用氟离子选择电极的氟化镧晶体膜对氟离子具有选择性响应,在一定条件下,被测试液中氟电极与饱和甘汞电极的电位差可随溶液中氟离子活度的变化而变化,电位变化规律符合能斯特方程式:E = E0 + (0.0591/n) log [F-]其中,E为电池电动势,mV;E0为标准电极电势,mV;n为电子转移数;[F-]为氟离子浓度。
通过测量电极与已知F浓度溶液组成的原电池电动势和电极与待测F浓度溶液组成原电池的电动势,即可计算出待测水样中F浓度。
三、实验仪器与试剂1. 仪器:1. 氟离子选择电极2. 饱和甘汞电极或银氯化银电极3. 精密pH计或离子活度计,精确到0.1 mV4. 磁力搅拌器和塑料包裹的搅拌子5. 容量瓶:100 mL、50 mL6. 移液管或吸液管:10.00 mL、5.00 mL7. 聚乙烯烧杯:50 mL、100 mL2. 试剂:1. 基准氟化钠(NaF)2. 乙酸钠(CH3COONa)3. 盐酸(HCl)4. 二水合柠檬酸钠(Na3C6H5O7·5H2O)5. 硝酸钠(NaNO3)6. 氢氧化钠溶液(NaOH)7. 盐酸溶液(HCl)8. 离子强度缓冲液I(TISAB I)9. 离子强度缓冲液II(TISAB II)四、实验步骤1. 准备标准溶液:准确称取0.2210 g基准氟化钠,用水溶解后转入1 000 mL容量瓶中,稀释至标线,摇匀,得氟化物标准贮备液(CF100 μg/mL)。
2. 标准曲线绘制:取6个100 mL容量瓶,分别加入不同体积的氟化物标准贮备液,用水稀释至标线,摇匀。
用离子活度计测定各溶液的电动势。
3. 待测水样测定:准确吸取一定体积待测水样,用水稀释至100 mL,加入适量TISAB溶液,摇匀。
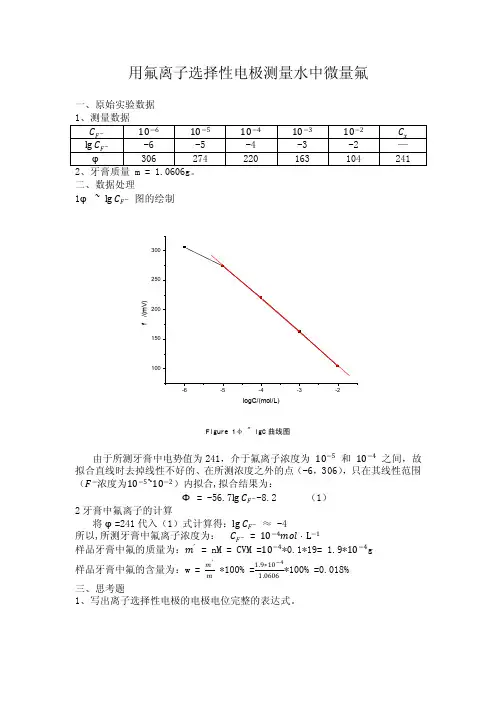
用氟离子选择性电极测量水中微量氟一、原始实验数据二、数据处理1φ ~ lg C F − 图的绘制f /(m V )logC/(mol/L)Figure 1φ ~ lgC 曲线图由于所测牙膏中电势值为241,介于氟离子浓度为 10−5 和 10−4 之间,故拟合直线时去掉线性不好的、在所测浓度之外的点(-6,306),只在其线性范围(F −浓度为10−5~10−2)内拟合,拟合结果为:Φ = -56.7lg C F −-8.2 (1)2牙膏中氟离子的计算将φ=241代入(1)式计算得:lg C F − ≈ -4所以,所测牙膏中氟离子浓度为: C F − = 10−4mol ·L −1样品牙膏中氟的质量为:m ′ = nM = CVM =10−4*0.1*19= 1.9*10−4g 样品牙膏中氟的含量为:w = m ′m *100% =1.9∗10−41.0606*100% =0.018%三、思考题1、写出离子选择性电极的电极电位完整的表达式。
E F− = K- 2.303RTlg a F−F2、为什么要加入离子强度调节剂?答:离子强度调节剂TISAB主要包含乙酸、NaCl、柠檬酸钠等。
乙酸缓冲溶液调节溶液的PH,加入NaCl是为了增强溶液离子强度,从而使离子活度系数恒定。
加入柠檬酸进行掩蔽干扰离子:阴离子,OH-,阳离子,Fe3+ Al3+ 、Sn。
四、做好本实验的几点建议1、各浓度标准液的配制每份溶液在保证浓度准确的情况下,所加入离子强度调节剂的量也得一致!如果从所配高浓度溶液(如10−2)依次提取配制次高浓度(10−3)的溶液,则每次配制时均需补加离子强度调节剂。
2、每次测量时保证测量环境和处理方式一致每次测量时均不变的条件包括:搅拌子转速、所测标准液的体积、电极在标准液中的高度、每次测完后冲洗氟电极的水量等。
3、实验开始前将氟电极用10−4mol·L−1标准液浸泡30分钟,实验全部结束后用蒸馏水清洗氟电极10min,期间换水三次。

水中氟离子的测定离子选择性电极法测定水样中氟离子的含量一、氟元素简介人体必需的微量元素之一,可以坚固骨骼和牙齿,预防龋齿。
轻度氟中毒症状:氟斑牙,牙齿变黄,变黑。
重度氟中毒症状:氟骨症,骨头变形,丧失劳动和生活自理能力。
二、预备知识电分析化学(electroanalytical chemistry)是以溶液中物质的电化学性质及变化来进行分析的方法。
电化学性质主要包括以电导、电位、电流、电量等电化学参数作为研究对象,从而找出其与被测物质含量间的关系。
电位分析是在零电流条件下测定两电极间的电位差来确定物质浓度或含量的一类方法,它是一种重要的电化学分析法。
三、测定目的掌握离子选择电极法的测定原理及测定方法学会正确使用氟离子选择性电极四、测定原理氟离子选择性电极是以氟化镧(LaF3)单晶片敏感膜的电位法指示电极,对溶液中的氟离子具有良好的选择性。
晶体膜的响应机理一般用晶体离子传导原理及膜表面上相同离子见的扩散作用来解释。
离子在晶体中的导电过程,是借助于晶格缺陷而进行的。
挨近缺陷空穴的导电离子,能够运动至空穴中:LaF3+空穴→LaF2++F-由于晶体膜表面不存在离子交换作用,所以电极在使用前不需浸泡活化,其电位的产生,仅是由于溶液中的待测离子能扩散进入膜相的缺陷空穴,而膜相中的晶格缺陷上的离子也能进入溶液相,因而在两项界面上建立双电层结构而在敏感膜两侧形成膜电位所致。
五、消除干扰对晶体膜电极的干扰,主要不是由于共存离子进入膜相参与响应,而是来自晶体表面的化学反应,即共存离子与晶格离子形成难溶盐或络合物,从而改变了膜表面的性质。
对于氟电极而言,主要的干扰是OH-,这是由于在晶体表面存在下列化学反应:LaF3(固体)+3OH- LaOH(固体)+3 F-实验表明,电极使用时最适宜的溶液pH范围为5-5.5。
六、定量依据1. 氟电极与饱和甘汞电极组成的电池可以表示为:Hg, Hg2Cl2︱KCl(饱和)‖F-试液︱LaF3(10-3mol·L-1), NaF(10-1mol·L-1), NaCl(0.1 mol·L-1) ︱AgCl2. 电池电动势E与氟离子活度的关系式为E=K-2.303RT/F·lgaF-=K-0.059 lgaF-(25℃) 3. 其中0.059为25℃时电极的理论响应斜率,其他符号具有通常意义。

9408 离子选择电极法测定水中氟的含量.doc实验十二离子选择电极法测定水中氟的含量;一、目的要求;1、掌握电位法的测定原理和方法;2、学会正确使用;自从氟离子选择电极问世以来,用该电极直接电位法测;图1氟离子选择电极结构简图;以氟电极为指示电极,饱和甘汞电极为参比电极,插入;氟离子选择电极│F-试液│饱和甘汞电极;当试液的离子强度为定值时,电池的电动势E 与F-试;2.303RT;E?K?lgCF?;F实验十二离子选择电极法测定水中氟的含量一、目的要求1、掌握电位法的测定原理和方法;2、学会正确使用氟离子选择电极。
二、方法原理自从氟离子选择电极问世以来,用该电极直接电位法测定各种水样中的氟便是一种普遍、方便和准确的方法。
氟离子选择电极简称为氟电极,其敏感膜是LaF3单晶(结构简图见图1)。
图1 氟离子选择电极结构简图以氟电极为指示电极,饱和甘汞电极为参比电极,插入试液中,组成一个测量电池:氟离子选择电极│F-试液│饱和甘汞电极当试液的离子强度为定值时,电池的电动势E与F-试液的浓度CF-有确定的关系:2.303RTE?K?lgCF?FE与lgCF?成线性关系,因此可以用直接电位法测定F -的浓度。
当氟电极插入到F-溶液中时,F-在晶体膜表面进行交换。
25℃时: E = K - 0.059 lgaF- = K + 0.059 pF离子选择性电极测量的是溶液中的离子活度,通常定量分析需要测量的是离子的浓度,不是活度,所以必须控制试液的离子强度,才可以近似认为测量的是离子浓度。
本实验用标准工作曲线法测定水中氟离子的含量,测量的pH值范围为5.0-6.0,加入含有氯化钠、乙酸及柠檬酸钠的总离子强度调节缓冲剂(TISAB)以控制酸度、保持一定的离子强度和消除干扰离子对测定的影响。
三、仪器与试剂仪器: pH离子计,电磁搅拌器;氟离子选择电极和饱和甘汞电极各一支;玻璃器皿一套。
试剂:0.1000mol/L氟标准溶液:准确称取经105℃下烘2h的NaF4.199g,用二次去离子水溶解后定容于1L容量瓶中,贮存于聚乙烯瓶中备用。

实验6 氟离子选择电极测定水中的微量氟一、实验目的1、了解用F -离子选择电极测定水中微量氟的原理和方法。
2、了解总离子强度调节缓冲溶液的组成和作用。
3、掌握用标准曲线法测定水中微量F -的方法。
二、实验原理离子选择电极的分析方法较多,基本的方法是工作曲线法和标准加入法。
用氟电极测定F -浓度的方法与测pH 值的方法相似。
以氟离子选择电极为指示电极,甘汞电极为参比电极,插入溶液中组成电池,电池的电动势E 在一定条件下与F -离子的活度的对数值成直线关系: F FRT K E αlg 303.2-= 式中K 值为包括内外参比电极的电位,液接电位等的常数。
通过测量电池电动势可以测定F -离子的活度。
当溶液的总离子强度不变时,离子的活度系数为一定值,则F c F RT K E lg 303.2-'= E 与F -离子的浓度C F -的对数值成直线关系。
因此,为了测定F -离子的浓度,常在标准溶液与试样溶液中同时加入相等的足够量的惰性电解质作总离子强度调节缓冲溶液,使它们的总离子强度相同。
氟离子选择电极适用的范围很宽,当F -离子的浓度在1~10-6 mol/L 范围内时,氟电极电位与pF (F -离子浓度的负对数)成直线关系。
因此可用标准曲线法或标准加入法进行测定。
应该注意的是,因为直接电位法测得的是该体系平衡时的F -,因而氟电极只对游离F-离子有响应。
在酸性溶液中,H +离子与部分F -离子形成HF 或HF 2-,会降低F -离子的浓度。
在碱性溶液中LaF 3薄膜与OH -离子发生交换作用而使溶液中F -离子浓度增加。
因此溶液的酸度对测定有影响,氟电极适宜测定的pH 范围为5-7。
三、仪器与试剂仪器:酸度计;E-1型氟离子选择电极;232型甘汞电极;电磁搅拌器。
试剂:(1)100 μg/mL 氟标准溶液:准确称取在120℃干燥2小时并冷却的分析纯NaF 0.221 g ,溶于去离子水中,转入1000 mL 容量瓶中稀释至刻度,储于聚乙烯瓶中。

离子选择性电极法测定自来水中氟的含量一、实验目的(1)掌握离子选择性电极法测定离子含量的原理和方法; (2)掌握标准曲线法和标准加入法的适用条件; (3)了解使用总离子强度调节缓冲溶液的意义和作用; (4)熟悉氟电极和饱和甘汞电极的结构和使用方法;二、实验原理饮用水中氟含量的高低对人体健康有一定影响,氟的含量太低易得龋齿,过高则会发生氟中毒现象,适宜含量为0.5mg ·L -1左右。
因此,监测饮用水中氟离子含量至关重要。
氟离子选择性电极法已被确定为测定饮用水中氟含量的标准方法。
离子选择性电极是一种电化学传感器,它可将溶液中特定离子的活度转换成相应的电位信号。
氟离子选择性电极的敏感膜为LaF 3单晶膜(掺有微量EuF 2,利于导电),电极管内装有0.1mol ·L -1 NaCl-NaF 组成的内参比溶液,以Ag-AgCl 作内参比电极。
当氟离子选择电极(作指示电极)与饱和甘汞电极(参比电极)插入被测溶液中组成工作电池时,电池的电动势正在一定条件下与F -离子活度的对数值成线性关系:--=F S K E αlg式中,K 值在一定条件下为常数;S 为电极线性响应斜率(25℃时为0.059V)。
当溶液的总离子强度不变时,离子的活度系数为一定值,工作电池电动势与F -离子浓度的对数成线性关系:--=F c S K E lg '为了测定F -的浓度,常在标准溶液与试样溶液中同时加入相等的足够量的惰性电解质以固定各溶液的总离子强度。
试液的pH对氟电极的电位响应有影响。
在酸性溶液中H+离子与部分F-离子形成HF或HF2-等在氟电极上不响应的形式,从而降低了F-离子的浓度。
在碱性溶液中,OH-在氟电极上与F-产生竞争响应,此外OH-也能与CaF3晶体膜产生如下反应:CaF3+3OH-—→La(OH)3+3F-由此产生的干扰电位响应使测定结果偏高。
因此测定需要在pH=5~6的溶液中进行,常用缓冲溶液HOAc-NaOAc来调节。

电位法测定天然水中微量的氟化物电位法测定天然水中微量的氟化物是一种常用的分析方法,其原理是利用氟离子选择性电极测定溶液中的氟离子浓度。
以下是该方法的详细步骤和优缺点。
一、实验步骤1.样品采集与处理:采集天然水样,用聚乙烯瓶密闭保存,以防止样品在运输和储存过程中受到污染。
样品处理前需进行过滤,以去除悬浮物和杂质。
2.仪器准备:使用氟离子选择性电极和相应的电位计进行测量。
确保电极在使用前已经活化并校准。
3.实验操作:将电极浸入样品中,搅拌均匀,等待数分钟使溶液达到平衡。
然后读取电位计上的读数,记下该浓度对应的毫伏数。
4.标准曲线绘制:制备一系列不同浓度的氟化物标准溶液,按照上述方法测定其电位值,绘制标准曲线。
5.结果计算:根据测得的电位值和标准曲线,计算出样品中氟化物的浓度。
二、优缺点分析1.优点:电位法测定水中微量氟化物具有灵敏度高、选择性好、操作简便等优点。
氟离子选择性电极对氟离子的测量具有很高的灵敏度和响应速度,使得测量结果准确可靠。
此外,该方法还可以用于测定不同水样中的氟化物浓度,适应性强。
2.缺点:电位法也存在一些局限性。
首先,氟离子选择性电极对溶液的酸碱度和温度等因素较为敏感,因此需要在实验过程中控制好这些因素。
其次,电极在使用过程中会出现老化现象,需要定期进行维护和更换。
此外,电位法只能测定溶液中的氟离子浓度,对于某些特定类型的氟化物(如氟乙酸等)可能无法准确测定。
三、注意事项1.在采集和运输水样时,要保证样品不被污染。
采集后的水样应立即过滤并妥善保存,以防止氟化物在储存过程中发生变化。
2.在实验过程中,要控制好溶液的酸碱度和温度等参数,以确保电极的正常工作。
同时,要定期对电极进行维护和校准,以保证测量的准确性和稳定性。
3.在绘制标准曲线时,要选用与样品基质相同或相似的标准溶液,以减少误差。
同时,要保证标准曲线的线性关系良好,以提高测量的准确度。
4.在分析过程中,要避免交叉污染和干扰。
水中微量氟的测定实验报告误差分析篇一《水中微量氟的测定实验:那点不靠谱的误差事儿》嘿,咱这水中微量氟的测定实验啊,那可真是一场充满“惊喜”的冒险。
咱就说说那次实验,那叫一个状况百出啊。
记得那天,我信心满满地准备大干一场。
先把各种仪器设备都摆弄好,那架子摆得,就像是要进行一场超级精密的“手术”。
量取水样的时候,我可是小心翼翼的,眼睛都瞪得像铜铃一样,生怕多了一滴或者少了一滴,心里想着:“可不能在这第一步就掉链子啊。
”可谁能想到,这才刚开始,麻烦就来了。
那移液管啊,就跟个调皮的小家伙似的。
我明明看着刻度吸得挺准的,结果一放,总感觉它像是在跟我开玩笑,滴出来的量怎么看都不对劲。
我就琢磨啊,这是咋回事呢?后来发现,原来是移液管的内壁上沾了点小水珠,这小水珠不起眼,但就这么捣乱,把我的精心准备全给搅和了。
再说说那滴定的过程。
我手里握着滴定管,就像拿着一把“魔法棒”,心里想着滴到那个神奇的终点。
可是啊,这“魔法棒”也不咋听话。
那滴定液滴下去的时候,速度一会儿快一会儿慢,就像一个没睡醒的孩子,完全不受控制。
而且,这颜色变化啊,也不那么明显。
我瞪大眼睛瞅着那溶液,一会儿觉得好像变色了,一会儿又觉得好像还差点。
结果,就这么稀里糊涂地,可能把终点给错过了。
还有那电极,那也是个闹心事。
本来它应该稳稳当当给我个准确的读数,结果呢,时不时地就抽个风,读数乱跳。
我在那干着急,心里想着:“你能不能靠谱点啊,别在这添乱了。
”等到最后算出结果,跟理论值那是相差了十万八千里。
看着那误差,我真是哭笑不得。
这一通折腾下来,才明白这实验里的误差啊,就像一个个小鬼,躲在各个角落等着给你使绊子。
咱以后可得长点记性,把这些小细节都给伺候好了,不然啊,这误差能把咱给整得晕头转向的。
篇二《揪出水中微量氟测定实验误差背后的“小捣乱”》上次那水中微量氟测定实验的误差啊,可让我心里头一直惦记着。
咱今天就再来扒一扒那些藏在背后的“小捣乱”。
就说那水样本身吧。
水中氟的测定(一)一、概述氟(fluorine)是最活泼的非金属元素,常温下几乎能与全部的金属和非金属元素化合,与水可发生强烈的反应,在自然界以稳定的氟化物形式存在。
含氟化合物的自然矿石有萤石(CaF2)、氟磷灰石[CaF2·3Ca3(PO4)2]和冰晶石(3NaF·A1F3)等。
多数氟化物有良好的水溶性,20℃时,(NaF)的溶解度高达40g/L,CaF2·3Ca3(PO4)2为0.2~0.5g/L,CaF2的溶解度也达0.04g/L。
离子是良好的配位体,能与多种金属离子形成稳定的配位离子。
水体中氟的来源可分为自然来源和人为污染两类。
因为氟广泛存在于自然界中而且氟化物有较高的溶解度,雨水、地表水、地下水流经含氟土壤和岩石,可从中淋溶出部分氟,因此各类水体中都含有一定量的氟化物。
雨水中氟含量比较低,约为0.05~0.1mg/L,地表水普通为0.2~0.5mg/L,地下水含氟由微量至10mg/L以上,流经含氟矿层的地下水可达2~5mg/L,温泉水含氟量都比较高,通常为10mg/L,有的可高达300mg/L氟矿石是重要的化工原料,广泛应用于电解铝、磷肥、陶瓷、、冶金、玻璃、航空燃料、电子、农药等工业,这些工业废水中氟含量较高,工业废水和矿物燃料是水中氟的主要污染源。
氟在水中主要为离子状态,若有铝、铁等金属离子共存,则主要为稳定的配离子,它们均为溶解态,易随水流而迁移;有钙离子共存时,水中的氟则可发生从水层到沉积物的迁移。
一些水生植物和动物可汲取水中的氟并富集于体内,其富集系数可高达两个数量级。
氟是人体必须微量元素之一,对牙齿和骨骼的形成和结构均有重要作用,氟缺乏或过多均可产生不良影响。
人体摄入氟不足,可诱发龋齿,特殊是婴幼儿,但过量摄入则会发生氟斑牙,严峻时会发生氟骨症。
成人天天需摄入2.3 mg氟,其中50%通过饮水摄入,为保证人群的氟摄入,供水工程常要举行加氟或脱氟处理,因而氟是水质理化检验中常规项目之一。
专业:制药工程 姓名:熊贤康 学号:2011115123水中氟离子的测定一、实验原理 1、离子电极氟离子电极是一种电化学传感器,他们将溶液中的F -离子的活度转换成相应的电 位。
当氟电极插入溶液时,其敏感膜对F -离子产生响应,在膜和溶液之间产生一定的 电位:--=F a FRTk lg 303.2ϕ当氟电极与饱和甘汞电极插入被测溶液中组成原电池时,电池的电动势E 与F -离子 活度的关系--'=F a FRTF lg 303.2E当加入TISAB 时,由于离子活度系数γ为一定值时,则电动势E 则与F -离子浓度 有如下关系:-F c lg RT303.2-K E F''=2、标准加入法 当试液为离子强度比较大的金属离子浓度,且溶液中存在络合剂,若要测定金属离子的总浓度,则应采用标准加入法。
该法是在原待测试样中,加入少量体积高浓度的待测离子的标准溶液,根据加入标准溶液后试样浓度的增量△C ,以及标准溶液加入前后电动势的差值△E,推算出待测金属离子的总浓度C x 。
该法的优点是仅需一种标准溶液,操作简单快速,适用于组成比较复杂,份数较少的试样。
二、实验内容 标准加入法测定水中微量F -离子的浓度: 1、准确吸取50ml 自来水样于100ml 容量瓶中,加入10ml 的TISAB 溶液,用去离子水稀释至刻度,摇匀,吸取50ml 于烧杯中,测定E 1。
2、在上述试液中准确加入0.5ml 浓度约10-3mo l ·L -1的氟标准溶液,混匀,继续测定E 2。
3、在测定过E 2的试液中,加入5ml 的TISAB 溶液及45ml 去离子水,混匀,测定E 3。
4、计算水中微量F -离子的浓度(C x ):1-S)-E 10C 12x E C (∆=ss V V C C =∆301.0E -E 2ln E -E S 3232==三、数据记录四.数据计算2.计算水中微量氟离子的浓度(-F C ):△C=0V V C S S =mLL L mol 50m 5.0100.112⨯•⨯--=1.01410--•⨯L molS=2ln 32E E -=301.032E E - 代入数据,求得:1S =-49.83 2S =-39.87x C =1-10/s (12)△E E C -代入数据,求得:1x C =15-mol 1087.3-•⨯L 2x C =15-mol 1048.2-•⨯L =X C 15-mol 1013.3-•⨯L则 x 2C C F ⨯=-=2×=X C 15-mol 1026.6-•⨯L五、分析讨论1、标准加入法是在原待测试样中,加入少量体积高浓度的待测离子的标准溶液,根据加入标准溶液后试样浓度的增加量△C ,以及标准溶液加入前后电动势的差值△E ,推算出待 测金属离子的总浓度x C 。
实验13直接电位法测定水中微量氟的含量1.实验目的①掌握直接电位法的基本原理和操作;②了解氟离子选择性电极的构造及测定氟离子的工作电池的构成;③学会用标准曲线法和标准加入法对水中微量氟离子含量的测定。
2.仪器和试剂pHS—25pH计,pF—1氟离子选择性电极,232饱和甘汞电极10.00mg/L氟离子标准溶液;总离子强度调节剂;自来水样3.实验原理①工作电池电动势与氟离子浓度的关系:直接电位法是将指示电极、参比电极与待测溶液组成的工作电池,测定该电池的电动势,依据电动势与待测物质含量的关系,求出待测物质的含量:E=K'-2.303RTFlgc F利用氟离子选择电极作指示电极,和做参比电极组成工作电池,利用电位仪测定电池电动势。
②标准曲线法原理:测定电池的电动势与试液中氟离子浓度的对数呈线性关系,这是离子选择性电极测定氟离子的理论依据。
做出标准曲线,求出试液中氟离子的浓度:c F=V S c SV0+V S(10∆E S−V0V0+V S)③总离子强度调节剂的作用:NaCl充当通常意义的离子强度调节剂,控制溶液的离子强度,使溶液的离子强度、活度系数保持恒定。
柠檬酸钠充当掩蔽剂,避免F-与Al3+、Fe3+络合而使游离F-浓度降低,干扰测定。
而柠檬酸盐可以消除Al3+、Fe3+的干扰。
乙酸和乙酸钠充当缓冲剂控制溶液pH值在5.0~5.5间:pH过低,易形成HF,使F-的浓度降低;P H值过高,La F3将与OH-反应释放出F-,浓度增加的响应,影响电极使用寿命。
4.实验步骤①标准曲线法的步骤:用刻度移液管分别吸取1.00、2.00、3.50、6.00及10.00mL10.00mg/L氟离子标准溶液于50mL容量瓶中,加10mLTISAB,用蒸馏水定容。
由此配得氟离子浓度分别为0.20、0.40、0.70、1.20及2.00mg/L的标准系列溶液。
将标准系列溶液从低浓度到高浓度逐个转入塑料烧杯,指示电极和参比电极侵入其中;在电磁搅拌下,读取平衡电位E。
水质中氟化物的检测方法比较分析摘要:本文研究了氟离子选择性电极法、氟试剂分光光度法及离子色谱法测定水样中氟化物的差异,探讨了三种方法的优劣。
结果表明:三种方法的标准曲线的相关性均符合实验的技术要求。
色谱法的回收率、准确性及精密度高于其他两种方法。
关键词:电极法分光光度法离子色谱法氟化物方法比较一、氟化物的性质及危害氟化物指含氟的二元化合物。
与其他卤化物不同,氟化银可溶于水。
氟化氢的水溶液称氢氟酸,是一种弱酸。
氟普遍存在于自然水体中,人体各组织中都含有氟,但主要积聚在牙齿和骨筋中。
适当的氟是人体所必需的,过量的氟对人体有危害,氟化钠对人的致死量为6~12克,饮用水含2.4~5毫克/升则可出现氟骨症。
其致毒机理为,氟离子会与血液中的钙离子结合,生成不溶的氟化钙,从而进一步造成低血钙症[1]。
氟化氢在相比之下更加危险,因为它具有腐蚀性和挥发性,因此可通过吸入或皮肤吸收而进入人体,造成氟中毒。
目前,氟化物的测定方法主要包括离子选择性电极法、氟试剂分光光度法和离子色谱法[2]。
本文主要对这三种方法的标准曲线、准确度、精确度、加标回收率进行比较,分析了三种方法的优缺点,以下是对这三种方法的比较分析。
二、氟化物的检测方法比较1.仪器与试样仪器:氟离子选择性电极;饱和甘汞电极;pH-3C 型pH 计;723S型分光光度计;美国戴安ICS5000型离子色谱仪。
水样:采集5个实际水样进行分析,分别为浅层地下水、河水、海水、长江水、工厂废水,每个采样点水样平行测定5次,取平均值进行加标回收率试验。
2.操作步骤2.1离子选择电极法分别移取浓度为10μg/ ml氟标准溶液0. 00、1. 00、2.00、5. 00、10. 00、20.00 ml 分别置于50 ml比色管中,然后分各加入10 ml TISAB缓冲溶液,用蒸馏水定容至刻度,摇匀后倾入放入搅拌子的聚乙烯烧杯中,插入氟离子电极和甘汞电极,读取电位值(mV),以mV 为纵坐标,以lgC为横坐标,绘制标准曲线[3]。