辽宁省沈阳同泽女中11-12学年高二化学上学期期末考试试题新人教版
- 格式:doc
- 大小:169.50 KB
- 文档页数:6

沈阳市高二上学期期末化学模拟试卷(I)卷姓名:________ 班级:________ 成绩:________一、单选题 (共25题;共50分)1. (2分)下列反应中,其中反应物的总能量高于生成物的总能量的是()①NaOH溶液中加入盐酸②由乙醇制C2H4 ③铝热反应④由氯酸钾制O2 .A . ①②B . ②③C . ①③D . ①④2. (2分) (2016高二下·阳高开学考) 下列说法正确的是()A . 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质B . 已知H2C2O4是弱酸,其电离方程式为:H2C2O4⇌2H++C2O42﹣C . 若反应C(s)+CO2(g)⇌2CO(g)在常温下不能自发,则该反应的△H>0D . 工业合成氨温度控制在500℃,目的是为了提高产率3. (2分)(2019·浙江选考) 下列属于强电解质的是()A . 硫酸钡B . 食盐水C . 二氧化硅D . 醋酸4. (2分) (2016高二上·嘉兴期中) 等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb ,则它们之间的关系是()A . Va>10VbB . Vb=10VaC . Va<10VbD . Vb>10Va5. (2分)生物燃料电池是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应为C2H5OH+3H2O﹣12e﹣═2CO2+12H+ .下列说法中不正确的是()A . C1极为电池负极,C2极为电池正极B . 溶液中的H+向C1电极移动C . 该生物燃料电池的总反应方程式为C2H5OH+3O2═2CO2+3H2OD . 电流由C2极经外电路流向C1极6. (2分)(2018·大同模拟) 25 ℃时,将1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。

2020-2021学年辽宁省沈阳市同泽中学高二化学期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列电子排布图能表示氮原子的最低能量状态的是A. B. C. D.参考答案:C略2. 可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等⑧右图中阴影部分面积更大,以上说法中正确的是A. ②④⑤⑦B. ①④⑥⑧C. ②③⑤⑧D. ①③⑥⑦参考答案:A略3. 近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物.假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的()A.铝质轻,便于运输、贮存,且安全B.在地球上,铝矿资源比较丰富C.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制D.现代电解铝的工业技术已为铝作为新能源奠定了重要基础参考答案:D考点:铝的化学性质.专题:几种重要的金属及其化合物.分析:A、Al为固体,且密度较小;B、Al大量存在于矿石中;C、燃烧反应放出热量,氧化铝对环境无污染;D、电解Al消耗能源,但Al作为新能源提供能量.解答:解:A、因Al为固体,且密度较小,则铝质轻,便于运输、贮存,且安全,故A正确;B、Al是地壳中含量最多的金属元素,大量存在于矿石中,则铝矿资源比较丰富,故B正确;C、Al燃烧时放出热量较大,且生成的氧化铝,则对环境的污染容易得到有效的控制,故C正确;D、电解Al消耗能源,但Al作为新能源提供能量,二者之间没有必然的联系,故D错误;故选D.点评:本题考查Al的性质和能源,学生应熟悉Al的物理性质和化学性质,并把握信息中利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物是解答本题的关键.4. 右图为农夫山泉矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指()A.原子B.分子C.单质D.元素参考答案:D略5. 为了证实胃舒平的有效成分是Al(OH)3而做的实验中,一定需要的试剂是A.CH3COOH B.CH3CH2OH C.NaOH和HCl D.NaHCO3参考答案:C略6. 下列变化为放热的化学反应的是()A.H2O(g)===H2O(l)ΔH=-44.0 kJ/molB.2HI(g)===H2(g)+I2(g)ΔH=+14.9 kJ/molC.形成化学键时共放出能量862 kJ的化学反应D.能量变化如图所示的化学反应参考答案:D略7. 生活中各种各样的“油”随处可见,下列油属于酯类的是()A. 石油 B、石蜡油 C、甘油 D、菜子油参考答案:D略8. 对滴有酚酞试液的下列溶液,操作后颜色变深的是() A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl固体D.小苏打溶液中加入少量NaCl固体参考答案:B略9. 甲烷是以碳原子为中心的正四面体结构,而不是正方形的平面结构,其理由是A.甲烷中的四个键的键长、键角相等 B .CH是分子晶体C.二氯甲烷只有一种结构 D .三氯甲烷只有一种结构参考答案:C略10. 研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法不正确的是()A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量小,速度快B.燃烧法是研究确定有机物成分的有效方法C.质谱法通常用于分析有机物中不同环境氢原子的种数和个数D.同位素示踪法可以用来确定有机反应中化学键的断裂位置参考答案:C略11. 下列各组元素中,电负性依次减小的是( )A.K、Na、AlB.O、Cl、HC.As、P、HD.O、S、Cl参考答案:B略12. 一种新型的灭火剂叫“1211”,其分子式为CF2ClBr,命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的“0”可略去)。

辽宁省2023-2024学年高二上学期期中阶段测试化学试题(答案在最后)考试时间:75分钟试题满分:100分可能用到的相对原子量:H-1O-16Na-23一、单选题(共15小题,每小题3分,共45分。
每题只有一个选项符合题意。
)1.下列关于热化学反应的描述中正确的是A.表示甲烷的燃烧热:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3kJ/molB.已知稀盐酸和稀NaOH溶液反应的中和热ΔH=-57.3kJ/mol,则H2SO4溶液和Ba(OH)2溶液反应生成1mol H2O时放出57.3kJ的热量C.已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4kJ/mol;则0.5molN2与1.5molH2在一定条件下充分反应,放出热量为46.2kJD.2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH22.25℃时,水的电离达到平衡:H2OH++OH-,下列叙述正确的是A.将纯水加热到95℃时,K w变大,pH不变,水仍呈中性B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,K w变小C.向纯水中加入少量Na2CO3固体,c(OH-)增大,K w不变,影响水的电离平衡D.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中()()3c Hc CH COOH+减小3.一定温度下,在固定容积的密闭容器中发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m、n、p、q为任意正整数时,下列状态一定能说明反应已达到平衡状态的是①体系的压强不再发生变化②体系的密度不再发生变化③各组分的物质的量浓度不再改变④各组分的质量分数不再改变⑤物质的量之比n(A):n(B):n(C)=n(D)=m:n:p:qA.③④⑤B.②③④C.①②③④D.①②③④⑤4.室温下,向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,pH的变化曲线如图所示。

沈阳市高二上学期期末化学试卷A卷姓名:________ 班级:________ 成绩:________一、选择题 (共18题;共36分)1. (2分) (2019高一下·深圳期中) 工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2 Hg+SO2还原出的汞呈气态,冷凝得液态汞。
其流程如图,下列说法不正确的是()A . 洗涤粗汞时可用5%的盐酸代替5%的硝酸B . HgS+O2 Hg+SO2属于置换反应C . 含汞烟气必须处理达标后才能排放D . 流程中加入氧化钙的目的是减少SO2的排放2. (2分) (2016高一上·武汉期中) NA为阿伏伽德罗常数,下列叙述中正确的是()A . 0.1 mol NaHSO4 晶体中含阴阳离子总数是0.3NAB . 6.2gNa2O溶入水配成1L溶液,所得溶液的物质的量浓度为0.2 mol/LC . 11.2 L CO2和O3混合气体中含有的原子数是1.5 NAD . 17 g H2O2完全分解,转移电子数是1NA3. (2分) (2016高一上·青海期中) 在无色透明酸性溶液中,能共存的离子组是()A . NH4+、OH﹣、Al3+、Cl﹣B . K+、SO42﹣、HCO3﹣、Na+C . Mg2+、NO3﹣、Cl﹣、Na+D . MnO4﹣、K+、SO42﹣、Na+4. (2分) (2016高二上·南涧期中) 下列离子方程式书写正确的是()A . 铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑B . AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓C . 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+D . 向Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O5. (2分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.下列操作中可能使所测NaOH溶液的浓度数值偏低的是()A . 酸式滴定管未用盐酸润洗就直接注入标准盐酸B . 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥C . 酸式滴定管在滴定前有气泡,滴定后气泡消失D . 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数6. (2分) (2015高二下·桂林期中) 已知热化学方程式:SO2(g)+ O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为()A . 196.64kJB . 196.64kJ/molC . <196.64kJD . >196.64kJ7. (2分)恒温、恒压下,反应N2 (g)+3H2 (g) 2NH3 (g)从两条途径分别建立平衡:Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;Ⅱ.NH3的起始浓度为4 mol / L。

沈阳市高二上学期化学期末考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共16题;共16分)1. (1分) (2016高二上·广平期中) 某化学反应的△H=﹣122kJ•mol﹣1 ,△S=+231J•mol﹣1•K﹣1 ,则此反应在下列哪种情况下可自发进行()A . 在任何温度下都能自发进行B . 在任何温度下都不能自发进行C . 仅在高温下自发进行D . 仅在低温下自发进行2. (1分)在2A+B=3C+4D的反应中,下列表示该反应速率最大的是()A . vA=0.5mol/(L.min)B . vB=0.3mol/(L.min)C . vC=0.8mol/(L.min)D . vD=1mol/(L.min)3. (1分)(2018·泉州模拟) 新型Zn-GO(GO为氧化石墨烯:C2O)电池,如图所示,GO反应过程中转化为rGO(rGO 为石墨烯:C)。
下列有关说法错误的是()A . 电池工作时,电子由a经外电路流向bB . b极电极反应式:C2O+2e-+H2O=2C+2OH-C . 每生成0.1molZn(OH)42- ,转移电子数为0.2NAD . 放电过程中电解质溶液的pH增大4. (1分) (2016高一上·宁德期末) 下列叙述正确的是()A . 1molN2的质量为28gmol﹣1B . 3.01×1023个SO2分子的质量为32gC . Cl2的摩尔质量为71gD . 标准状况下1mol任何物质的体积均为22.4L5. (1分)对于25℃、pH=2的醋酸溶液,下列说法错误的是()A . 加适量水稀释,溶液中c(H+)与c(OH-)的乘积不变B . 加入醋酸钠固体,当溶液呈中性时c(Na+)=c(CH3COO-)C . 该溶液中由水电离产生的c(OH-)=1×10-12mol/LD . 用0.01mol/L NaOH中和同体积同pH的盐酸和醋酸消耗NaOH体积,V(盐酸)>V(醋酸)6. (1分) (2015高二上·大方期末) 被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内是离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2十H2O═ZnO+2MnO(OH).下列说法正确的是()A . 该电池的正极为锌B . 该电池反应中二氧化锰起催化剂作用C . 当 0.1mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023D . 电池正极反应式为:2MnO2+2e一+2H2O═2MnO (OH)十2OH﹣7. (1分) (2018高一上·成都期中) 某金属的硫酸盐受热分解生成SO2、O2和该金属的氧化物。

沈阳市高二上学期化学期末考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共15题;共30分)1. (2分)(2018高一上·云南期中) 以下表示的是碳及其化合物的相互转化关系:CCO2→H2CO3→CaCO3→CO2其中涉及的基本反应类型依次为()A . 置换、化合、分解、复分解B . 置换、化合、复分解、分解C . 化合、置换、分解、复分解D . 化合、置换、复分解、分解2. (2分)下列叙述正确的是()A . Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物B . 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成C . 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质D . 将水蒸气通过灼热的铁粉,反应后固体质量增加3. (2分) (2018高二上·武汉期末) 一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2的总量的是()①铜粉②铁粉③石墨粉④CuO⑤浓盐酸⑥碳酸钠⑦醋酸钠A . ①③⑤B . ②③⑤⑦C . ①③④⑤D . ④⑤⑥4. (2分) (2016高二上·辽源期中) 对于合成氨反应N2(g)+3H2(g)⇌2NH3(g) 298K时,△H=﹣92.2kJ•mol ﹣1 ,△S=﹣198.2kJ•mol﹣1•K﹣1 ,下列说法正确的是()A . 升高温度和增大压强都有利于平衡向生成氨的方向移动B . 298K时合成氨反应不能自发进行C . 298K时合成氨的反应速率一定很大D . 298K时合成氨反应可自发进行5. (2分) (2017高一上·延安期中) 用固体氢氧化钠配制一定物质的量浓度溶液时,下列操作能导致溶液浓度偏高的是()A . 在烧杯中溶解时,有少量液体溅出B . 样品中混有碳酸钠固体C . 容量瓶使用前未经干燥D . 定容时俯视容量瓶刻度线6. (2分)下列有关能源与能量的说法正确的是()A . 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源B . 蒸汽属于一次能源C . 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应D . 反应物和生成物的总能量决定反应是放热还是吸热7. (2分)(2016·深圳模拟) 设NA为阿伏伽德罗常数的值,下列说法正确的是()A . l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NAB . 将lmol Cl2通入水中,HClO、Cl﹣、ClO﹣粒子数之和为2NAC . 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NAD . 将CO2通过Na2O2使其增重a克时,反应中转移电子数为8. (2分) (2018高二上·成都期末) 常温下向pH=3的醋酸中加入下列物质后,溶液中水电离出的c(H+)减小的是()A . 水B . NaHSO4固体C . CH3COONa固体D . NaCl固体9. (2分) (2015高一上·涡阳月考) 下列反应的离子方程式书写正确的是()A . 氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣B . 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑C . 钠放入水中:Na+H2O═Na++OH﹣+H2↑D . 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O.10. (2分)(2015·辽宁模拟) 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是()A . 每生成2分子AB吸收bkJ热量B . 该反应中反应物的总能量高于生成物的总能量C . 断裂1molA﹣A键和1molB﹣B键,放出a kJ能量D . 该反应焓变为△H=+(a﹣b)kJ/mol11. (2分) (2017高二上·万州期末) 下列说法或表示方法正确的是()A . 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多B . 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/molC . 2H2(g)+O2(g)═2H2O(l)△H=﹣Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=﹣Q2 kJ/mol,则Q1>Q2D . 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ12. (2分)稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。

辽宁省沈阳市2017-2018学年高二化学上学期期末考试试题可能用到的相对原子质量: H-1C-12 O-16 N-14 C1-35.5 Br-80 Na-23 Fe-56 Ag-108 Ca-40Cu-64 Mg-24 A1-27 S-32 Mn-55 Zn-65 Ba-137 I-127 K-39第I卷选择题(42分)一、选择题(本题包括10小题,1-8每小题4 分,9-10每小题5 分,共42 分。
每小题只有一个选项符合题意。
)1、化学与科技生产、生活环境等密切相关,下列说法不正确的是A.“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质,属于天然高分子化合物B.使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染C.石墨烯是一种从石墨材料中用“撕裂”方法“剥离”出的单层碳原子面材料,石墨烯和乙烯都属于烯烃D.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的2、室温下,将0.05 mol Na2CO3固体溶于水配成100mL 溶液,向溶液中分别加入下列物质。
有关结论正确的是A.加入0.05molCaO,溶液中c(OH-)/c (HCO3-)增大B.加入50mL 1mol/LH2SO4,反应结束后,c(Na+)=c(SO42-)C.加入50mL H2O,由水电离出的c(H+)·c(OH-)不变D.加入0.1molNaHSO4固体,反应完全后,溶液pH 减小,c(Na+)不变3、下列实验装置或操作能达到实验目的的是4、下列关于糖类、脂肪和蛋白质的说法不正确的是A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体B.葡萄糖可以发生氧化反应和银镜反应,说明葡萄糖具有还原性C.通过盐析从溶液中析出的蛋白质仍能溶解于水D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠5、下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是A.铁电极应与Y 相连接B.H+透过质子交换膜由右向左移动C.当N 电极消耗0.25mol 气体时,则铁电极增重16gD.M 电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+6、下列涉及有机物的性质或应用的说法不正确的是A.淀粉、纤维素、蛋白质都是天然高分子化合物B.酶是一类特殊的蛋白质,是生物体内重要的催化剂C.从牛奶中提取的酪素,可以用来制作食品和塑料D.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应7、下列说法中正确的是A.丙烯分子所有原子均在同一平面上B.向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同C.C4H4只有和CH C-CH=CH2 两种同分异构体D.芳香烃和的一氯代物都只有2 种8、将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收B.产物的平均摩尔质量为24g/molC.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3D.反应中消耗的氧气为56g9、ClO2是一种高效安全的杀菌消毒剂。

辽宁省高二上学期期末化学试卷(文科)姓名:________ 班级:________ 成绩:________一、选择题 (共15题;共30分)1. (2分)下列物质与危险化学品标志的对应关系不正确的是()A . AB . BC . CD . D2. (2分) (2020高二下·辽源期末) 下面的排序错误的是()A . 晶体熔点由低到高:CF4﹤CCl4﹤CBr4﹤CI4B . 硬度由大到小:金刚石>碳化硅>晶体硅C . 酸性:HClO4>H2SO4>H3PO4>H2SiO3D . 晶格能由大到小: NaI>NaBr> NaCl>NaF3. (2分) (2017高二上·宁城期末) 下列表述中,合理的是()A . 准确量取20.00mL高锰酸钾溶液,可选用25mL碱式滴定管B . 将水加热,Kw增大,pH不变C . 用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol 电子转移时,阴极析出6.4g金属D . NaAlO2的水溶液经加热浓缩、蒸干灼烧后能得到NaAlO2固体4. (2分) (2016高一上·石嘴山期中) NA为阿伏加德罗常数,下列叙述错误的是()A . 18gH2O中含的质子数为10NAB . 1.7克H2O2中含有的电子数为0.9 NAC . 46gNO2和N2O4混合气体中含有原子总数为3NAD . 1 mol Na 与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子5. (2分) (2017高一上·红桥期中) 下列关于物质分类及反应类型关系示意图正确的是()A .B .C .D .6. (2分) (2018高二下·广州期中) 环境问题是当今社会大家关注的重大问题。
下列因果关系错误的是()A . 粉尘较多的环境——易患(诱发)肺病B . NO2和SO2排入大气中——导致酸雨C . 汽车尾气(含氮的氧化物等)——造成光化学烟雾D . 滥用化肥及含磷洗衣粉——重金属元素污染水土7. (2分)下列说法正确的是()A . 向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色B . 欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶C . 漂白粉的有效成分是CaCl2和Ca(ClO)2 ,应密封保存D . 实验室用MnO2和稀HCl加热法制取Cl2 ,若有14.6 gHCl参加反应,则可制得7.1 g Cl28. (2分)随着建筑装饰材料进入百姓家庭,某些装饰不久的居室由于装饰材料释放出来的污染物浓度过高,影响人体健康。

沈阳市高二上学期化学期末考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共20题;共20分)1. (1分) (2017高二上·攀枝花期中) 将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:⑴反应所需时间:乙<甲⑵开始时反应速率:甲>乙⑶参加反应的锌的质量:甲=乙⑷整个反应阶段的平均速率:乙>甲⑸盛盐酸的容器中有锌剩余⑹盛醋酸的容器中有锌剩余.以上判断正确的是()A . (1)(2)(3)(5)B . (1)(3)(5)C . (2)(3)(6)D . (1)(3)(4)(5)2. (1分) (2016高三上·青海期中) 一定条件下,碳钢腐蚀与溶液pH的关系如下:下列说法不正确的是()A . 在pH<4溶液中,碳钢主要发生析氢腐蚀B . 在pH>6溶液中,碳钢主要发生吸氧腐蚀C . 在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e﹣═2H2OD . 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓3. (1分)下列仪器中,常用于物质分离的是()A . ①③④B . ②③④C . ②④D . ①②④4. (1分)强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ/mol,向1 L 0.5 mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3 ,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是()A . ΔH1>ΔH2>ΔH3B . ΔH1<ΔH3<ΔH2C . ΔH2>ΔH1>ΔH3D . ΔH1>ΔH3>ΔH25. (1分)分析右面的能量变化示意图,确定下列选项中正确的是()A . 2A(g)+B(g)=2C(g)△H<0B . 2A(g)+B(g)=2C(g)△H>0C . 2A+B=2C△H<0D . 2C=2A+B△H<06. (1分)某反应2AB(g)⇌C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为()A . △H<0,△S>0B . △H<0,△S<0C . △H>0,△S>0D . △H>0,△S<07. (1分) (2018高二上·安平期中) 使10 mL浓度为1 mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的量的是()A . KNO3B . CH3COONaC . CuSO4D . Na2CO38. (1分) (2020高二上·那曲期末) 一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)4NO2(g) + O2(g)ΔH>0。
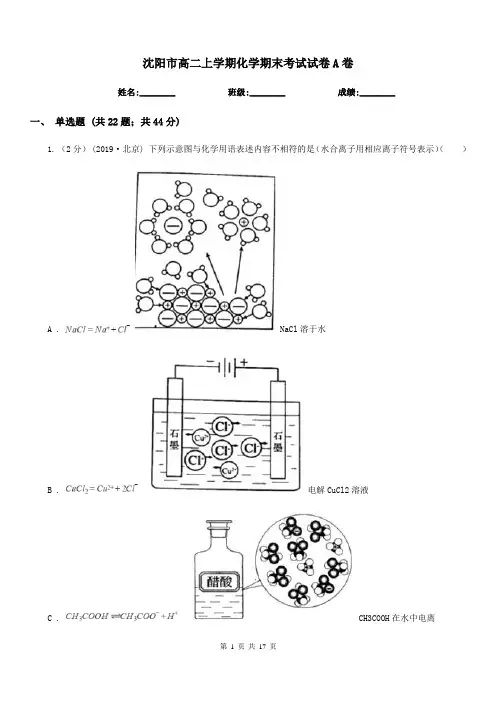
沈阳市高二上学期化学期末考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共22题;共44分)1. (2分)(2019·北京) 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)()A . NaCl溶于水B . 电解CuCl2溶液C . CH3COOH在水中电离D . H2(g)+Cl2(g)=2HCl(g) △H=183kJ·mol-1 H2与Cl2反应能量变化2. (2分) (2018高二上·惠州期末) 治理被酸雨侵蚀过的酸性土壤,可以加入适量的()A . Ca(OH)2B . KNO3C . SiO2D . NaCl3. (2分) (2018高三下·姜堰开学考) 下列指定反应的离子方程式正确的是()A . 向Na2SiO3溶液中通入过量CO2: SiO32-+CO2+H2O = H2SiO3↓+CO32-B . 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2OC . 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-= Mg(OH)2↓D . 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑4. (2分)已知反应X+Y═M+N为放热反应,对该反应的说法正确是()A . X的能量一定高于MB . Y的能量一定高于NC . X和Y的总能量一定高于M和N的总能量D . 因为该反应为放热反应,故不必加热就可发生5. (2分) (2014高二下·资阳期末) 在下列溶液中,一定能大量共存的离子组是()A . 常温下=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-B . 含有大量Al3+的溶液中:SO42-、S2-、AlO2-、ClO-、C . 能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-D . 常温下,在由水电离出的c(H+)=1×10-13 mol·L-1的溶液中:K+、Fe3+ 、Cl-、SO42-6. (2分)为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列六步操作:①过滤,②加稍过量的NaOH溶液,③向滤液中加适量盐酸,④加稍过量的Na2CO3溶液,⑤加稍过量的BaCl2溶液,⑥将滤液蒸发结晶.下列各组操作顺序合理的是()A . ②④⑤①③⑥B . ⑤②④①③⑥C . ④②⑤①③⑥D . ②⑤④③①⑥7. (2分) (2018高二下·房山期中) 如图所示,能表示人体大量喝水时,胃液的pH变化的图像是()A .B .C .D .8. (2分) (2018高二上·慈溪期中) 10mL浓度为1mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是()A . CH3COOHB . K2SO4C . CuSO4D . Na2CO39. (2分) (2016高一下·大庆期中) 在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)⇌C(g)+D(g)已达到平衡状态()①混合气体的压强②混合气体的质量③各气体物质的物质的量浓度④气体的总物质的量⑤混合气体的平均相对分子质量.A . ①②③B . ②③⑤C . ②③④⑤D . ①③④⑤10. (2分) (2018高二上·唐山期中) 在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是()①增大压强②增加炭的量③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升温A . ①③④B . ①③⑥C . ②④⑥D . ③⑤⑥11. (2分) (2017高二上·涡阳期末) 常温下,向100mL 0.01mol•L﹣1的HA溶液中逐滴加入0.02mol•L﹣1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是()A . HA为弱酸B . 常温下,MA溶液的pH>7C . K点对应的溶液中:c(M+)+c(MOH)=c(A﹣)D . 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH﹣)+c(A﹣)12. (2分)(2018·乌鲁木齐模拟) 某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。

同泽女中2011-2012学年度高二上学期期末考试语文试题注意事项:本试卷分第I卷(阅读题)和第Ⅱ卷(表达题)两部分,其中第Ⅱ卷第三、四题为选考题,其它题为必考题。
考生作答时,务必先将自己的姓名、学号填写在答题纸上考试结束只交答卷纸。
第Ⅰ卷阅读题(共70分)甲必考题(45分)一、社科类现代论述文阅读(9分)阅读下面的文字,完成文后1-3题。
(每小题3分)河南文物局提出确认曹操墓葬六大依据张波身为古代伟人,曹操的名字可谓家喻户晓。
作为中国历史上第一位提出“薄葬”的帝王,曹操墓到底在哪里?1000多年来,众说纷纭,谜团重重。
日前,国家文物局郑重公布,安阳县安丰乡西高穴村村南的一座东汉大墓,就是传说中的魏武王曹操高陵墓。
该大墓的平面为甲字形,坐西向东,是一座带斜坡墓道的双室砖券墓,规模宏大,结构复杂,主要由墓道、前后室和四个侧室构成。
斜坡墓道长39.5米,宽9.8米,最深处距地表约15米;墓圹平面略呈梯形,东边宽22米,西边宽19.5米,东西长18米;大墓占地面积约740平方米。
该墓曾数次被盗掘,但仍幸存一些重要的随葬品。
这批文物中,尤其以刻铭石牌和遗骨最为珍贵。
此次共出土刻铭石牌59件,有长方形、圭形等,铭文记录了随葬物品的名称和数量。
其中8件圭形石牌极为珍贵,分别刻有“魏武王常所用格虎大戟”、“魏武王常所用格虎大刀”等铭文。
在追缴回的该墓被盗的一件石枕上,刻有“魏武王常所用慰项石”铭文。
这些出土文字材料,为研究确定墓主身份提供了重要的、最直接的依据。
除上述器物外,该墓还出土有大量画像石残块。
在墓室清理中,考古人员还发现有人头骨、肢骨等部分遗骨,其中,墓主人为男性,年龄在60岁左右。
经鉴定,他就是传说中的曹操。
做出这样的判断究竟有哪些有力证据呢?第一,这座墓葬规模巨大,总长度近60米,砖券墓室的形制和结构与已知的汉魏王侯级墓葬类似,与曹操魏王的身份相符;该墓未发现封土,也与文献记载曹操寿陵“因高为基,不封不树”的情况相符合。
沈阳二中2013——2014学年度上学期期末考试高二(15届)化学试题说明:1.测试时间:90分钟总分:100分2.客观题涂在答题纸上,主观题答在答题纸的相应位置上可能用到的相对原子质量:H:1 O:16 C:12 S:32 Ca:40 Al:27 Cl:35.5Na:23 Cu:64 Fe:56 K:39 Ag:108 Zn:65第Ⅰ卷(50分)一、选择题(本题包括10小题,每小题2分,共20分。
每小题只有一个正确答案)1.下列电子排布图所表示的元素原子中,其能量处于最低状态的是( )A.①② B.②③ C.③④ D.③⑤2.下列说法中不正确的是( ) A.s轨道不能参与形成π键B.ss σ键与sp σ键的电子云形状对称性相同C.碳碳双键的键能是碳碳单键键能的2倍D.N2分子中有一个σ键,2个π键3.下列分子中,属于非极性分子的是( )①SO2②BeCl2③BBr3④COCl2A.①② B.②③ C.③④ D.①④4.据报道,科学家开发出了利用太阳能分解水的新型催化剂。
下列有关水分解过程的能量变化示意图正确的是( )5.可逆反应m A(g)+n B(g)p C(g)+g D(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
①a1=a2②a1<a2③b1=b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等⑧图乙中阴影部分面积更大以上所列正确的为( ) A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧6.下列说法正确的是( )A.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性B.25 ℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐C.25 ℃时,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍D.100 ℃时某溶液中由水电离产生的c(H+)=1×10-11mol·L-1,则该溶液的pH可能是11或37.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是 ( )A.配制标准溶液的固体KOH中混有NaOH杂质B.滴定终点读数时,仰视滴定管的刻度,其他操作正确C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液8.分别用pH=2和pH=3的醋酸溶液中和等物质的量的苛性钾溶液,消耗两种醋酸溶液的体积分别为V1和V2。
2020年辽宁省沈阳市第十一高级中学高二化学上学期期末试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列各装置中,能构成原电池的是()A B C D参考答案:A略2. 丁腈橡胶的结构简式为具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是()①CH2===CH—CH===CH2②CH3—C≡C—CH3③CH2===CH—CN④⑤CH3—CH===CH2⑥CH3—CH===CH—CH3A.③⑥ B.②③C.①③ D.④⑤参考答案:C略3. 下列说法中,正确的是()A.含氧的化合物一定是氧化物B.酸根中不一定含有氧元素C.盐的组成中一定含有金属元素D.酸中一定不含金属元素参考答案:B略4. 相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2 mol,Y:1 mol ) 乙(X:1 mol,Y:1 mol )丙(X:2 mol,Y:2 mol ) 丁(X:1 mol,Y:2 mol )在相同温度下,建立平衡时,X或Y的转化率大小关系为A.X的转化率为:甲<丙<乙<丁 B.X的转化率为:甲<乙<丙<丁C.Y的转化率为:甲>丙>乙>丁 D.Y的转化率为:丁>乙>丙>甲参考答案:A略5. 有关氧化还原反应的叙述不正确的是A.氧化剂本身发生氧化反应B.氧化还原反应的实质是元素化合价的升降C.阳离子只有氧化性,阴离子只有还原性D.物质所含元素化合价升高的反应是氧化反应参考答案:ABC6. 取少量某有机物分别进行如下实验,结果是①能使酸性高锰酸钾溶液褪色;②与水混合静置后分层;③加入滴有酚酞试液的强碱共热后酚酞变无色。
此有机物是A.乙酸钠 B.油酸甘油酯 C.乙酸乙酯 D.甲苯参考答案:B略7. 下列电离方程式中正确的是()A.Na2CO3 2Na+ + CO32-B.H2CO3 2H+ + CO32-C.NH3·H2O NH3 + H2O D.H2SO3 H+ + HSO3-参考答案:D略8. 下列叙述从化学角度分析,其中不正确的是()A.蜂蚁蜇咬人的皮肤时,会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛B.氟利昂(CF2Cl2)或NO2都可破坏臭氧层导致“温室效应”C.向燃料煤中加入生石灰,可减少对大气的污染D.甲醛可以消毒杀菌,常用于制作动物标本,但不可以保存海鲜参考答案:B略9. 人剧烈动动,骨骼肌组织会供氧不足,导致葡萄糖无氧氧化,产生大量酸性物质(分子式为C3H6O3),如果该物质过度堆积于腿部,会引起肌肉酸痛。
同泽女中2011-2012学年度上学期末考试高二化学考试时间;90分钟 满分:100 分(可能用到的相对原子质量:H-1 C-12 O-16 )客观题(60分)一、选择题(下列每题只有一个正确选项,每小题4分,共60分)1、下列关于反应热的说法正确的是( ) A .当∆H ﹤0时,表示该反应为吸热反应 B .已知C(s)+21O 2(g)=CO(g) △H=-110.5kJ/mol ,说明碳的燃烧热为110.5kJ/mol C .反应热的大小与反应物所具有的能量和生成物所具有的能量无关D .化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 2、同温同压下,已知下列各反应为放热反应,下列各热化学方程式中△H 最小的是( ) A .2A (l) + B (l) = 2C (g) △H 1 B .2A (g) + B (g) = 2C(g) △H 2 C .2A (g) + B (g)= 2C (l) △H 3 D .2A (l)+ B (l) = 2C(l) △H 43、用铜片、银片设计成如图所示的原电池。
以下有关该原电池的叙述正确的是( )A .电子通过盐桥从乙池流向甲池B .铜导线替换盐桥,原电池仍继续工作C .开始时,银片上发生的反应是:Ag —e = Ag +D .将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同4、钢铁在潮湿的空气中会被腐蚀,会发生的原电池反应。
以下说法正确的是( ) A .负极发生的反应为:Fe -3e - = Fe 3+B .正极发生的反应为:2H 2O+O 2+4e - = 4OH -C .原电池是将电能转变为化学能的装置D .钢铁在水下部分比在空气与水交界处更容易腐蚀5、微型钮扣电池在现代生活中有广泛应用。
有一种银锌电池,其电极分别是Ag 2O 和Zn ,电解质溶液为KOH ,电极反应为:Zn+2OH --2e-=ZnO+H 2O ;Ag 2O+H 2O+2e-=2Ag+2OH -。
根据上述反应式,判断下列叙述中正确的是( ) A.在使用过程中,电池负极区溶液的pH 增大 B.电子由Ag 20极经外电路流向Zn 极C.Zn 是负极,Ag 2O 是正极D.Zn 电极发生还原反应,Ag 2O 电极发生氧化反应 6、下列有关沉淀溶解平衡的说法正确的是( ) A.K SP (AB 2)小于K SP (CD),则AB 2的溶解度小于CD 的溶解度B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的K SP 增大C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动7、把80mL 盐酸加入120mLNaOH 溶液中,所得溶液的pH 为12。
如果混合前NaOH 溶液和盐酸的物质的量浓度相同,它们的浓度是( )A .0.05mol/LB .0.1mol/LC .0.5mol/LD .1mol/L 8、己知:HCN(aq)与NaOH(aq)反应的=—12.1kJ·mol -1;HCl(aq)与NaOH(aq)反应的=—55.6 kJ·mol -1。
则HCN 在水溶液中电离的反应热等于( )A .—67.7 kJ·mol -1B .—43.5 kJ·mol -1C .+43.5 kJ·mol -1D . +67.7 kJ·mol -1 9、对于可逆反应A (g )+2B(g)2C(g) ΔH ﹥0,下列图象中正确的是 ( )10、反应CO(g)+NO 2(g) CO 2(g)+NO(g);ΔH <0,在温度t 1时达到平衡,c 1(CO)=c 1(NO 2)=1.0 mol·L -1,其平衡常数为K 1。
其他条件不变,升高反应体系的温度至t 2时,反应物的平衡浓度分别为c 2(CO)和c 2(NO 2),平衡常数为K 2,则( )A .若增大CO 浓度,K 2 和K 1都增大B .K 2 >K 1C .c 2(CO)=c 2(NO 2)D .c 1(CO)>c 2(CO)11、25℃时,水的电离达到平衡:H 2O H ++OH —;ΔH >0,下列叙述正确的是( )A .向水中加入稀氨水,平衡逆向移动,c(OH ―)降低B .向水中加入少量固体硫酸氢钠,c(H +)增大,K w 不变C .向水中加入少量固体CH 3COONa ,平衡逆向移动,c(H +)降低 D .将水加热,K w 增大,pH 不变12、常温下,设pH 均为5的H 2SO 4和A12(SO 4)3溶液中由水电离出的c (H +)分别为c 1 、c 2,则c 1/c 2是( )A .1B .104C .10-4D .10-1413、某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,pH 随溶液体积变化的曲线如右图所示。
据图判断正确的是( ) A .II 为盐酸稀释时的pH 值变化曲线B .b 点溶液的导电性比c 点溶液的导电性强C .a 点K W 的数值比c 点K w 的数值大D .b 点酸的总浓度大于a 点酸的总浓度14、某温度下,Fe(OH)3(S)和Cu(OH)2(S)分别在溶液中达到沉淀溶解平衡后,改变溶液pH ,时间时间时间压强金属阳离子浓度的变化如图所示。
据图分析,下列判断错误..的是( ) A .[][]2F OH C OH sp sp K e K 3()<u () B .加适量4NH Cl 固体可使溶液由a 点变到b 点C .c d 、两点代表的溶液中H c +()与OH c -()乘积相等D .Fe(OH)3、Cu(OH)2分别在b 、c 两点代表的溶液中达到饱和 15、常温下,用 0.1000 mol·L1-NaOH 溶液滴定 20.00mL0.1000 mol·L1-3CH COOH 溶液所得滴定曲线如右图。
下列说法正确的是( )A .点①所示溶液中:()()()()33CH COO OH CH COOH H c c c c --++=+B .点②所示溶液中:()()()33Na CH COOH CH COO c c c +-=+ C .点③所示溶液中:()()()()3Na OH CH COO H c c c c +--+>>>D .滴定过程中可能出现:()()()()()33CH COOH CH COO H Na OH c c c c c -++->>>>主观题(40分)二、填空题16、(10分)(1)根据所学化学反应原理填空:① 升高温度时,水的pH (填“增大”“减小”或“不变”)②体积、pH 均相同的盐酸和醋酸溶液,中和等浓度的NaOH 溶液时所需体积分别为V 1、V 2 。
则V 1 V 2(填“<”、“>”或“=”)③某反应放热且熵增加,该反应 自发进行(用“能”或“不能”表示) (2)依据事实,用化学用语填空:①1 mol NO 2气体与水完全反应生成硝酸溶液和NO 气体,放出热量46 kJ 。
该反应的热化学方程式______________________________________。
②用离子方程式表示氯化铵溶液的酸碱性:_ 。
③用离子方程式表示向碳酸镁沉淀中加入NaOH 溶液后的沉淀转化:。
17、(10分)在一定体积的密闭容器中,进行如下化学反应: CO 2(g )+H 2(g ) CO (g )+H 2O (g ),其化学平衡常数K 和温度t 的关系如下表:回答下列问题:(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。
在其他条件不变的情况下,扩大容器的体积,平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO 、5mol H 2O ,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”) (5)若1200℃时,在某时刻平衡体系中CO 2、H 2、CO 、H 2O 的浓度分别为2 mo l ·L -1、2 mo l ·L -1、4 mo l ·L -1、4 mo l ·L -1,则此时上述反应的平衡移动方向为 。
(选填“正反应方向”、“逆反应方向”、“不移动”) 18、(10分)某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下:实验过程中溶液pH 控制及所用的物质x ,y表I 表II请填写下列空白(1)溶液I 一定含有的金属阳离子是 ;沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂x 可选用表Ⅱ中的 (填序号,且选出全部合理的)。
(3)步骤③加入的试剂y 可选用表Ⅱ中的 (填序号,且选出全部合理的)。
(4)步骤⑤要得到无水CuCl 2,应控制的一定条件是 。
19、(10分)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:溶液II请回答下列问题:(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸。
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2mol/L (填“是”或“否”)。
混合溶液中c(A-)与c(Na+)离子浓度的大小关系是(填序号)。
A.前者大B.后者大C.一样大D.无法判断(3)从丙组结果分析,HA是酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L写出该混合溶液中下列算式的精确结果(不能做近似计算) c(Na+)—c(A-)= mol/L同泽女中2011-2012学年度上学期末考试高二年级化学科目试题答案客观题(60分)一、选择题(下列每题只有一个正确选项,每小题4分,共60分)主观题(40分)二、填空题16、(10分)(1)①减小(1分)②<(2分)③能(1分)(2) ① 3NO2(g)+H2O(l)==2HNO3(aq)+NO(g) ∆H=-138kJ/mol(2分)②NH 4++H2O NH3⋅H2O+H+(2分)③ MgCO3+2OH-==Mg(OH)2+CO32-(2分)。