第十二章 配位化合物
- 格式:docx
- 大小:147.04 KB
- 文档页数:14


配位化合物第一节配位化合物的基本概念一、配位化合物的定义在CuSO4溶液中加少量氨水,生成浅蓝色Cu(OH)2↓,再加入氨水,沉淀溶解变成深蓝色溶液,加入乙醇,降低溶解度,得到深蓝色晶体,该晶体经元素分析,得知含Cu、SO42-、4NH3、H2O;取深蓝色溶液,加BaCl2,生成白色BaSO4↓,说明存在SO42-,加少量NaOH,无Cu(OH)2↓和NH3产生,说明溶液中不存在Cu2+和NH3分子,从而分析其结构为:[Cu(NH3)4]SO4·H2OCu和NH3之间的加合,既无氧化数的变化,也没有提供单电子配对而形成共价键,不符合经典的化合价理论。
这类化合物就是配合物。
二、配位化合物的组成1893年,维尔纳(A. Werner)提出配位理论。
1、配离子可以是阴或阳离子2、中心离子:简单阳离子,特别是过渡金属离子,也有金属原子。
位于配离子的中心。
3、配体:位于中心离子周围,可以是中性分子,也可以是负离子。
其特点是配位原子含有孤对电子。
能作为配位原子的元素主要有:N、O、C、S及卤素等。
4、配位数:配合物中,配位原子的总数。
决定于中心离子和配位体的性质,其电荷、体积、电子层结构及它们之间相互影响,形成时的条件(T、C)中心离子的电荷:+1 +2 +3 +4特征配位数: 2 4(或6) 6(或4) 6(或8)三、配位化合物的命名服从一般无机化合物的命名原则。
如果化合物的负离子是一个简单离子,叫某"化"某;如果化合物的负离子是一个复杂离子,叫某"酸"某。
络合物内界命名次序为:配位数(一、二、三、四)-配位体名称-"合"(表示配位结合)-中心离子名称-中心离子氧化数(Ⅰ、Ⅱ、Ⅲ、Ⅳ)例:[Co(NH3)6]Cl3[Pt(NH3)4](OH)2K2[PtCl6] H2[PtCl6]氯化六氨合钴(Ⅲ)氢氧化四氨合铂(Ⅱ)六氯合铂(Ⅳ)酸钾六氯合铂(Ⅳ)酸不止一种配体:先列阴离子,后列中性分子,若配体同是阴离子或中性分子,则按配位原子元素符号的英文次序排列。



配位化合物教案一、引言配位化合物是无机化学中具有重要意义的一类化合物,它们由中心金属原子与周围的配体通过配位键结合而成。
本教案将详细介绍配位化合物的基本概念、性质、结构和应用。
二、配位化合物的基本概念1. 配位键:配位化合物是通过中心金属原子与配体之间的配位键结合而成的。
配位键的形成是通过配体的一个或多个孤对电子与中心金属原子的空轨道形成的。
2. 配体:配位化合物中与中心金属原子形成配位键的分子或离子称为配体,常见的配体有氨、氯化物离子、水和羰基等。
3. 配位数:一个中心金属原子周围配位的配体个数称为配位数,配位数通常能够反映配位化合物的稳定性和几何结构。
三、配位化合物的性质1. 颜色:许多配位化合物呈现出艳丽的颜色,这是由于配体和中心金属原子之间的电荷转移和d轨道电子跃迁所致。
2. 成分:配位化合物的成分通常以化学式表示,中心金属原子的名称位于前面,配体的名称位于后面,成分中可包含水合物、氯化物等信息。
3. 稳定性:配位化合物的稳定性与中心金属原子的电子结构、配体的性质以及配位数等因素密切相关。
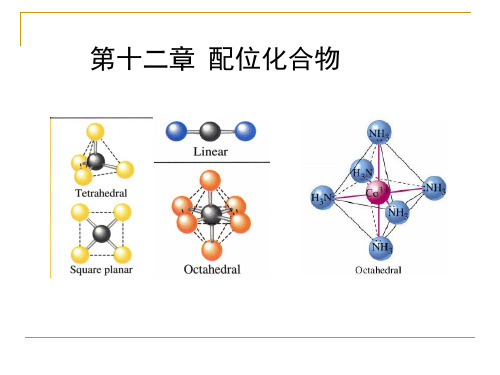
四、配位化合物的结构1. 八面体结构:当中心金属原子的配位数为6时,常见的结构是八面体结构,此结构对应配位数为6的稳定几何结构。
2. 四面体结构:当中心金属原子的配位数为4时,常见的结构是四面体结构,此结构对应配位数为4的稳定几何结构。
3. 六角形平面结构:当中心金属原子的配位数为6时,常见的结构是六角形平面结构,此结构对应配位数为6的稳定几何结构。
五、配位化合物的应用1. 工业应用:配位化合物广泛应用于工业生产中,用作催化剂、染料、药物等。
2. 生物学应用:配位化合物在生物学领域具有重要应用,可用于生物标记、药物传递等领域。
3. 环境应用:配位化合物也可应用于环境保护领域,用于污水处理、废水处理等方面。
六、总结配位化合物是无机化学中的重要研究对象,具有丰富的性质和广泛的应用价值。
通过本教案的学习,希望能够深入了解配位化合物的基本概念、性质、结构和应用,为进一步的学习和研究提供帮助。

第十二章配位化合物12.1 配合物的基本概念12.1.1配合物的定义历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3(普鲁士蓝)。
它是在1704年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离技术、新材料的制取和分析;50年代开展的配位催化,以及60年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
配合物的形成:在CuSO4溶液中加入氨水,首先得到难溶物,继续加氨水,难溶物溶解,得到透明的深蓝色的溶液。
蓝色物质为复杂离子[Cu(NH3)4]2+ ,蒸发该溶液析出深蓝色晶体,其化学组成为[Cu(NH3)4]SO4·H2O。
在纯的[Cu(NH3)4]SO4溶液中,除了水合硫酸根离子和深蓝色的[Cu(NH3)4]2+离子外,几乎检查不出Cu2+离子和NH3分子的存在。
[Cu(NH3)4]2+这种复杂离子不仅存在于溶液中,也存在于晶体中。
从上面实例可以看出,这些复杂离子至少不符合经典原子价理论,在晶体和溶液中有能以稳定的难离解的复杂离子存在的特点。
由于这类化合物的组成比较复杂,要给它下一个严密的定义是很困难的。
从实质上看,配合物中存在着与简单化合物不同的键--配位键,这才是配合物的本质特点。
因此把配合物的定义可归纳为:中国化学会在1980年制订的《无机化学命名原则》中对配合物作了如下的定义:配位化合物(简称配合物)是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。





LOGO第十二章 配位化合物 ( coordination compound )第一节 配位化合物的基本概念一、配位化合物的定义CuSO4(蓝色溶液)+NaOH→Cu(OH)2(蓝色↓) +BaCl2 →BaSO4(白色↓ )CuSO4(蓝色溶液)+NH3(浓)→ 深蓝色溶液 蓝色晶体:1.没有氨臭→无游离的氨2. +NaOH: (-) →无游离的Cu2+ 3. +BaCl2 :(+) →有游离的SO42Cu2+与NH3形成了一种复杂离子[ Cu ( NH3 ) 4] 2+第一节 配位化合物的基本概念定义:配离子:由简单阳离子(或原子)和一定数 目的中性分子或阴离子配体通过 配位键结合,并按一定的组成和 空间构型所形成的复杂离子配合物:含有配离子的化合物或配分子第一节 配位化合物的基本概念二、配合物的组成 [ Cu ( NH3 ) 4] SO4(inner sphere)内界(离子键)外界(outer sphere) [ Cu ( NH3 ) 4]2+中心原子Cu2+ 配体NH3 配位原子:N 配位键:中心原子Cu2+提供空轨道 配位原子N提供孤对电子第一节 配位化合物的基本概念配合物的结构离子键 配位键K4+┆ [Fe┆(CN)6] 4中心原子 配体外界内界配合物第一节 配位化合物的基本概念中心原子(central atom):一般为副族元素 配体(ligand):一般为负离子或中性分子 如:H2O、CO、NH3 、 X- 、 OH- 、 CN、 NO2-、ONO-、SCN-、NCS-、乙二胺 等。
配位原子(donor atom):提供孤对电子的 原子。
1第一节 配位化合物的基本概念第一节 配位化合物的基本概念配位数(coordination number) =配位原子个数 ≠配体个数:一般为2,4,6单齿配体(monodentate ligand) :一个配体内一 个配位原子配位数=配位原子个数= 配体个数多齿配体(multidentate ligand) :一个配体内多 个配位原子配位数=配位原子个数≠ 配体个数第一节 配位化合物的基本概念乙二胺:H2NCH2CH2NH2 [Cu(en)2]SO4 配位数=4乙二胺四乙酸(EDTA):一个分子有六个配位原子HOOCCH 2 HOOCCH 2NCH 2CH 2NCH 2COOH CH 2COOH第一节 配位化合物的基本概念影响配位数的因素1.中心原子的体积和电荷 2.配体的体积和电荷 3.中心原子和配体的半径 4.配体的浓度和反应时温度第一节 配位化合物的基本概念三、配合物的命名1.配离子:配体数—配体名称—“合”—中心原 子名称(氧化数)(用罗马字表示)Cu(NH3)42+ 四氨合铜(II)配离子 2.多配体:先无机后有机,先阴后中,先简单 后复杂,最后以配位原子元素的英文字母顺 序先后排列[Co(OH)2(NH3)4]+ 二羟•四氨合钴(III)配离子第二节 配合物的化学键理论一、价键理论 (一)要点:1.中心原子与配体之间的化学键是配位键。
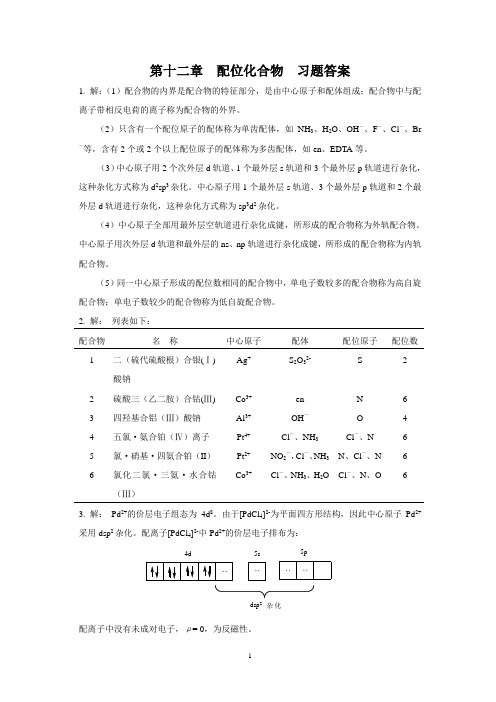
第十二章 配位化合物 习题答案1. 解:(1)配合物的内界是配合物的特征部分,是由中心原子和配体组成;配合物中与配离子带相反电荷的离子称为配合物的外界。
(2)只含有一个配位原子的配体称为单齿配体,如NH 3、H 2O 、OH -、F -、Cl -、Br-等,含有2个或2个以上配位原子的配体称为多齿配体,如en 、EDTA 等。
(3)中心原子用2个次外层d 轨道、1个最外层s 轨道和3个最外层p 轨道进行杂化,这种杂化方式称为d 2sp 3杂化。
中心原子用1个最外层s 轨道、3个最外层p 轨道和2个最外层d 轨道进行杂化,这种杂化方式称为sp 3d 2杂化。
(4)中心原子全部用最外层空轨道进行杂化成键,所形成的配合物称为外轨配合物。
中心原子用次外层d 轨道和最外层的ns 、np 轨道进行杂化成键,所形成的配合物称为内轨配合物。
(5)同一中心原子形成的配位数相同的配合物中,单电子数较多的配合物称为高自旋配合物;单电子数较少的配合物称为低自旋配合物。
2. 解: 列表如下: 配合物 名 称中心原子 配体 配位原子配位数 1二(硫代硫酸根)合银(Ⅰ) 酸钠 Ag +S 2O 32-S22 硫酸三(乙二胺)合钴(Ⅲ) Co 3+ en N 63 四羟基合铝(Ⅲ)酸钠 Al 3+ OH -O 4 4 五氯·氨合铂(Ⅳ)离子 Pt 4+ Cl -、NH 3Cl -、N6 5 氯·硝基·四氨合铂(II ) Pt 2+ NO 2-,Cl -、NH 3 N 、Cl -、N 6 6氯化二氯·三氨·水合钴(Ⅲ)Co 3+Cl -、NH 3、H 2O Cl -、N 、O63. 解: Pd 2+的价层电子组态为4d 8。
由于[PdCl 4]2-为平面四方形结构,因此中心原子Pd 2+采用dsp 2杂化。
配离子[PdCl 4]2-中Pd 2+的价层电子排布为:配离子中没有未成对电子,μ= 0,为反磁性。

高二化学知识点总结配位化合物的性质与应用配位化合物是由中心金属离子与周围的配位体通过配位键连接而形成的化合物。
这类化合物在化学领域中具有重要的性质与应用。
本文将对配位化合物的性质与应用进行总结,并介绍其相关知识点。
以下是对配位化合物的性质与应用的简要概述。
一、配位化合物的性质1. 配位数:指配位体与中心金属离子之间的配位键数量。
不同的配位数决定了化合物的结构和性质。
常见的配位数有四、五、六等。
2. 配位键的极性:配位键的极性直接影响了配位化合物的稳定性和反应性。
极性较大的配位键通常会增强化合物的稳定性。
3. 配位体的电荷:配位体可以是带正电荷、负电荷或中性的。
不同的配位体会带来不同的电荷效应,影响化合物的稳定性和反应性。
4. 配合物的颜色:一些配位化合物具有明显的颜色,在可见光范围内吸收和反射特定波长的光。
这是由于电子跃迁引起的,这一性质在颜料工业和光学领域中具有重要应用。
二、配位化合物的应用1. 催化剂:许多配位化合物具有催化作用,可在化学反应中降低活化能,提高反应速率。
例如铂金等贵金属配合物可用作催化剂,在石油加工、有机合成等领域广泛应用。
2. 荧光探针:一些配位化合物具有荧光性质,能够被用作荧光探针。
通过观察其发射的特定波长的荧光,可以实现对生物分子的检测和成像。
3. 医药应用:一些配位化合物被用作药物的配体,与靶分子结合以达到治疗目的。
例如,白金配合物是一类抗癌药物的重要成分之一。
4. 金属离子的分离与富集:通过合适的配体选择,可以实现金属离子的选择性分离和富集。
这在环境监测和资源回收等领域具有重要意义。
5. 电子材料:某些配位化合物具有导电、半导体或磁性等特性,可用于电子材料的制备。
例如,一些含过渡金属离子的配合物被应用于显示器和传感器等领域。
综上所述,配位化合物的性质与应用具有广泛的研究价值和实际应用前景。
了解并掌握相关的化学知识点对于深入理解和应用配位化合物至关重要。
通过进一步研究与探索,我们可以不断拓展对配位化合物的认识,并为科学研究和工业生产做出更多贡献。

第十二章配位化合物12.1 配合物的基本概念12.1.1配合物的定义历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3(普鲁士蓝)。
它是在1704年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离技术、新材料的制取和分析;50年代开展的配位催化,以及60年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
配合物的形成:在CuSO4溶液中加入氨水,首先得到难溶物,继续加氨水,难溶物溶解,得到透明的深蓝色的溶液。
蓝色物质为复杂离子[Cu(NH3)4]2+ ,蒸发该溶液析出深蓝色晶体,其化学组成为[Cu(NH3)4]SO4·H2O。
在纯的[Cu(NH3)4]SO4溶液中,除了水合硫酸根离子和深蓝色的[Cu(NH3)4]2+离子外,几乎检查不出Cu2+离子和NH3分子的存在。
[Cu(NH3)4]2+这种复杂离子不仅存在于溶液中,也存在于晶体中。
从上面实例可以看出,这些复杂离子至少不符合经典原子价理论,在晶体和溶液中有能以稳定的难离解的复杂离子存在的特点。
由于这类化合物的组成比较复杂,要给它下一个严密的定义是很困难的。
从实质上看,配合物中存在着与简单化合物不同的键--配位键,这才是配合物的本质特点。
因此把配合物的定义可归纳为:中国化学会在1980年制订的《无机化学命名原则》中对配合物作了如下的定义:配位化合物(简称配合物)是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
1.配位键:是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
例如,氨气(NH3)与氯化氢(HCl)气体之间的反应。
这两种无色气体混合后,会产生厚厚的白烟。
烟是由固体小颗粒分散在空气中形成的,氨气与氯化氢气体生成的白烟是微小的氯化铵(NH4Cl)结晶。
反应的过程中,氯化氢向氨分子传递了一个氢离子(H+),氢离子依附于氨分子的未共享电子对上,使氨分子变成了铵离子( NH4+)。
氢离子是以配位键的形式依附于铵离子( NH4+)上的,氯传递到氮上边的仅为氢的原子核,氢的电子留在了氯上边并导致氯原子变为带负电的氯离子(Cl-)。
一旦铵离子形成,我们便分辨不出谁是配位共价键,谁是非配位共价键了,因为它们间找不到任何区别。
配位键的表示:如下图所示,我们用箭头表示配位键。
箭头发自提供电子对的原子,指向接受电子对的原子。
配位键形成配合物的条件:中心原子有空轨道,配体有孤对电子。
配位键的存在是配合物与其它物质最本质的区别。
2.配合物的组成配合物一般由两部分组成:内界和外界。
例如: [Cu(NH3)4]SO4内界外界具有一定稳定性的结构单元称为配合物的内界,用一中括号表示出来,其余部分称为配合物的外界。
上述配合物的内界为配阳离子。
又如: K3[Fe(CN)6]外界内界内界是配阴离子。
配合物的内界和外界以离子键相结合。
如果配合物的内界是中性分子,如[PtCl2(NH3)2]、[PtCl4]等,则这类配合物无外界。
(1)中心原子(中心离子)a.定义:配合物的形成体,形成体是配合物的核心部分,它位于配位单元的中心位置,提供接受孤电子对或不定域电子的空轨道。
过渡金属阳离子电中性金属原子b.中心原子类型阴离子如I5-{[I(I2)2]-}高氧化态的P区非金属元素例: [SiF6]2-C.根据中心原子的数目对配合物的分类:单核配合物:含有一个中心原子的配合物。
多核配合物:含有两个或两个以上中心原子的配合物。
(2)配位体和配位原子a.定义:在配合物中,与中心离子(或原子)相结合的、提供孤对电子或多个不定域电子的离子或分子,称为配位体,简称配体。
在每个配位体中,直接提供孤电子对的原子称为配位原子。
例如,NH3分子的N原子是配位原子。
通常能做配位原子的元素多为非金属原子。
b.配位体分类:按照配位原子种类的不同,可把配体分为以下几种:含氮配体如 NH3、NO(亚硝基)、 NO2(硝基)等。
含氧配体如H2O 、OH-、无机含氧酸根如CO32-、ONO-(亚硝酸根)、R—OH(醇)、R —O—R(醚)、R—COOH(羧基)等。
含碳配体如 CN、 CO(羰基)等。
含硫配体如 S2-、SCN-(硫氰酸根)、RSH(硫醇)、R2S(硫醚)含磷配体如 PH3、PR3(膦)、 PF3、PCl3、PBr3等。
卤素配体如 F-、Cl-、 Br-、I-等。
按配体中所含配体原子的数目,又可分为单齿配体和多齿配体两大类:单齿配体只含有一个配位原子的配体,叫做单齿配体,又称单基配体包括F-、Cl-、OH-、CN-等负离子和NH3、H2O、CO等中性分子。
中性分子配体和含有负离子配体的化合物,如NH3、CO、NH4F、NaCl、KCN等统称为配位剂。
多齿配体含有两个或两个以上配体原子并能同时和一个中心离子相结合的配体称为多齿配体,又称为多基配体。
例如乙二胺(en)H2N—CH2—CH2—NH2、氨三乙酸根。
由多齿配体形成的配合物又被形象地叫做螯合物。
螯合剂:提供螯合物配体的试剂。
(3)配位数直接与中心离子(或原子)结合的配位原子的数目称为该中心离子(或原子)的配位数。
配位数的计算:①配位离子(或分子)中的配体都是单齿配位时,则配位数与配位体的数目相同。
例如在[Cu(NH3)4]²+配阳离子中,Cu2+的配位数为4;在[Fe(CN)6]3-配位离子中,Fe3+的配位数为6;在[PtCl2(NH3)2]配位分子中,Pt的配位数为4。
②配位离子(或分子)中含有多齿配体时,则配位数与配体的数目不相同。
例如在[Cu(en)2]2+配阳离子有两个双齿配体,因此中心离子Cu2+的配位数为4;[Fe(en)3]3+配阳离子中,中心离子Fe3+的配位数为6;[CrCl2(en)2]+配阳离子中含有两个双齿配体和两个单齿配体,因此中心离子Cr3+的配位数为6。
应当着重指出,计算中心离子的配位数时,不能只看化合物的组成,更要看实际配位的情况,不能从表面观察,冒然下结论。
要根据实验事实来确定配位数。
Cs3CoCl5表面上猛一看可能认为Co2+离子的配位数是为5,实际上它的化学实验式经实验确定为Cs2[CoCl4]CsCl ,所以Co2+离子的配位数是4而不是5。
影响配位数大小的因素:①中心离子的性质对配位数的影响(i) 中心离子的电荷数越高,吸引配体的能力越强,容易形成高配位数,例如,Pt4+易形成6配位[PtCl6]2-,而Pt2+易形成4配位[PtCl4]2-;Cu2+易形成4配位[Cu(CN)4]2-,而Cu+易形成2配位[Cu(CN)2]-。
(ⅱ)中心离子半径较大是在它的周围可容纳较多的配体,易形成配位体。
例如Al3+与B3+价态相同,但离子半径前者(50pm)大于后者(20pm),因此它们与F-分别形成的配位离子为[AlF6]3-和[BF4]-。
但是中心离子的半径过大又削弱了它对配位体的吸引力。
反而会降低配位数。
例如IIB族的Cd2+离子半径为97pm,它与Cl-离子可形成6配位的[CdCl6]4-配离子,而半径较大的Hg2+(101pm)只能形成4配位的[HgCl4]2-配离子。
②配体的性质对配位数的影响在一般情况下配离子的中心离子都是金属阳离子,当配体带有较多的负电荷时,一方面增加了中心离子与配体的静电引力,但另一方面又增加了配体之间的斥力,有时配位数会降低。
例如,对Co2+来说,它同配体CN-可形成6配位的[Co(CN)6]4-配离子,而同配体SO42-只能形成4配位的[Co(SO4)2]2-配离子。
配体的半径较大时,在同一中心离子周围所能容纳的配体的数目减少,故配位数降低。
例如,Al3+同卤数离子形成配合物时,与半径较小的F-可形成6配位的[AlF6]3-,而与半径较大的Cl-、Br-、I-则形成4配位的[AlCl4]-、[AlBr4]-和[AlI4]-。
(4)配离子的电荷配离子所带的电荷数等于中心离子电荷数与配体总电荷数的代数和。
3.配合物的类型简单配合物按配位方式分类螯合物单核配合物按所含中心原子数目分类多核配合物简单配合物:中心原子与单齿配体键合形成的配合物。
如: [Cu(NH3)4] 2+螯合物:多齿配体有两个或两个以上的配位原子与1个中心原子直接键合形成具有环状结构的配合物。
如: [Cu(en)2]2+根据螯合物的形成条件,凡含有两个或两个以上能提供孤电子对的原子的配位体称为螯合剂,因此,螯合剂为多齿配位体(也称多基配位体)。
螯合物的稳定性和它的环状结构(环的大小和环的多少)有关。
一般来说以五元环、六元环稳定。
多于五或六元环的配合物一般都是不稳定的,而且很少见。
一个配位体与中心离子形成的五元环的数目越多,螯合物越稳定。
如钙离子与EDTA形成的螯合物中有五个五元环,因此很稳定。
金属螯合物与具有相同配位原子的非螯合配合物相比,具有特殊的稳定性。
这种特殊的稳定性是由于环形结构形成而产生的。
我们把这种由于螯合物具有的特殊稳定性称为螯合效应。
由于Ca2+,Mg2+离子都能与三聚磷酸钠形成稳定螯合物,所以常把三聚磷酸钠加入锅炉水中,用以防止钙、镁形成难溶盐沉淀,结在锅炉内壁。
螯合物稳定性高,很少有逐级解离现象。
且一般有特征颜色,几乎不溶于水,而溶于有机溶剂。
利用这些特点可以进行沉淀溶剂萃取分离,比色定量等方面工作。
12.1.2复盐与配合物的区别复盐:由两种或两种以上的盐组成的盐。
例如:KMgCl3·3H2O(光卤石)、KAl(SO4)2·12H2O (明矾)、Na3AlF6 (冰晶石)、Ca5(PO4)3F (磷灰石)、 Al2(SiO4)F2(黄玉)等。
络盐:如果一种复盐在其晶体中和水溶液中都有络离子存在,属于配合物,称为络盐。
例如,一种铑的红色复盐,组成为CsRh(SO4)·4H2O,易溶于水,加入BaCl2,短时间无沉淀,其水溶液中主要组分为[Rh(H2O)4(SO4)2]-和Cs+,前者也存在于晶体中。
12.1.3配合物的命名配合物的命名法服从一般无机化合物的命名原则,如果配合物中的酸根是一个简单的阴离子,则称某化某,如[Co(NH3)6]Cl3称三氯化六氨合钴(Ⅲ)。