注射剂型药品不良反应报表
- 格式:doc
- 大小:50.00 KB
- 文档页数:1
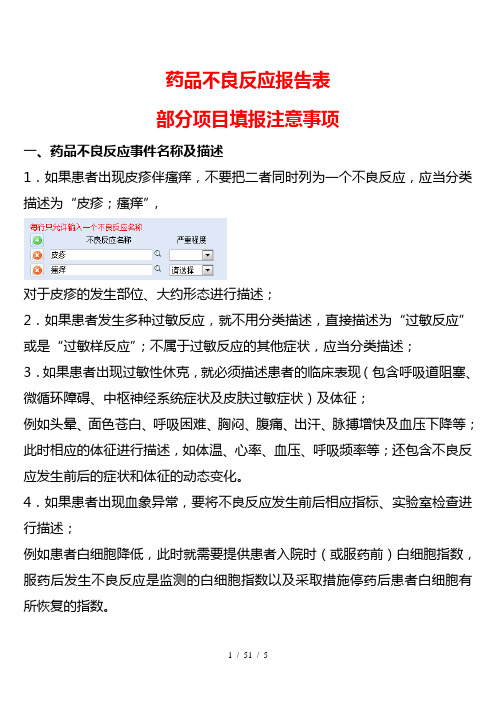
药品不良反应报告表
部分项目填报注意事项
一、药品不良反应事件名称及描述
1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,
对于皮疹的发生部位、大约形态进行描述;
2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;
3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;
例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;
例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;
例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归
1、药品不良反应发生以后,主要采取的治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
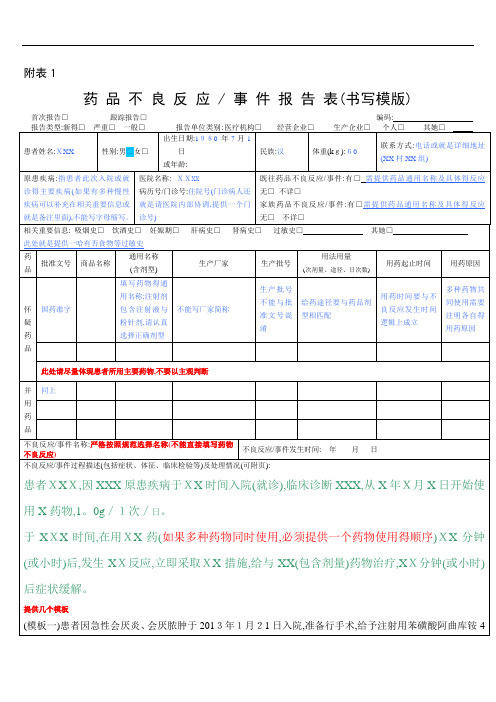
附表1
药品不良反应 / 事件报告表(书写模版) 首次报告□跟踪报告□编码:
药品不良反应报告表
部分项目填报注意事项
一、药品不良反应事件名称及描述
1。如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,
对于皮疹得发生部位、大约形态进行描述;
2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或就是“过敏样反应”;不属于过敏反应得其她症状,应当分类描述;
3.如果患者出现过敏性休克,就必须描述患者得临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;
例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应得体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后得症状与体征得动态变化。
4、如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;
例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应就是监测得白细胞指数以及采取措施停药后患者白细胞有所恢复得指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关得症状; 例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物就是什么。
二、药品不良反应发生后采取得措施及转归
1、药品不良反应发生以后,主要采取得治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体得治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗得药物及剂量。

药物不良反应报告表
药物不良反应报告表是一种重要的医学文书,它记录了药物治疗中的不良反应情况,有助于医生进行有效的治疗和防止病人出现不良后果。以下是一份药物不良反应报告表的范例,供医生参考:
一、基本信息
姓名:xxx 性别:男/女年龄:xx岁住址:xxxxxxxx
病史:xxxxx
二、用药信息
药品名称:xxxxx 厂家:xxxxx 批号:xxxxx
用药剂量:xxxxx 用药时长:xxxxx
给药方式:口服/注射等
三、不良反应信息
表现症状:xxxxx
发生时间:xxxxx
严重程度:轻/中/重
处理方法:xxxxx
是否再次应用药品:是/否四、病人反应信息
语言描述:xxxxx
病人签字:_________
五、报告人信息
报告人姓名:xxxxx
报告人联系方式:xxxxx
报告日期:xxxxx
以上为药物不良反应报告表的基本信息和范例,医生们在进行
药物治疗时应该注意认真记录患者的药物使用情况和不良反应状况,及时进行统计和分析,以便更有效地进行治疗和预防。同时,医生也应该积极鼓励患者配合填写不良反应报告表,共同维护医
学治疗的公平、科学和安全。

药品不良反应报告表范例 LELE was finally revised on the morning of December 16, 2020
药品不良反应 / 事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:部门:电话:报告日期:年月日
不良反应
分析
1.用药与不良反应的出现有无合理的时间关系有√无□
2.反应是否符合该药已知的不良反应类型是√否□不明□
3.停药或减量后,反应是否消失或减轻是√否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应是□否□不明□未再使用√
5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释是□否√不明□
报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称(企业):报告人签名:

制表单位:
紧急□ 一般√ 编号:□□□□□□□□□□□□□□□
药品不良反应报告表(医疗单位使用)
医院名称:解放军第251医院科别:呼吸科电话:8785120 报告日期:2004年1月18日
患者姓名:高凤荣性别:男□女√ 出生日期:1967年4月2日民族:汉体重:56
(kg)家族药品不良反应:有□无□不详√
病历号:235674
(门诊号)工作单位或地址:张家口市二毛纺厂电话:8161684 既往药品不良
反应情况:有√ 无□ 不详□
原患疾病:慢性气管炎急性发作不良反应
名称: 速发性哮喘反应不良反应发生时间:2004年1月19日
不良反应的表现:
(包括临床检验)
因慢性气管炎急性发作,抗感染治疗及雾化吸入后,症状消失,用5%葡萄糖注射液
500ml加黄芪注射液30ml静滴,用药2min,出现胸闷、呼吸困难、气喘、张口呼吸,查双肺
满布哮鸣音,考虑为黄芪注射液致速发性哮喘反应。
不良反应处理情况:
立即停止静滴黄芪注射液,吸氧,给予地塞米松注射液10mg,3min后,呼吸困难、气喘改善,2h后症状消失,双肺呼吸音清,无哮鸣音。
药品名称生产厂家批号剂型用药途径日剂量用药起止时间用药原因
怀疑引起不良反应的药品
黄芪注射液石家庄市神威药业有限公司0310621 注射液静滴
30ml 2004年1月17日
10:00-10:02 慢性气管炎急性发作
并用药品
5%葡萄糖注射液251医院制剂中心031107 灭菌溶液静滴500ml 2004年1月17日
10:00-10:02 溶媒
不良反应的结果:治愈√好转□有后遗症□ 表现:死亡□ 直接原因:死亡时间:年月日
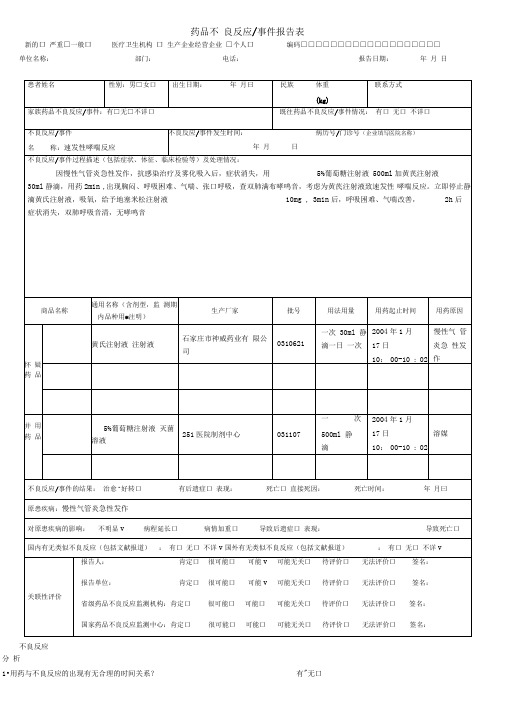
药品不良反应/事件报告表
新的口严重□一般口医疗卫生机构口生产企业经营企业□个人口编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日
不良反应
分析
1•用药与不良反应的出现有无合理的时间关系?有"无口
是"
否口 不明口
未停药或未减量口 是口 否口 不明口 未再使用"
是口 否" 不明口
报告人签名:
2. 反应是否符合该药已知的不良反应类型?
3. 停药或减量后,反应是否消失或减轻?
4. 再次使用可疑药品后是否再次出现同样反应?
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
报告人职业(医疗机构):医生口 药师口 护士口 其他口 报告人职务职称(企业)
是“否□不明口

药品不良反应报告表格
一、背景介绍
药品安全是一个极其重要的问题,任何时候,都不能忽视对药品不良反应的监测和报告。药品不良反应是指使用药物后,出现的与治疗目的无关的不良症状或事件。这些不良反应可能是轻微的,也可能是严重的,甚至可能危及生命。
二、意义和目的
药品不良反应报告表格的目的在于收集关于药物使用过程中出现的不良反应信息,以便及时发现和评估药品的安全性,并采取相应的措施来减少不良反应对患者的伤害。通过报告不良反应,可以提高公众对药物使用风险的认识,增强患者和医生的药物安全意识,为改进药物治疗提供数据支持。
三、报告表格内容
药品不良反应报告表格通常包括以下内容:
1. 药品信息:包括药品的通用名称、商品名、剂型、规格等。
2. 不良反应信息:详细描述患者使用药物后出现的不良反应症状,
如头痛、恶心、呕吐等。同时,还需要填写发生不良反应的时间、
频率和严重程度等。
3. 患者信息:包括患者的姓名、性别、年龄、身体状况等基本信息。同时,还需要填写患者的病历号码、联系方式等以方便进一步的联系。
4. 医生信息:填写处方医生的姓名、执业医师证号、科室等信息,
以便进行进一步的咨询和调查。
5. 报告人信息:填写报告人的姓名、职位、联系方式等,以方便进
行后续的沟通和取证。
四、使用流程
1. 实施单位(如医院、药店等)需要将药品不良反应报告表格制作
成电子版或纸质版,并确保在相关部门和医务人员中进行广泛宣传。
2. 患者或医生在发现药品不良反应后,应填写完整的药品不良反应
报告表格,并尽快递交给相关部门或医务人员。
3. 相关部门或医务人员收到报告后,需要及时进行初步评估,并进
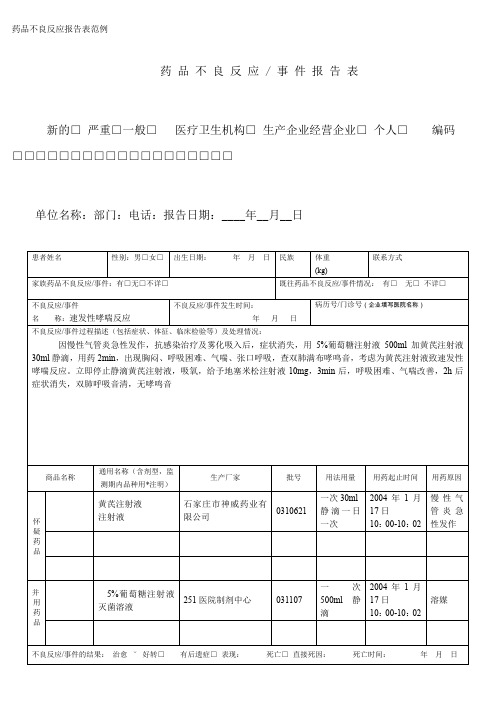
药品不良反应 / 事件报告表
新的□ 严重□一般□医疗卫生机构□ 生产企业经营企业□ 个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:部门:电话:报告日期:____年__月__日
不良反应
分析
1.用药与不良反应的出现有无合理的时间关系?有√ 无□
2.反应是否符合该药已知的不良反应类型?是√否□不明□
3.停药或减量后,反应是否消失或减轻?是√ 否□ 不明□ 未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应?是□ 否□ 不明□ 未再使用√
5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□ 否√ 不明□
报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称(企业):报告人签名:
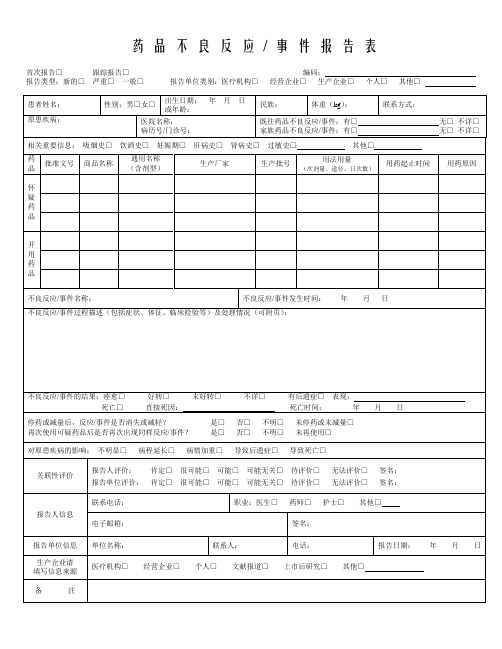
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
药品不良反应/ 事件报告表示例
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
《药品不良反应/事件报告表》填写说明
1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□
(1)新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。有随访信息的,应当及时报告。
![药品不良反应报告范文范例[1]](https://img.taocdn.com/s1/m/2257c49270fe910ef12d2af90242a8956becaa01.png)
药品不良反应报告范文范例[1]
支气管肺炎
既往药品不良反应/事件:无家族药品不良反应/事件:无相关重要信息:怀疑用药序号1批准文号国药准字H20051402商品名称通用名称注射
用盐酸氨溴索剂型:注射剂生产厂家生产批号用法用量15毫克/1日1次
给药途径静脉滴注用药起止时间从2022-05-15到2022-05-15用药原因痰
异常
山东罗欣药业股份514026091有限公司
并用药品序号批准文号1国药准字H20064193商品名称通用名称葡萄
糖注射液(基)剂型:注射剂生产厂家生产批号用法用量给药途径静脉滴注
用药起止时间用药原因
山东齐都药业有限50毫升/14C140318018公司日1次
从2022-05-15药品溶剂到2022-05-15
不良反应/事件详细信息不良反应/事件名称:过敏性休克(严重)不良反应/事件发生时间:2022-05-15
患儿因支气管肺炎入院,2022年5月15日09:25给予盐酸氨溴索
15mg加葡萄糖注射液50ml静滴,1日1次,,约1分钟,患儿突然出现面
色苍白、口唇青紫、四肢发冷、烦躁不安、频繁呕吐,伴腹部不适,呕吐
胃内容物,共7-8次,非喷射性呕吐,不伴腹泻,无皮疹及瘙痒,查体:
T36℃,P173次/分,R43次/分,BP85/45mmHg,神志清,精神差,面色苍白,口周发青,双肺呼吸音粗,可闻及粗湿啰音,心音低钝,心率快,律齐,
未闻及病理性杂音,腹平软,未触及包块,肠鸣音正常。立即切断静脉通道,考虑为“盐酸氨溴索”引起的过敏反应,嘱重新建立2个静脉通路,
停用氨溴索,立即静滴地塞米松5mg,肌肉注射盐酸异丙嗪50mg,迅速给予吸氧,心电监护,告知患儿家长病重,并请不良反应/事件过程描述:王某某主任医师前来会诊,患儿吸氧后面色逐渐改善,意识稍模糊,烦躁,监护仪显示心率188次/分,血氧饱和度98%,四肢冷,脉细速,测血压85/35mmHg,王某某主任医师考虑为:盐酸氨溴索引起的过敏性休克,嘱立即给予快速静滴0.9%氯化钠注射液扩容,给予盐酸肾上腺素0.45mg入0.9%氯化钠注射液4.5ml稀释后静推,给予地塞米松6mg稀释后静推,测微量血糖示6.8mmol/l,给予甲泼尼龙20mg入10%葡萄糖注射液250ml静滴,患儿血压逐渐回升至117/69mmHg,患儿神志清,逐渐入睡。于11:30急诊科前来会诊,

附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
药品不良反应报告表
部分项目填报注意事项
一、药品不良反应事件名称及描述
1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,
对于皮疹的发生部位、大约形态进行描述;
2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;
3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;
例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;
例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;
例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归
1、药品不良反应发生以后,主要采取的治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
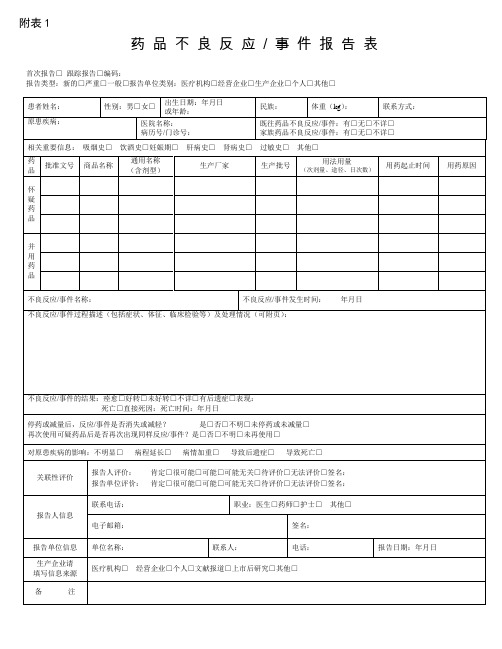
附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
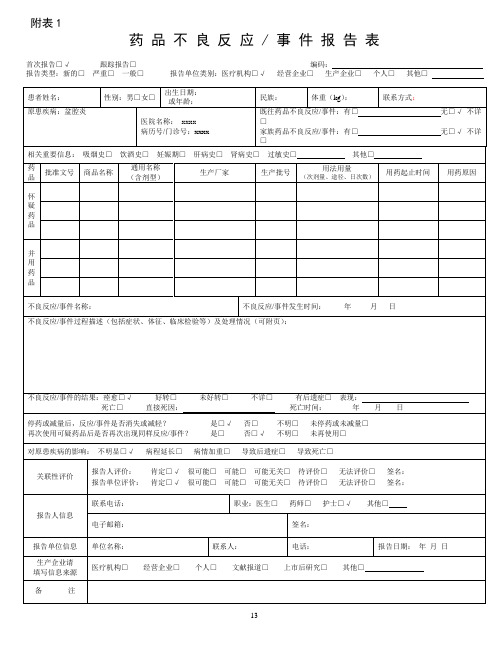
附表1
药品不良反应 / 事件报告表
首次报告□√跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□
13
14

药品不良反应/事件报告表
报告基本信息
首次/跟踪报
告:
首次报告编码: **************
报告类型:新的一般报告单位类
别:
医疗机构
患者基本信息
患者姓名: *** 性别:女民族:汉族
出生年
月:
1971-03-29 年龄:40 岁体重:56 (公斤)
联系方
式:
*******
原患疾病:女性慢性盆腔炎
医院名
称:
************ 病历号/门诊号:12070208
既往药品不良反应/事件:
无家族药品不良反应/事件:
无相关重要信息:
怀疑用药
序号批准文号商品名称通用名称
生产厂
家
生产批号用法用量
给药途
径
用药起止时间用药原因
1 国药准字
H20046286
注射用头孢
米诺钠
剂型:注射剂
广东博
洲药业
有限公
司
12031201
1.5 克/
1日 1次
静脉滴
注
从2011-07-02
到2011-07-02
抗菌治疗
并用药品
序号批准文号
商品名
称
通用名称生产厂家生产批号用法用量给药途径用药起止时间用药原因
1 国药准字
H20023822
氯化钠注射
液
剂型:注射剂
石家庄鹏海
制药有限公
司
1205302090
250毫升/1
日1次
静脉注射
从2011-07-02
到2011-07-05
溶媒用药
2 国药准字
H20060399
奥硝唑氯化
钠注射液
剂型:注射剂
四川科伦药
业有股份有
限公司
W112010701
0.5克/1日
1次
静脉滴注
从2011-07-02
到2011-07-05
抗菌治疗
3 国药准字
H13022062
葡萄糖注射
液
剂型:注射剂
石家庄鹏海
制药有限公
司
1204112040
250毫升/1
日1次
静脉滴注
从2011-07-02
到2011-07-05

药品不良反应报告表范例 .doc
药品不良反应记录
日期:xxxx年xx月xx日
药品名称:xxxx
制剂规格:xxxx
生产企业:xxxx
患者信息:
姓名:xxx
性别:xxx
年龄:xxx
病情/疾病诊断:xxx
不良反应记录:
1.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。症状持续时间约为xx小时/天。患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
2.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。症状持续时间约为xx小时/天。患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
备注:
1.患者的不良反应于xx年xx月xx日报告给医生,并得到及时处理。
2.对患者的不良反应进行了详细的记录,包括症状的描述、发生时间、处理措施和疗效结果。
3.患者在接受治疗后的症状得到缓解,并无其他严重不良反应发生。
以上是患者使用该药品期间出现的不良反应的详细记录。如有进一步需要,请及时与我联系。
医师签名:xxxx
日期:xxxx年xx月xx日

药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码
□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日患者姓名性别:男□女□出生日期:年月日民族体重
(kg)
家族药品不良反应/事件:有□无□不详□
不良反应/事件
名称:速发性哮喘反应不良反应/事件发生时间:
年月日
既往药品不良反应/事件情况:有□无□不详□病历号/门诊号(企业填写医院名称)联系方式不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
因慢性气管炎急性发作,抗感染治疗及雾化吸入后,症状消失,用5%葡萄糖注射液500ml加黄芪注射液30ml静滴,用药2min,出现胸闷、呼吸困难、气喘、张口呼吸,查双肺满布哮鸣音,考虑为黄芪注射液致速发性哮喘反应。立即停止静滴黄芪注射液,吸氧,给予地塞米松注射液10mg,3min后,呼吸困难、气喘改善,2h后症状消失,双肺呼吸音清,无哮鸣音
商品名称通用名称(含剂型,监
测期内品种用*注明)生产厂家批号用法用量用药起止时间用药原因怀
疑
药
品黄芪注射液
注射液石家庄市神威药业有
0310621
限公司一次30ml
静滴一日
一次2004年1月17日慢性气管炎急10:00-10:02性发作并
用
药
品5%葡萄糖注射液
251医院制剂中心
灭菌溶液一
031107500ml
滴次
静2004年1月17日溶媒10:00-10:02不良反应/事件的结果:治愈ˇ好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日原患疾病:慢性气管炎急性发作
对原患疾病的影响:不明显ˇ病程延长□病情加重□导致后遗症□表现:导致死亡□国内有无类似不良反应(包括文献报道):有□无□不详ˇ国外有无类似不良反应(包括文献报道):有□无□不详ˇ报告人:肯定□很可能□可能ˇ可能无关□待评价□无法评价□签名:报告单位:肯定□很可能□可能ˇ可能无关□待评价□无法评价□签名:关联性评价