乙醇练习1
- 格式:ppt
- 大小:141.50 KB
- 文档页数:10


苏教版高中化学必修二同步训练3.2.1乙醇一、单选题1.下列有关乙醇的物理性质的应用中,不正确的是( )A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C.由于乙醇能够以任意比溶于水中,所以酒厂可以勾兑各种浓度的酒D.由于乙醇容易挥发,所以才有“酒香不怕巷子深”的说法2.乙醇是一种比较理想的可再生资源,目前新兴起的车用乙醇汽油就是掺加一定比例乙醇的汽油。
下列说法中正确的是( )A.在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,耗氧量不相同B.在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,放出的热量相同C.用乙醇作燃料不会导致“温室效应”D.用乙醇作燃烧不会导致酸雨3.酒精的化学式为C2H5OH。
下列有关酒精的说法正确的是( )A.酒精中氢元素的质量分数最大B.酒精中碳、氢元素的质量比为1:3C.酒精属于有机物D.酒精分子中6个氢原子都可以与钠反应4.下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )A.1mol乙醇完全燃烧生成3mol H2OB.乙醇分子中只有1个氧原子C.1mol乙醇跟足量的钠反应得到0.5mol H2D.乙醇与水能以任意比互溶5.酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K Cr O227酸性水溶液乙醇迅速生成蓝绿色3+Cr.下列对乙醇的描述与此测定原理有关的是( )①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧化合物A.②④B.②③C.①③D.①④6.下列关于乙醇的说法正确的是( )A.乙醇在水溶液中-电离出少量的H+,所以乙醇是电解质B.乙醇结构中有-OH,所以乙醇显碱性C.乙醇分子中只有烃基上的氢原子可被钠置换出来D.乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质7.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是()A.和金属钠反应时键①断裂B.在铜催化共热下与O反应时断裂①和③2C.在铜催化共热下与O反应时断裂①和⑤2D.在空气中完全燃烧时断裂①②③④⑤8.能说明乙醇分子结构简式为C2H5OH,而不是CH3OCH3的事实是( )A.乙醇无同分异构体B.乙醇与水以任意比例互溶C.1 mol乙醇完全燃烧只生成2 mol CO2和3 mol H2OD.乙醇的化学性质与HOCH2CH2OH相似,与CH3CH2OCH2CH3不同9.下列有机物中,既能跟金属钠反应放出氢气,又能发生酯化反应,还能发生催化氧化反应的是( )A.乙酸B.乙醇C.乙酸乙酯D.水10.关于乙醇的说法中正确的是( )A.乙醇结构中有-OH,所以乙醇溶于水,可以电离出OH-而显碱性B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性C.乙醇与钠反应可以产生氢气,所以乙醇显酸性D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼11.乙醇能发生如下反应:①CH3CH2OH+3O22CO2+3H2O;②2Cu+O22CuO,CH3CH2OH+CuO CH3CHO+H2O+Cu。

乙醇与乙酸1.决定乙酸主要化学性质的原子或原子团是( )A.甲基(-CH3)B.羟基(-OH)C.羧基(-COOH)D.氢离子(H+)【答案】C【解析】决定有机物主要化学性质的原子或原子团称为官能团,乙酸分子的官能团是羧基(-COOH),因此决定乙酸主要化学性质的原子或原子团是羧基(-COOH),C符合题意;故选C。
2.下列化学用语不正确的是()A.乙醇的官能团:—OH B.乙酸的分子式:CH3COOHC.乙烯的结构简式:CH2CH2D.乙酸乙酯的官能团:【答案】C【解析】乙烯的结构简式:CH2=CH23.下列有机物能与Na、NaOH、NaHCO3反应的是()A.CH3COOH B.CH3CH2OH C.CH3COOC2H5 D.H2O【答案】A【解析】CH3CH2OH只能与Na反应,CH3COOC2H5只能与NaOH反应、H2O只能与Na反应,唯有CH3COOH能与Na、NaOH、NaHCO3都反应。
4.下列有关乙醇的表述正确的是()A.乙醇分子中含有甲基,甲基的电子式为B.乙醇的结构简式为C2H6OC.乙醇分子中羟基的电子式为D.乙醇分子的空间充填模型为【答案】D【解析】甲基的电子式为,A项错误;乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;羟基的电子式为,为中性基团,C项错误。
5.决定乙醇主要化学性质的原子或原子团是()A.羟基B.乙基(—CH2CH3)C.氢氧根离子D.氢离子【答案】A【解析】决定乙醇性质的原子团为羟基,羟基为乙醇的官能团。
6.某有机物的结构简式为HCOOCH2CH==CH2,它不具有的官能团是()A.B.C.D.【答案】B【解析】根据有机物的结构简式可知,该有机物含有酯基、碳碳双键()和醛基(),没有羧基(),故选B。
7.乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是()A.乙酸的官能团为—OHB.乙酸的酸性比碳酸弱C.乙酸能够与金属钠反应产生氢气D.乙酸能使紫色的石蕊溶液变蓝【答案】C【解析】乙酸的官能团为—COOH,A错误;乙酸的酸性比碳酸强,B错误;乙酸具有酸的通性,与钠反应产生氢气,C正确;乙酸能使紫色石蕊溶液变红,D错误。

第三节乙醇与乙酸第1课时乙醇基础过关练题组一乙醇的结构与物理性质1.(2019吉林省实验中学高一下期末)下列有关乙醇的物理性质的说法中不正确的是()A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D.由于乙醇容易挥发,所以才有“酒香不怕巷子深”的说法2.有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是()A.Ⅰ和Ⅱ互为同分异构体B.Ⅰ和Ⅱ物理性质有所不同C.Ⅰ和Ⅱ化学性质相同D.Ⅰ和Ⅱ中C的质量分数相同3.决定乙醇主要化学性质的原子或原子团是()A.羟基(—OH)B.乙基(—CH2CH3)C.氢氧根离子(OH-)D.氢离子(H+)题组二乙醇的化学性质4.向盛有乙醇的烧杯中投入一小粒金属钠,下列对该实验现象的描述中正确的是(深度解析)A.钠粒浮在乙醇液面上B.钠粒熔化成小球C.钠粒在乙醇液面上游动D.钠粒表面有气泡产生5.(2020内蒙古呼和浩特高一月考)如图是一种生活中常见有机物的球棍模型。
关于该物质的说法正确的是()A.分子式为C3H6B.含有氢氧根离子,水溶液呈碱性C.能电离出氢离子,水溶液呈酸性D.能与金属钠反应放出氢气6.(2020北京八十中高一期中)能证明乙醇分子中含有一个羟基的事实是()A.乙醇容易挥发B.乙醇能与水以任意比例互溶C.乙醇完全燃烧生成CO2和H2OD.0.1mol乙醇与足量Na反应生成0.05mol H27.(2020山东济南高一期中)类比乙烯和乙醇的化学性质,推测丙烯醇(CH2CH—CH2OH)不可发生的化学反应有()A.加成反应B.聚合反应C.取代反应D.与Na2CO3溶液反应放出CO28.催化氧化的产物是CH3—CH2—CH2—CHO的醇是()A.B.C.D.9.(2019甘肃兰州一中高一下期末)某实验小组用下列装置进行乙醇催化氧化的实验。

实验一乙醇的蒸馏2页实验一:乙醇的蒸馏一、实验目的1.学习掌握蒸馏的基本原理和操作方法。
2.通过蒸馏实验,了解乙醇的性质和沸点。
二、实验原理蒸馏是一种常用的物质分离和纯化技术,基于不同物质间沸点的差异进行分离。
乙醇是一种常见的有机溶剂,具有较高的沸点,可用于蒸馏分离。
通过本实验,我们可以了解乙醇的沸点,学习蒸馏操作技巧,为后续的实验打下基础。
三、实验步骤1.准备实验器材:圆底烧瓶、蒸馏头、冷凝管、接受瓶、加热装置、量筒。
2.将50ml乙醇加入圆底烧瓶中。
3.安装蒸馏装置:将圆底烧瓶置于加热装置上,插入蒸馏头,连接冷凝管和接受瓶。
4.开始加热:打开加热装置,观察乙醇的沸腾情况。
当有液体开始流入冷凝管时,降低加热速度,控制流速。
5.收集馏分:观察馏分的颜色和粘度,记录数据。
当馏分不再流出时,关闭加热装置。
6.测量馏分体积:用量筒测量馏分的体积。
7.分析成分:利用酒精计测量馏分的酒精浓度。
四、实验结果与分析1.实验结果:乙醇的沸点为78℃,收集到的馏分体积为XXml,酒精浓度为XX%。
2.结果分析:通过实验,我们得到了乙醇的沸点数据,了解了乙醇的物理性质。
同时,通过收集馏分和测量酒精浓度,我们验证了蒸馏的效率。
本实验中,乙醇的回收率较高,说明蒸馏效果较好。
但在实验过程中需注意控制加热速度,避免因加热过快导致乙醇损失。
五、结论本实验通过蒸馏方法成功分离出乙醇,并测定了其沸点及浓度。
实验结果表明,乙醇的沸点为78℃,与文献值相符。
通过本实验,我们掌握了蒸馏的基本操作技巧,学会了如何收集和测量馏分。
此外,我们还了解到乙醇作为一种常见的有机溶剂,在化工、医药等领域具有广泛的应用价值。
在今后的学习和实践中,我们应加强对乙醇性质的了解和应用研究,为相关领域的发展做出贡献。
六、建议与展望1.在实验过程中,应严格控制加热速度,避免因加热过快导致乙醇损失。
同时,注意观察馏分的颜色和粘度变化,以便及时调整收集方法。
2.在收集馏分时,应注意保证接受瓶的清洁,避免污染馏分。

3.2.1 乙醇学案(含答案)第二单元食品中的有机化合物第1课时乙醇一.乙醇的物理性质和分子结构1乙醇的物理性质1乙醇是无色.有特殊香味.易挥发的液体,密度比水小,能够溶解多种有机物和无机物。
2乙醇与水以任意比互溶,因此乙醇不能用作从碘水中提取碘的萃取剂。
3含乙醇99.5体积分数以上的叫无水乙醇,制无水乙醇时,要加入新制的生石灰再进行蒸馏,得到无水乙醇。
4检验乙醇中是否含有水通常加入无水硫酸铜固体,无水硫酸铜固体变蓝,则证明其中含有水。
2乙醇的分子结构1乙醇的分子组成与结构2烃的衍生物的概念乙醇可以看成是乙烷分子中的氢原子被羟基取代后的产物。
烃分子中氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
例1xx中山高一测试下列有关乙醇的物理性质的应用中,不正确的是A由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C由于乙醇能够以任意比溶于水,所以酒厂可以勾兑各种浓度的酒D由于乙醇容易挥发,所以才有“酒香不怕巷子深”的说法答案A解析由于乙醇与水互溶,故不能用分液的方法除去乙醇中的水。
易错警示乙醇与水以任意比互溶,因此乙醇不能用作从碘水中提取碘的萃取剂;除去乙醇中的水应加生石灰,然后蒸馏,不能用分液的方法。
二.乙醇的化学性质1乙醇与金属钠的反应水与钠反应乙醇与钠反应实验现象钠变化钠粒浮于水面,熔成闪亮的小球,并快速地四处游动,很快消失钠粒开始沉于试管底部,未熔化,最终慢慢消失声现象有“嘶嘶”的声响无声响气体检验点燃,发出淡蓝色的火焰点燃,发出淡蓝色的火焰剧烈程度钠与水剧烈反应钠与乙醇缓慢反应实验结论密度大小NaH2ONaC2H5OH反应方程式2Na2H2O2NaOHH22Na2CH3CH2OH2CH3CH2ONaH2反应实质氢原子被置换羟基氢原子被置换羟基氢活泼性水中氢原子乙醇羟基氢原子2.乙醇的氧化反应1乙醇的燃烧乙醇在空气中燃烧生成二氧化碳和水,发出淡蓝色的火焰,同时放出大量的热。

乙醇的催化氧化进阶练习1 1、能用来检验酒精中是否含有水的试剂是()
A: CuSO
4·5H
2
O B:无水CuSO
4
C:浓硫酸 D:金属钠
2.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的是()
A. 硝酸
B. 盐酸
C. 石灰水
D. 无水乙醇
3、某有机物6g 与足量钠反应生成 0.05molH
2
,该有机物可能是( )
A. CH
3CH
2
OH B. CH
3
CH
2
CH
2
OH
C. CH
3OH D. CH
3
-O-CH
3
4.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A. 和金属钠反应时键①断裂
B. 在铜催化共热下与O
2
反应时断裂①和③
C. 在铜催化共热下与O
2
反应时断裂①和⑤
D. 在空气中完全燃烧时断裂①②③④⑤
5. 能证明乙醇分子中有一个羟基的事实是( )
A. 0.1 mol乙醇与足量钠反应生成0.05 mol氢气
B. 乙醇完全燃烧生成CO
2和H
2
O
C. 乙醇能溶于水
D. 乙醇能发生催化氧化。

第3节 饮食中的有机化合物第1课时 乙 醇[课标要求]1.了解乙醇的组成、物理性质和主要应用。
2.掌握乙醇的化学性质,特别是乙醇的催化氧化。
3.通过观察思考,培养观察能力、思维能力和实验设计能力。
1.乙醇(CH 3CH 2OH)是一种无色、有特殊香味、密度比水小、易溶于水的液体,是一种优良的有机溶剂。
2.乙醇常用作燃料,体积分数为75%的乙醇溶液常用作医疗上的消毒剂。
3.重要的化学方程式:2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑, CH 3CH 2OH +3O 2――→点燃2CO 2+3H 2O , 2CH 3CH 2OH +O 2――→催化剂△2CH 3CHO +2H 2O 。
乙醇的物理性质及分子结构1.物理性质乙醇俗称酒精,是酒类的主要成分。
它是无色透明、具有特殊香味的液体;密度小于水,20 ℃时密度为0.789 g·cm -3;熔点为-117.3 ℃,沸点为78.5 ℃,易挥发;能与水以任意比例互溶,能溶解多种无机化合物和有机化合物,是优良的有机溶剂。
2.分子结构1.下列有关乙醇的物理性质的应用中不正确的是( )A .由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B .由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C .由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒D .由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法解析:选A 乙醇的密度比水小,但可与水以任意比互溶,故除去乙醇中的水不能用分液的方法,应加入生石灰,然后蒸馏。
2.比较乙烷和乙醇的结构,下列说法错误的是( ) A .两个碳原子以单键相连B .乙基与一个羟基相连就是乙醇分子C .乙醇与钠反应而钠与乙烷不反应D .分子里都含6个相同的氢原子解析:选D 乙烷和乙醇的结构简式分别为CH 3CH 3和CH 3CH 2OH ,由于官能团—OH 的存在,使乙醇的结构和性质与乙烷不相同,乙醇分子中有3种氢原子,其中只有羟基上的氢原子与钠反应,乙烷与钠不反应,故选D项。
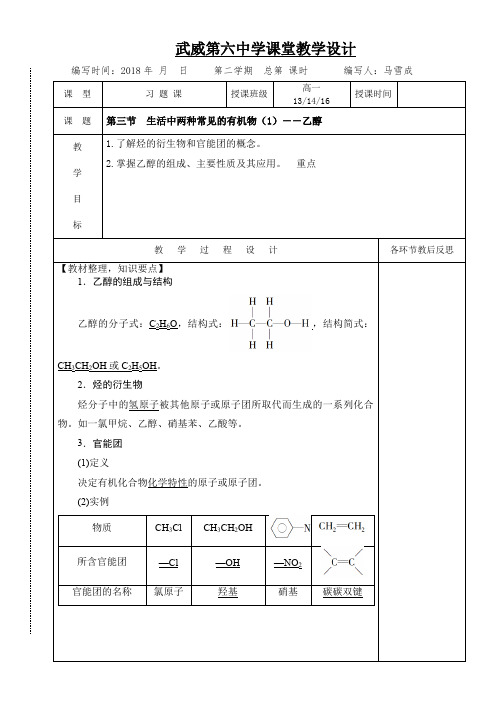
武威第六中学课堂教学设计编写时间:2018年月日第二学期总第课时编写人:马雪成课型习题课授课班级高一13/14/16授课时间课题第三节生活中两种常见的有机物(1)――乙醇教学目标1.了解烃的衍生物和官能团的概念。
2.掌握乙醇的组成、主要性质及其应用。
重点教学过程设计各环节教后反思【教材整理,知识要点】1.乙醇的组成与结构乙醇的分子式:C2H6O,结构式:,结构简式:CH3CH2OH或C2H5OH。
2.烃的衍生物烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
如一氯甲烷、乙醇、硝基苯、乙酸等。
3.官能团(1)定义决定有机化合物化学特性的原子或原子团。
(2)实例物质CH3Cl CH3CH2OH所含官能团—Cl —OH —NO2官能团的名称氯原子羟基硝基碳碳双键2.化学性质(1)与Na 反应化学方程式:2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑。
(2)氧化反应①燃烧a .化学方程式:CH 3CH 2OH +3O 2――→点燃2CO 2+3H 2O 。
b .现象:产生淡蓝色火焰,放出大量的热。
②催化氧化化学方程式:2CH 3CH 2OH +O 2――→Cu/Ag △2CH 3CHO +2H 2O 。
③与强氧化剂反应反应原理:CH 3CH 2OH ――――――→KMnO 4(H +)或K 2Cr 2O 7(H +)CH 3COOH 。
3.乙醇的用途(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作化工原料。
(3)医疗上常用体积分数为75%的乙醇溶液作消毒剂。
练习册习题1.下列化学用语正确的是( )A .乙醇的官能团:—OHB .乙醇的分子式:CH 3CH 2OHC .乙烯的结构简式:CH 2CH 2D .乙烯无官能团【答案】 A2.下列物质属于烃的衍生物的是________。
【答案】 ②④⑤⑥⑦2.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是()A.和金属钠反应时键①断裂B.在铜或银催化共热下与O2反应时断裂①和③C.在铜或银催化共热下与O2反应时断裂①和⑤D.在空气中完全燃烧时断裂①②③④⑤【解析】乙醇与钠反应生成乙醇钠,是羟基中的O—H键断裂,A 正确;乙醇催化氧化成乙醛时,断裂①和③化学键,B正确,C错误;乙醇完全燃烧时,化学键全部断裂,D正确。

第三节生活中两种常见的有机物第1课时乙醇课前预习情境素材人们常说:司机一滴酒,亲人两行泪。
上网搜索酒后驾车,会有许多熟悉的名字出现在你面前,如:牛振华、洛桑等。
2003年的统计显示,每3起酒后驾车引起的交通事故中就有1人死亡。
因此,各个地区都在加大酒后驾车的处罚力度。
各种酒中都含有一定量的乙醇。
为什么司机饮酒容易发生交通事故?交警通过什么方法检查司机饮酒是否过量?这里面利用了乙醇的什么性质?作为一种常见的有机物,乙醇具有怎样的结构和重要性质呢?知识预览1.乙醇的分子结构乙醇的分子式为C2H6O,乙醇分子的结构式为,乙醇的结构简式为CH3CH2OH或C2H5OH。
乙醇分子中含有—OH基团,称为羟基。
2.烃的衍生物烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
如:乙醇可看成是乙烷的衍生物、一氯甲烷可看成是甲烷的衍生物。
3.官能团烃的衍生物中取代氢原子的其他原子或原子团使烃的衍生物具有不同于相应烃的特殊性质,称为官能团。
如:乙醇中的羟基、一氯甲烷中的氯原子分别是乙醇和一氯甲烷的官能团。
5.乙醇与金属钠的反应(2)钠与乙醇的反应实质乙醇与金属钠反应,钠置换了羟基中的氢,生成了氢气和乙醇钠。
其方程式为2CH3CH2OH+2Na2CH3CH2ONa+H2↑6.乙醇的氧化反应(1)燃烧氧化乙醇在空气中燃烧,放出大量的热,发出淡蓝色火焰。
其方程式为CH3CH2OH+3O2−−点燃2CO2+3H2O。
−→(2)催化氧化乙醇在铜或银催化下,可被氧气氧化为乙醛。
其方程式为2CH3CH2OH+O22CH3CHO+2H2O。
(3)被强氧化剂氧化乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸。
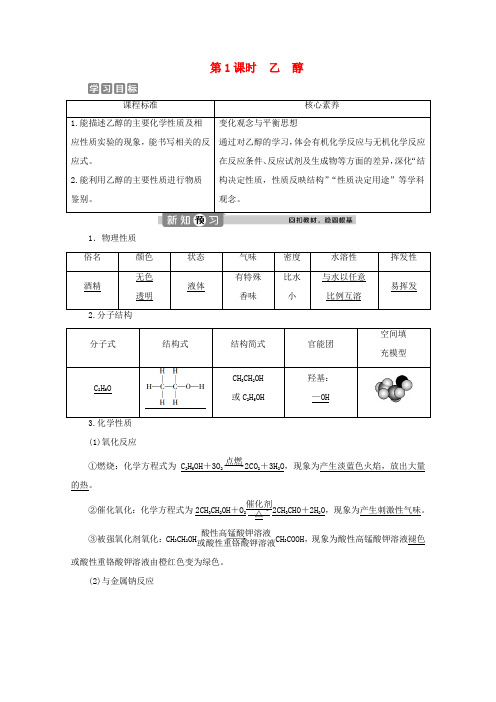
第1课时 乙 醇课程标准核心素养1.能描述乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式。
2.能利用乙醇的主要性质进行物质鉴别。
变化观念与平衡思想通过对乙醇的学习,体会有机化学反应与无机化学反应在反应条件、反应试剂及生成物等方面的差异,深化“结构决定性质,性质反映结构”“性质决定用途”等学科观念。
1.物理性质 俗名 颜色 状态气味 密度 水溶性 挥发性酒精无色透明液体有特殊香味比水小与水以任意比例互溶易挥发 2.分子结构分子式结构式结构简式官能团空间填充模型C 2H 6OCH 3CH 2OH或C 2H 5OH羟基:—OH(1)氧化反应①燃烧:化学方程式为C 2H 5OH +3O 2――→点燃2CO 2+3H 2O ,现象为产生淡蓝色火焰,放出大量的热。
②催化氧化:化学方程式为2CH 3CH 2OH +O 2――→催化剂△2CH 3CHO +2H 2O ,现象为产生刺激性气味。
③被强氧化剂氧化:CH 3CH 2OH ――→酸性高锰酸钾溶液或酸性重铬酸钾溶液CH 3COOH ,现象为酸性高锰酸钾溶液褪色或酸性重铬酸钾溶液由橙红色变为绿色。
(2)与金属钠反应实验 操作实验现象①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;②烧杯内壁有水珠产生;③向烧杯中加入澄清石灰水,石灰水不变浑浊实验结论乙醇与钠反应生成H 2,化学方程式为2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑4.用途用作燃料、造酒原料、有机溶剂和化工原料等,医疗上则用75%(体积分数)的乙醇溶液杀菌、消毒。
1.乙醇分子的结构特点(1)乙醇分子中有C —H 、C —C 、C —O 、O —H 4种化学键; (2)官能团为羟基,且羟基氢最活泼; (3)一定条件下,可断裂其中的一个或几个化学键2.乙醇反应中键的断裂情况乙醇的性质 键的断裂 与钠反应 断①键 燃烧 断①②③④⑤键 催化氧化断①③键3.乙醇催化氧化的实质总反应方程式为2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O ,反应中Cu 做催化剂。



第三节生活中两种常见的有机物第1课时乙醇1.据美国权威机构麦肯锡分析,随着低碳经济概念的提出与完善,纤维素乙醇产业对中国的潜在贡献巨大。
乙醇是一种比较理想的再生能源,目前新兴起的车用乙醇汽油就是掺入一定比例乙醇的汽油。
下列说法正确的是( )A.在相同状况下,同体积的乙醇气体和乙烯气体都完全燃烧,耗氧量不同B.在相同状况下,同体积的乙醇气体和乙烯气体都完全燃烧,产物相同,产物的量也相同C.用乙醇作燃料不会导致“温室效应”D.用乙醇作燃料不会导致酸雨2.C2H5OH的官能团是—OH,含有—OH的物质具有与乙醇类似的化学性质,在Cu或Ag催化下,下列物质不能与O2发生氧化反应的是( )3.下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )①C2H5OH ②H2CO3溶液③H2OA.①>②>③ B.②>①>③C.③>①>② D.②>③>①4.某饱和一元醇C n H2n+1OH 14.8 g和足量的金属钠反应生成H2 2.24 L(标准状况),则燃烧3.7 g该醇生成的水的物质的量为( )A.0.05 mol B.0.25 molC.0.5 mol D.0.75 mol5.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是( )A.H2 B.CO和H2C.NH3 D.CH3CH2OH(g)6.丙烯醇(CH2CH—CH2OH)可发生的化学反应有( )①加成②氧化③燃烧④加聚⑤取代A.只有①②③ B.只有①②③④C.①②③④⑤ D.只有①③④7.某有机物6 g与足量Na反应,生成0.05 mol H2,该有机物可能是( )8.酒精灯的火焰分为三层,由外到内依次为外焰、内焰、焰心,若把一根洁净的铜丝,由外焰逐渐深入到内焰,能观察到的现象是( )A.始终是红色 B.由红色变为黑色C.在外焰变为黑色,到内焰变为红色 D.在外焰是红色,到内焰变为黑色9.为了测定乙醇的结构式是还是,利用乙醇和钠的反应,设计如图装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。

第I卷选择题(每题1.5分,共60分)1. 下列属于种群的是A.一块农田中的害虫B.一个菌落中的细菌C.一座高山上的全部鸟D.一个池塘中的单细胞2. SARS 是一种冠状病毒,其遗传物质是一条单链RNA,下列关于SARS 病毒的叙述中,正确的是A.可独立生活和复制B.DNA和RNA同时存在C.能在寄生细胞内合成多种蛋白质D.含有简单的细胞器3. 下列组合中,依次属于种群、群落和生态系统的一组是①生活在人体大肠内的微生物②某一池塘中的全部鱼类③肺炎患者肺部的肺炎双球菌④一根枯木及枯木上所有的生物A.①②④B.②③④C.③②①D.③①④4. 下列关于细胞学说的叙述,错误的是A.1 665 年,英国科学家罗伯特·虎克发现了细胞,并创立了细胞学说B.细胞是一个有机体,一切动植物都由细胞发育而来,并由细胞和细胞产物所构成C.细胞是一个相对独立的单位,既有它自己的生命,又对与其他细胞共同组成的整体的生命起作用D.新细胞可以从老细胞中产生5. 细胞内组成DNA的五碳糖是A.核糖B.葡萄糖C.脱氧核糖D.麦芽糖6. 下列各组元素中,占细胞总量97 %(大量)的一组是A . C 、H 、O、N 、P、SB .C 、Fe 、K 、Ca 、B 、MgC . N 、P、S 、K 、Ca 、MgD . Fe 、Mn 、B 、Zn 、Cu 、Co7. 组成细胞的最基本元素是A . PB .OC . ND . C8. 鉴定脱脂奶粉中的脂肪含量是否较低,可以使用的化学试剂是A.苏丹III 试剂 B .强碱试剂 C .斐林试剂 D .双缩脲试剂9. 在人的唾液中加入双缩脲试剂,其结果应该是A.产生气泡 B .溶液呈蓝色 C .溶液呈紫色 D .产生砖红色沉淀10. 缺少下列哪种元素时,可能使花药和花丝萎缩、花粉发育不良A.B B .N C .P D .K11. 两个氨基酸分子缩合形成二肽,并生成一分子水,这个水分子中的氢来自A.氨基B.羧基C.氨基和羧基D.连在碳原子上的氢12. 下列各项中,不是蛋白质所具有功能的一项是A.调节作用B.免疫作用C.运输作用D.遗传作用13. 某一条多肽链中共有肽键151个,则此分子中―NH2 和―COOH的数目至少有A.152 152 B.151 151 C.1 1 D.2 2 14. 下列有关蛋白质的叙述中,不正确的是A.促使淀粉分解成麦芽糖的酶是蛋白质B .构成蛋白质的核苷酸的种类有20 种C .蛋白质是构成细胞和生物体的重要组成物质D .蛋白质是调节生物体新陈代谢的重要物质15. 下列各项与蛋白质结构多样性无关的是A.氨基酸的数目、种类和排列顺序 B .构成蛋白质的多肽链的数目C .构成蛋白质的多肽链的空间结构D .氨基酸至少含一个氨基和一个羧基16. 下列结构中属于组成蛋白质的氨基酸的分子结构是17. 还原糖与斐林试剂发生作用,结果为A.生产砖红色沉淀B.显蓝色C.显褐色D.显绿色18. 由DNA分子蕴藏的信息所支配合成的RNA在完全水解后,得到的化学物质是A.氨基酸、葡萄糖、碱基 B .氨基酸、核苷酸、葡萄糖C .核糖、碱基、磷酸D .脱氧核糖、碱基、磷酸19.下列有关核酸的叙述,不正确的是A.核酸的基本组成单位是氨基酸B .核酸存在于细胞核和细胞质中C .核酸包括DNA和RNA两种D .核酸由C 、H 、O、N 、P等元素构成20. 细胞通过呼吸作用分解糖类并释放能量,主要是利用A.麦芽糖B.核糖C.葡萄糖D.蔗糖21. 组成淀粉、纤维素的单体都是A.核糖B.半乳糖C.葡萄糖D.脱氧核糖22. 在人和动物皮下含量丰富的储能物质是A.糖原B.淀粉C.脂肪D.蛋白质23. 医生给低血糖休克的病人静脉注射50%的葡萄糖溶液,其目的主要是A.供给全面营养 B .供给能源 C .维持细胞的渗透压 D .供给水分24. 下列各项糖类中,人体细胞不具有2007-2008学年度上学期06级9月份月考(生物)试卷(文)满分:100分时间:60分钟出题人:A.麦芽糖 B .葡萄糖 C .核糖 D .糖原25. 动物生殖腺分泌的性激素的化学本质是A.糖类 B .脂肪 C .脂质 D .固醇26. 下面是有关磷脂的生物学功能的是A.生物膜的重要成分 B .储能分子、保温C .构成生物体表面的保护层D .对生命活动起调节作用27. 足球运动员比赛结束后,消耗体力很大,为了尽快恢复体力,应该吃下列哪类食物A.肉类 B .鸡蛋 C .馒头 D .鱼类28. 日常活动量相似的甲、乙二兄弟,前者喜食油炸食品,后者喜食清蒸食品,若二人体质和食量均相似,则最易发胖的是A.甲 B .乙 C .同样胖 D .无法判断29. 细胞核内行使遗传功能的结构是A.核膜B.核孔C.染色质D.核仁30. 下列物质不属于脂质的是A.胰脂肪酶 B .胆固醇 C .维生素D D .雄性激素31. 下列关于细胞核的说法,不正确的是:A.细胞核是遗传物质贮存和复制的场所B.细胞核控制细胞的代谢和遗传C.细胞核位于细胞的正中央,所以它是细胞的控制中心D.DNA主要存在于细胞核内32. 酷暑季节,室外作业的工人应多喝A.盐汽水 B .碳酸型饮料 C .蛋白质饮料 D .纯净水33. 生活在沙漠中的植物,其细胞中含量最多的化合物是A.水 B .蛋白质 C .核酸 D .糖类34. 细胞中含量最多的有机化合物是A.蛋白质B.淀粉C.水D.糖原35. 组成细胞膜的主要成分是A.磷脂、蛋白质、糖类 B .糖脂、糖蛋白C .脂质、蛋白质、无机盐D .磷脂、蛋白质、核酸36. 雌性家兔体细胞中高尔基体数量最多的是A.神经细胞 B .心肌细胞 C .乳腺细胞 D .红细胞37. 细胞内与能量转换有关的细胞器是A.高尔基体与中心体 B .中心体与叶绿体C .线粒体与内质网D .叶绿体与线粒体38. 1997 年,用母羊甲的乳腺细胞的细胞核与母羊乙的卵细胞的细胞质组成一个细胞,培育成功了“多利”羊,下列说法错误的是A.高度特化的动物细胞核具有全能性B .乳腺细胞核内含有该物种所需要的全套遗传物质C . “多利”羊的特征与母羊乙几乎相同D . “多利”羊的特征与母羊甲几乎相同39. 细胞核中与核糖体的形成有关的结构是A.核膜 B .染色质 C .核仁 D .核孔40. 下列关于酶的表述,全面而正确的是A.酶不能脱离生物体起作用B.酶是蛋白质C.酶与无机催化剂没有本质区别D.酶是活细胞产生的有催化作用的有机物第II卷非选择题(每空1分,共40分)41、下列某多肽化合物的分子结构式,请完成有关问题:(1)上述结构中,代表氨基的结构式为,代表肽键的结构式为。

第三节乙醇与乙酸第1课时乙醇课后篇素养形成夯实基础轻松达标1.下列性质中,不能说明乙醇宜作燃料的是()A.燃烧时发生氧化还原反应B.充分燃烧的产物不污染环境C.乙醇是一种可再生能源D.燃烧时放出大量的热,不产生污染物,并且原料易得,燃烧过程中放出大量的热,属于可再生资源。
2.比较乙烷和乙醇的分子结构,下列说法错误的是()A.两个碳原子以单键相连B.分子里都含6个相同的氢原子C.乙基与一个氢原子相连就是乙烷分子D.乙基与一个羟基相连就是乙醇分子CH3CH3和CH3CH2OH,乙醇分子中有3种等效氢原子,所以B选项错误。
3.下列有关乙醇的物理性质的应用的说法不正确的是()A.由于乙醇的密度比水小,所以乙醇中混有的水可以通过分液的方法除去B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质,无法用分液法将乙醇中混有的水除去。
4.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生等量的氢气。
则这三种醇的物质的量之比为()A.6∶3∶2B.1∶2∶3C.3∶2∶1D.4∶3∶21∶1。
三种醇与钠反应放出等量的氢气,则三种醇提供的羟基数相同,因此三种醇的物质的量之比为1∶12∶13=6∶3∶2。
5.下列醇不能发生催化氧化的是()A.CH3OHB.C. D.O—H键和连接羟基的碳原子上的C—H键。
C项中连接羟基的碳原子上没有C—H键,故不能发生催化氧化。
6.结合乙烯和乙醇的结构与性质,推测丙烯醇(CH2CH—CH2OH)不能发生的化学反应有()A.加成反应B.氧化反应C.与Na反应D.与Na2CO3溶液反应放出CO2,具有烯烃的性质,能发生加成反应和氧化反应;含有醇羟基,具有醇的性质,能发生氧化反应,能与钠反应,但不具有酸性,不能与Na2CO3溶液反应放出CO2。