碱度投加量的实例计算
- 格式:doc
- 大小:36.50 KB
- 文档页数:6

炉水碱度测定及计算方法
炉水碱度测定及计算方法
一、碱度测定
1.用适量(25ml)炉水溶液倒入碱度瓶中,滴加指示剂,用碱度滴定管完成测定。
2.停止滴定后,观察滤液颜色。
3.用实测滴定量求出炉水碱度几何证多少,即以咪唑烷二硫酸钾K2Cr2O7为指示剂,滴定管滴定量为mL,炉水碱度计算式为:碱度/μg/L=0.28×滴定量/mL
例如:炉水滴定量为8.2mL,则炉水碱度为:
碱度/μg/L=0.28×8.2/mL=2.296μg/L
二、碱度计算
1.炉水碱度的计算式为:
碱度/μg/L=测定含量/100×比重
其中:测定含量为单位为g的硝酸根成分的质量;
比重为当量碱度的比重值,一般为1.2。
- 1 -。

污水生物硝化处理工艺pH值控制及碱度核算污水生物硝化处理工艺pH值控制及碱度核算一、影响硝化的重要因素1、pH和碱度对硝化的影响pH值酸碱度是影响硝化作用的重要因素。
硝化细菌对pH反应很敏感,在pH中性或微碱性条件下(pH为8~9的范围内),其生物活性最强,硝化过程迅速。
当pH>9."6或<6."0时,硝化菌的生物活性将受到抑制并趋于停止。
若pH>9."6时,虽然NH4+转化为NO2—和NO3—的过程仍然异常迅速,但是从NH4的电离平衡关系可知,NH3的浓度会迅速增加。
由于硝化菌对NH3极敏感,结果会影响到硝化作用速率。
在酸性条件下,当pH<7."0时硝化作用速度减慢,pH<6."5硝化作用速度显著减慢,硝化速率将明显下降。
pH<5."0时硝化作用速率接近零。
pH下降的原因pH下降的原因可能有两个,一是进水中有强酸排入,导致人流污水pH降低,因而混合液的pH也随之降低。
由硝化方程式可知,随着NH3-N被转化成NO3—-N,会产生部分矿化酸度H+,这部分酸度将消耗部分碱度,每克NH3-N转化成NO3—-N约消耗7."14g碱度(以CaC03计)。
因而当污水中的碱度不足而TKN负荷又较高时,便会耗尽污水中的碱度,使混合液中的pH值降低至7.0以下,使硝化速率降低或受到抑制。
如果无强酸排人,正常的城市污水应该是偏碱性的,即pH一般都大于7."0,此时的pH则主要取决于人流污水中碱度的大小。
所以,在生物硝化反应器中,应尽量控制混合液pH>7."0,制pH>7."0,是生物硝化系统顺利进行的前提。
而要准确控制pH,pH<6."5时,则必须向污水中加碱。
应进行碱度核算。
2、有机负荷的影响在采用曝气生物滤池工艺进行硝化除氮时,NH4-N的去除在一定程度上取决于有机负荷。
当有机负荷稍高于3."0kgBOD/(m3滤料·d)时,NH3-N的去除受到抑制;当有机负荷高于4."0kgBOD/(m3滤料·d)时,NH3-N的去除受到明显抑制。

一、上课例题例题:原水总碱度为L (以CaO 计),投加精制硫酸铝(含Al 2O 3约16%)26 mg/L 。
若剩余碱度取L ,试计算水厂石灰(市售品纯度为50%)投量需多少mg/L (已知原子量Al=27,O=16,Ca=40)解:投药量折合Al 2O 3为26×16%= mg/L Al 2O 3分子量为102,故投药量相当于102=L 则【CaO 】=3【a 】-【x 】+【δ】=3×-+= mmol/L =×56 mg/L= mg/L 水厂需投加市售石灰= mg/L例题: (2008年)某水厂地面水源的总碱度为10mg/L (以CaO 计),混凝剂Al 2(SO 4)3的投加量为28mg/L ,若不计算剩余碱度,则需投加( )mg/L 的NaOH 。
(已知原子量Al=27,S =32,O=16,Na =23,H =1,Ca=40) A B 5.4 C D 解析:水源总碱度折合为: 10/56=L ;Al 2(SO 4)3分子量为342,故Al 2(SO 4)3投加量为:28/342=L ; 需纯石灰投量为:【CaO 】=3【a 】-【x 】+【δ】 =3×-+0= mmol/L由于1mmol/LCaO 相当于2mmol/LNaOH, 因此水厂需投加的NaOH 为 ×2= mmol/L =L 故B 为正确答案。
注意:使用中国建筑工业出版社《给水工程(第四版)》P271式(15-29)时,若水源的总碱度和剩余碱度以NaOH 或HCO 3-计,则【x 】和【δ】前面的系数均为。
例题: V=18mm/s ,B=3H ,Fr =×10-5。
在池的1/3,2/3 处各加一道隔墙,忽略隔墙厚度,求新的Fr 。
解:(1)Fr=v2/Rg (2)(3)Fr 2/Fr 1=(3H/5)/(H/3)=9/5=Fr 2= ×10-5 ×= ×10-5例题:异向流斜管沉淀池,设计能力20000m3/d,平面净尺寸10×10m ,结构系数, 斜管长1m ,安装角60 度。

碱度、酸度、Fe3+/Fe2+离子的测定方法及计算一、碱度的测定1.需用的试剂类型:HCl 0.1mol/L标准溶液甲基红-溴甲酚绿混合指示剂2.分析过程取10ml清洗液于锥形瓶中,加少许水溶液稀释,加4~6滴甲基红-溴甲苯酚混合指示剂,用酸式滴定管装满HCl标准溶液进行滴定,颜色由亮绿色变为酒红色,记录下消耗的毫升数V13.计算方法:C碱度= 0.1*V1*40*100 =0.04 V110*1000二、酸度的测定1.需用的试剂类型:NaOH 0.1mol/L标准溶液甲基红-溴甲酚绿混合指示剂2.分析过程取10ml清洗液于锥形瓶中,加少许水溶液稀释,加4~6滴甲基红-溴甲苯酚混合指示剂,用碱式滴定管装满标准NaOH标准溶液进行滴定,颜色由酒红色变为亮绿色,记录下消耗的毫升数V23.计算方法:C酸度= 0.1*V2*210.4*100 =0.2104 V210*1000三、铁含量的测定1.需用的试剂类型:EDTA 0.01mol/L标准溶液10%磺基水杨酸指示剂20%过硫酸铵溶液1+1HCl溶液2.分析过程取1ml清洗液,用少许水溶液稀释,加入2~3滴1+1HCl溶液调PH值至1~2,再加入1ml 10%磺基水杨酸指示剂,用0.01mol/L EDTA标准溶液进行滴定,滴定至红紫色消失,记录下消耗的毫升数V1,用来计算Fe3+含量。
再加入10ml 20%过硫酸铵溶液,用0.01mol/L EDTA 标准溶液进行滴定,滴定至红紫色消失,记录下消耗的毫升数V2,用来计算Fe2+含量。
3.计算方法:C Fe3+= 0.01*V1*56*100 =560* V1 (mg/L)1*1000C Fe2+= 0.01*(V2-V1)*56*100 =560* (V2-V1) (mg/L)1*1000C总铁= C Fe3++ C Fe2+ (mg/L)。

各种加药计算1. 浓联氨的需用量的计算:N2H4= c*d*v*1000/w (kg)式中:c——欲配溶液的百分比浓度d——所配制溶液的比重(稀联氨溶液可取1.0g/m3)v——所配稀联氨溶液体积m3w——浓联氨的百分比浓度(一般为40%)2.一般是程序控制,连续加入.1. 氢氧化钠和碳酸钠加药量的计算(1) 空锅上水时给水所需加碱量X1=(YD-JD +JD+ JDGMV式中:X1 一一空锅上水时, 需加NaOH 或Na2C03 的量,g;YD 一一给水总硬度,mmol/L;JD 一一给水总碱度,mmol/L;JDG 一一锅水需维持的碱度,mmol/L;V 一一锅炉水容量,m3;M 一一碱性药剂摩尔质量; 用NaOH 为40 g/mol, 用Na2C03 为53g/mol 。
(2) 锅炉运行时给水所需加碱量1) 对于非碱性水可按下式计算X2=(YD-JD +JDGP)M式中:X2 一一每吨给水中需加NaOH 或Na2C03 的量,g/t;PL 一锅炉排污率,10-2;其余符号同上式。
如果NaOH 和NazC03 同时使用时, 则在上述各公式中应分别乘以其各自所占的质量分数, 如NaOH 的用量占总碱量的η×10-2, 则Na2C03 占(1-η)×10-2 , 两者的比例应根据给水水质而定。
一般对于高硬度水、碳酸盐硬度高或续硬度高的水质宜多用NaOH, 而对于以非碳酸盐硬度为主的水质, 应以Na2C03 为主, 少加或不加NaOH 。
2) 对于碱性水, 也可按上式计算, 但如果当JDG 以标准允许的最高值代入后, 计算结果出现负值, 则说明原水钠钾碱度较高, 将会引起锅水碱度超标, 宜采用偏酸性药剂, 如Na2HP04 、NaHJ04 等。
2. 磷酸三纳(Na3P04 ·12H20) 用量计算磷酸三纳在锅内处理软水剂中, 一般用来作水渣调解剂和消除残余硬度用。
当单独采用锅内水处理时, 加药量是按经验用量计算。
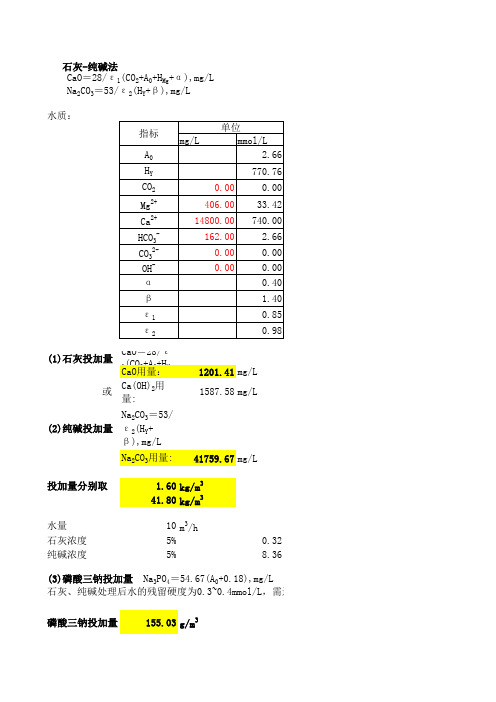

1mmol/L(NaOH 分子量40)0.5mmol/L(CaCO3分子量100)以NaOH 计的碱度=2以CaO 计的碱度请大家讨论以下公式:投加碱剂的量的计算:1、投加CaO 时,石灰(CaO )的投加量:混凝剂反应方程式碱剂(CaO )用量(mmol/L )碱度计算方法Al 2 (SO 4)3(分子量342) Al 2(SO 4)3+3H 2O+3CaO=2Al (OH )3+3CaSO 4 3[a ]-[x ]+[δ]原水碱度[x ]、剩余碱度[δ]都以CaO 计。
3[a ]-0.5[x ]+0.5[δ] 原水碱度[x ]、剩余碱度[δ]都以NaOH 计。
FeCl 3(分子量162.5)2FeCl 3+3H 2O+3CaO=2Fe (OH )3+3CaCL 2 1.5[a ]-[x ]+[δ]原水碱度[x ]、剩余碱度[δ]都以CaO 计。
1.5[a ]-0.5[x ]+0.5[δ] 原水碱度[x ]、剩余碱度[δ]都以NaOH 计。
2、投加NaOH 时,NaOH 的投加量:混凝剂反应方程式碱剂(NaOH )用量(mmol/L ) 碱度计算方法Al 2 (SO 4)3(分子量342) Al 2(SO 4)3+6NaOH=2Al (OH )3+3Na 2SO 4 6[a ]-[x ]+[δ] 原水碱度[x ]、剩余碱度[δ]都以NaOH 计。
6[a ]-2[x ]+2[δ]原水碱度[x ]、剩余碱度[δ]都以CaO 计。
FeCl 3(分子量162.5)2FeCl 3+6NaOH=2Fe (OH )3+6NaCl3[a ]-[x ]+[δ] 原水碱度[x ]、剩余碱度[δ]都以NaOH 计。
3[a ]-2[x ]+2[δ]原水碱度[x ]、剩余碱度[δ]都以CaO 计。
[a] 3[a][a] 1.5[a][a] 6[a][a]3[a]★各种碱剂的投加计算公式:混凝剂碱剂用量(mmol/L)CaO(分子量56) NaOH(分子量40)Al2(SO4)3(分子量342) 3[a]-[x]+[δ]6[a]-[x]+[δ]FeCl3(分子量162.5) 1.5[a]-[x]+[δ]3[a]-[x]+[δ][a]-混凝剂投加量,mmol/L[x]-原水碱度,按mmol/L,CaO计;[δ]-保证反应顺利进行的剩余碱度,一般取0.25~0.5 mmol/L(CaO)。

硝化反硝化系统加碱量如何计算一、硝化细菌硝化反应过程:在有氧条件下,氨氮被硝化细菌所氧化成为亚硝酸盐和硝酸盐。
他包括两个基本反应步骤:由亚硝酸菌(Nitrosomonas sp)参与将氨氮转化为亚硝酸盐的反应;硝酸菌(Nitrobacter sp)参与的将亚硝酸盐转化为硝酸盐的反应,亚硝酸菌和硝酸菌都是化能自养菌,它们利用CO2、CO32-、HCO3-等做为碳源,通过NH3、NH4+或NO2-的氧化还原反应获得能量。
硝化反应过程需要在好氧(Aerobic 或Oxic)条件下进行,并以氧做为电子受体,氮元素做为电子供体。
其相应的反应式为:亚硝化反应方程式:55NH4++76O2+109HCO3→C5H7O2N﹢54NO2-+57H2O+104H2CO3硝化反应方程式:400NO2-+195O2+NH4-+4H2CO3+HCO3-→C5H7O2N+400NO3-+3H2O硝化过程总反应式:NH4-+1.83O2+1.98HCO3→0.021C5H7O2N+0.98NO3-+1.04H2O+1.884H2CO3通过上述反应过程的物料衡算可知,在硝化反应过程中,将1g氨氮氧化为硝酸盐氮需好氧4.57g(其中亚硝化反应需耗氧3.43g,硝化反应耗氧量为1.14g),同时约需耗7.14g重碳酸盐(以CaCO3计)碱度。
在硝化反应过程中,氮元素的转化经历了以下几个过程:氨离子NH4-→羟胺NH2OH→硝酰基NOH→亚硝酸盐NO2-→硝酸盐NO3-。
二、反硝化细菌反硝化反应过程:在缺氧条件下,利用反硝化菌将亚硝酸盐和硝酸盐还原为氮气而从污水中逸出,从而达到除氮的目的。
反硝化是将硝化反应过程中产生的硝酸盐和亚硝酸盐还原成氮气的过程,反硝化菌是一类化能异养兼性缺氧型微生物。
当有分子态氧存在时,反硝化菌氧化分解有机物,利用分子氧作为最终电子受体,当无分子态氧存在时,反硝化细菌利用硝酸盐和亚硝酸盐中的N3+和N5+做为电子受体,有机物则作为碳源提供电子供体提供能量并得到氧化稳定,由此可知反硝化反应须在缺氧条件下进行。

环境监测碱度的计算例题
以下是一个环境监测碱度的计算例题:
假设要测量一杯海水的碱度,海水的 pH 值为 8.0。
要求测量海水中的碳酸根离子 (CO3^2-) 和氢氧根离子 (OH-) 浓度,并通过计
算确定海水的碱度。
首先,测量海水中的碳酸根离子和氢氧根离子浓度可以使用以下公式:
CO3^2- = (Na2CO3×0.00159)÷ (pH+1)
OH- = (NaOH×0.00159)÷ (pH-1)
其中,Na2CO3 和 NaOH 是海水中碳酸根离子和氢氧根离子的基
准物质,其浓度可以使用实验室制备的标准溶液进行标定。
pH 值是
海水的酸碱度指标,其值范围为 0 到 14,pH 值越大,表示海水越酸。
在本题中,海水的 pH 值为 8.0,因此:
CO3^2- = (0.00159×0.01)÷ (8.0+1) = 0.000189mol/L
OH- = (0.00159×0.01)÷ (8.0-1) = 0.000189mol/L 接下来,我们需要计算海水的碱度。
碱度可以通过碳酸根离子和氢氧根离子的浓度计算得到:
碱度 = 0.000189mol/L×(Na2CO3/NaOH)×1000
在本题中,海水中的碳酸根离子和氢氧根离子浓度已经计算得出,因此可以直接代入公式计算出海水的碱度:
碱度 = 0.000189mol/L×(0.00159/0.005)×1000 =
0.0245mol/L
因此,海水的碱度为 0.0245mol/L。

酸碱中和反应的酸度与碱度计算实例酸碱中和反应是化学中常见的一种反应类型,涉及到酸度和碱度的计算是了解和分析这类反应的重要基础。
本文将通过实例来介绍酸碱中和反应中酸度和碱度的计算方法。
实例一:硫酸与氢氧化钠的中和反应硫酸(H2SO4)是一种强酸,氢氧化钠(NaOH)是一种强碱。
当它们发生中和反应时,酸度和碱度的计算方法如下:1. 计算酸度(酸的浓度):酸度的计算公式为:酸度(mol/L)= 酸的物质的物质量(g)/ 酸的摩尔质量(g/mol)硫酸(H2SO4)的摩尔质量为:1*2 + 32 + 16*4 = 98 g/mol假设有50 g硫酸溶解在1000 mL水中,酸度为:50 g / 98 g/mol = 0.51 mol/L2. 计算碱度(碱的浓度):碱度的计算公式与酸度类似:碱度(mol/L)= 碱的物质的物质量(g)/ 碱的摩尔质量(g/mol)氢氧化钠(NaOH)的摩尔质量为:23 + 16 + 1 = 40 g/mol假设有80 g氢氧化钠溶解在1000 mL水中,碱度为:80 g / 40g/mol = 2 mol/L3. 判断酸碱的滴定比例:在酸碱中和反应中,酸的摩尔与碱的摩尔应该是1比1的比例。
根据以上计算得知,酸的摩尔浓度为0.51 mol/L,碱的摩尔浓度为2 mol/L,因此滴定比例为1:4。
实例二:稀硝酸与氢氧化钠的中和反应稀硝酸(HNO3)是一种强酸,氢氧化钠(NaOH)是一种强碱。
下面以它们的中和反应为例,介绍酸度和碱度的计算方法。
1. 计算酸度:稀硝酸(HNO3)的摩尔质量为:1 + 14 + 16*3 = 63 g/mol假设有30 g稀硝酸溶解在1000 mL水中,酸度为:30 g / 63 g/mol = 0.48 mol/L2. 计算碱度:氢氧化钠(NaOH)的摩尔质量为:23 + 16 + 1 = 40 g/mol假设有60 g氢氧化钠溶解在1000 mL水中,碱度为:60 g / 40g/mol = 1.5 mol/L3. 判断酸碱的滴定比例:酸的摩尔浓度为0.48 mol/L,碱的摩尔浓度为1.5 mol/L,滴定比例为1:3.125(即1:3)。

万能兑碱公式
哎呀呀,我还真没听说过“万能兑碱公式”呢,不过我可以给你想象一下呀。
比如假设一个公式:所需碱量 = 液体总量× 碱浓度比例。
举个例子哈,就像你在做面包的时候,你有一大盆面团(液体总量),然后你想要达到一个特定的碱度(碱浓度比例),那你不就得根据这个公式来算算到底需要放多少碱呀!这不就跟你出门前得根据天气和场合搭配衣服一样嘛,得选对才行呢!
哈哈,我这临时想的,也不知道对不对,但说不定真有类似的公式能帮大家在各种需要兑碱的情况下不出错呢。
你觉得怎么样呀?。
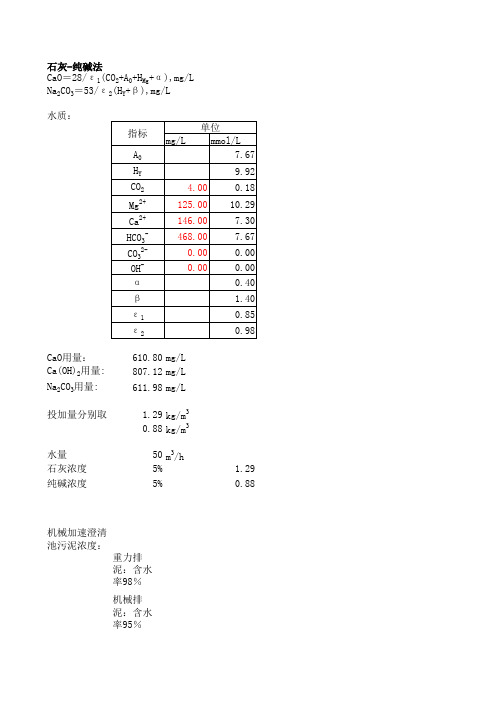
水质:CaO 用量:610.80mg/L Ca(OH)2用量:807.12mg/L Na 2CO 3用量:611.98mg/L 投加量分别取 1.29kg/m 30.88kg/m 3水量50m 3/h石灰浓度5%1.29纯碱浓度5%0.88机械加速澄清池污泥浓度:重力排泥:含水率98%机械排泥:含水率95%污泥组成主要为由加入的石灰反应生成的碳酸钙、由絮凝剂生成的氢氧化铁、进出水悬浮物浓度差絮凝剂加药量为30-80mg/L 以FeSO4.7H 2O计算,折算成氢氧化铁污泥为10-30mg/L石灰-纯碱法CaO =28/ε1(CO 2+A 0+H Mg +α),mg/LNa 2CO 3=53/ε2(H Y +β),mg/L碳酸钙泥量W1=石灰量*100/74氢氧化铁泥量W2=25mg/L悬浮物泥量W3=S1-S2排泥量W=(W1+W2+W3)*Q/0.02kg/d 排泥体积V=W/1020备注所有指标单位均为1价物质的量总碱度(以H+计)H Mg+H ca-H HCO3-(总永久硬度)原水镁硬度 即H Mg原水钙硬度即H Ca重碳酸盐碱度碳酸盐碱度氢氧化物碱度1/2Ca(OH)2过剩量,一般为0.2-0.4mmol/L1/2Na2CO3过剩量,一般为1.0-1.4mmol/L生石灰的纯度%纯碱的纯度%m3/hm3/h含水率=1-(W1-W2)/W1W1---进水污泥重量W2---浓缩或脱水后污泥重量机械加速澄清池排泥密酸钙、由絮凝剂生成的氢氧化铁、进出水悬浮物浓度差.7H2O计算,折算成氢氧化铁污泥为10-30mg/L加入石灰量为“方法二”中的量Q为一天的水量后污泥重量排泥密度约为1020kg/m3。

碱度投加量的实例计算!
一、PH对硝化的影响
pH值酸碱度是影响硝化作用的重要因素。
硝化细菌对pH反应很敏感,在pH中性或微碱性条件下(pH为8~9的范围内),其生物活性最强,硝化过程迅速。
当pH>9.6或<6.0时,硝化菌的生物活性将受到抑制并趋于停止。
若pH>9.6时,虽然NH4+转化为NO2—和NO3—的过程仍然异常迅速,但是从NH4的电离平衡关系可知,NH3的浓度会迅速增加。
由于硝化菌对NH3极敏感,结果会影响到硝化作用速率。
在酸性条件下,当pH<7.0时硝化作用速度减慢, pH <6.5硝化作用速度显著减慢,硝化速率将明显下降。
pH<5.0时硝化作用速率接近零。
pH下降的原因
pH下降的原因有两个,一是进水碱度不高。
二是进水碳源不足,无法补充硝化消耗的一半的碱度。
由硝化方程式可知,随着NH3-N被转化成NO3—-N,会产生部分矿化酸度H+,这部分酸度将消耗部分碱度,每克NH3-N转化成NO3—-N约消耗7.14g 碱度(以CaC03计)。
因而当污水中的碱度不足而TKN 负荷又较高时,便会耗尽污水中的碱度,使混合液中的pH值降低至7.0以下,使硝化速率降低或受到抑制。
如果无强酸排人,正常的城市污水应该是偏碱性的,即pH一般都大于7.0,此时的pH则主要取决于人流污水中碱度的大小。
所以,在生物硝化反应器中,应尽量控制混合液pH>7.0,制pH>7.0,是生物硝化系统顺利进行的前提。
而要准确控制pH,pH<6.5时,则必须向污水中加碱。
应进行碱度核算。
二、脱氮需碱量的计算
在硝化过程中需要消耗一定量的碱度,如果污水中没有足够的碱度,硝化反应将导致pH值的下降,使反应速率减缓,所以硝化反应要顺利进行就必须使污水中的碱度大于硝化所需的碱度。
在实际工程应用中,对于典型的城市污水,进水中NH3-N浓度一般为20~40mg
/L(TKN约50~60mg/L),碱度约200mg/
L(以Na2CO3计)左右。
1、一般来说,在硝化反应中每硝化lgNH3-N需要消耗7.14g碱度,所以硝化过程中需要的碱度量可按下式计算:
碱度=7.14×QΔCNH3-N×10-3 (1)
式中:
Q:日平均污水量,m3/d;
ΔCNH3-N:NH3-N浓度的差值,mg/L;
7.14:硝化需碱量系数,kg碱度/kgNH3-N。
2、对于含氨氮浓度较高的工业废水,通常需要补充碱度才能使硝化反应器内的pH值维持在7.2~8.0之间。
计算公式如下:
碱度=K×7.14×QΔCNH3-N×10-3 (2)
式中,K为安全系数,一般为1.2~1.3。
3、实际工程中进行碱度核算应考虑以下几部分:入流污水中的碱度,生物硝化消耗的碱度,分解BOD5产生的碱度,以及混合液中应保持的剩余碱度。
要使生物硝化顺利进行,必须满足下式:
ALKw+ALKc>ALKN+AlKE (3)
如果碱度不足,要使硝化顺利进行,则必须投加纯碱,补充碱度。
投加的碱量可按下式计算:
ΔALK=(ALKN+ALKE)-(ALKw+
ALKc)(4)
式中:
ΔALK:系统应补充的碱度,mg/L;
ALKN:为生物硝化消耗的碱量;ALKN一般按硝化每kgNH3-N消耗7.14kg碱计算。
ALKE:混合液中应保持的碱量,ALKE一般按曝气池排出的混合液中剩余50mg/L碱度(以Na2CO3计)计算ALKw:原污水中的总碱量;
ALKc:反硝化过程中产生的碱量
三、实例计算
如前所述,硝化反应中每消耗1g氨氮要消耗碱度
7.14g。
一般污水尤其是工业污水对于硝化反应来说,碱度往往是不够的,因此应投加必要的碱量以维持适宜的pH值,保证硝化反应的正常进行。
某处理厂采用脱氮工艺,日处理污水10000m3/d。
来水水中:BOD5=50mg/L(0.05kg/m3),NH3-N =50mg/L,碱度ALKw=100mg/L
(0.10kg/m3)。
欲使出水BOD5<5mg/L,NH3-N<5mg/L,剩余碱度10mg/L(0.01kg/m3)。
试核算该硝化系统的碱度,如果碱度不足,试计算投碱量。
解:
每日进水碱度ALKw =0.10×10^4=1000kg/d
反硝化ALKc =(0.05-0.005)×10^4×3.47=1683kg/d(反硝化降解每克BOD5产碱3.47g计算)
ALKN =(0.05-0.005)×10^4×7.14=3213 kg/d (按1kgNH3-N消耗7.14kg碱计算)
每日剩余碱度ALKE =0.01×10^4=100 kg/d
ALKw+ALKc =1000kg/d+1683kg/d =
2683kg/d
ALKN+ALKE =3213 kg/d+100 kg/d = 3313 kg/d
ALKw+ALKc ≯ALKN+ALKE
因此,该硝化系统内碱源不足。
如果不外加碱源,pH 将降低,抑制硝化进行,出水NH3-N超标。
如果外加碱源,则投碱量为:
ΔALK=3313—2683=630 kg/d
即每天需向来水中投加碱源630kg,具体可根据纯碱的有效成分,换算出纯碱的投加量。
——推广——。