中国儿科超说明书用药专家共识
- 格式:docx
- 大小:20.97 KB
- 文档页数:8



医疗机构超药品说明书用药管理专家共识_医疗机构超药品说明书用药管理专家共识一、引言1.1 背景和目的医疗机构在使用超药品时需要准确、规范的用药管理。
为此,本共识旨在提供医疗机构超药品说明书用药管理的指导原则和操作建议,以确保用药的安全性和有效性。
1.2 适用范围本共识适用于医疗机构内对超药品的使用和管理。
二、定义和缩写2.1 定义(在此定义医疗机构、超药品等相关术语)2.2 缩写(在此列出常用的缩写及其全称)三、超药品说明书用药管理的原则3.1 安全性原则3.1.1 严格遵守超药品说明书的使用方法、适应症、禁忌症等要求3.1.2 对超药品的使用应按照医疗机构内部的规定和制度进行管理,并建立监测和反馈机制3.1.3 报告和处理超药品使用中的不良反应和药物事件3.2 有效性原则3.2.1 根据超药品的适应症,合理选用超药品3.2.2 严格控制超药品的使用适应症,避免滥用和误用3.2.3 提高医务人员对超药品的知识和技能,确保正确使用超药品四、医疗机构超药品说明书用药管理的操作建议4.1 采购和储存4.1.1 根据超药品的质量要求,选择合格的供应商采购超药品4.1.2 超药品的储存条件应符合超药品说明书的要求,并进行定期检查和记录4.2 配置和分发4.2.1 配置超药品时,应保证超药品的完整性和正确性4.2.2 分发超药品时,应建立明确的分发流程和记录机制4.3 使用和管理4.3.1 医疗机构应建立超药品使用的规范和制度4.3.2 医务人员应接受超药品使用和管理方面的培训和教育4.3.3 医务人员在使用超药品时应严格按照超药品说明书的要求行事4.3.4 医疗机构应建立超药品使用监测和反馈机制4.3.5 医务人员应及时报告和处理超药品使用中的不良反应和药物事件五、附件(在此列出相关的附件文件)六、法律名词及注释(在此列出本文所涉及的法律名词及其注释)(本文档结束)。

超药品说明书用药中患者知情同意权的保护专家共识(广东省药学会2019年5月10日发布)1 概述随着人类疾病谱不断变迁和现代医药学持续发展,目前超药品说明书用药(以下简称“超说明书用药”)在世界范围内已是非常普遍的现象。
在普通成人用药中超说明书用药占7.5%~40%[1]。
在孕妇、儿童等特殊用药对象中更为常见。
英国一项来自利物浦妇女医院的研究显示,该院孕妇用药中58%的药品和55%的处方属于孕妇慎用或禁用,其中,有16%的药品和10%的处方属于高危超说明书用药[2]。
欧洲一项来自5个国家(英国、瑞典、德国、意大利、荷兰)各1所医院的儿科用药调查显示,46%的处方属于超说明书用药;儿童患者中超说明书用药高达67%[3]。
对某些特殊药物,如抗肿瘤药、抗精神病药超说明书使用较为频繁,有报告称5种使用最广泛的抗肿瘤药物的处方中有50%都是超说明书用药[4],而对于使用抗精神病药的患者,57.6%为超说明书用药[5]。
合理的超说明书用药在一定程度上有利于患者疾病治愈并推动现代医药学发展,但同时若不对此现象加以严格监管和规范,其潜在的危害不容忽视。
由超说明书用药引发的医疗损害赔偿案件近些年不时见诸报端,引起了医疗界、法律界和广大民众的关注。
目前从法院判决的有关超说明书用药的诉讼案例中,患者主张医方赔偿的主要案由除了药品不良反应带给患者的医疗损害以外,医方在超说明书用药的同时未对患者进行充分的知情告知、侵害患方知情同意权也是患方起诉医院赔偿的常见原因之一。
1.1 超说明书用药的概念超说明书用药也称未注册用法(off-label uses,unlabeled uses,out of label usage or outside of labeling),其内容包括超适应证、超剂量、超疗程、超适应人群及改变说明书中规定的用药途径与用药间隔时间等[6-7]。
药品说明书是经过严格的临床试验,并经过药品监督管理部门审核通过,具有重要法律地位的用药依据。

小儿麻醉常用药物超说明书使用专家共识(2017)左云霞,史琳,庄蕾,李克忠,李超,连庆泉,邹小华,宋兴荣,张马忠(负责人/执笔人),张建敏,陈怡绮,赵平,姜丽华1前言药物说明书经常滞后于临床实践,临床药物治疗中超说明书用药普遍存在。
儿科超说明书用药可达50%~90%,特别低龄新生儿、早产儿用药无法获得充分的循证医学证据,因而更易出现超说明书用药。
在我国医患关系有待改善的前提下,合理对待超说明书用药、保护超说明书用药的人群及用药医师意义重大,必须引起关注。
目前我国有关超说明书用药的法规尚未完善,一旦发生医疗意外事件,并且合并了超说明书使用麻醉药物,临床一线麻醉科医师将承担较大风险。
本文希望为从事小儿麻醉临床一线医师提供参考依据,以便更合理、安全、有效地使用现有麻醉药物,促进小儿麻醉事业的发展。
文献参照牛津大学EBM中心关于文献类型的新五级标准[1] ,从证据力强、设计严谨、偏差少至证据力弱、偏差多分为五级,分别为:1a级:随机对照的系统评价研究;1b级:随机对照研究;1c级:全或无病案研究;2a级:队列研究的系统评价研究;2b级:队列研究或较差随机对照研究;2c级:“结果”研究、生态学研究;3a级:病例对照研究的系统评价;3b:病例对照研究;4级:单个病例系列研究;5级:未经明确讨论或基于生理学、实验室研究或“第一原则”的专家意见。
2常用吸入麻醉药(一)七氟烷(sevoflurane)1. 说明书摘要[2]七氟烷用于成年人和儿童全身麻醉诱导和维持,包括住院和门诊患者,应由受过全身麻醉训练的医务人员使用。
使用时确保气道通畅,并备有人工呼吸机、给氧设备和循环复苏设备。
用法与用量:使用七氟烷专用挥发器。
诱导:七氟烷无刺激性气味,不刺激呼吸系统,适用于1岁~18岁儿童和成年人的面罩诱导麻醉。
维持全身麻醉所需七氟烷浓度呈年龄依赖性,当与N2O复合吸入时,儿童患者的七氟烷的MAC等量应适当降低,早产儿MAC还未确定,见表1。

医疗机构超药品说明书用药管理专家共识引言随着医疗技术和药物研发的不断进步,医疗机构对于药品的使用和管理也变得更加复杂。
为了确保患者的用药安全和有效性,医疗机构需要借助专家共识,加强对超药品说明书用药的管理。
本文将介绍医疗机构在超药品说明书用药管理方面的专家共识。
一、定义和范围超药品说明书用药指的是在临床实践中使用药品时,药品的使用目的、用法、剂量等方面与药品说明书中所列有所不同。
这种情况通常出现在临床医生为了更好地满足患者的个体化需求、提供更好的治疗效果而进行的药品使用。
专家共识的适用范围包括但不限于以下情况:1. 当某种药品的使用需要超过药品说明书中的限制时;2. 当患者存在个体差异需要个体化用药时;3. 当临床实践中出现新的适应症时;4. 当联合用药需要进行调整时;5. 当药品途径和频次需要根据患者情况调整时。
二、共识制定的原则和过程医疗机构应当基于科学依据和实践经验,制定超药品说明书用药管理专家共识。
制定共识的原则包括但不限于以下几点:1. 依据权威的药理学、临床研究和经验指南;2. 充分考虑患者的个体差异和特殊情况;3. 引入多学科的专家进行讨论和决策;4. 持续更新和改进共识内容。
共识的制定过程通常包括以下几个步骤:1. 提出需求和目标:明确共识的目的和制定的具体需求;2. 收集证据和资料:通过文献回顾、实践经验和研究数据收集相关证据和资料;3. 召开专家会议:组织相关领域的专家召开会议,讨论共识的制定和更新;4. 制定共识草案:根据专家会议的讨论和决策,制定共识的初步草案;5. 专家评审和意见征集:将共识草案发给参与制定共识的专家进行评审,并征集其他相关人员的意见;6. 最终共识确定和发布:根据专家评审和意见征集的结果,对共识进行修改和完善,并最终确定和发布。
三、专家共识的内容和要点专家共识的内容应当包括以下几个方面:1. 超药品说明书用药的适应症和禁忌症;2. 超药品说明书用药的剂量和给药途径;3. 超药品说明书用药的安全性和不良反应;4. 超药品说明书用药的监测和评估;5. 超药品说明书用药的时间和持续时间。

药评中心[gcplive]:超说明书用药是违法的,这是目前最大的共识。
“专家共识”,只能限制和规范超说明书用药行为,并不能免除医疗机构、医生和药师,在超说明书用药所造成的医疗纠纷中的责任!一是,因为《药品管理法》《医疗机构药事管理规定》《处方管理办法》《药品不良反应报告和监测管理办法》等法规迄今为止没有对“超说明书用药”这一行为进行规定。
二是,因为《侵权责任法》《执业医师法》《药品管理法》中涉及的有关条款原则上都不支持超说明书用药。
超说明书用药专家共识推荐意见——中国药理学会治疗药物监测研究专业委员会药品风险管理学组一、超说明书用药目的只能是为了患者利益临床诊疗过程中,无其他合理的可替代药物治疗方案时,为了患者的利益选择超说明书用药,而不是以试验、研究或其它关乎医师自身利益为目的的使用。
为了保护药品的知识产权,超说明书用药应当限于无合理可替代药品的前提下,如果市场存在可替代药品,应当优先选择该药品,而不应当超说明书用药二、权衡利弊,保障患者利益最大化超说明书用药时,必须充分考虑药品不良反应、禁忌症、注意事项等,权衡患者获得的利益和可能带来的风险,保证该药物治疗方案是最佳方案,以保障患者利益最大化。
三、有合理的医学证据支持超说明书用药必须有充分的文献报道、循证医学研究结果等证据支持。
具体证据及推荐强度分以下5个等级。
1.证据可靠,可使用级:(1)相同通用名称药品的国外或国内药品说明书标注的用法;(2)国内外医学和药学学术机构发布指南认可的超说明书用药;(3)经系统评价或Meta分析、多中心大样本随机对照试验证实的超说明书用药。
2.证据可靠性较高,建议使用级:(1)国内外权威医学专著已经收载的超说明书用药;(2)单个大样本的随机对照试验证实的超说明书用药。
3.证据有一定的可靠性,可以采用级:设有对照,但未用随机方法分组研究证实的超说明书用药。
4.证据可靠性较差,可供参考:(1)无对照的病例观察;(2)教科书收载的超说明书用药。


前言药物说明书是临床医师开立药物的主要依据。
但随着循证医学的日益发展,药物临床试验周期长、药物说明书更新慢等问题使许多药物说明书中的使用适应症、用量及用法远远落于临床实际应用。
超说明书用药在多个学科中是非常普遍的现象。
风湿性疾病、儿科疾病、肿瘤性疾病等均在各专科领域中发表了多个相关超说明书用药的专家共识。
重症患者作为一个特殊群体,接受诊治过程中超说明书用药常常无法避免。
目前我国关于超说明书用药的法规不健全,临床医师选择超说明书用药承担的风险大。
2021年《中华人民共和国医师法》第二十九条指出,在尚无有效或者更好治疗手段等特殊情况下,医师取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据的药品用法实施治疗。
广东省药学会重症医学用药专家委员会在2020年发布了第一版《临床重症与药学超说明书用药专家共识》,总结了常用且有参考价值的临床重症药物超说明书使用循证医学证据。
在本次专家共识更新中,我们新增了常用的镇痛镇静药物、多黏菌素、利奈唑胺、抗凝血用枸橼酸钠溶液、重组人血小板生成素在重症患者中的超说明书使用循证医学证据。
临床医师应该时刻评估重症患者的获益及风险,在遵循国家、地方政府及医院有关法规前提下,参考相关专家共识的意见进行个体化治疗。
需要强调的是,按照常规说明书可获得较好疗效时,应尽量避免超说明书用药。
本专家共识收录药品标准参考广东省药学会《超药品说明书用药目录》的收录标准,满足以下条件之一:1、美国、欧洲、日本说明书收录;2、《中国药典临床用药须知》、《临床诊疗指南》(中华医学会著、人民卫生出版社出版)收录;3、国际主流指南或共识(如NCCN)收录;4、Micromedex®有效性、推荐等级在Ⅱb级、证据等级B级或以上;5、四大医学期刊(NEJM、The Lancet、JAMA、The BMJ)或本专业SCI的I区期刊发表的RCT研究或meta分析证明适用。
本共识参照Micromedex®的Thomson 分级系统标准,对收录药物从有效性等级、推荐等级及证据等级三方面进行评价(Micromedex® 的Thomson 分级系统详见附录一)。



中国儿科超说明书用药专家共识原创2016-08-31略儿科空间儿科空间cmachild传播儿科学术资讯本文原载于中华儿科杂志, 2016,54(02) 超说明书用药(off–label use of drugs)是指药物的应用超出了国家药监部门认可的生产厂家提供的药品说明书界定范围,包括超出了适用年龄、剂量、剂型、给药途径或适应证等。
但是"超说明书用药"并不意味着不合理用药、违法用药或试验性用药[1],通常是经过广泛临床观察,并且有文献和循证医学证据支持的。
在儿科领域,超说明书用药面临一定风险和法律问题。
中华医学会儿科学分会临床药理学组经过组内各儿科亚专业医师和组外多位儿科临床药师的集体讨论,经过2年的撰写及修改,形成此共识,以期提高广大儿科临床医生对超说明书用药的认识,建立用药规范化流程,并推进各方力量规避超说明书用药的潜在风险。
目前尚缺乏国内儿科超说明书用药的整体数据。
来自国内三级甲等儿童医院的数据显示,超说明书用药在门诊及住院患儿均为普遍现象,住院患儿更为突出[2,3]。
来自首都医科大学附属北京儿童医院门诊数据显示:抽取2012年4月至2013年3月门诊处方10 716张,分析处方用药医嘱23 909条,涉及药品451种。
按处方数、用药医嘱数、药品总数、基本药物数以及非处方药(OTC)药品数计,超说明书用药发生率分别为53.0%、29.6%、65.0%、67.0%及79.8%。
其中超说明书用药发生率居前3位的年龄段为幼儿期(29.8%)、学龄前期(29.5%)和婴儿期(29.2%)。
超说明书用药类型主要包括:无儿童用法、用量和信息(61.7%),给药频次(12.8%)和剂量(11.1%)[4]。
对国内外门诊及住院儿童超说明书用药现状的系统评价显示[5,6],(1)门诊超说明书用药发生率:三级医疗机构发生率高于初级医疗机构,分别为26.0%、19.5%;新生儿、婴儿和青少年高于其他年龄组儿童;在药品种类中,呼吸系统用药、全身用抗感染药、感觉器官和皮肤用药的超说明书使用最常见;"无儿童用药信息"的超说明书用药和超年龄用药较常见。

2024超说明书用药管理专家共识3款药物超说明书用药(Off-Iabeldruguse,unlabeleduses)是指药品使用的适应证、剂量、途径、疗程或人群等未在药品监督管理部门批准的药品说明书范围内的用法。
临床药物治疗中,超说明书用药情况较为普遍,由此可能引发药物治疗的安全性、有效性、医疗责任和伦理学等一系列问题。
新版《中华人民共和国医师法》首次将诊疗指南、循证医学指导下的超说明书用药写入法条,明确了超药品说明书用药的条件与法律地位,这是我国临床用药管理的重大突破,对从业医师和药师具有重要意义,也为医疗机构规范管理超药品说明书用药提出了要求。
近日,《黑龙江省超说明书用药管理专家共识》于《黑龙江医药》期刊发布,为规范管理黑龙江省医疗机构超说明书用药提供管理建议,其中,眼科疾病相关用药涉及以下3款。
一、地塞米松A超适应证:(1)累及眼后段的非感染性葡萄膜炎(玻璃体内植入剂);(2)糖尿病黄斑水肿的治疗(玻璃体内植入剂\A用法用量:(1)累及眼后段的非感染性葡萄膜炎:推荐剂量为单只患眼在玻璃体内给予一枚植入剂(0.7mgX每支给药器只能用于治疗一只眼睛,若另T则眼睛需要治疗,必须使用新的给药器。
玻璃体内注射应在受控的无菌条件下进行;玻璃体内注射后,应监测患者眼内压升高和眼内炎。
(2)糖尿病黄斑水肿的治疗:推荐剂量为单只患眼在玻璃体内给予一枚植入剂(0.7mg)o每支给药器只能用于治疗一只眼睛,若另一侧眼睛需要治疗,必须使用新的给药器。
玻璃体内注射应在受控的无菌条件下进行;玻璃体内注射后,应监测患者眼内压升高和眼内炎。
A超用法用量:(1)眼内、视神经、眼眶、眼肌炎性疾病的对症治疗(葡萄膜炎,网状脉络膜炎,视网膜血管炎,视神经炎,眼眶炎性假瘤,眼眶漏斗尖端综合征服肌麻痹)结膜下注射一次0.33-2.1mg球后注射一次0.83-4.1mg;滴眼一次0.21-0.83mg,一日3-8次;(2)外眼部和前眼部炎性疾病的对症治疗,滴眼不合适或不充分的(眼睑炎,结膜炎,角膜炎,巩膜炎,虹膜睫状体炎)结膜下注射一次0.33-2.1mg,球后注射一次0.83-4.1mg;(3)眼科领域的术后炎症:结膜下注射一次0.33-2.1mg,滴眼0.21-0.83mg,一日3-8次。


超药品说明书用药中患者知情同意权的保护专家共识(广东省药学会2019年5月10日发布)1 概述随着人类疾病谱不断变迁和现代医药学持续发展,目前超药品说明书用药(以下简称“超说明书用药”)在世界范围内已是非常普遍的现象。
在普通成人用药中超说明书用药占7.5%~40%[1]。
在孕妇、儿童等特殊用药对象中更为常见。
英国一项来自利物浦妇女医院的研究显示,该院孕妇用药中58%的药品和55%的处方属于孕妇慎用或禁用,其中,有16%的药品和10%的处方属于高危超说明书用药[2]。
欧洲一项来自5个国家(英国、瑞典、德国、意大利、荷兰)各1所医院的儿科用药调查显示,46%的处方属于超说明书用药;儿童患者中超说明书用药高达67%[3]。
对某些特殊药物,如抗肿瘤药、抗精神病药超说明书使用较为频繁,有报告称5种使用最广泛的抗肿瘤药物的处方中有50%都是超说明书用药[4],而对于使用抗精神病药的患者,57.6%为超说明书用药[5]。
合理的超说明书用药在一定程度上有利于患者疾病治愈并推动现代医药学发展,但同时若不对此现象加以严格监管和规范,其潜在的危害不容忽视。
由超说明书用药引发的医疗损害赔偿案件近些年不时见诸报端,引起了医疗界、法律界和广大民众的关注。
目前从法院判决的有关超说明书用药的诉讼案例中,患者主张医方赔偿的主要案由除了药品不良反应带给患者的医疗损害以外,医方在超说明书用药的同时未对患者进行充分的知情告知、侵害患方知情同意权也是患方起诉医院赔偿的常见原因之一。
1.1超说明书用药的概念超说明书用药也称未注册用法(off-label uses,unlabeled uses,out of label usage or outside of labeling),其内容包括超适应证、超剂量、超疗程、超适应人群及改变说明书中规定的用药途径与用药间隔时间等[6-7]。
药品说明书是经过严格的临床试验,并经过药品监督管理部门审核通过,具有重要法律地位的用药依据。
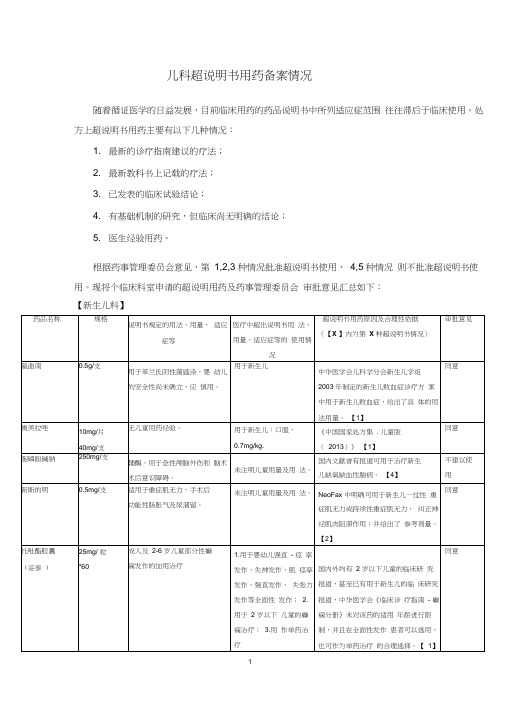
儿科超说明书用药备案情况
随着循证医学的日益发展,目前临床用药的药品说明书中所列适应症范围往往滞后于临床使用。
处方上超说明书用药主要有以下几种情况:
1. 最新的诊疗指南建议的疗法;
2. 最新教科书上记载的疗法;
3. 已发表的临床试验结论;
4. 有基础机制的研究,但临床尚无明确的结论;
5. 医生经验用药。
根据药事管理委员会意见,第1,2,3 种情况批准超说明书使用,4,5 种情况则不批准超说明书使用。
现将个临床科室申请的超说明用药及药事管理委员会审批意见汇总如下:
【新生儿科】
小儿神经和消化科】
小儿呼吸肾脏内分泌科】
传染儿科】
儿童心血管科】
麻醉科】
产科】
儿科教研室/门诊部】。


超说明书用药专家共识中国药理学会治疗药物监测研究专业委员会药品风险管理学组超说明书用药又称“药品说明书外用法”、“药品未注册用法”,是指药品使用的适应证、剂量、疗程、途径或人群等未在药品监督管理部门批准的药品说明书记载范围内的用法。
临床药物治疗中,超说明书用药普遍存在。
在美国,有21%已批准药物存在超说明书用药情况;其中,在成人用药中占7.5%40%,在儿科用药中占50%90%[1]。
一项针对欧洲五国儿科病房用药的调查发现,46%的处方中存在超说明书适应证用药的情况[2]。
另一项针对英国利物浦妇女医院17695份用药医嘱的研究显示,该院孕妇用药中有84%的药品品种和75%的用药医嘱存在超说明书用药情况;58%的药品品种和55%的医嘱用药属于孕妇慎用或禁用,其中超说明书用药分别有16%的药品品种和10%的用药医嘱用药属于食品和药品管理局(FDA)高危药品目录中药品[3]。
超说明书用药在各个治疗领域广泛存在,由此引发了药品安全性、有效性、医疗责任和伦理学等一系列问题,有必要对其进行规范。
1 国内外超说明书用药相关立法情况1.1国外超说明书用药相关立法情况美国、德国、意大利、荷兰、新西兰、印度和日本已有超说明书用药相关立法,除印度禁止超说明书用药外,其余6国均允许合理的超说明书用药。
美国、英国、德国、意大利、荷兰、澳大利亚、新西兰、中国、日本和南非10个国家的政府部门或学术组织发布了与超说明书用药相关的指南或建议[4]。
在美国,FDA明确表示,“不强迫医生必须完全遵守官方批准的药品说明书用法”[5]。
美国权威的指导超说明书用药的资料如American Medical Association:Drug Evaluations、Us Pharmacopoeia:Drug Information和American Hospital Formulary Service:Drug Information,收录了说明书用药顾问委员会认可以及医疗专家推荐的广泛应用于临床的“说明书用法(labeled uses)”和“说明书之外的用法(off-labeled uses)”,并且定期修改和更新其中美国药典委员会定期更新的Drug Information,由美国药典委员会顾问小组根据当前的文献资料、临床实践中的用法及合理用药等知识,将“药品说明书用法”和“说明书之外的用法”列为“已接受的用法”,而“不合适的用法(inappropriate uses)”、“未被验证的用法(unproved uses)”及“过时的用法(obsolete uses)”等,则被列入“不可接受的用法(unaccepted uses)”。

最新:重点监控药品超说明书临床合理应用专家共识之儿科相关推荐为贯彻落实国务院办公厅《关于加强三级公立医院绩效考核工作的意见》,国家卫生健康委员会于2023年1月13日确定了《第二批国家重点监控合理用药药品目录》(简称《目录》),以进一步规范和促进药品在临床中的合理使用。
随着医疗技术的不断进步和药物研发的日益完善,一些药物可能在超出其说明书范围的情况下,对某些特定患者或疾病表现出积极的治疗效果。
然而,这种超说明书使用必须谨慎,避免带来潜在的风险或不良反应。
鉴于此,中华医学会临床药学分会成立《国家重点监控药品超说明书临床合理应用专家共识》编写小组,通过循证检索和专家评估,分别于2023年4月18日和5月16日两次召开第七届天府药学论坛线上会议,指导专家委员会对《目录》中30余种药品常见的超说明书用药情况进行评估,明确临床应用条件和原则,旨在进一步加强医务人员对重点监控药品超说明书临床应用的认知,引导临床医师在必要情况下进行合理、规范应用,从而最大程度地提高治疗效果,保障患者的用药安全。
表1第二批国家重点监控合理用药药品目录Tab.1List of the second batch of national keymonitoring drugs rational drug catalogue序号药品通用名序号药品通用名1奥美拉哇16左氧板沙星2人血白蛋白17法莫替丁3头布服酮舒巴坦18奥拉西坦4依达拉奉19雷贝拉畦5银杏叶提取物20前列地尔6泮托拉哇21骨肽7复方赛基酸22罂粟嶂8地佐辛23烟酸9倍他司汀24乙酰谷酰胺10布地奈德25兰索拉畦H烟酰胺26脑蛋白水解物12头苑他啜27美罗培南13底拉西林他哩巴坦28磷酸肌酸14艾司奥美拉哩29单唾液酸四己精神经节昔脂15毗拉西坦30头抱曜脂以下简要介绍涉及儿科用药的内容:一、质子泵抑制药(PPIs)儿童使用PPIs的经验相对有限,目前我国药品说明书中均未明确推荐儿童使用PPIs,但临床中却存在多种酸相关疾病儿童使用PPIs 的情况,梳理儿童超说明使用PPIs的循证证据十分有必要。
中国儿科超说明书用药专家共识原创2016-08-31略儿科空间儿科空间cmachild传播儿科学术资讯本文原载于中华儿科杂志, 2016,54(02) 超说明书用药(off–label use of drugs)是指药物的应用超出了国家药监部门认可的生产厂家提供的药品说明书界定范围,包括超出了适用年龄、剂量、剂型、给药途径或适应证等。
但是"超说明书用药"并不意味着不合理用药、违法用药或试验性用药[1],通常是经过广泛临床观察,并且有文献和循证医学证据支持的。
在儿科领域,超说明书用药面临一定风险和法律问题。
中华医学会儿科学分会临床药理学组经过组内各儿科亚专业医师和组外多位儿科临床药师的集体讨论,经过2年的撰写及修改,形成此共识,以期提高广大儿科临床医生对超说明书用药的认识,建立用药规范化流程,并推进各方力量规避超说明书用药的潜在风险。
目前尚缺乏国内儿科超说明书用药的整体数据。
来自国内三级甲等儿童医院的数据显示,超说明书用药在门诊及住院患儿均为普遍现象,住院患儿更为突出[2,3]。
来自首都医科大学附属北京儿童医院门诊数据显示:抽取2012年4月至2013年3月门诊处方10 716张,分析处方用药医嘱23 909条,涉及药品451种。
按处方数、用药医嘱数、药品总数、基本药物数以及非处方药(OTC)药品数计,超说明书用药发生率分别为53.0%、29.6%、65.0%、67.0%及79.8%。
其中超说明书用药发生率居前3位的年龄段为幼儿期(29.8%)、学龄前期(29.5%)和婴儿期(29.2%)。
超说明书用药类型主要包括:无儿童用法、用量和信息(61.7%),给药频次(12.8%)和剂量(11.1%)[4]。
对国内外门诊及住院儿童超说明书用药现状的系统评价显示[5,6],(1)门诊超说明书用药发生率:三级医疗机构发生率高于初级医疗机构,分别为26.0%、19.5%;新生儿、婴儿和青少年高于其他年龄组儿童;在药品种类中,呼吸系统用药、全身用抗感染药、感觉器官和皮肤用药的超说明书使用最常见;"无儿童用药信息"的超说明书用药和超年龄用药较常见。
(2)住院儿童超说明书用药:超说明书用药在全球儿科和新生儿病房普遍存在,不同国家和病房报告的超说明书用药发生率差异大。
各类儿科病房超说明书用药发生率中位数为:新生儿重症监护病房(ICU)52.5%,儿科ICU 43.5%,普通儿科35.5%,儿科手术病房27.5%。
各研究报告不同年龄段超说明书用药发生率不一致,超说明书用药类型构成比依次为:无儿童用药信息7%~54%,超剂量和疗程8%~86%,超年龄用药3%~67%。
2012年中华医学会儿科学分会临床药理学组对北京、上海、湖南、四川、广州、新疆等21家医院的儿科医师进行了"超药品说明书用药"问卷调查,通过对收回的578份有效问卷的分析显示:67.19%的医师有开具超说明书用药处方经历,技术职称越高,开具超说明书处方的可能性越大,不同职称医生对超说明书用药的认知存在差异;多数医生认同超说明书用药中知情同意的重要性;82.70%认为超说明书用药在某种程度上不可避免;19.10%的医师认为开具超说明书用药处方违法;仅有28.77%的医生所在医院对开具超说明书用药相关制度有统一的规定[7]。
1.医生超说明书用药存在执业风险:我国《处方管理办法》第十四条规定:"医师应当根据医疗、预防、保健需要,按照诊疗规范、药品说明书中的药品适应证、药理作用、用法、用量、禁忌、不良反应和注意事项等开具处方。
"限定的处方依据是药品说明书和国家或专业学(协)会发布的治疗指南和技术规范。
《执业医师法》第二十五条指出:"执业医师应严格按照规定使用合格药品,否则由此造成的后果由本人负责,依照法律规定受到处罚。
"我国目前对超药品说明书用药虽然没有禁止,但也没有对其合法性进行规定。
因此对于儿科医生而言超说明书用药存在一定法律风险。
2.医疗机构处在法律风险中:在2015年4月新颁布的《中华人民共和国药品管理法》第九十二条规定:"药品的生产企业、经营企业、医疗机构违反本法规定,给药品使用者造成损害的,依法承担赔偿责任。
"超说明书用药现象的存在使医疗机构也处于法律风险中。
3.增加患儿用药不良事件的发生风险:在可能无药可医的情况下,医生选择给患儿超说明书用药,是希望他们得到最适合的药物治疗。
但不可避免的是,超说明书用药后患儿不良事件的发生风险确实较说明书内用药提高[8]。
超说明书用药现象如此普遍,与以下原因有关:1.药品说明书的更新滞后:超说明书用药的最常见形式是说明书无儿童用药信息,而更新说明书需要药品生产企业大量投入,进行临床试验,因此国内多数企业不愿主动更新或修改说明书。
2.儿科医学实践的不断发展:临床医生在探索对患儿的治疗过程中不断积累临床经验,获得临床用药疗效证据,使得某些药物的超说明书用药成为普遍现象。
3.儿科医生的无奈选择:对于某些疾病或儿科某些群体(例如新生儿),如均在说明书内用药则面临无药可医的局面。
4.其他原因:确有某些儿科医生执业行为不规范、制药企业利益博弈、药监部门审批程序繁琐等其他因素的影响。
(一)多角度同时进行应对1.从医药行政主管部门角度:应认识到某些超说明书用药的合理性,明确具有法律效力的"诊疗规范"的概念,制定规范化的政策流程。
2.从医疗机构角度:应有相应的药事管理及药物治疗委员会,与医学伦理学委员会一起制定详尽的、可操作性的流程,规范医疗机构内超说明书用药的流程。
3.从临床医生角度:应规范自己的执业行为,按照流程执业,避免不必要的超说明书用药;临床医生还应积极参与儿童药物临床研究,为积累更多的临床用药依据打下基础;应积极检索追踪国际相关疾病治疗药物的最新文献,为超说明书用药提供科学的文献依据;必须遵循其所在医疗机构的超说明书用药管理流程。
4.从行业学会角度:应收集证据、制定诊疗指南或专家共识,加强医师药师培训并进行患者教育。
5.从制药企业角度:应开展儿童临床药物试验,更新、修订说明书。
6.从药监部门角度:应监管并敦促制药企业进行说明书的更新,应对儿科药物说明书的修订进行流程的简化及优先,并对儿童药物临床试验给予政策的支持及优惠。
7.从法律制定部门角度:应对超说明书用药有明确的立法规定,明确超说明书用药在哪些情况下具有合理性,建议将权威行业学会所指定的相关用药的指南及专家共识作为用药依据,而非拘泥于药品说明书。
目前超说明书用药有明确立法的国家仅7个,印度官方是唯一禁止超说明书用药的国家,其余6个国家(美国、日本、德国、意大利、荷兰、新西兰)均允许超说明书用药,且有相关的用药规范。
8.从公众教育角度:利用多种宣传途径向公众解释儿童合理用药问题,加强科普宣教,以增进公众对药物使用的了解和认知,加强医患的良好沟通,以降低医疗过程中因误解导致的医患矛盾。
(二)多层面共同实施管理1.从学术层面:儿科学术组织积极开展儿童的药物临床研究、为儿童用药提供循证医学证据,建立指南及共识,为临床合理用药提供依据。
2.从管理层面:超说明书用药应遵循六项原则(无替代、有证据、非试验、获批准、有知情、可监控),即对"超说明书用药"的使用必须具备以下条件:在影响患者生活质量或危及生命的情况下,无合理的可替代药品;用药目的不是试验研究;有合理的医学实践证据;经医院药事管理与药物治疗学委员会(或药事管理委员会)及伦理委员会批准;保护患者的知情权;并对证据来源、药品种类、医师权限、用药人群进行分级管理。
3.从操作层面:医疗机构应有完善的管理流程,包括如下步骤:临床医生提出超说明书用药申请→同时提供超说明书用药证据→超说明书用药评价专家组评定→经伦理委员会和(或)药事管理委员会批准,备案→获得患者知情同意→药学部门处方审核及用药监控,建立超说明书用药数据库,组织专家进行评估并定期更新;超说明书用药的开具有提示、有记录,超说明书用药的审核有证据,有结果统计,有用药相关信息反馈。
总之,超说明书用药是不容回避的现实情况。
只有通过医药行政主管部门、药监部门、医疗机构、儿科医生、制药企业、行业学会、法律部门的共同配合,才能使超说明书用药的发生率下降,并给儿科医生合理合法超说明书用药的空间,最终目的是使患儿得到最合理的药物治疗,真正保护我国儿童健康成长。
(吴晔执笔)参加本共识制定的专家:北京大学第一医院儿科(王丽、吴晔);四川大学华西第二医院药剂科(张伶俐),儿科(石晶);首都医科大学附属北京儿童医院药剂科(王晓玲);首都医科大学附属北京佑安医院药剂科(朱晓红);复旦大学附属儿科医院药剂科(李智平);重庆医科大学附属儿童医院呼吸科(刘恩梅);首都医科大学宣武医院药剂科(姜德春);广东省深圳市儿童医院神经科(廖建湘);浙江大学附属儿童医院药剂科(王珏);吉林省长春市儿童医院呼吸科(王振华);广东省南方医科大学珠江医院儿科(杨丽华、王爱华);福建省福州南京军区总医院儿科(任榕娜);山东大学齐鲁医院儿童医疗中心神经科(刘心洁);江西省儿童医院呼吸科(刘建梅);福建省医科大学附属协和医院药学部(刘茂柏);中国医科大学附属盛京医院儿科(刘雪雁);陕西省西安市儿童医院(成华);上海交通大学医学院附属上海儿童医学中心麻醉科(张马忠);湖北省武汉市儿童医院药剂科(张华年);湖南省儿童医院神经科(张洁);上海交通大学医学院附属新华医院药剂科(张健);江苏省南京医科大学附属南京儿童医院儿科(张爱华);首都儿科研究所附属儿童医院神经科(李尔珍);新疆石河子大学医学院第一附属医院儿科(谷强);黑龙江省大庆油田总医院儿科(陈英才);北京中医药大学东方医院临床药理基地办公室(周鹍);江苏省苏州大学附属儿童医院血液肿瘤科(胡绍燕);湖北省华中科技大学同济医院儿科(徐三清);中南大学湘雅医院儿科(黄榕);四川省成都市妇女儿童中心医院儿科(谢晓丽);湖南省中南大学湘雅二院儿科(薄涛)。