人教版第二节元素性质的周期性变化规律
- 格式:ppt
- 大小:2.04 MB
- 文档页数:47
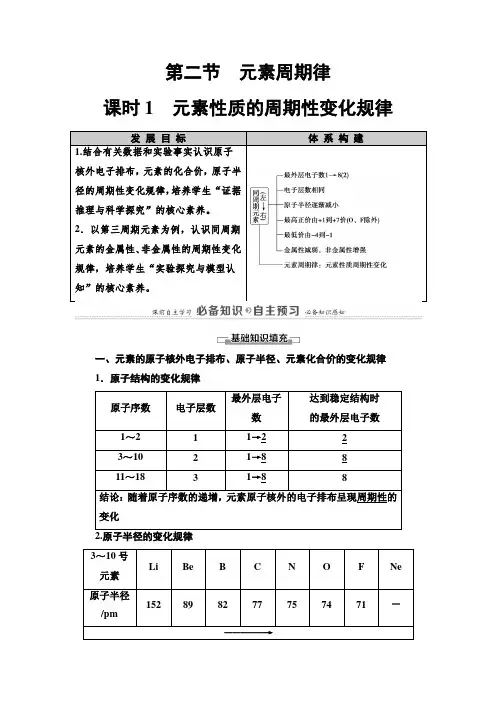
第二节元素周期律课时1元素性质的周期性变化规律发展目标体系构建1.结合有关数据和实验事实认识原子核外电子排布,元素的化合价,原子半径的周期性变化规律,培养学生“证据推理与科学探究”的核心素养。
2.以第三周期元素为例,认识同周期元素的金属性、非金属性的周期性变化规律,培养学生“实验探究与模型认知”的核心素养。
一、元素的原子核外电子排布、原子半径、元素化合价的变化规律1.原子结构的变化规律原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~2 1 1→2 23~10 2 1→8 811~18 3 1→8 8结论:随着原子序数的递增,元素原子核外的电子排布呈现周期性的变化3~10号元素Li Be B C N O F Ne 原子半径/pm152 89 82 77 75 74 71 -―――――→逐渐减小11~18号元素Na Mg Al Si P S Cl Ar 原子半径/pm186 160 143 117 110 102 99 -变化趋势―――――→逐渐减小结论:随着原子序数的递增,元素原子的半径呈现周期性变化原子序数主要化合价的变化1~2 +1―→03~10+1―→+5-4―→-1―→011~18+1―→+7-4―→-1―→0结论:随着原子序数的递增,元素的主要化合价呈周期性变化二、第三周期元素性质的递变1.钠、镁与水的反应钠镁实验操作实验现象钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色反应原理2Na+2H2O===2NaOH+H2↑Mg+2H2O=====△Mg(OH)2↓+3(1)实验探究:①向AlCl3溶液中加入足量氨水,现象为产生白色沉淀,反应的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH+4。
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为白色沉淀逐渐溶解,离子方程式为Al(OH)3+3H+===Al3++3H2O;另一支试管中加入NaOH溶液,现象为白色沉淀逐渐溶解,离子方程式为Al(OH)3+OH-===AlO-2+2H2O。


元素周期表的周期性规律与元素性质变化及元素周期表的趋势元素周期表是化学中重要的工具,它以一种有序的方式展示了所有已知化学元素的信息。
元素周期表的设计有助于我们理解元素的性质和规律,在化学研究和实践中发挥着重要的作用。
本文将探讨元素周期表的周期性规律、元素性质变化以及元素周期表的趋势。
1. 元素周期表的周期性规律元素周期表按照原子序数的顺序排列,将元素按照一定的规律分类。
周期表的每一横行称为一个周期,每一竖列称为一个族。
这种排列方式揭示了许多元素性质的周期规律。
1.1 原子半径的周期性变化原子半径是一个元素的原子中心到其最外层电子的平均距离。
从周期表中可以看出,原子半径随着周期数的增加而减小,而在同一周期内,随着原子序数的增加,原子半径也逐渐减小。
这是因为随着电子层数的增加,同时核吸引力对电子的作用也增强,使得电子云更加紧密,从而缩小了原子半径。
1.2 电离能和电子亲和能的周期性变化电离能是指从一个原子或离子中移去一个电子所需的能量,而电子亲和能是指一个原子或离子吸引并获得一个额外电子所释放出的能量。
这两个性质也有周期性变化。
在周期表中,可以观察到电离能和电子亲和能随着原子序数的增加而增加。
这是因为随着电子层数和核电荷的增加,电子与原子核的相互作用也相应增强,因此需要更多的能量才能移除一个电子或者吸收一个电子。
2. 元素性质的变化元素周期表不仅展示了元素的周期性规律,还反映了元素性质的变化。
不同族和周期的元素具有特定的化学性质,可以根据周期表的排列来预测元素的性质。
2.1 金属、非金属和类金属根据周期表可以将元素分为金属、非金属和类金属。
在周期表的左侧,大部分元素都是金属,具有良好的导电性、热导性和延展性。
在周期表的右侧,有一群非金属元素,它们通常是不良导体,脆弱且不可塑性。
在中间部分,是一些性质介于金属和非金属之间的元素,被称为类金属。
2.2 元素的化合价和氧化性元素的化合价指的是一个元素与其他元素形成化合物时所带的电荷。

元素周期表的周期性规律与元素性质变化元素周期表是化学家们对元素进行分类、归纳和整理的重要工具,它展示了元素的周期性规律与性质变化。
通过仔细观察元素周期表,我们可以发现一些重要的规律,包括原子半径、电离能、电负性、金属性质等等。
本文将介绍这些规律及其对元素性质的影响,以便更好地理解元素周期表的意义。
1. 原子半径的周期性规律在元素周期表中,原子半径以递增和递减的方式呈现周期性变化。
具体来说,原子半径从左到右在周期表中递减,而在同一周期内,原子半径从上到下递增。
这种规律的原因主要取决于电子排布。
从左到右,原子核中的质子数量逐渐增加,增加的质子数吸引了更多的电子,使原子变得紧凑,半径变小。
而从上到下,新的能级不断添加,电子在更远离原子核的能级中排列,导致原子半径变大。
2. 电离能的周期性规律电离能指的是从一个原子中移除一个电子所需的能量。
同样地,电离能也呈现出周期性的变化。
从左到右,电离能逐渐增加,而从上到下,电离能逐渐减小。
这种规律主要取决于原子结构。
从左到右,原子核中的质子数量增加,原子的正电荷也增加,使得电子与原子核之间的吸引力增强,电离能增加。
而从上到下,原子半径增加,电子与原子核之间的距离增大,电离能减小。
3. 电负性的周期性规律电负性是一个元素在化学键中吸引和保留电子的能力。
元素周期表中,电负性也显示出周期性的规律。
从左到右,元素的电负性逐渐增加;而从上到下,电负性逐渐减小。
电负性的变化也与原子结构有关。
从左到右,原子核中的质子数量增加,电子在共享键中受到更强的引力,使元素的电负性增加。
而从上到下,原子半径增加,电子云变得更广泛稀疏,元素的电负性减小。
4. 金属性质的周期性规律元素周期表中,金属性质也呈现出一定的周期性规律。
金属通常位于元素周期表的左侧和中间区域,而非金属通常位于右侧。
这种规律与原子结构有关。
金属具有较低的电离能和较大的原子半径,有较强的导电性和热传导性。
非金属具有较高的电离能和较小的原子半径,通常是不良导体。


元素性质的周期性变化的规律元素性质的周期性变化是指元素的一些物理和化学性质随着元素原子序数的增加而出现规律性变化的现象。
这一周期性的变化反映了元素内电子结构的变化。
本文将从周期表的发现开始,介绍元素性质周期性变化的规律、主要原因以及应用。
周期表的发现元素周期表是化学家门捷列夫于1869年提出的化学元素分类图表。
在这个表中,元素按照原子序数的递增排列,同时可以根据元素的周期性变化进行分组。
化学家门捷列夫根据元素的性质绘制了第一版的周期表,并发现了元素周期性变化的规律。
1.原子半径:随着元素原子序数的增加,原子半径呈现周期性变化。
在同周期内,随着原子序数的增加,原子半径逐渐减小。
在同族内,随着原子序数的增加,原子半径逐渐增加。
2.电离能:电离能是指从一个原子或离子中移去一个电子所需要的能量。
随着元素原子序数的增加,第一电离能呈现周期性变化。
在同周期内,随着原子序数的增加,第一电离能逐渐增加。
在同族内,随着原子序数的增加,第一电离能逐渐减小。
3.电负性:电负性是指元素吸引和结合电子的能力。
随着元素原子序数的增加,电负性呈现周期性变化。
在同周期内,随着原子序数的增加,元素的电负性逐渐增加。
在同族内,随着原子序数的增加,元素的电负性逐渐减小。
4.酸性:酸性是指物质在溶液中释放出H+离子的能力。
随着元素原子序数的增加,酸性呈现周期性变化。
在同周期内,随着原子序数的增加,元素的酸性逐渐减弱。
在同族内,随着原子序数的增加,元素的酸性逐渐增强。
5.金属性:金属性是指元素的物理和化学性质,如导电性、延展性和反射性等。
随着元素原子序数的增加,金属性呈现周期性变化。
在同周期内,随着原子序数的增加,元素的金属性逐渐减弱。
在同族内,随着原子序数的增加,元素的金属性逐渐增强。
6.化合价:化合价是指一个原子和其他原子形成化合物时与其他原子相连的价数,即原子化学价。
随着元素原子序数的增加,化合价呈现周期性变化。
在同周期内,随着原子序数的增加,元素的最高可达价数逐渐增加。

元素性质的周期性变化的规律一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;但由于阴离子是电子最外层得到了电子而阳离子是失去了电子所以, 同种元素 1 阳离子半径原子半径 3 阴离子半径>阳离子半径。
短周期中电子填充到最外电子层,同层电子间屏蔽效应弱,因此有效核电荷增加显著,而电子层数不变,核对外层电子吸引力逐渐变大,所以短周期元素原子半径从左到右递减较快。
长周期元素中,从第 3(ⅢB)族开始,电子填充至到次外层上,这新增加到次外层上的电子对外层电子屏蔽作用强。
因此,随核电荷的增加而有效核电荷却增加不多。
同一族元素中,由上至下虽然核电荷增加较多,但相邻两元素之间依次增加一个电子层因而屏蔽作用也较大,结果有效核电荷增加不显著。
同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
主族中从上到下核电荷明显增大,但随电子层数的增加,屏蔽作用增加,因而有效核电荷增加不明显,由于电子层数的增加,原子半径明显增大;副族的过渡元素,第一过渡系与第二过渡系由于有效核电荷增大不及电子层增加的作用,原子半径增大。
但由于镧系收缩,使第二、第三过度系同族元素的半径几乎不变,有的甚至减小。
二、电离能同周期主族元素从左到右作用到最外层电子上的有效核电荷逐渐增大,半径逐渐减小,电离能也逐渐增大,稀有气体由于具有稳定的电子层结构,其电离能最大,故同周期元素从强金属性逐渐变到非金属性,直至强非金属性。
同周期副族元素从左至右,由于有效核电荷增加不多,原子半径减小缓慢,有电离能增加不如主族元素明显。
由于最外层只有两个电子,过渡元素均表现金属性。
同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,电离能由大变小,元素的金属性逐渐增强。
同一副族电离能变化不规则。
三、电子亲和能变化趋势与电离能相似,具有大的电离能的元素一般电子亲和能也很大四、电负性一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减。

人教版初三化学元素周期表认识元素性质元素周期表是用于反映元素性质和组织元素关系的重要工具。
它把所有已知的化学元素按照一定的规则排列,使得相似性质的元素归于同一族,而且依据元素的电子结构理论上很好地解释了化学元素的一系列性质。
人教版初三化学教材对于元素周期表的认识和元素性质的学习是很重要的。
一、元素周期表的基本概念和组成元素周期表是由上至下按元素的原子序数递增排列,元素周期表上的每一个元素方格都包含了该元素的原子序数、元素符号、相对原子质量和元素名等信息。
周期表可以分为横行称为周期,纵列称为族。
周期表中的元素按照不同的电子排布规律自上向下地排列,同一周期内的元素有着类似的化学性质。
二、元素周期表的排列规律元素周期表的排列规律主要包括原子序数增加的规律、周期性性质的出现以及元素周期律的具体表现。
元素周期表的排列方式是根据每个元素的原子核中质子数的增加顺序建立的,根据元素的电子结构和属性进行分类。
在周期表中,元素周期表是根据弗兰克-科顿摄谱系列律排列的,周期表展示了元素的有规律的性质变化。
例如,同一周期内的元素原子半径逐渐减小,电子亲和能增加、电离能增加;而同一族内的元素具有相似的化学性质,例如碱金属的活泼性都很强。
三、元素性质的认识元素周期表的存在使得我们能够很好地认识元素的性质和规律。
具体来说,可以通过元素周期表对元素的位置和周期表中的性质特征来认识元素的性质。
1. 元素周期表中的族:根据元素的性质和性质变化规律,元素周期表将元素分为不同的族。
不同族的元素具有一些相似的性质。
例如,第一族元素是碱金属,它们的特点是活泼、易失去电子,而且易与非金属反应形成化合物;第十六族的氧族元素是非金属元素,具有高的电负性,易于与金属形成氧化物。
2. 元素周期表中的周期:元素周期表的周期也是有规律的,周期性的性质随着周期的变化而出现。
例如,原子半径是指元素中心到电子云边缘的距离,一般来说,周期表上同一周期内的元素原子半径逐渐减小。

化学元素的周期性规律性质化学元素是构成物质的基本单位,它们的性质和行为对于化学研究和工业应用至关重要。
化学元素的周期性规律性质是指元素周期表中元素性质的有规律的周期性变化。
本文将探讨化学元素的周期性规律性质,并分析其对于化学研究和应用的意义。
1. 原子半径周期性变化原子半径是指元素的原子的半径大小。
在周期表中,元素的原子半径呈现一定的周期性变化规律。
一般来说,从左至右,原子半径逐渐减小,因为电子层的数量增加,但核电荷不变,所以电子云受到的吸引力增强,原子半径减小。
而从上至下,原子半径逐渐增大,因为电子层数目增加,电子云远离原子核,原子半径增大。
这一周期性变化对于元素的化学反应和物理性质有重要影响。
2. 电离能周期性变化电离能是指在气态下,一个原子中最外层电子脱离原子形成阳离子所需的能量。
周期表中,电离能呈现一定的周期性变化规律。
从左至右,电离能逐渐增大,因为原子半径减小,原子核对最外层电子的吸引力增强,电子更难被脱离。
而从上至下,电离能逐渐减小,因为原子半径增大,最外层电子与原子核之间的吸引力减弱,电子更容易被脱离。
电离能的周期性变化对于元素的化学反应和电子结合行为具有重要的影响。
3. 电负性周期性变化电负性是指原子吸引和保持共价化合物中的电子对的能力。
周期表中,电负性呈现一定的周期性变化规律。
从左至右,电负性逐渐增大,因为原子半径减小,核电荷增强导致原子对电子的吸引力增强。
而从上至下,电负性逐渐减小,因为原子半径增大,核电荷增强对电子的吸引力减弱。
电负性的周期性变化对于元素在化学反应中的电子转移和共价键形成具有重要影响。
4. 金属性和非金属性的周期性变化周期表中的元素可以分为金属和非金属。
从左至右,金属性逐渐减弱,非金属性逐渐增强。
金属具有良好的导电性和热导性,而非金属多为绝缘体或者半导体。
金属与非金属在化学反应中表现出不同的性质和行为,这一周期性变化对于元素的化学性质具有重要的指导意义。
综上所述,周期表中化学元素的周期性规律性质对于我们理解元素的性质和行为具有重要的意义。


第四章《物质结构元素周期律》教学设计第二节元素周期表律第一课时元素性质的周期性变化规律【规律】随着原子序数的递增,元素原子的核外电子排布呈现周期性变化.如下图所示:【教师】评价、强调:周期元素的原子半径的变化规律是由左向右元素的原子半径逐渐减小(不包括稀有气体)。
【教师】追问:观察下图,判断同周期和同主族元素原子半径的变化规律【学生】同主族元素由上向下元素的原子半径逐渐增大,同周期元素由左向右元素的原子半径逐渐减小。
H是所有原子中半径最小的。
【教师】评价、补充。
【问题3】阅读教材P107108页内容,观察表45,作出原子序数与元素化合价函数图象,由此可得出什么规律?并完成表格内容【学生1】同周期由左向右元素的最高正价逐渐升高,元素的最低负价由ⅠA族的4价逐渐升高至ⅠA族的1价。
【教师】强调、投影:原子序数与元素化合价函数图象(横坐标原子序数,纵坐标元素的主要化合价)。
【学生2】完成表格内容、展示交流:同周期主族元素的主要化合价周期序号原子序数主要化合价第一周期 1 +1第二周期3→9最高价+1→+5(不含O、F) ,最低价-4→-1第三周期11→17最高价+1→+7 ,最低价-4→-1【教师】评价、投影:【教师】追问:随着原子序数的递增,元素的主要化合价呈现周期性变化,具体有哪些表现?【学生1】随着元素核电荷数的递增,同一周期元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的规律性变化;【学生2】最外层电子数=最高正价;最高正价+|最低负价|=8(H、O、F除外);【学生3】主族序数=最高正价=最外层电子数(O、F除外)。
【教师】评价、强调:金属无负价;H最高价为+1,最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1【对应练习1】对于原子核外电子层数为3的元素,随着最外层电子数的增大,下列说法中错误的是A.原子半径逐渐减小B.原子的失电子能力逐渐增强C.最高正化合价逐渐增大D.元素的非金属性逐渐增强【答案】B【解析】A.原子核外电子层数为3的元素,随着最外层电子数的增大,原子半径依次减小,A正确;B.原子核外电子层数为3的元素,随着最外层电子数的增大,原子得电子能力依次增强,B错误;C.原子核外电子层数为3的元素,随着最外层电子数的增大,最高正化合价逐渐增大,C正确;D.原子核外电子层数为3的元素,随活【过渡】根据第三周期元素原子核外电子排布规律,周期元素金属性和非金属性又具有怎样的变化规律呢? 【问题1】讨论交流:回顾已学知识,思考判断元素金属性和非金属性强弱的依据有哪些?【教师】结合所学知识,思考判断金属性强弱的方法有哪些?【学生1】利用原子结构判断:电子层数越多,最外层电子数越少,金属性越强。