高三化学物质的量
- 格式:ppt
- 大小:2.76 MB
- 文档页数:52


高三化学物质的量知识点化学是自然科学的一个重要分支,研究物质的性质、组成以及变化规律等。
其中,物质的量是化学中一个重要的概念。
本文将介绍一些高三化学中关于物质的量的知识点。
1. 物质的量的概念物质的量是描述物质数量的一个基本概念,用符号n表示,单位是摩尔(mol)。
一个摩尔的物质的量等于该物质中包含的粒子(原子、离子、分子等)的数量,其中包含的粒子数量被称为阿伏伽德罗常数,约为6.022×10²³。
2. 摩尔质量摩尔质量是指一个物质摩尔的质量,用符号M表示,单位是克/摩尔(g/mol)。
摩尔质量可以通过原子质量或分子质量进行计算。
原子质量是一个元素原子质量的摩尔质量,分子质量是一个分子的摩尔质量。
3. 摩尔体积摩尔体积是指一个物质摩尔的体积,用符号V表示,单位是升/摩尔(L/mol)。
摩尔体积可以通过气体的体积和气体的物质的量来计算。
在标准状况下,一个摩尔的任何气体的体积约为22.4升。
4. 摩尔比摩尔比是指不同物质摩尔的比值。
它可以表示化学方程式中物质的量的比例关系。
例如,对于化学方程式2H₂+ O₂→ 2H₂O,它表示了氢气和氧气的摩尔比为2:1。
5. 反应物的量和生成物的量的关系在化学反应中,反应物的量和生成物的量之间存在一定的关系。
这种关系可以通过化学方程式和摩尔比来推导和计算。
根据化学方程式中的摩尔比,可以确定反应物和生成物的物质的量之间的关系。
6. 摩尔浓度摩尔浓度是指溶液中溶质的物质的量与溶液的体积之比,用符号C表示,单位是摩尔/升(mol/L)。
摩尔浓度可以通过溶质的物质的量和溶液的体积来计算。
它是描述溶液浓度的重要参数。
7. 摩尔反应热摩尔反应热是指在化学反应中单位摩尔反应物转化为产物时释放或吸收的能量,用符号ΔH表示,单位是焦耳/摩尔(J/mol)。
摩尔反应热可以通过实验测量得到,它反映了化学反应的放热或吸热性质。
总结:通过对高三化学物质的量知识点的介绍,我们了解到物质的量是描述物质数量的重要概念,摩尔质量、摩尔体积、摩尔比、摩尔浓度和摩尔反应热等是与物质的量相关的重要参数。


高三总复习专题二----- 物质的量知识点一、物质的量、摩尔质量、阿伏加德罗常数、气体摩尔体积⑴物质的量(n)的单位是摩尔(mol)。
把含有阿伏加德罗常数(约6.02×1023)个粒子的集体定义为1摩尔(1mol)。
①阿伏加德罗常数(NA)与物质的量(n)的关系:※N == n·N A (N:微粒数)②摩尔质量(M)与物质的量(n)的关系:※m == n·M (m :物质的质量)⑵气体摩尔体积(V m):单位物质的量的任何气体在相同条件下占有的体积。
单位是L/ mol。
①单位物质的量的任何气体在相同条件下占有的体积相等。
推论1 在标况下,任何气体1mol所占有的体积相等,约为22.4L。
推论2 在相同条件下,任何等物质的量的气体所占有的体积相等,但不一定是22.4L。
②气体摩尔体积(V m)与物质的量(n)的关系:※V == n ·V m (V:气体的体积)知识点二、阿伏加德罗定律及应用①定义:在同温同压下,同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。
②阿伏加德罗定律的应用同温同压下,任何气体的体积比等于气体的物质的量之比,即V1/V2 == n1/n2同温、定容时,任何气体的压强比等于气体的物质的量之比,即P1/P2 == n1/n2同温同压下,任何气体的密度比等于它们的相对分子质量之比,即ρ1/ρ2== M1/M2同温同压下,任何气体的质量比等于它们的相对分子质量之倒数比,即m1/m2=M1/M2同温、同压下,等质量的任何气体的体积比等于等于它们的相对分子质量之倒数比:V1/V2=M2/M1知识点三、物质的量浓度(c)c B == n B / V注意:⑴物质的量的科学表达,它的计算对象是微观粒子。
⑵概念要清晰,分清楚物质的量、物质的质量、摩尔质量。
⑶注意物理量的单位别混淆。
⑷气体摩尔体积22.4L/mol是适用于标准状况下的气体。
知识点三、配制一定物质的量浓度的溶液(C)⑴配制步骤①计算:算出固体溶质的质量或液体溶质的体积。


高三化学物质的量练习题化学是自然科学的一门重要学科,其中物质的量是化学研究中非常基础的概念之一。
掌握物质的量的概念和计算方法对于高三学生来说非常重要。
下面是一些化学物质的量练习题,帮助学生更好地理解和应用该知识。
1. 请计算下列物质的摩尔质量:a) 氨气(NH3)b) 二氧化碳(CO2)c) 硫酸(H2SO4)2. 将下列物质的质量转换为摩尔数:a) 36 g的水(H2O)b) 120 g的氧气(O2)c) 80 g的硝酸(HNO3)3. 对于下列反应,求出所需物质的量比:a) 2 NH3 + 4 O2 → 2 HNO3 + 3 H2Ob) 2 NaOH + H2SO4 → Na2SO4 + 2 H2Oc) C6H12O6 + 6 O2 → 6 CO2 + 6 H2O4. 请计算下列反应中的产物的摩尔质量:a) 4 NH3 + 5 O2 → 4 NO + 6 H2Ob) 2 H2 + O2 → 2 H2Oc) C6H6 + O2 → CO2 + H2O5. 在金属镁与氯气反应过程中,如果有4 mol的氯气,问需要多少摩尔的镁才能完全反应?写出反应的化学方程式。
6. 一定量的硝酸与过量的氢氧化钠反应生成硝酸钠和水,如果生成了3.5 mol的硝酸钠,问开始时有多少摩尔的硝酸参与了反应?写出反应的化学方程式。
7. 氢气和氯气反应生成盐酸,如果反应生成了2 mol的盐酸,问需要多少摩尔的氢气和氯气?写出反应的化学方程式。
8. 铁和硫反应生成硫化铁,如果生成了0.5 mol的硫化铁,问需要多少摩尔的铁和硫?写出反应的化学方程式。
9. 氨气和氧气反应生成一种化合物,如果反应生成了4 mol的化合物,问需要多少摩尔的氨气和氧气?写出反应的化学方程式。
10. 氮气和氢气反应生成氨气,如果反应生成了8 mol的氨气,问需要多少摩尔的氮气和氢气?写出反应的化学方程式。
思考题:如果反应过程中有限制剂存在,那么最终生成物的摩尔数和理论上的计算结果有什么关系?为什么?以上就是高三化学物质的量练习题,希望通过这些练习题,学生们能够更好地掌握和理解物质的量的概念和计算方法。

必考部分第一章化学中常用的物理量——物质的量第1讲物质的量气体摩尔体积考纲要求:1.了解物质的量(n)及其单位摩尔(mol)的含义。
2.了解摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(C)、阿伏伽德罗常数(N A)的含义。
3.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行相关运算。
考点一物质的量、摩尔质量核心知识1.物质的量、摩尔、阿伏伽德罗常数(1)物质的量:①定义:表示含有一定数目微观粒子的集合体的物理量。
②符号:n,单位:mol(摩尔)补充:七个基本物理量:1971年第十四届国际计量大会确定,它们分别是:长度(m)、时间(s)、质量(kg)、热力学温度(K)、电流(A)、发光强(cd)、物质的量(mol)。
注意事项:1.“物质的量”是一个基本物理量,而不是摩尔,它是一个整体,不能增添或删减,也不能说物质的质量或物质量。
2.“物质的量”仅用于表示微观的粒子,即分子、原子、离子、质子、中子、电子不能表示宏观粒子。
3.“物质的量”是构建微观粒子和宏观物质的桥梁。
4.“摩尔”是物质的量的单位。
正如“米”是长度的单位一样。
5.使用摩尔是必须指明微粒的名称或符号或化学式等具体组合。
如:1mol氢(×) 1molH(√) 1mol氢原子(√)1mol水(√) 1molHO(√) 1mol水分子(√)2(2)摩尔(ρ):①摩尔是物质的量的单位,简称:摩。
符号:mol②数值规定:国际上规定,1mol粒子集合体所含有的粒子数与0.012kgC12中所含的碳原子数相同,约为6.02×1023。
(3)阿伏伽德罗常数:①概念:1mol任何粒子的粒子数。
符号为N,单位为mol-1A②精确值:0.012kg12C中所含的碳原子数。
③近似值:N A≈6.02×1023mol-1④关系式:物质的量与微观粒子的换算关系:n=N/N A注意事项:1.阿伏伽德罗常数在数值上约为:6.02×1023。
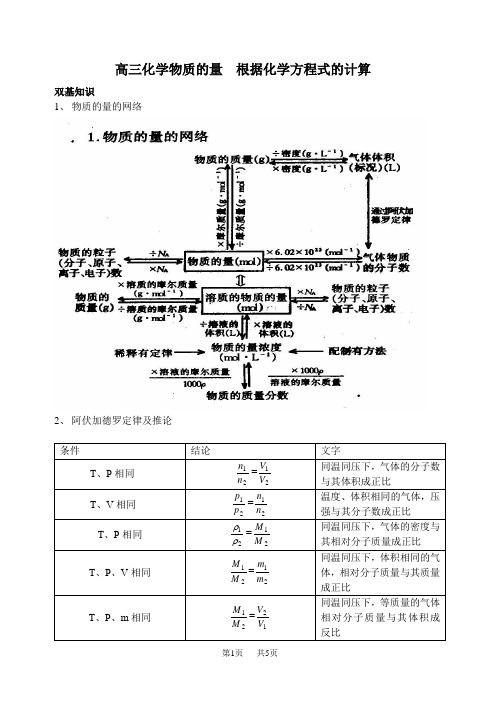
高三化学物质的量根据化学方程式的计算双基知识1、物质的量的网络2、阿伏加德罗定律及推论3、 气体相对分子质量的计算(1) 已知标准状况下气体密度ρ,M=22.4ρ(2) 已知气体A 对气体B 的相对密度d ,M A =dM B (3) 已知混合气体的平均相对分子质量为M ,M =m 总/n 总(式中m 总是气体混合物的总质量,n 总是混合气体的总物质的量)(4)M =M 1w 1+M 2w 2+……如M(空气)=28×78%+32×21%+40×0.94%+44×0.03%+18×0.03%=28.964、 物质的量浓度溶液的配制(1) 计算:所需固体的质量或浓溶液的体积(小数点后保留一位小数)。
(2) 称:用天平。
注意NaOH 等易潮解和腐蚀性的物质要放在小烧杯中迅速称量。
量:用量筒或滴管,注意规格。
(3) 溶解:在烧杯中进行。
注意烧杯规格与所配溶液体积相近,加水量为所配溶液体积的一半。
(4) 移液:在冷却后进行,注意容量瓶规格。
(5) 洗涤:洗涤烧杯、玻璃棒2~3次,一起注入容量瓶中,并轻轻摇动容量瓶,再加水至近刻度1~2cm 处。
(6) 定容:注意定容后摇匀(此时液面有可能低于刻度线,那是在瓶塞处损耗之故,无需再定容)。
巧思巧解1、 关于物质的量浓度的计算主要包括:(1) 溶质的质量、溶液的体积和物质的量浓度之间的计算。
可运用公式:n=m/M ,c=n/V 或运用“倍数关系”算出1L 溶液所含溶质的物质的量。
(2) 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的密度,计算溶液中的溶质的物质的量浓度。
应先运用n=V/22.4L/mol,求出溶质的物质的量,运用V=m/ρ(液) 求出溶液的体积.(3) 计算溶液中的离子浓度,还要根据溶质的电离方程式,算出离子的物质的量。
2、 溶液中溶质的质量分数与物质的量浓度之间的换算,溶液的密度是必不可少的条件。

化学高三知识点物质的量化学高三知识点:物质的量一、引言在化学中,物质的量是一个非常重要的概念。
了解物质的量对于理解化学反应、计算摩尔质量以及进行化学计量等都至关重要。
本文将介绍关于物质的量的基本概念、计算方法以及相关应用。
二、物质的量的概念1. 物质的量的定义物质的量(简称“物量”,符号为n)是指物质所含粒子(原子、分子、离子等)的数量。
物质的量与物质的质量(m)以及物质的摩尔质量(M)有关,可以用下式表示:n = m/M2. 摩尔摩尔是物质的量的计量单位,简称mol,表示每一物质所含有的物质的量。
1摩尔物质的量等于Avogadro常数(6.022×10^23)个粒子的物质的量。
三、物质的量的计算1. 根据质量计算物质的量已知物质的质量m,摩尔质量M,可以用下式计算物质的量:n = m/M2. 根据体积计算物质的量对于理想气体,在一定温度和压力下,物质的物质的量与其体积成正比。
可以使用理想气体状态方程PV = nRT中的V(体积)来计算物质的量。
四、物质的量在化学计算中的应用1. 化学方程式的配平配平化学方程式是化学反应的基础,物质的量在配平方程式中起着至关重要的作用。
根据物质的量比例可以确定不同反应物的系数,达到质量守恒和电荷守恒的要求。
2. 粒子间的比例关系物质的量可以用来推导粒子间的比例关系。
例如,利用摩尔比可以确定化学反应中各种物质的摩尔比,得到反应物和生成物之间的化学计量关系。
3. 计算摩尔质量摩尔质量是指1摩尔物质的质量,通常以g/mol为单位。
通过计算物质的摩尔质量可以确定物质的化学式及其相对分子质量。
五、案例分析:物质的量在实际问题中的应用例如,我们需要制备硝酸铁。
已知Fe(OH)3的含量为2g,要求制备250mL硝酸铁溶液,浓度为0.1mol/L。
我们可以通过以下步骤计算所需的物质的量:1. 计算Fe(OH)3的摩尔质量M;2. 根据已知质量和摩尔质量计算Fe(OH)3的物质的量;3. 根据所需溶液体积和浓度计算硝酸铁的物质的量。


第3讲物质的量【学习目标】1、了解定量研究的方法是化学发展为一门科学的重要标志。
2、了解物质的量的单位—摩尔(mol)、摩尔质量、气体摩尔体积、阿伏加德罗常数、物质的量浓度的含义。
3、根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
了解溶液体积、物质的量的浓度和溶质的物质的量之间的关系。
4、了解配制一定溶质质量分数、物质的量浓度溶液的方法。
【预习案】一、物质的量1、物质的量是国际单位制的七种基本量之一,________是物质的量的单位。
每摩尔物质含有阿佛加德罗常数个微粒,阿伏加德罗常数:其数值为0.012 kg 12C 所含的碳原子数,大约为____________,单位:______2、摩尔质量:_________________________________________单位:____________物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间存在的关系:____________ 3、气体摩尔体积:___________________________________________________单位:______标准状况下气体摩尔体积:________________4、物质的量浓度:溶质的物质的量、溶液的体积与物质的量浓度的关系:______________ 例1:下列关于物质的量的说法中不正确的是( )A.物质的量是国际单位制的7个基本单位之一B.物质的量实际上表示含有一定数目的粒子集体C.物质的量的单位是“摩尔”D.是表示物质数量的单位例2:下列说法正确的是(N A表示阿伏加德罗常数的值)()A.在常温常压下,11.2LN2含有的分子数为0.5N AB.在常温常压下,1molNe含有的原子数为N AC.71gCl2所含分子数为2N AD.在同温同压下,相同体积的任何气体单质所含的原子数相同二、阿伏伽德罗定律在相同温度和压强下,同体积的任何气体都含有相同数目的分子。

高三物质的量知识点总结物质的量是物质的基本属性之一,也是化学中一个重要的概念。
在高三化学学习中,物质的量是一个必须要掌握的知识点。
本文将对高三物质的量知识点进行总结。
一、物质的量的概念物质的量是描述物质中所含有的粒子数目的量。
它用单位摩尔(mol)来表示,符号为n。
二、物质的量的计算公式物质的量与物质中的粒子数有关,可以通过质量、摩尔质量和粒子数之间的关系来计算。
计算公式如下:物质的量(mol) = 质量(g)/摩尔质量(g/mol)物质的量(mol) = 粒子数目/阿伏伽德罗常数(6.0221×10^23 mol^-1)三、摩尔质量摩尔质量是指单位物质的质量,摩尔质量与元素的原子质量有关。
常用的单位是克/摩尔(g/mol)。
四、实质量与相对分子质量实质量指的是物质的真实质量,使用单位是克(g)。
而相对分子质量是指相对于碳-12同位素的质量,它是一个无量纲的量,用符号Mr表示。
五、化学方程式中的物质的量关系在化学方程式中,物质的量之间存在着一定的关系。
化学方程式中的物质的量关系为化学计算提供了重要的依据。
六、气体的物质的量气体的物质的量可以通过气体的体积和压强与标准状态下的物质的量之间的关系来计算。
此关系由理想气体状态方程PV=nRT (P为气体的压强,V为气体的体积,T为气体的温度,R为气体常量)给出。
七、溶质的物质的量和溶度在溶液中,溶质的物质的量与溶质的质量和溶液的体积之间存在关系。
溶质的物质的量可以用溶质的质量除以溶质的摩尔质量来计算。
八、物质的量在化学反应中的应用物质的量是化学反应中的一个重要概念,它对反应的进度、生成物的数量等都有着重要影响。
通过物质的量可以确定化学反应的化学方程式以及物质的变化。
九、物质的量的浓度物质的量浓度是指单位体积(或质量)溶液中物质的量的多少。
它可以用物质的量除以溶液的体积(或质量)来计算。
总结:高三物质的量是化学中的重要概念,通过物质的量的计算可以了解到不同物质之间的关系及其在化学反应中的应用。

高中化学物质的量相关计算公式有哪些高中化学物质的量相关计算公式1.物质的量=微粒数/阿伏伽德罗常数(n=N/NA)2.物质的量=物质的质量/物质的摩尔质量(n=m/M)3.物质的量=气体的体积/气体的摩尔体积(n=V/Vm)4.c=1000mL/Lρ(密度) w / M5:物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol)6.c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 用浓溶液配制稀溶液时使用在稀释溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液的物质的量相等。
7.c混·V混=c1·V1+c2·V2+……+cn·Vn(有多少种溶液混合n就为几)8.同温同压时 V1/V2=n1/n2=N1/N2 正比同温同体积 P1/P2=N1/N2=n1/n2 正比同压同物质的量 V1/V2=T1/T2 正比同温同物质的量 V1/V2=P2/P1 反比同体积同物质的量 P1/P2=T1/T2 正比同温同压同体积 m1/m2=Mr1/Mr2=M1/M2 正比同温同压同质量 V1/V2=p1/p2=M2/M1 反比同温同体积同质量 p1/p2=Mr1/Mr2=M2/M1 反比同温同压密度1/密度2=Mr1/Mr2=M1/M2 正比9.n、V、Vm、N、NA、m、M、c的关系n=m/M=N/NA=V/Vm=cVPS:V----体积 p------压强T-----温度 n ------物质的量N ----分子数 Mr----相对分子质量M------摩尔质量 m-----质量c------物质的量浓度9.关于物质的量浓度与质量分数的转化(推导和演化)C=ρ·ω·1000/M其中,C:物质的量浓度(单位mol/L)ω:溶液的密度,(形式为质量分数,1) ρ:密度,(单位g/mL)M:物质的摩尔质量,(单位g/mol)c=n/Vn(溶质的物质的量)=ω__m(溶液质量)/Mm(溶液质量)=ρ· Vm(溶液溶质的质量)=ω(质量分数)·ρ(密度)·V故,n(溶质的物质的量)=ω·ρ·V / Mc= n/V=(ω·ρ· V /M) / V=ω·ρ· V /M V=ω·ρ/M若密度ρ单位为1000kg/m^3(国际单位)=1 g/cm^3.有关溶液稀释和浓缩的计算V1ρ1×ω1= V2ρ2×ω2 (溶质的质量守恒)C1V1=C2V2 (溶质的物质的量守恒)有关两种不同浓度溶液混合的计算C3V3 =C1V1+C2V2 (混合前后溶质的物质的量总和不变)高考化学复习指导方法1.后期的复习除注重知识重现和巩固外,还必须加强答题用语准确和书写规范训练。




高中化学常用公式1. 有关物质的量(mol )的计算公式(1)物质的量(mol )()=物质的质量物质的摩尔质量()g g mol /(2)物质的量(mol )()=⨯微粒数(个)个6021023./mol(3)气体物质的量(mol )=标准状况下气体的体积().(/)L L mol 224(4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL )=溶液质量溶液体积()()g mL②溶质的质量分数()=⨯+溶质质量溶质质量溶剂质量(g g )()100%③物质的量浓度(mol/L )=溶质物质的量溶液体积()()mol L(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数=⨯⨯⨯⨯物质的量浓度溶质的摩尔质量溶液密度(mol /L)1(L)(g /mol)1000(mL)(g /mL)100% ②物质的量浓度=⨯⨯⨯1000(mL)(g /mL)(g /mol)1(L)溶液密度溶质的质量分数溶质摩尔质量(3)溶液的稀释与浓缩(各种物理量的单位必须一致):①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c (浓)·V (浓)=c (稀)·V (稀)] (4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)3. 有关溶解度的计算公式(溶质为不含结晶水的固体) (1)基本公式:①溶解度饱和溶液中溶质的质量溶剂质量(g)100(g)(g)(g)=②溶解度溶解度饱和溶液中溶质的质量饱和溶液的质量(g)100(g)(g)(g)(g)+=(2)相同温度下,溶解度(S )与饱和溶液中溶质的质量分数(w%)的关系:S g w g w g g ()()()()()=-⨯100100w S g S g %()()()=+⨯100100%(3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m 的计算:m g g g =⨯溶解度蒸发溶剂(水)的质量()()()100 (4)降低热饱和溶液的温度,析出晶体的质量m 的计算:()()m g g =+⨯-高温溶解度低温溶解度高温溶解度高温原溶液质量100()()4. 平均摩尔质量或平均式量的计算公式(1)已知混合物的总质量m (混)和总物质的量n (混):M m n =()()混混说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。

高三一轮复习化学第一部分 基本概念专题1——物质的量及物质的量浓度计算一、物质的量1.物质的量物质的量是国际单位中七个基本物理量之一,用来计量原子、分子或离子等微观粒子的多少。
基准:以0.012kg 12C 中所含的碳原子数为基准,即阿伏加德罗常数。
【注】a.用物质的量来表示微粒时,要用化学式注明微粒的种类或其特定组合; 如1mol 水(不正确)和1molH 2O (正确)b.物质的量只适用于微观粒子,不适用于宏观物质。
如1mol 麦粒、1mol 电荷、1mol 元素的描述都是错误的。
2.阿伏加德罗常数阿伏加德罗常数是一个可以用实验测出的准确值,目前只测出6.0221367×1023mol -1,在应用中用6.02×1023 mol -1作为它的最大近似值用于计算。
阿伏加德罗常数是一个非常大的数,只适用于表示微观粒子。
公式:n =AN N【注】应用时要注意:a.特殊物质的摩尔质量及微粒数目:如D 2O 、18O 2、H 37Cl 等。
b.某些特定组合物质分子中的原子个数:如稀有气体为单原子分子,O 3为三原子分子,白磷(P 4)为四原子分子。
c.某些物质中的化学键数目:如白磷(31g 白磷含1.5molP -P 键)、金刚石(12g 金刚石含2mol C -C 键)、晶体硅及晶体SiO 2(60g 二氧化硅晶体含4molSi -O 键)等。
d.某些特殊反应中的电子转移数目:如Na 2O 2与H 2O 、CO 2的反应(1mol Na 2O 2转移1mol 电子;Cl 2与H 2O 、NaOH 的反应(1mol Cl 2转移1mol 电子。
若1mol Cl 2作氧化剂,则转移2mol 电子);Cu 与硫的反应(1mol Cu 反应转移1mol 电子或1mol S 反应转移2mol 电子)等。
e.电解质溶液中因微粒的电离或水解造成微粒数目的变化:如强电解质HCl 、HNO 3等因完全电离,不存在电解质分子;弱电解质CH 3COOH 、HClO 等因部分电离,而使溶液中CH 3COOH 、HClO 浓度减小;Fe 3+、Al 3+、CO 32–、CH 3COO –等因发生水解使该种粒子数目减少;Fe 3+、Al 3+、CO 32–等因发生水解反应而使溶液中阳离子或阴离子总数增多等。

考点05 物质的量气体摩尔体积一、物质的量的单位——摩尔1.物质的量(1)物质的量是表示含有一定数目粒子的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔(3)书写方法及含义表述微观粒子的物质的量时,必须指明微观粒子的种类:如1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子。
2.阿伏加德罗常数3.物质的量、阿伏加德罗常数与粒子数之间的关系(1)关系式:n=NN A。
(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比。
4.物质的量的理解——“四化”二、摩尔质量 1.摩尔质量2.物质的量、质量和摩尔质量之间的关系 n =m M。
3.以物质的量(n )为桥梁联系宏观物质质量(m )与微观微粒数(N )之间的关系。
m M =n =N N A。
4.摩尔质量概念的理解 ①等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
②确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
5.摩尔质量的计算方法①已知任意状态物质的质量时:M =mn (定义式)。
②已知一个分子的质量时:M =m (分子)×N A 。
三、决定物质体积大小的因素及阿伏加德罗定律 1.决定物质体积大小的因素 (1)物质体积大小的影响因素(2)粒子数目相同物质的体积关系2.阿伏加德罗定律在相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的,这是理解气体体积的理论基础。
(1)阿伏加德罗定律的内容相同的温度和压强下,粒子数相同的任何气体都具有相同的体积,也可以说,在相同的温度和压强下、相同体积的任何气体都含有相同数目的粒子。
(2)特别提示①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”。
四、气体摩尔体积1.气体摩尔体积2.标准状况下的气体摩尔体积所以标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。