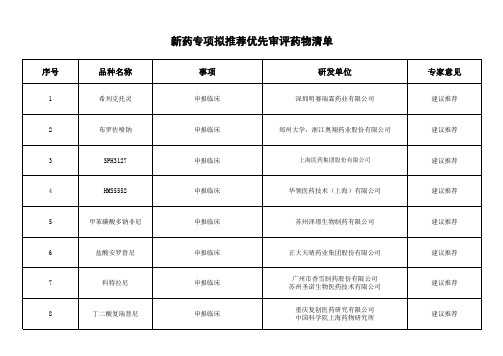
新药专项拟推荐优先审评药物清单
- 格式:xls
- 大小:30.00 KB
- 文档页数:2

药审中心建议批准的重要治疗领域药品介绍2014-03-11中国医药报抗感染用药帕拉米韦氯化钠注射液该药是重度甲型或乙型流感病毒感染的治疗药物,是我国具有自主知识产权的化合物。
该药经特殊审批程序和措施完成生产上市审评,及时为甲流治疗和疫情防控提供了新的有效手段。
环丝氨酸胶囊该药是合成的广谱抗菌药品,对耐药结核有效并不易产生耐药。
世界卫生组织推广的DOTS-Plus的治疗策略中就包括该药和卷曲霉素。
我国依据其多剂量药代动力学研究和生物等效性研究数据,以及我国结核病治疗需要,批准其生产上市。
首个环丝氨酸仿制药品的批准生产上市,符合我国二线抗结核病药物储备的需要,是抗击“耐多药结核病”重大公共卫生事件的重要药物基础。
吗啉硝唑氯化钠注射液该药是我国自主研发和创制的全新抗厌氧菌药。
其针对的目标适应证,即厌氧菌导致的妇科盆腔炎和化脓性阑尾炎、坏疽性阑尾炎一直是临床治疗难点。
该药上市后将为我国患者提供新的治疗手段,拓展用药选择空间。
抗肿瘤用药甲磺酸伊马替尼片和胶囊该药是目前国际公认治疗慢性髓性白血病的一线治疗药物。
由于进口原研的伊马替尼价格昂贵,我国仅少数患者能够使用。
我国结合该治疗领域的临床用药实际,依据相关法规,对国内企业的首仿申请采取了特殊审批程序,保证了该产品在专利到期后及时上市,为白血病患者提供了有效、价廉的药品,大幅降低了患者的用药费用。
达沙替尼片该药是一种强效的酪氨酸激酶抑制剂,对5种关键性致癌酪氨酸蛋白激酶均有作用,为目前治疗慢性白血病的主流药物。
该药于2006年6月在美国获准上市,随后2006年11月在欧盟上市。
在我国于2011年9月获得进口批件。
该药尚无国内企业生产,国产仿制药上市为患者用药可及性和可支付性提供了重要保证。
阿瑞匹坦胶囊该药是高选择性P物质神经激肽1(NK1)受体拮抗剂,可通过对P物质的拮抗,抑制NK1受体参与的急性呕吐和延迟性呕吐。
批准该药的进口上市和国内分包装,可为我国肿瘤患者在高度呕吐性化疗中,预防和治疗急性或迟发性恶心和呕吐带来更多选择手段,尤其针对迟发性恶心和呕吐将带来更好的治疗效果。
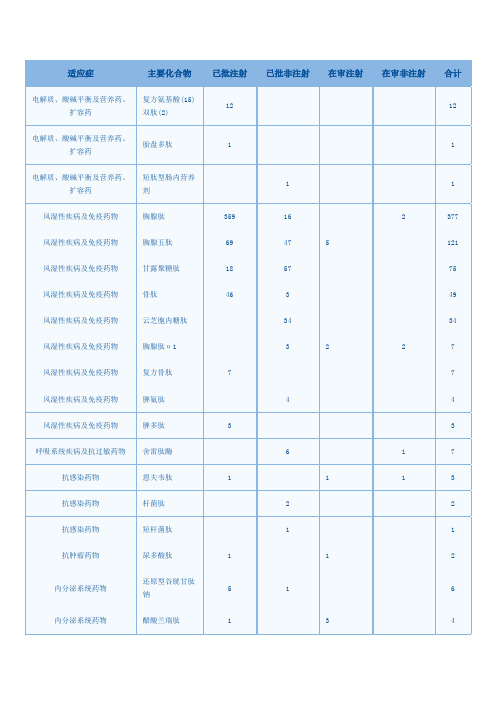
电解质、酸碱平衡及营养药、扩容药复方氨基酸(15)双肽(2)12 12电解质、酸碱平衡及营养药、扩容药胎盘多肽 1 1电解质、酸碱平衡及营养药、扩容药短肽型肠内营养剂1 1风湿性疾病及免疫药物胸腺肽359 16 2 377 风湿性疾病及免疫药物胸腺五肽69 47 5 121 风湿性疾病及免疫药物甘露聚糖肽18 57 75 风湿性疾病及免疫药物骨肽46 3 49 风湿性疾病及免疫药物云芝胞内糖肽34 34 风湿性疾病及免疫药物胸腺肽α1 3 2 2 7 风湿性疾病及免疫药物复方骨肽7 7 风湿性疾病及免疫药物脾氨肽 4 4 风湿性疾病及免疫药物脾多肽 3 3 呼吸系统疾病及抗过敏药物舍雷肽酶 6 1 7 抗感染药物恩夫韦肽 1 1 1 3 抗感染药物杆菌肽 2 2 抗感染药物短杆菌肽 1 1 抗肿瘤药物尿多酸肽 1 1 2内分泌系统药物还原型谷胱甘肽钠5 1 6内分泌系统药物醋酸兰瑞肽 1 3 4内分泌系统药物帕瑞肽 3 3 内分泌系统药物诺利糖肽 1 1 2 内分泌系统药物醋酸普兰林肽 1 1 2 内分泌系统药物艾塞那肽 2 2 皮肤科及五官科药物眼氨肽20 8 28 皮肤科及五官科药物复方氨肽素11 11 皮肤科及五官科药物氨碘肽 1 3 4 神经系统疾病药物肌氨肽苷50 50 神经系统疾病药物脑苷肌肽 6 6 神经系统疾病药物复方曲肽 3 3 神经系统疾病药物复方脑肽节苷脂 3 3 神经系统疾病药物薄芝糖肽 2 2神经系统疾病药物复方天麻蜜环糖肽生殖系统疾病药物蹄甲多肽10 10 消化系统疾病药物醋酸奥曲肽35 17 4 1 57 消化系统疾病药物肝水解肽28 28 消化系统疾病药物还原型谷胱甘肽19 3 1 1 24 消化系统疾病药物谷胱甘肽 4 2 6 消化系统疾病药物氨肽素硫酸锌 5 5 消化系统疾病药物免疫7肽 1 1 2消化系统疾病药物五肽胃泌素 1 1 2 血液系统疾病药物抑肽酶49 7 56 血液系统疾病药物氨肽素30 30 血液系统疾病药物聚明胶肽12 12 血液系统疾病药物依替巴肽 1 1 2 血液系统疾病药物爱啡肽 1 1 2 循环系统疾病药物胰激肽原酶12 28 40 循环系统疾病药物心肌肽 1 1 镇痛药及麻醉科用药科博肽 5 4 9 镇痛药及麻醉科用药鹿瓜多肽7 7。

中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》文章属性•【制定机关】中共中央办公厅,国务院办公厅•【公布日期】2017.10.08•【文号】•【施行日期】2017.10.08•【效力等级】党内规范性文件•【时效性】现行有效•【主题分类】卫生体制改革正文中共中央办公厅国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(2017年10月8日)当前,我国药品医疗器械产业快速发展,创新创业方兴未艾,审评审批制度改革持续推进。
但总体上看,我国药品医疗器械科技创新支撑不够,上市产品质量与国际先进水平存在差距。
为促进药品医疗器械产业结构调整和技术创新,提高产业竞争力,满足公众临床需要,现就深化审评审批制度改革鼓励药品医疗器械创新提出以下意见。
一、改革临床试验管理(一)临床试验机构资格认定实行备案管理。
具备临床试验条件的机构在食品药品监管部门指定网站登记备案后,可接受药品医疗器械注册申请人委托开展临床试验。
临床试验主要研究者应具有高级职称,参加过3个以上临床试验。
注册申请人可聘请第三方对临床试验机构是否具备条件进行评估认证。
鼓励社会力量投资设立临床试验机构。
临床试验机构管理规定由食品药品监管总局会同国家卫生计生委制定。
(二)支持临床试验机构和人员开展临床试验。
支持医疗机构、医学研究机构、医药高等学校开展临床试验,将临床试验条件和能力评价纳入医疗机构等级评审。
对开展临床试验的医疗机构建立单独评价考核体系,仅用于临床试验的病床不计入医疗机构总病床,不规定病床效益、周转率、使用率等考评指标。
鼓励医疗机构设立专职临床试验部门,配备职业化的临床试验研究者。
完善单位绩效工资分配激励机制,保障临床试验研究者收入水平。
鼓励临床医生参与药品医疗器械技术创新活动,对临床试验研究者在职务提升、职称晋升等方面与临床医生一视同仁。
允许境外企业和科研机构在我国依法同步开展新药临床试验。
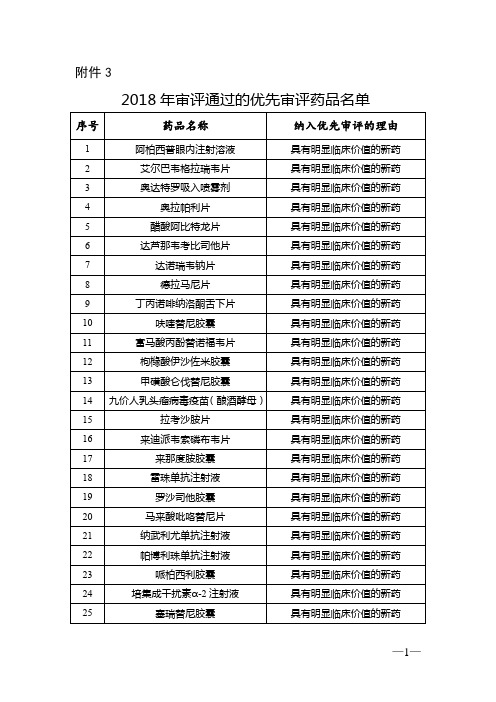


2023年医保新药目录
2023年医保新药目录包括以下药品:
1、抗癌药物:恩替卡韦片、替比夫定片、奥沙利铂片、阿霉
素片、阿尔茨海默氏症药物、洛匹那韦片、阿司匹林片、替米沙坦片、多西他赛片、依托泊苷片等。
2、抗感染药物:阿奇霉素片、头孢克肟片、氟哌酸片、氯霉
素片、头孢曲松片、阿莫西林片、利奈唑胺片、阿米卡星片等。
3、抗心血管病药物:氯吡格雷片、维拉帕米片、阿卡波糖片、贝特米特片、氢氯噻嗪片、美托洛尔片、西地那非片、坎地沙坦片等。
4、抗精神病药物:氟哌利多片、奥氮平片、氟罗沙星片、氟
比米片、氟哌利多滴眼液、复方氟哌利多片、氟哌酸片、复方奥氮平片等。
5、抗痛风药物:氨氯地平片、贝特米特片、苯妥英钠片、苯
扎那芬片、苯巴比妥片、西替利嗪片等。
6、其他药物:布洛芬片、美洛昔康片、美法令片、美罗培南片、维生素K1片、硫酸镁片、硫酸钙片、硫酸钠片等。

医药行业分析报告1、医药行业进入新常态医药行业是我国国民经济的重要组成部分,其持续发展源自药品的刚性消费,具有弱周期性的特征。
随着我国经济持续增长,人民生活水平不断提高,医疗保障制度逐渐完善以及人口老龄化趋势,我国医药行业呈现出良好的发展态势,成为我国发展最快的市场之一。
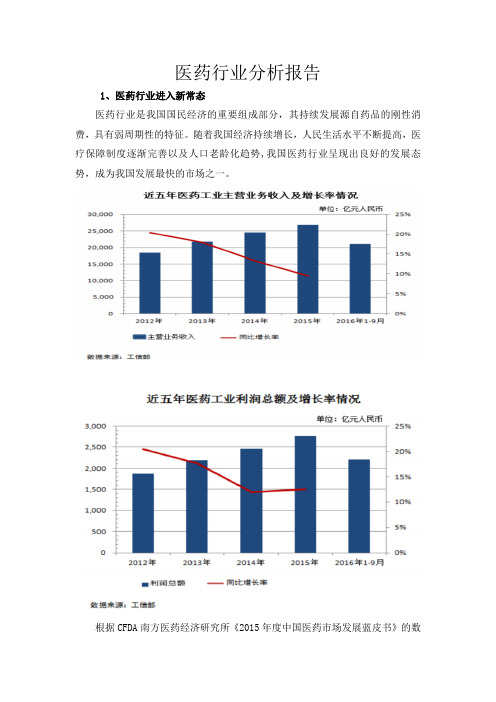
根据CFDA南方医药经济研究所《2015年度中国医药市场发展蓝皮书》的数据,我国医药工业总产值由2007年的6,719 亿元上升至2014年的25,798亿元,年均复合增长率达21.19%。
2015年,我国产业面临较大的结构调整压力,整体经济下行压力进一步增大,医药行业受大趋势影响,增速随之降低。
2015年全国规模以上工业增速为6.1%,医药工业增加值增长9.8%,主营业务收入增长9.2%,利润增长12.2%,亏损企业数量同比增长12.1%。
中国医药产业布局整体趋于优化,但增速趋缓。
随着医改的不断深入推进,以及人口老龄化、产业迭代升级等趋势的推动,未来三至五年,中国医药行业仍将保持较高的复合增长率。
2、抗肿瘤药物市场前景广阔在医药行业中,最具有市场前景之一的是抗肿瘤药物。
肿瘤具有发病率高、隐蔽性强及致死率高等特点,已经成为人类健康的第一杀手。
根据国家癌症中心公布的2015年癌症统计数据,2015年中国癌症总发病429.16万例,总死亡281.42万例。
据《全球癌症报告2014》显示,全球癌症病例呈现迅猛增长态势,由2012年的1,400万将逐年递增至2025 年的1,900万,而中国新增癌症病例高居第一位。
从2010年至2015年,中国癌症新发病例的复合增长率为6.79%,癌症死亡病例的复合增长率为7.50%。
肿瘤是人类健康第一杀手,而抗肿瘤药物市场也是全球第一大药物市场。
2010年-2014年,全球抗肿瘤药物市场复合增长率为6.5%。
2010-2014年中国抗肿瘤药物市场高速增长,由约430亿元增长至约 850 亿元,复合增长率18.6%。


国家中医药管理局关于国家中医药管理局新药开发专项第二批课题申报工作的通知文章属性•【制定机关】国家中医药管理局•【公布日期】2003.07.21•【文号】国中医药办发[2003]28号•【施行日期】2003.07.21•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家中医药管理局关于国家中医药管理局新药开发专项第二批课题申报工作的通知(国中医药办发[2003]28号)各省、自治区、直辖市卫生厅局、中医药管理局,有关单位:我局于2001年底启动了国家中医药管理局新药开发专项(以下简称“专项”)首批课题,目前研究工作进展顺利。
经研究,我局决定开展专项第二批课题申报工作,继续重点支持适应市场需求、具有较高科技含量和较好工作基础的中药新品种及其相关新技术、新工艺、新剂型的开发研究。
本次申报工作截止于2003年8月31日(以邮戳为准)。
请根据《国家中医药管理局新药开发专项第二批课题申报指南》(见附件)的要求,认真组织申报。
根据新药开发研究的特点,今后专项课题的申报将采取集中申报结合随时受理的形式。
本次集中申报截止后,随时受理的申请书将根据数量集中审评,经我局审核同意后,作为下一批课题立项。
《国家中医药管理局新药开发专项第二批课题申报指南》、《国家中医药管理局新药开发专项课题申请书》可从以下网站下载:附件:1.《国家中医药管理局新药开发专项第二批课题申报指南》2.《国家中医药管理局新药开发专项课题申请书》二00三年七月二十一日附件1 国家中医药管理局新药开发专项第二批课题申报指南(国家中医药管理局科技教育司二00三年七月)目录一、新药开发专项课题的申报(一)课题的申报人(二)课题的申报渠道(三)课题的申报材料及报送方式(四)课题申报要求二、新药开发专项支持重点三、新药开发专项课题的评定四、新药开发专项的运作方式一、新药开发专项课题的申报(一)申报人新药开发专项课题申报人包含中华人民共和国境内外的个人和单位。
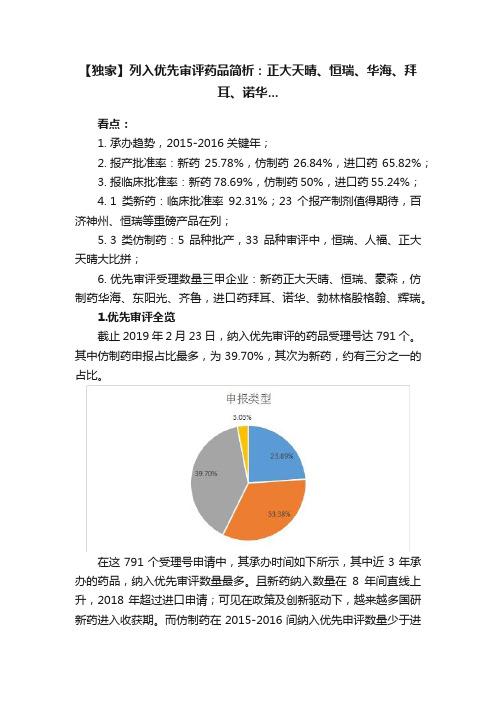
【独家】列入优先审评药品简析:正大天晴、恒瑞、华海、拜耳、诺华...看点:1. 承办趋势,2015-2016关键年;2. 报产批准率:新药25.78%,仿制药26.84%,进口药65.82%;3. 报临床批准率:新药78.69%,仿制药50%,进口药55.24%;4. 1类新药:临床批准率92.31%;23个报产制剂值得期待,百济神州、恒瑞等重磅产品在列;5. 3类仿制药:5品种批产,33品种审评中,恒瑞、人福、正大天晴大比拼;6. 优先审评受理数量三甲企业:新药正大天晴、恒瑞、豪森,仿制药华海、东阳光、齐鲁,进口药拜耳、诺华、勃林格殷格翰、辉瑞。
1.优先审评全览截止2019年2月23日,纳入优先审评的药品受理号达791个。
其中仿制药申报占比最多,为39.70%,其次为新药,约有三分之一的占比。
在这791个受理号申请中,其承办时间如下所示,其中近3年承办的药品,纳入优先审评数量最多。
且新药纳入数量在8年间直线上升,2018年超过进口申请;可见在政策及创新驱动下,越来越多国研新药进入收获期。
而仿制药在2015-2016间纳入优先申评数量少于进口及新药,这与当时处于仿制药变革期有一定的关系,渡过风口之后的仿制药在2017、2018年数量大增,热度再次回归。
以下从申报类型新药、仿制药、进口药三个维度具体分析。
2.申报类型简析2.1新药2.1.1申报批准情况新药列入优先审评主要理由有具有明显临床价值的创新药、重大专项、儿童用药、罕见病新药、具有明显治疗优势的新药等。
目前列入优先审评的新药受理号总计达189个,其主要申请为申报生产,数量达128个,占比67.72%,已经批准33个受理号,批准率为25.78%。
而申报临床数量虽不及报产,但批准率较高,达78.69%。
2.1.2申报企业申报受理号(包括原料药)数量上,正大天晴受理数量最多,达17个,其次为恒瑞医药及豪森药业。
作为国内新药产出较多的企业,3企业纳入优先审评的药品数量情况,一定程度也能窥见其创新力所受认可度。

2005年新药介绍目录及第一期新药介绍一、抗感染药物类:1、青霉素类:盐酸仑氨苄西林、阿洛西林、呋布西林钠、2、头孢菌素类:头孢噻吩钠、头孢替安、头孢替唑钠、头孢丙烯、头孢地嗪、头孢硫脒、头孢尼西钠、头孢泊肟酯、头孢匹胺钠、头孢他美酯、头孢唑肟、头孢克肟。
3、氧头孢烯类:拉氧头孢、头孢米诺。
4、其他β-内酰胺类抗生素:美洛培南。
5、氨基糖苷类:依替米星。
6、四环素类:多西环素。
7、大环内酯类:克拉霉素、地红霉素。
8、氯霉素类:甲砜霉素。
9、万古霉素类:去甲万古霉素。
10、磺胺类:磺胺二甲嘧啶钠、磺胺嘧啶银。
11、喹诺酮类:司帕沙星、加替沙星、盐酸芦氟沙星。
12、硝基咪唑类:奥硝唑。
13、林可霉素类、多粘菌素类及硝基呋喃类无新药购进。
14、抗病毒药:喷昔洛韦、咪喹莫特乳膏剂。
二、抗肿瘤类:1、烷化剂类:尼莫司汀、卡莫司汀、氮烯咪胺(达卡巴嗪)。
2、抗代谢类抗肿瘤药:替加氟-尿嘧啶、去氧氟尿苷、卡莫氟、卡培他滨、吉西他滨。
3、激素类抗肿瘤药:来曲唑、他莫西芬。
4、抗生素类抗肿瘤药:无新药购进。
5、抗肿瘤抗体类:无新药购进。
6、天然来源抗肿瘤药:多西他赛(多西紫杉醇)、拓朴替康、去甲斑蝥酸钠。
7、其他抗肿瘤药及抗肿瘤辅助药:奥沙利铂、奈达铂(捷佰舒)、门冬酰胺酶、托烷司琼、艾迪注射液。
三、心血管系统药物:1、强心药:米力农。
2、抗心律失常药:艾司洛尔、索他洛尔。
3、降血压药:①、α肾上腺素受体阻滞药:特拉唑嗪、甲磺酸多沙唑嗪。
②、β肾上腺素受体阻滞药:美托洛尔、富马酸比索洛尔、盐酸塞利洛尔。
③、αβ受体阻滞药:拉贝洛尔、卡维地洛。
④、血管紧张素转换酶抑制剂:马来酸依那普利、苯那普利、赖诺普利、盐酸喹那普利、福辛普利钠、盐酸贝那普利。
⑤、血管紧张素受体拮抗药:缬沙坦、厄贝沙坦、坎地沙坦酯⑥、血管扩张药:尼可地尔。
⑦、利尿药:吲达帕胺、布美他尼、阿米洛利、托拉塞米。
⑧、中枢性降压药:盐酸莫索尼定。
4、钙通道阻滞剂:拉西地平、苯磺酸氨氯地平、左旋氨氯地平、尼索地平、贝尼地平。


289种药品列入一致性评价目录CFDA今日发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2022年第106号),指出289种化学药品仿制药口服固体制剂原则上应在2022年底前完成一至性评价。
以下全文:为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2022〕8号),提高仿制药质量,现将有关事项公告如下:一、评价对象和实施阶段(一)化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2022年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2022年底前完成一致性评价。
(三)上述第(二)款以外的化学药品仿制药口服固体制剂,可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产相同品种的一致性评价申请。
二、参比制剂的选择和确定(四)药品生产企业对拟进行一致性评价的品种,参照《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告2022年第61号)要求选择参比制剂。
(五)药品生产企业按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2022年第99号),将选择的参比制剂向食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。
行业协会可向一致性评价办公室推荐参比制剂,原研药品生产企业、国际公认的同种药物生产企业可向一致性评价办公室申报参比制剂。
一致性评价办公室主动对参比制剂的备案、推荐和申报信息向社会公开。
食品药品监管总局及时公布推荐和确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价。
(六)企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。
三、一致性评价的研究内容(七)在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。