2018-2019年高考化学备考专题一轮二轮复习策略:苏教版第15讲烃和烃的衍生物(浙江专用)-学术小金刚系列
- 格式:ppt
- 大小:3.95 MB
- 文档页数:35

第二单元烃和卤代烃考纲定位1.掌握烷、烯、炔和芬芳烃的构造与性质。
2.掌握卤代烃的构造与性质以及与其余有机物之间的互相转变。
3.掌握加成反响、代替反响和消去反响等有机反响种类。
考点 1|脂肪烃[ 基础知识自查]1.烷烃、烯烃和炔烃的构成、构造特色和通式2.脂肪烃的物理性质3.脂肪烃的化学性质(1)烷烃的代替反响①代替反响:有机物分子中某些原子或原子团被其余原子或原子团所代替的反响。
②烷烃的卤代反响a.反响条件:气态烷烃与气态卤素单质在光照下反响。
b.产物成分:多种卤代烃混淆物( 非纯净物 ) + HX。
c.定量关系:即代替1 mol氢原子,耗费1_mol卤素单质生成 1 mol HCl。
(2)烯烃、炔烃的加成反响①加成反响:有机物分子中的不饱和碳原子与其余原子或原子团直接联合生成新的化合②烯烃、炔烃的加成反响( 写出相关反响方程式)(3)加聚反响①丙烯加聚反响方程式为。
催化剂②乙炔加聚反响方程式为n CH≡CH――→CH===CH 。
(4)二烯烃的加成反响和加聚反响①加成反响 ( 以 1,3- 丁二烯为例 )-80℃。
a.1,2- 加成: CH===CH— CH===CH+ Br――→22260℃。
b.1,4- 加成: CH2===CH— CH===CH2+ Br 2――→c.完整加成:足量 Br 2。
CH2===CH— CH===CH2+ 2Br 2――→催化剂。
②加聚反响: n CH2===CH—CH===CH2――→(5) 脂肪烃的氧化反响烷烃烯烃炔烃焚烧现象焚烧火焰较光亮焚烧火焰光亮,焚烧火焰很光亮,带黑烟带浓黑烟通入酸性 KMnO4溶液不退色退色退色[ 考点多维研究]角度 1脂肪烃的构成、构造与性质1.以下对于烷烃与烯烃的性质及反响种类的表达正确的选项是 ()【导学号:】A .烷烃只含有饱和键,烯烃只含有不饱和键B .烷烃不可以发生加成反响,烯烃不可以发生代替反响C .烷烃的通式必定是 C n H 2n +2,而烯烃的通式必定是C n H 2nD .烷烃与烯烃对比,发生加成反响的必定是烯烃D [A 项,烯烃能够含饱和键和不饱和键;B 项,烯烃能够发生代替反响;C 项,单烯烃的通式为 C n H 2n ,多烯烃的通式不是 C n H 2n ; D 项,加成反响是不饱和烃的特色反响。


第二单元烃和卤代烃考点1| 脂肪烃[基础知识自查]1.烷烃、烯烃和炔烃的组成、结构特点和通式2.脂肪烃的物理性质3.脂肪烃的化学性质(1)烷烃的取代反应①取代反应:有机物分子中某些原子或原子团被其他原子或原子团所替代的反应。
②烷烃的卤代反应a.反应条件:气态烷烃与气态卤素单质在光照下反应。
b.产物成分:多种卤代烃混合物(非纯净物)+HX。
c .定量关系:即取代1 mol 氢原子,消耗1_mol 卤素单质生成1 mol HCl 。
(2)烯烃、炔烃的加成反应 ①加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
②烯烃、炔烃的加成反应(写出有关反应方程式)(3)加聚反应①丙烯加聚反应方程式为。
②乙炔加聚反应方程式为n CH ≡CH ――→催化剂 CH===CH 。
(4)二烯烃的加成反应和加聚反应①加成反应(以1,3-丁二烯为例)a .1,2-加成:CH 2===CH —CH===CH 2+Br 2――→-80℃。
b .1,4-加成:CH 2===CH —CH===CH 2+Br 2――→60℃。
c .完全加成:CH 2===CH —CH===CH 2+2Br 2――→足量Br 2。
②加聚反应:n CH 2===CH —CH===CH 2――→催化剂。
(5)脂肪烃的氧化反应角度1 脂肪烃的组成、结构与性质1.下列关于烷烃与烯烃的性质及反应类型的叙述正确的是( )【导学号:37742334】A .烷烃只含有饱和键,烯烃只含有不饱和键B .烷烃不能发生加成反应,烯烃不能发生取代反应C .烷烃的通式一定是C n H 2n +2,而烯烃的通式一定是C n H 2nD .烷烃与烯烃相比,发生加成反应的一定是烯烃D [A 项,烯烃可以含饱和键和不饱和键;B 项,烯烃可以发生取代反应;C 项,单烯烃的通式为C n H 2n ,多烯烃的通式不是C n H 2n ;D 项,加成反应是不饱和烃的特征反应。


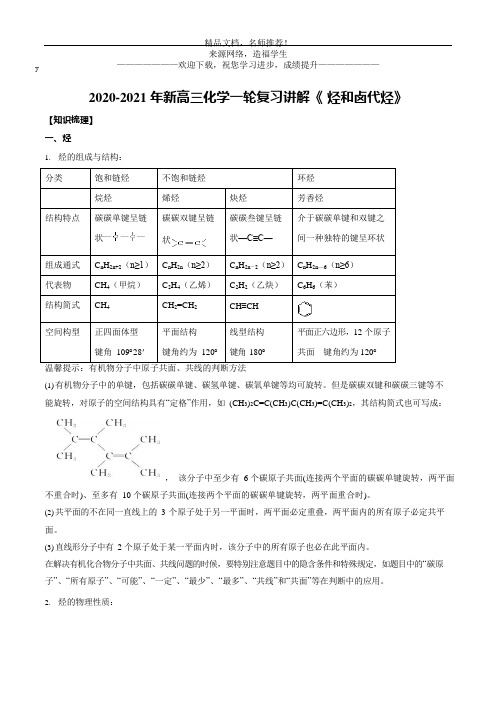
2020-2021 年新高三化学一轮复习讲解《 烃和卤代烃》【知识梳理】一、烃1. 烃的组成与结构:分类饱和链烃 不饱和链烃 环烃烷烃烯烃 炔烃 芳香烃结构特点 碳碳单键呈链状碳碳双键呈链状碳碳叁键呈链状—C≡C—介于碳碳单键和双键之间一种独特的键呈环状组成通式 C n H 2n+2(n≥1) C n H 2n (n≥2) Cn H 2n -2(n≥2) C n H 2n —6(n≥6) 代表物 CH 4(甲烷) C 2H 4(乙烯) C 2H 2(乙炔)C 6H 6(苯)结构简式 CH 4CH 2=CH 2 CH ≡CH空间构型正四面体型键角 109︒28' 平面结构键角约为 120︒ 线型结构键角 180︒平面正六边形,12 个原子共面 键角约为 120︒(1) 有机物分子中的单键,包括碳碳单键、碳氢单键、碳氧单键等均可旋转。
但是碳碳双键和碳碳三键等不能旋转,对原子的空间结构具有“定格”作用,如 (CH 3)2C=C(CH 3)C(CH 3)=C(CH 3)2,其结构简式也可写成:, 该分子中至少有 6 个碳原子共面(连接两个平面的碳碳单键旋转,两平面不重合时)、至多有 10 个碳原子共面(连接两个平面的碳碳单键旋转,两平面重合时)。
(2) 共平面的不在同一直线上的 3 个原子处于另一平面时,两平面必定重叠,两平面内的所有原子必定共平面。
(3) 直线形分子中有 2 个原子处于某一平面内时,该分子中的所有原子也必在此平面内。
在解决有机化合物分子中共面、共线问题的时候,要特别注意题目中的隐含条件和特殊规定,如题目中的“碳原子”、“所有原子”、“可能”、“一定”、“最少”、“最多”、“共线”和“共面”等在判断中的应用。
2. 烃的物理性质:3.烃的化学性质:温馨提示:不同的碳碳键对有机物的性质有着不同的影响。
(1)碳碳单键有稳定的化学性质,典型反应是取代反应;(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;(4)苯的同系物支链易被酸性高锰酸钾溶液氧化,是因为苯环对取代基的影响。





重 点 突 破锁定高考热点 探究规律方法1.不溶于水,密度比水小,碳原子数不超过4的烃在常温下为气态。
2.化学性质(1)能燃烧。
C n H m +(n +m /4)O 2――→点燃n CO 2+m /2H 2O 。
具体地讲,烷烃为C n H 2n +2(n ≥1),无官能团;烯烃为C n H 2n (n ≥2),含有碳碳双键;炔烃为C n H 2n -2(n ≥2),含碳碳三键;苯及其同系物为C n H 2n -6(n ≥6),含有苯环。
(2)氧化反应。
①烯烃和炔烃被高锰酸钾酸性溶液氧化,如果高锰酸钾酸性溶液过量,烯烃、炔烃分子中的碳碳双键、碳碳三键会完全断裂,生成羧酸、二氧化碳或酮。
CH 2===CH 2――→KMnO 4酸性溶液CO 2+H 2OCH ≡CH ――→KMnO 4酸性溶液CO 2+H 2ORCH===CH 2――→KMnO 4酸性溶液RCOOH +CO 2+H 2ORC ≡CH ――→KMnO 4酸性溶液RCOOH +CO 2+H 2O②苯的同系物与高锰酸钾酸性溶液反应,产物为芳香酸。
(3)加成反应。
烯烃、炔烃都可以与氢气、卤化氢、溴的四氯化碳溶液等物质发生加成反应;苯及其同系物在一定条件下能与氢气发生加成反应,但不能与溴的四氯化碳溶液发生加成反应。
(4)取代反应。
烷烃可以在光的作用下发生取代反应;苯的同系物在光的作用下其侧链烃基上可发生取代反应,在催化剂的作用下苯环上可发生取代反应。
题组训练1.下列关于烷烃与烯烃的性质及反应类型叙述正确的是() A.烷烃只含有饱和键,烯烃只含有不饱和键B.烷烃不能发生加成反应,烯烃不能发生取代反应C.烷烃的通式一定是C n H2n+2,而烯烃的通式一定是C n H2nD.烷烃与烯烃相比,发生加成反应的一定是烯烃解析烯烃中含有碳氢饱和键和碳碳饱和键,A项错;烯烃中的氢原子有可能发生取代反应,B项错;环烷烃的通式是C n H2n,只有单烯链烃的通式才是C n H2n,C项错。

第二单元 常见的烃1.掌握烷、烯、炔和芳香烃的结构与性质。
2.了解烃类的重要应用。
脂肪烃[知识梳理]一、脂肪烃的组成、结构特点和通式三、脂肪烃的化学性质 1.烷烃的化学性质 (1)取代反应例如:乙烷和氯气生成一氯乙烷:CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(2)分解反应(又叫裂解反应) 例如:C 8H 18――→高温C 4H 10+C 4H 8。
(3)燃烧反应燃烧通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
2.烯烃的化学性质(1)与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
(2)燃烧反应燃烧通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
(3)加成反应例如:CH 2===CH —CH 3+Br 2―→。
CH 2===CH —CH 3+H 2O ――→催化剂△。
CH 2===CH —CH===CH 2+2Br 2―→。
CH 2===CH —CH===CH 2+Br 2―→(1,4加成)。
(4)加聚反应例如:n CH 2===CH —CH 3――→催化剂。
3.炔烃的化学性质 (1)与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
例如:CH≡CH――→KMnO 4H 2SO 4CO 2(主要产物)。
(2)燃烧反应燃烧通式为C n H 2n -2+3n -12O 2――→点燃n CO 2+(n -1)H 2O 。
(3)加成反应例如:CH≡CH+H 2――→催化剂△CH 2===CH 2, CH ≡CH +2H 2――→催化剂△CH 3—CH 3。
(4)加聚反应例如:n CH ≡CH ――→催化剂CH===CH 。
四、几种简单有机物分子的空间构型1.甲烷:,正四面体结构,碳原子位于正四面体中心,分子中的5个原子中任意4个原子不处于同一平面内。

第2讲烃[考纲要求] 1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
2。
了解天然气、石油液化气和汽油的主要成分及应用.3.举例说明烃类物质在有机合成和有机化工中的重要作用。
4。
了解加成反应、取代反应和聚合反应。
考点一烷烃、烯烃、炔烃的结构和性质1.烷烃、烯烃、炔烃的组成、结构特点和通式2.物理性质(1)随着分子中碳原子数的递增,烃的物理性质呈现规律性的变化。
性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度随着碳原子数的增多,相对密度逐渐增大,密度均比水小水溶性均难溶于水(2)甲烷、乙烯、乙炔的结构和物理性质比较烃的种类甲烷乙烯乙炔分子式CH4C2H4C2H2结构简式CH2===CH2CH≡CH分子结构特点正四面体结构,键角为109.5°,由极性键形成的非极性分子平面结构,键角为120°,所有原子处于同一平面内,非极性分子H—C≡C—H直线形结构,键角为180°,分子中所有的原子均处于同一3(1)甲烷的化学性质①通常状况下,甲烷的性质稳定,与强氧化剂(如KMnO4)、强酸、强碱等均不能发生化学反应。
但在一定条件下可以燃烧,可以发生取代反应.②取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
完成甲烷与Cl2发生取代反应的化学方程式:(2)烷烃的化学性质和甲烷类似,通常较稳定,在空气中能点燃,在光照条件下能与氯气发生取代反应。
①稳定性:通常情况下,与强氧化剂、强酸及强碱都不发生反应,也难与其他物质化合.②可燃性:C n H2n+2+错误!O2错误!n CO2+(n+1)H2O(以通式表示,写化学方程式)。
③取代反应:与气态卤素单质在光照条件下发生取代反应。
(举例写化学方程式)如乙烷和氯气生成一氯乙烷:CH3CH3+Cl2错误! CH3CH2Cl+HCl.④高温裂解:如重油裂化过程。