氮化物
- 格式:ppt
- 大小:405.50 KB
- 文档页数:62

氮化物陶瓷(nitride ceramics)一、关于氮化物陶瓷氮化物一般是以MxNy表示氮化合物。
根据氮化物的物理性质和键的特点,氮化物可分为非金属氮化物和金属氮化物。
氮化硼和氮化硅属非金属氮化物。
金属氮化物中又可分成过镀金属氮化物和非过渡金属氮化物。
过镀金属氮化物有氮化钛、氮化钼和氮化钨等。
氮化铝属非过渡金属氮化物。
主要有氮化硅、赛龙、氮化铝、氮化硼等氮化物陶瓷。
氮与金属或非金属元素以共价键相结合的难熔化合物为主要成分的陶瓷。
应用较广的陶瓷有四氮化三硅(Si3N4)、氮化硼(BN)、氮化铝(AlN)等陶瓷。
其中以四氮化三硅陶瓷的抗氧化能力最佳,1400℃时开始活性氧化,抗化学腐蚀性很好。
有的还具有特殊的机械、介电或导热性能。
烧结较困难。
先制出优质粉末原料,然后采用氮化反应烧结法和热压烧结法、热等静压烧结法等制成陶瓷制品。
氮化硅陶瓷刀具氮化硅陶瓷滚珠二、当代氮化物陶瓷的制备方法(以氮化硅陶瓷为例)氮化硅陶瓷是一种先进的工程陶瓷材料。
该陶瓷于19世纪80年代发现,20世纪五十年代获得较大规模发展。
中国是在七十年代初开始研究,到八十年代中期已取得一定成绩。
该材料具有高的室温和高温强度、高硬度、耐磨蚀件、抗氧化性和良好的抗热冲击及机械冲击性能,被材料科学界认为是结构陶瓷领域中综合性能优良、最有希望替代镍基合金在高科技、高温领域中获得广泛应用的一种新材料。
因此近二、三十年来颇受青睐和重视。
氮化硅是共价键化合物。
它有两种晶型:针状的α氮化硅和颗粒状的β氮化硅。
它们均属于六方晶系。
氮化硅的晶体结构为Si原于和周围的4个N原子形成共价键,构成[SiN4]四面体结构单元,所有四面体共享顶角构成四维空间网络。
正是由于[SiN4]四面体结构单元的存在,氮化硅具有较高的硬度。
氮化硅陶瓷制备粉体制备:氮化硅粉体都是人工合成的。
大量研究表明,高质量粉体是得到高性能陶瓷重要保证。
作为制备高性能氮化硅材料所需的粉体必须具备:窄的颗粒尺寸分布,低的金属杂质含量(Fe, Ti等)和氧含量,价格低廉适中。

二维材料;氮化物;综述一、引言二维材料是指晶体结构在垂直于晶体生长方向上只有一层原子或分子厚度的材料。
这些材料具有独特的电子、光学和力学性质,因此在能源、电子器件和传感器等领域具有广泛的应用前景。
氮化物是一类重要的二维材料,由氮原子和金属原子组成,具有优异的物理和化学性质。
本文将对氮化物作一综述,探讨其在不同领域的应用和研究进展。
二、氮化物的结构和性质氮化物的结构可以分为两种类型:一种是具有共价键结构的氮化物,如氮化硼(h-BN)和氮化铝(AlN);另一种是具有离子键结构的氮化物,如氮化镓(GaN)和氮化铟(InN)。
这些材料具有较大的禁带宽度和优异的导电性能,同时具有优异的热导率、机械强度和化学稳定性。
三、氮化物的制备方法制备氮化物的方法主要包括物理气相沉积、化学气相沉积和溶液法等。
物理气相沉积方法可以通过在高温下将金属和氮气反应制备氮化物。
化学气相沉积方法则通过在低压下控制气体反应制备氮化物。
溶液法是一种简单、低成本的制备方法,可以通过将金属溶解在溶剂中,然后加入氮源,最后通过热处理得到氮化物。
四、氮化物在能源领域的应用由于氮化物具有较大的禁带宽度和优异的导电性能,因此在能源领域具有广泛的应用前景。
氮化物可以作为光电催化剂,用于太阳能光解水制氢。
此外,氮化物还可以作为电池材料,用于锂离子电池和超级电容器等能量存储设备。
五、氮化物在电子器件领域的应用氮化物具有优异的电子性能和热稳定性,因此在电子器件领域有广泛的应用。
氮化物可以作为高电子迁移率晶体管(HEMT)的材料,用于高频功率放大器和射频开关等器件。
此外,氮化物还可以用于制备发光二极管(LED)和激光器等光电器件。
六、氮化物在传感器领域的应用氮化物具有优异的化学稳定性和机械强度,因此在传感器领域有广泛的应用。
氮化物可以用于气体传感器,通过吸附目标气体来改变电学性能,实现对气体的检测。
此外,氮化物还可以用于压力传感器、湿度传感器和光学传感器等多种传感器设备。

几类氮化物陶瓷的简介
多数氮化物陶瓷的熔点都比较高,尽管氮化物的种类很多,但可作为材料应用的也是有限的。
氮化物陶瓷一般都有非常高的硬度,即使对于硬度很低的六方BN,当其晶体结构转变为立方结构后则具有仅次于金刚石的硬度。
BN,Si3N4,AlN等在高温下不出现熔融状态,而是直接升华分解。
氮化物陶瓷主要有氮化硅(Si3N4)、氮化铝(AlN)、氮化硼(BN)、氮化钛(TiN)和赛隆陶瓷等。
图1 各类氮化物陶瓷
和氧化物相比,氮化物抗氧化能力较差,从而限制了其在空气中的使用。
氮化物的导电性能变化很大,一部分过渡金属氮化物属于间隙相,其晶体结构与原来金属元素的结构是相同的,氮则填隙于金属原子间隙之中,它们都具有金属的导电特性。
B、Si、Al元素的氮化物则由于生成共价键晶体结构而成为绝缘体。
1. 氮化硅陶瓷
1.1 氮化硅的基本特性
aα-Si3N4:低温型,是针状结晶体。
β-Si3N4:高温型,是颗粒状结晶体。
将高纯硅在1200-1300℃下氮化,可得到白色或灰白色的α-Si3N4,而在1450℃左右氮化时,可得到β-Si3N4。
aα-Si3N4在1400-1600℃下加热,会转变成β-Si3N4。
1900℃分解。
Si3N4强度和韧性优于SiC,但抗氧化性和高温强度不及SiC。
1.2氮化硅的制备技术
(a)氮化硅粉末合成:。

h13氮化检测标准氮化检测标准是用来评估材料或制品中氮化物含量的质量控制标准。
氮化物是指由氮气和其他元素形成的化合物,常见的氮化物有氮化硼、氮化铝、氮化硅等。
这些氮化物具有独特的物理和化学性质,对于材料的性能和应用具有重要影响。
因此,为了确保材料质量和产品性能的稳定性,需要制定相关的氮化物检测标准。
一、氮化物检测方法的选择:1. 光谱法:采用光谱分析仪器,通过测量样品的发射光谱或吸收光谱来确定氮化物的含量。
光谱法具有分析速度快、准确度高、灵敏度高的优点,适用于大批量样品的快速检测。
2. 气体分析法:利用气相色谱、质谱仪等气体分析仪器对样品中的氮化物进行分析。
气体分析法可以测量氮化物的浓度,也可以分析氮化物的组成和结构。
3. X射线衍射法:通过测量材料中的X射线衍射图谱,确定氮化物的晶体结构和含量。
X射线衍射法可以提供氮化物晶体的定性和定量信息,适用于研究氮化物的晶体形态和晶体质量。
4. 电子显微镜:利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)等电子显微镜技术观察材料中的氮化物颗粒形态和分布情况。
电子显微镜可以提供氮化物颗粒的形貌信息,有助于评估材料的氮化物含量和分布均匀性。
二、氮化物检测标准的制定:1. 合格标准:根据材料的用途和要求,制定合格标准来评估氮化物含量的合格范围。
合格标准可以根据材料性能的要求来确定,包括氮化物含量的上限和下限,以及其对材料性能的影响程度。
2. 检测方法标准:制定氮化物检测方法的标准,包括样品采集、制备和处理的要求,仪器设备和仪器操作的规范,以及数据分析和结果判定的方法。
检测方法标准需要确保检测结果的准确性和可靠性,以提高氮化物检测的可比性和一致性。
3. 重复性和再现性评价:对于氮化物检测方法进行重复性和再现性评价,确定其检测结果的稳定性和可靠性。
重复性评价是在相同条件下重复测试同一样品,观察结果的一致性和偏差情况;再现性评价是在不同条件下测试同一样品,观察结果的一致性和偏差情况。

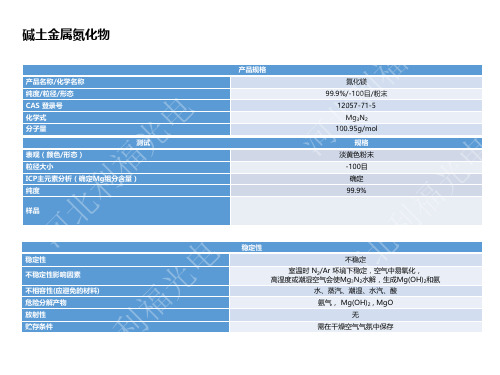
金属氮化物
金属氮化物是一类重要的无机材料,具有广泛的应用前景。
金属氮化物可以分为两类:一类是由金属和氮原子组成的化合物,如硼氮化铝、硼氮化硅等;另一类是由金属、氮和其他元素组成的化合物,如氮化镓、氮化铟等。
金属氮化物具有优异的物理、化学性质,例如高硬度、高熔点、高抗腐蚀性、高热导率等。
这些性质使得金属氮化物在电子、光电子、热电子、光伏等领域具有广泛的应用,如LED、太阳能电池、高温传感器等。
金属氮化物的制备方法包括固相反应法、气相反应法、液相反应法等多种方法。
其中,气相反应法可以得到高品质的金属氮化物,但成本较高;而液相反应法则成本较低,但得到的产物质量较差。
金属氮化物的未来发展趋势是开发高性能、低成本的制备方法,并进一步拓展其在新能源、环境保护等领域的应用。
- 1 -。

氮化的方式
氮化的方式可以分为两种,一种是热氮化,另一种是离子氮化。
热氮化是利用高温下氨气与物体表面的金属反应,形成氮化物薄膜的过程。
这种方式主要适用于高温下的金属材料,如钢、铁、铬等。
离子氮化是利用高能离子轰击物体表面,使得物体表面氮化物的含量增加,从而提高物体表面的硬度和耐磨性。
这种方式适用于各种材料,如陶瓷、塑料、金属等。
氮化的方式具有多种优点,如提高表面的硬度和耐磨性,增强材料的耐腐蚀性和耐高温性能,同时还能改善材料表面的润滑性和抗氧化性能。
因此,氮化技术在制造业中得到广泛应用,如机械制造、汽车制造、航空航天等领域。
- 1 -。



雪水中氮化物含量高的原因1. 引言1.1 背景介绍雪水中氮化物含量高的原因引言雪水是一种重要的自然水资源,在很多地区被广泛应用于灌溉、供水等方面。
近年来有研究表明,雪水中的氮化物含量持续上升,引起了人们的关注。
氮化物是一种重要的环境污染物,高浓度的氮化物不仅会污染水资源,还可能对生态环境造成较大影响。
了解雪水中氮化物含量高的原因对于保护水资源、维护生态环境具有重要意义。
随着工业化和城市化的迅速发展,大气中的氮化物排放量逐渐增加。
氮化物可以通过大气传播途径进入雪水中,导致雪水中氮化物含量升高。
深入研究氮化物在雪水中的来源、传播途径以及富集的原因对于解决雪水污染问题具有重要意义。
本文将深入探讨雪水中氮化物含量高的原因,以期为保护水资源和生态环境提供科学依据。
1.2 问题提出雪水是一种天然的淡水资源,被广泛应用于冰雪运动、农业灌溉和城市供水等方面。
近年来有研究表明,雪水中氮化物含量呈现出不断增加的趋势,这引起了人们的关注。
氮化物是一类含有氮元素的化合物,常见的有氨、硝酸盐和硝酸气等。
氮化物在环境中的积累与排放与人类活动密切相关,而雪水中氮化物含量的增加可能会对生态环境产生负面影响。
我们迫切需要了解雪水中氮化物含量高的原因,以及可能对环境带来的影响。
通过深入研究雪水中氮化物的来源、传播途径、富集原因以及影响因素,我们可以更好地保护雪水资源,维护环境生态平衡。
【201字】1.3 研究意义氮化物是雪水中的重要污染物之一,其含量的高低直接影响着雪水的质量和环境的健康。
研究雪水中氮化物含量高的原因具有重要的意义和价值。
通过研究雪水中氮化物含量高的原因,可以深入了解氮化物在大气环境中的来源和传播途径。
这有助于我们更好地认识氮化物的排放情况,制定相应的环保政策和措施,减少氮化物对大气环境的污染。
深入研究氮化物在雪水中富集的原因,可以帮助我们了解氮化物在不同环境中的行为规律,从而预测雪水中氮化物含量的变化趋势,减少氮化物对生态环境的影响,保护生态系统的健康发展。

氮元素的常见化合价对应的物质或原子团
氮元素是各种物质组成的关键要素,它不仅在空气中广泛存在,而且是生命过程中重要的元素。
这里讨论的是氮元素普遍存在时常见化合价对应的物质或原子团。
氮元素的一次氢化物其常见化合价为N(H)2 ,并且原子团中有两个氢原子,氮原子的化学价也可表示为-2。
这种水溶性化合物被称为氨(ammonia)。
在实际应用中,氮化物广泛应用于医药,清洗剂,农肥,溶剂和其它许多实验室试剂等。
氮元素的二次氢化物其常见化合价为N(H)4 。
其原子团中有四个氢原子,氮原子的化学价为-4,这种化合物也称作氨基酸(amino acid),它是生物体有机合成中的重要物质。
一般而言,二次氢化氮通常用于生物分子相关的研究,也可以用于抗菌和抗病毒的抗生素的合成。
氮元素的三次氢化物其常见化合价为N(H)6 。
这种氮化物中有六个氢原子,其原子团中的氮原子化学价为-6,这种化合物也称作氨基酸水解物(amino acid hydrolysates)。
这种化合物经常用于食品添加剂,治疗营养不良和胃部消化道疾病。
它们也可以用于人体的营养补充,尤其是对于婴儿或老年人来说相当重要。
此外,氮元素可以与其它元素或原子结合形成各种不同的化合物,如二氧化氮(NO2)和一氧化氮(NO)。
这些化合物常用于制造汽油和
柴油,以及电解质和燃料。
它们可以用来清洁空气和水,并改善环境
质量。
总而言之,氮元素通常存在于各种物质中,其最常见的化合价分
别为N(H)2 、N(H)4 和N(H)6 ,它们分别代表氨,氨基酸和氨
基酸水解物,可以应用于诸多领域。

氮化物的产生、危害及负氧离子对它的降解作用氮氧化物是被联合国环境规划署宣布为危害全球的六种化学品之一。
由于生物有机体含有氮,因此直接燃烧生物质(如柴草)或者是由生物质衍生而成的化石能源(如媒、石油)燃烧时都会产生氮氧化物。
一些化工厂、冶炼厂生产也会产生氮氧化物。
所以,在生话、工业生产和交通运输中都会产生很多的氮氧化物。
氮氧化物污染大气后会直接伤害人体的呼吸系统,有害于人体健康,它也能导致对动植物的伤害,还能腐蚀建筑物、文化古迹和各种生产设备。
氮氧化物能吸收地面的辐射热,因而和二氧化碳一样成为产生“温室效应”的气体之一;当它们跑到平流层后也会和臭氧起反应,因此也是破坏臭氧层的气体之一;它们还会导致产生酸雨和光化学烟雾,对环境和人体健康产生进一步的危害,特别是光化学烟雾,是目前聚居在城市里的约占一半的人口经常受到的一种威胁与伤害。
当生物质或矿物质燃料燃烧时所排放的碳氢化物、氮氧化物等初生污染物在阳光中紫外线的照射下便发生光化学反应,产生醛、酮、酸等次生污染物。
这些初生污染物和次生污染物的混合物,在大气压偏低、干燥和没有风的环境中形成的烟雾弥漫并使能见度降低的污染物叫光化学烟雾。
光化学烟雾会直接刺激人的眼睛,使眼睛的结膜发炎(即结膜炎),从而产生红眼病,并导致眼睛不适,流泪等现象。
光化学烟雾也会直接刺激人的呼吸道,从而产生咳嗽、哮喘、失声等支气管、咽炎、肺气肿等呼吸道疾病。
由于光化学烟雾使能见度降低,易于发生交通事故,导致车毁人亡的惨剧发生。
光化学烟雾产生后还可能随气流飘移,殃及邻近的城镇和农村。
一、一氧化氮(NO)一氧化氮是一种奇分子(具有奇数价电子的分子称为奇分子,通常奇分子都有颜色),但是一氧化氮为无色气体,微溶于水,但不与水反应,不助燃,在常温下极易与氧反应。
从历年的统计数据来看,一氧化氮的产生主要是来源于天然的物质排放(主要是细菌的作用);20世纪60、70年代人类活动排放的一氧化氮只占排放总量的1/10左右。

纳米结构过渡金属氮化物纳米结构过渡金属氮化物(Transition Metal Nitrides, TMNs)是一类具有特殊结构和优异性能的材料。
它们由过渡金属元素和氮元素组成,具有高硬度、高熔点、优异的导电性和热稳定性等特点。
由于这些独特的性质,纳米结构过渡金属氮化物在多个领域具有广泛的应用前景。
纳米结构过渡金属氮化物在催化领域表现出了出色的性能。
由于其高度活性的表面和丰富的活性位点,TMNs可以作为催化剂用于各种化学反应中。
例如,钼氮化物(MoN)和钒氮化物(VN)等TMNs在氮气还原反应中表现出了优异的活性和选择性,可用于合成氨。
此外,钨氮化物(WN)和铁氮化物(FeN)等TMNs也被广泛应用于催化剂的制备,用于有机合成、能源转化等领域。
纳米结构过渡金属氮化物在电子器件领域具有巨大的潜力。
由于其优异的导电性和热稳定性,TMNs被广泛应用于电子器件的制备中。
例如,铌氮化物(NbN)和钛氮化物(TiN)等TMNs可用作超导材料,用于制备超导体和量子比特等器件。
此外,钼氮化物(MoN)和钨氮化物(WN)等TMNs也可用于制备场发射器件、电子阴极和电极等。
纳米结构过渡金属氮化物还在能源领域具有广泛的应用前景。
由于其高硬度和优异的热稳定性,TMNs可用于制备高温陶瓷材料,如高温燃烧器和陶瓷涂层等。
纳米结构过渡金属氮化物作为一类具有特殊结构和优异性能的材料,在催化、电子器件和能源等领域具有广泛的应用前景。
随着材料科学的不断发展和深入研究,相信纳米结构过渡金属氮化物将会在更多领域展现出其独特的优势和潜力。
我们对于这一材料的研究和应用前景充满期待,相信在不久的将来,纳米结构过渡金属氮化物将会为人类社会的发展做出更大的贡献。

氮能形成5个共价键氮是一种非常重要的元素,它在自然界中广泛存在,是空气中的主要成分之一。
氮分子由两个氮原子组成,它们之间通过三个共价键相连。
但是,氮原子也可以形成更多的共价键,最多可以形成5个共价键。
我们需要了解什么是共价键。
共价键是指两个原子之间通过共享电子而形成的化学键。
在共价键中,每个原子都提供了一个或多个电子,这些电子被共享在两个原子之间,从而形成了化学键。
对于氮原子来说,它的电子排布为1s2 2s2 2p3。
这意味着氮原子有5个价电子,可以与其他原子形成化学键。
当氮原子与另一个氮原子结合时,它们之间可以形成3个共价键,这是因为每个氮原子都可以提供3个价电子。
这种结构被称为氮分子,是空气中的主要成分之一。
但是,氮原子也可以形成更多的共价键。
在一些特殊的化学反应中,氮原子可以形成4个或5个共价键。
这种情况下,氮原子需要提供更多的电子来形成更多的化学键。
在形成4个共价键的情况下,氮原子需要提供一个额外的电子。
这种结构被称为氮离子,它是一种非常稳定的离子。
氮离子在一些化学反应中起着重要的作用,例如在生物体内的氨基酸合成中。
在形成5个共价键的情况下,氮原子需要提供两个额外的电子。
这种结构被称为氮化物,它是一种非常稳定的化合物。
氮化物在一些工业应用中起着重要的作用,例如在半导体制造中用作材料。
氮原子可以形成不同数量的共价键,这取决于它所处的化学环境。
在自然界中,氮分子是最常见的形式,它由两个氮原子通过3个共价键相连而成。
但是,在一些特殊的化学反应中,氮原子也可以形成4个或5个共价键,这种结构在生物体内和工业应用中都起着重要的作用。