物理化学03化学势选编
- 格式:ppt
- 大小:2.86 MB
- 文档页数:66





第三章 化学势一.基本要求1.了解混合物的特点,熟悉多组分系统各种组成的表示法。
2.掌握偏摩尔量的定义和偏摩尔量的加和公式及其应用。
3.掌握化学势的狭义定义,知道化学势在相变和化学变化中的应用。
4.掌握理想气体化学势的表示式,了解气体标准态的含义。
5.掌握Roult 定律和Henry 定律的含义及用处,了解它们的适用条件和不同之处。
6.了解理想液态混合物的通性及化学势的表示方法,了解理想稀溶液中各组分化学势的表示法。
7.了解相对活度的概念,知道如何描述溶剂的非理想程度,和如何描述溶质在用不同浓度表示时的非理想程度。
8.掌握稀溶液的依数性,会利用依数性来计算未知物的摩尔质量。
二.把握学习要点的建议混合物是多组分系统的一种特殊形式,各组分平等共存,服从同一个经验规律(即Rault 定律),所以处理起来比较简单。
一般是先掌握对混合物的处理方法,然后再扩展到对溶剂和溶质的处理方法。
先是对理想状态,然后扩展到对非理想的状态。
偏摩尔量的定义和化学势的定义有相似之处,都是热力学的容量性质在一定的条件下,对任一物质B 的物质的量的偏微分。
但两者有本质的区别,主要体现在“一定的条件下”,即偏微分的下标上,这一点初学者很容易混淆,所以在学习时一定要注意它们的区别。
偏摩尔量的下标是等温、等压和保持除B 以外的其他组成不变(C B ≠)。
化学势的下标是保持热力学函数的两个特征变量和保持除B 以外的其他组成不变。
唯独偏摩尔Gibbs 自由能与狭义化学势是一回事,因为Gibbs 自由能的特征变量是,T p ,偏摩尔量的下标与化学势定义式的下标刚好相同。
多组分系统的热力学基本公式,比以前恒定组成封闭系统的基本公式,在最后多了一项,这项表示某个组成B 的物质的量发生改变B d n 时所引起的相应热力学函数值的改变。
最后一项中化学势B μ是常数,说明B d n 的改变并不是随意的,在数量一定的系统中只发生了B d n 的变化,或在数量很大的系统中改变了1 mol ,这样才能维持B μ不变。




物理化学化学势物理化学化学势是物理化学中的一个重要概念,它描述了物质在平衡状态下的化学势与温度、压力和其他物质化学势之间的关系。
化学势被广泛应用于化学、生物学和工程领域,如化学反应平衡的计算、相变过程的模拟和材料性能的预测等。
在物理化学中,化学势被定义为在一定温度和压力下,物质在无限稀释的条件下所具有的化学势。
它反映了物质在平衡状态下与其他物质之间的相互作用,以及物质在系统中的自由能变化。
计算化学势需要考虑到物质的性质和环境条件。
对于理想气体,化学势与温度和压力成正比,可以用公式表示为:μi=μi0+RTlnπi。
其中,μi表示物质i的化学势,μi0表示物质i的标准化学势,R表示气体常数,T表示温度,πi表示物质i的分压。
在实际应用中,化学势的计算还需要考虑物质的性质和状态。
例如,在凝聚态物质中,化学势与物质的浓度和活度有关,可以用活度系数来描述。
对于复杂反应体系,化学势的计算需要考虑到各种反应的平衡常数和反应速率等。
化学势在化学和生物学中有广泛的应用。
例如,通过计算化学势可以确定化学反应的平衡常数和反应速率,进而预测化学反应的结果。
在生物学中,化学势可以用来描述生物体内的代谢过程和物质传输过程。
总之,物理化学化学势是描述物质在平衡状态下自由能变化的重要概念。
通过计算化学势可以深入理解物质的性质和行为,为实际应用提供重要的理论依据。
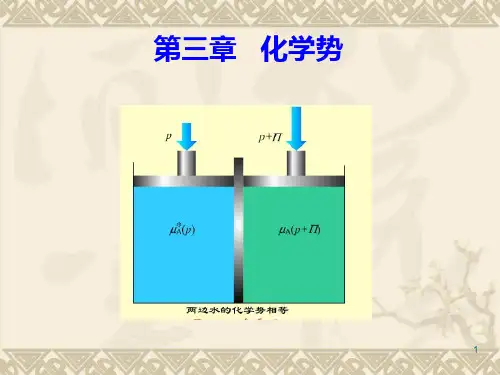
物理化学化学势练习题物理化学化学势练习题一、选择题1、在下列哪个条件下,两种物质的化学势相等? A. 在不同温度和压力下 B. 在相同温度和压力下 C. 在相同温度和不同的压力下 D. 在不同温度和不同的压力下2、以下哪种情况可能会导致化学势发生变化? A. 加入一种新的物质 B. 改变温度 C. 改变压力 D. 以上都是二、填空题1、当一个化学反应达到平衡状态时,____的化学势相等。
2、化学势是____的函数。
3、在一个封闭的系统中,当温度和压力不变时,化学势随物质浓度的变化而变化,这是因为____。