特异性生长因子测定试剂盒(化学法)产品技术要求jiuqiang
- 格式:docx
- 大小:15.23 KB
- 文档页数:4

化学发光免疫类体外诊断试剂(盒)产品技
术审评规范(2017版)
本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围
本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕
242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求
(一)综述资料
综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。

化学发光免疫类体外诊断试剂(盒)产品技
术审评规范(2017版)
本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围
本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕
242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求
(一)综述资料
综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。

(19)中华人民共和国国家知识产权局
(12)发明专利申请
(10)申请公布号 (43)申请公布日 (21)申请号 202011408347.1
(22)申请日 2020.12.03
(71)申请人 安徽大千生物工程有限公司
地址 231200 安徽省合肥市经开区桃花工
业园繁华大道工投·立恒工业广场
B12C
(72)发明人 芮双印 符修乐
(74)专利代理机构 合肥兴东知识产权代理有限
公司 34148
代理人 王伟
(51)Int.Cl.
G01N 33/539(2006.01)
G01N 33/543(2006.01)
G01N 33/68(2006.01)
(54)发明名称
一种肿瘤特异性生长因子胶乳增强免疫比
浊法检测试剂盒及其制备方法
(57)摘要
本发明提供了一种肿瘤特异性生长因子胶
乳增强免疫比浊法检测试剂盒及其制备方法,其
中肿瘤特异性生长因子胶乳增强免疫比浊法检
测试剂盒包括试剂R1和试剂R2。本发明采用多株
多抗分别交联到胶乳微球上混合后形成的胶乳
增强免疫比浊法试剂盒,相比酶联免疫法,该方
法测定TSGF,可在全自动生化分析仪上使用,成
本低廉且自动化高节省检测时间,相比于比色法
该方法具有更高的灵敏度和特异度。权利要求书3页 说明书12页 附图1页CN 112326956 A 2021.02.05
C N 112326956
A
1.一种肿瘤特异性生长因子胶乳增强免疫比浊法检测试剂盒,其特征在于:包括试剂R1和试剂R2;
所述试剂R1包括如下组分:
所述混合多克隆抗体胶乳微球为EGF、NGF、TGF-β、HGF四种多克隆抗体胶乳微球按1:2: 1:1混合后的混合物。

类体外诊断试剂《产品技术要求》
类体外诊断试剂是一类被广泛应用于临床医学检测的试剂,其主要用
于检测和诊断疾病、预测疾病进展和治疗效果等。为了确保类体外诊断试
剂的质量和安全性,各国纷纷发布了相关《产品技术要求》。本文将从标
准要求、分类和应用范围等方面来详细介绍类体外诊断试剂的《产品技术
要求》。
首先,类体外诊断试剂的《产品技术要求》主要包括以下几个方面的
内容:试剂的质量要求、性能要求、标记和包装要求、使用说明书要求、
试剂使用方法要求等。这些要求旨在确保试剂的质量稳定、准确性高、易
于操作和使用者的正常使用。
其次,类体外诊断试剂根据其功能和应用范围可以分为多个类别,如
荧光定量PCR试剂盒、酶联免疫吸附试剂盒、免疫荧光试剂盒等。每个类
别的试剂都有其特定的《产品技术要求》,以确保其性能和质量符合临床
需求。
再次,类体外诊断试剂广泛应用于临床医学检测的各个领域,如感染
性疾病诊断、肿瘤标志物检测、免疫学检测等。不同领域的试剂要求不同,有的需要高灵敏度和特异性,有的需要高准确性和稳定性。根据具体的应
用需求,制定相应的《产品技术要求》来指导试剂的生产和使用。
最后,随着医学技术的不断发展和临床需求的不断增加,类体外诊断
试剂的《产品技术要求》也在不断完善和更新。包括对新技术的应用、新
试剂的开发和新领域的需求等。同时,还需要加强对试剂的监管和管理,
保证试剂的质量和安全性。
总之,《产品技术要求》是保障类体外诊断试剂质量和安全的重要文件,对于试剂的生产和使用都具有指导性和约束性作用。相关部门和企业需密切关注《产品技术要求》的发布和更新,加强对试剂的研发和生产过程的控制,以提高试剂的质量和性能,为临床医学检测提供可靠的工具和方法。
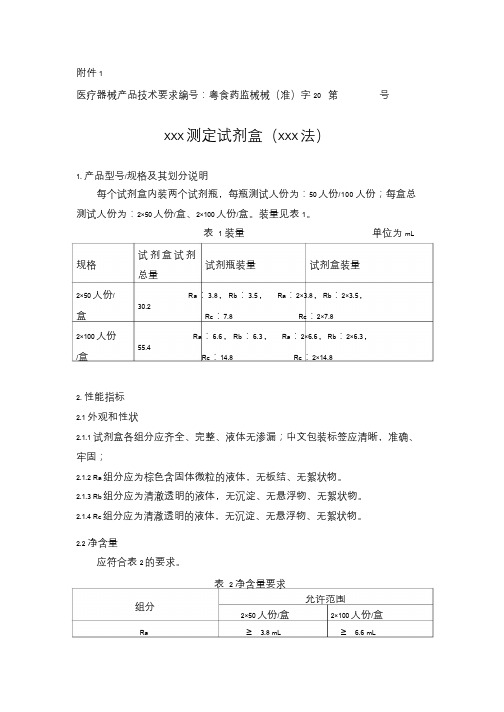
附件1
医疗器械产品技术要求编号:粤食药监械械(准)字20 第号
XXX测定试剂盒(XXX法)
1. 产品型号/规格及其划分说明
每个试剂盒内装两个试剂瓶,每瓶测试人份为:50人份/100人份;每盒总测试人份为:2×50人份/盒、2×100人份/盒。装量见表1。
表1 装量单位为mL 试剂盒试剂
规格试剂瓶装量试剂盒装量
总量
2×50人份/ Ra:3.8,Rb:3.5,Ra:2×3.8,Rb:2×3.5,
30.2
盒Rc:7.8 Rc:2×7.8
2×100人份Ra:6.6,Rb:6.3,Ra:2×6.6,Rb:2×6.3,
55.4
/盒Rc:14.8 Rc:2×14.8
2. 性能指标
2.1 外观和性状
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;
2.1.2 Ra组分应为棕色含固体微粒的液体,无板结、无絮状物。
2.1.3 Rb组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.1.4 Rc组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2 净含量
应符合表2的要求。
表2 净含量要求
组分
允许范围
2×50人份/盒2×100人份/盒
Ra ≥ 3.8 mL ≥ 6.6 mL
Rb ≥ 3.5 mL ≥ 6.3 mL
Rc ≥ 7.8 mL ≥ 14.8 mL
2.3 准确度
用产品配套的2个浓度的定值校准品作为样本进行检测,检测结果与标定浓度的相对偏差应在±10.0 %范围内。
2.4 最低检测限
应不大于0.5 ng/mL。
2.5 线性
试剂盒在1.0 n g/mL~1500 n g/mL区间内,其相关系数(r)应不低于0.9900。
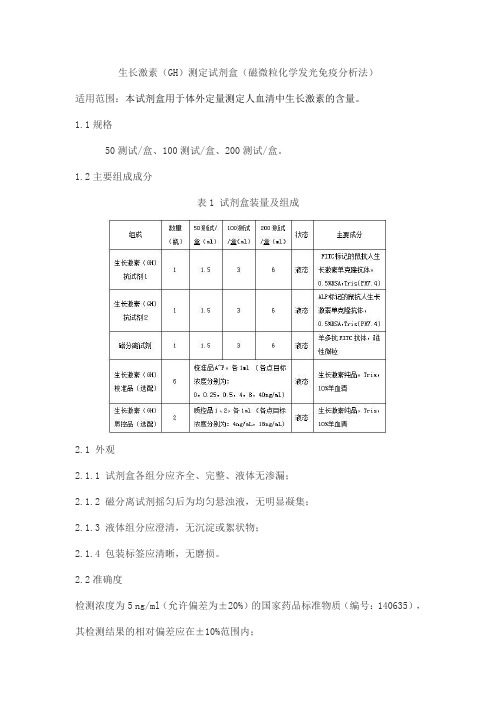
生长激素(GH)测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人血清中生长激素的含量。
1.1规格
50测试/盒、100测试/盒、200测试/盒。
1.2主要组成成分
表1 试剂盒装量及组成
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3 液体组分应澄清,无沉淀或絮状物;
2.1.4 包装标签应清晰,无磨损。
2.2准确度
检测浓度为5 ng/ml(允许偏差为±20%)的国家药品标准物质(编号:140635),其检测结果的相对偏差应在±10%范围内;
2.3空白检测限
应不大于0.01 ng/ml。
2.4线性
在(0.05,40)ng/ml的检测范围内,试剂盒的相关系数r应≥0.99。
2.5重复性
用两个质控品作为样本各重复检测10次,其变异系数(CV)均应≤10%。
2.6质控品测值
质控品检测结果均应在质控范围内。
2.7批间差
用三个批号试剂盒分别检测质控品1和质控品2,两个质控品检测结果的批间变异系数(CV)均应≤15.0%。
2.8分析特异性
将潜在交叉物质添加到含有18ng/ml(允许偏差为±15%)生长激素(GH)的基础样本中使其达到下表浓度,添加前后检测值偏差在±15%范围内,则认为本试剂盒与该物质没有明显交叉。
表2 潜在交叉物质浓度及交叉率要求
2.9溯源性
根据GB/T21415-2008及有关规定提供所用生长激素(GH)校准品的来源、赋值过程及测量不确定度等内容,溯源至生长激素(GH)国际参考物质(WHO

类胰岛素生长因子1(IGF-1)定量酶联免疫检测试剂盒
货号:AC-27F1
【产品名称】
通用名称:类胰岛素生长因子1(IGF-1)定量酶联免疫检测试剂盒
【包装规格】
96人份/盒
【预期用途】
试剂盒是双位点免疫酶分析法用来定量检测人类血清或血浆中类胰岛素生长因子,这个方法合并一个样本预处理的步骤,以避免结合蛋白的干扰。
【简介概述】
类胰岛素生长因子1 (IGF-1)是一个有70个氨基酸的生物多肽(7650道尔顿),并且是许多出现在循环中的相关类胰岛素生长因子中的一种。其分子显示约有50%的序列与胰岛素原的相似并且与胰岛素的一些生物活性相似。该肽高度依赖于生长激素(GH),但有越来越多的证据表明它和生长激素的分泌无关。IGF-1对生长发育的促进有很大影响,包括促进有丝分裂和促进软骨硫酸化。它也促进生长激素在骨骼和其他体液的作用并协调生长。
几乎所有(超过95%)的循环血清中的IGF-1都与特定的IGF结合蛋白连接,现在已经分辨出为6个种类(IGF-BPs 1-6)。BP3被认为是与IGF-1结合的主要蛋白,与IGF-1和酸不稳定性亚单位形成一个140000道尔顿的三聚体。
血清IGF-1的测量用于有生长病变的小孩和监测和诊断肢端肥大症。IGF-1的浓度随着年龄、营养状况、身体成份和生长激素分泌而改变。
单个基础的IGF-1项目的检测常常用于评估小孩矮身高和急性病的病人营养供应的研究。对于诊断肢端肥大症鉴别,单一的IGF-1诊断比一个任意的GH诊断更为可靠。
【检验原理】
病人的样本用试剂短暂孵育以阻止结合蛋白质,然后稀释样本以进行检测。在OCTEIA®IGF-1试剂盒中,一个纯化的多克隆羊抗IGF-1抗体包被在聚苯乙烯微量孔的内表面(固相或抗体捕获)。已预处理的稀释的样本和标上辣根过氧化酶的单克隆抗IGF-1抗体在已经有抗体包被的微量孔中室温下孵育2小时。微量孔清洗并且加入单一成份的显色底物(四甲基联苯胺)产生颜色。终止混合物的反应,吸光度在微量板读数仪上读取,颜色的强度与样本中IGF-1的数量成正比关系。

医疗器械产品技术要求编号:
*****检测试剂盒(胶体金法)
1。产品型号/规格及划分说明
试剂盒规格为10人份/盒,每个试剂盒内装10包检测试剂、1瓶抽提液A、1瓶抽提液B、10个采样管、10个小滴管和1份说明书。
2. 性能指标
2.1物理检查
2。1。1外观
包装盒整洁,各组分齐全;抽提液瓶盖严紧,无漏液;盒签和瓶签清晰完整,标识无误;品名、批号和有效期清楚;说明书清晰完整。
2。1。2膜条宽度
膜条宽度3.8±0。2mm。
2。1.3液体移行速度
液体移行速度应不低于10mm/min.
2.1.4装量
抽提液装量为4.0ml±0.2ml/瓶。
2。2阳性参考品符合率
10份***国家阳性参考品检测结果应全部为阳性,阳性参考品符合率(+/+)应为10/10或3份企业阳性参考品检测结果应全部为阳性,阳性参考品符合率(+/+)应为3/3。
2。3阴性参考品符合率
10份***国家阴性参考品检测结果应全部为阴性,阴性参考品符合率(-/—)应为10/10或10份企业阴性参考品检测结果应全部为阴性,阴性参考品符合率(—/-)应为10/10。
2。4重复性
使用***国家重复性参考品或企业重复性参考品进行检测,结果应为阳性,且显色一致无明显差别.
2。5最低检出限
使用***国家最低检出限参考品或企业最低检出限参考品进行检测,结果应为阳性,最低检出限应不高于1×105个菌/ml。
2。6批间差
使用***国家重复性参考品或企业重复性参考品对三批试剂盒进行检测,结果应符合2.4的规定。
2.7稳定性
试剂盒在规定的存储条件下存放至有效期末或37℃条件下放置14天,分别检测2.2~2.5项,结果应符合各项目的要求.

大肠杆菌菌体蛋白残留量(E.coli DH-5α)酶联免疫分析(ELISA)
试剂盒使用说明书
本试剂盒仅供研究使用。
1使用目的:
本试剂盒用于饲料、鱼、虾和肉类组织(如鸡、牛肉和猪肉),药物、血清和尿样中大肠杆菌菌体蛋白残留量(E.coli DH-5α)残留的定量检测。
2实验原理
本试剂盒采用竞争ELISA方法,在微孔板包被有大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原,加入大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品或样品,游离大肠杆菌菌体蛋白残留量(E.coli DH-5α)与微孔条上预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原互相竞争抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶标记物,用TMB底物显色,加入终止液后颜色由蓝色变为黄色,用酶标仪在450nm波长下进行检测,吸光值与样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)含量成反比,通过标准曲线计算样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)的含量。
3试剂盒组成
3.1预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原的可拆酶标板:1块(12孔×8条)。
3.2大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品:6瓶(1ml/瓶),含量分别是:0ug/ml, 0.1ug/ml,0.3ug/ml,0.9ug/ml,2.7ug/ml,8.1ug/ml
3.3抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶结合物:1瓶(6ml)。

1 性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量
应不少于试剂的标示装量值。
2.3准确度
2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限
应不大于0.02 ng/mL。
2.5线性
试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 5%。
2.7批间差
变异系数CV 应≤ 10%。
2.8校准品均一性
2.8.1校准品瓶内均一性
C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性
C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II
1
型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。

胎盘生长因子定量检测试剂盒
说明书
(PLGF ELISA试剂盒:EIA4529 96T)
1、简介
PLGF酶免试剂盒可用于血清中人胎盘生长因子的定量检测.此试剂盒仅供体外诊断用。血管生成和血管转化是胎盘正常发育过程中的重要步骤.血管生成和血管转化不正常是造成先兆性
子痫妊娠和宫内胎儿生长迟缓的重要原因.胎盘生长因子是VEGF家族中一员,主要由胎盘分泌,它是一种有效的血管生成因子.PLGF相应的受体(可溶性的fms样酪氨酸激酶1)也具有促血管生成的性质。
2、实验原理
PLGF ELISA试剂盒是一种固相的酶联免疫试剂盒,采用三明治夹心法的原理。包被板的微孔中包被了能识别PLGF分子上独特抗原位点的单克隆抗体。将含有一定量PLGF的病人样品加入到微孔中温育,之后洗板,洗板后加入对PLGF具有特异性的生物素标记多克隆抗体。温育后洗板除去未结合的酶复合物.过氧化酶的结合量与样品中PLGF的浓度成正比。加入底物液后,溶液所显示的颜色与样品中PLGF的浓度成正比。
3、试剂盒成分
1)包被板,12*8(可拆),96孔,包被了抗PLGF抗体(单克隆)
2)零标准品,1支,1ml,即用,0pg/ml,内含<0.35的proclin防腐剂。
3)标准品1-5,5支,1ml,即用,浓度:25;50;125;500;1000pg/ml,内含<0.35的proclin 防腐剂。
4)质控品,2支,1ml,即用,质控品的浓度值及可允许范围请见试剂瓶标签或质控单。内含<0.35的proclin防腐剂。
5)检测缓冲液,1支,30ml,即用,内含<0。35的proclin防腐剂.

细胞因子检测试剂盒的优势与局限性分析
细胞因子是生物体内参与细胞间信号传递的重要蛋白质分子,它们在细胞增殖、分化、免疫调节以及炎症等许多生物过程中发挥着关键的作用。为了检测和分析细胞因子的水平和功能,科研工作者们开发了各种细胞因子检测试剂盒。本文将重点讨论细胞因子检测试剂盒的优势与局限性,旨在全面了解这一技术的应用前景和限制。
细胞因子检测试剂盒的优势:
1. 批量分析能力:细胞因子检测试剂盒能够一次性检测多个细胞因子,大大提
高了工作效率。相比传统的单个分析方法如ELISA,细胞因子检测试剂盒将多个
指标结合在一个试剂盒中,可以同时检测多个细胞因子的水平。这种批量分析能力可以大大缩短实验时间,并且能够在较短的时间内提供更全面的数据信息。
2. 精确度高:细胞因子检测试剂盒采用高灵敏度的检测方法,能够准确地测量
细胞因子的浓度。这些方法包括免疫层析、荧光素酶标记方法等,能够检测到非常低浓度的细胞因子,提高了实验结果的可靠性和准确性。
3. 多样性:目前市场上有各种各样的细胞因子检测试剂盒可供选择,覆盖了大
部分常见的细胞因子。无论是免疫调节因子、炎症因子还是生长因子等,细胞因子检测试剂盒都能提供全面的测量。
4. 便携性:一些细胞因子检测试剂盒已经实现了便携化,方便在实验室之外使用。这种便携化的设计让研究人员能够在野外、动物实验中等需要移动的场合进行细胞因子检测。
细胞因子检测试剂盒的局限性:
1. 样品处理要求严格:细胞因子检测试剂盒通常要求样品的预处理,包括离心、过滤等操作,这可能会增加实验的复杂性和操作的技术要求。样品处理不当可能会对实验结果产生影响,因此需要研究人员具备一定的实验经验。
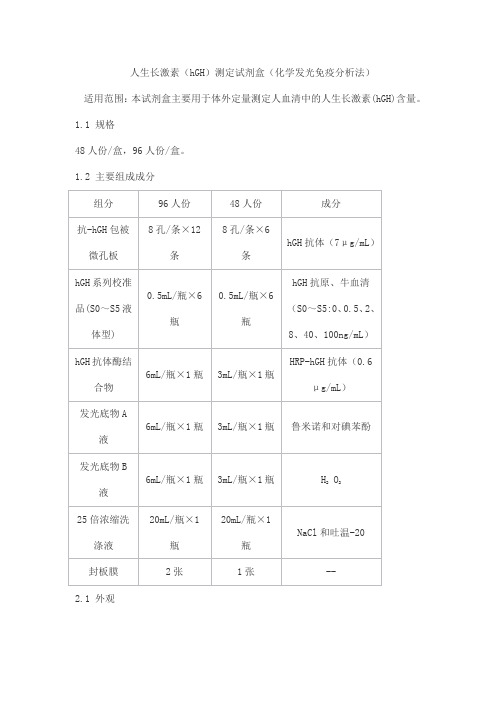
人生长激素(hGH)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的人生长激素(hGH)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
试剂盒校准品与国家标准品同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t-检验);以hGH国家标准品为对照品,试剂盒校准品的实测效价与标示效价之比应在0.900~1.100范围内。
2.4 剂量-反应曲线的线性
在[0.5,100]ng/mL范围内,用双对数数学模型拟合,剂量-反应曲线相关系数(r)应不低于0.9900。
2.5 精密度
2.5.1 重复性(CV%)应不高于15.0%;
2.5.2 批间差(CV%)应不高于20.0%。
2.6 最低检出量
应不高于0.250ng/mL。
2.7 质控血清测定值
应在允许范围内。
2.8 特异性
与浓度为100μIU/mL的PRL反应,测定结果应小于0.250ng/mL;
与浓度为200μg/mL的HPL反应,测定结果应小于0.250ng/mL。
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至国家标准品。

I C S11.100
C44
中华人民共和国医药行业标准
Y Y/T1674 2019
胰岛素样生长因子Ⅰ测定试剂盒
I n s u l i n-l i k e g r o w t h g a c t o rⅠt e s t i n g k i t
2019-10-23发布2020-10-01实施
目 次
前言Ⅲ
1 范围1
2 规范性引用文件1
3 分类1
4 要求1
5 试验方法2
6 标签和使用说明书4
7 包装㊁
运输㊁贮存4 参考文献5
前言
本标准按照G B/T1.1 2009给出的规则起草㊂
请注意本文件的某些内容可能涉及专利㊂本文件的发布机构不承担识别这些专利的责任㊂
本标准由国家药品监督管理局提出㊂
本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会(S A C/T C136)归口㊂本标准起草单位:中国食品药品检定研究院㊁河南省医疗器械检验所㊁郑州安图生物工程股份有限公司㊁深圳市新产业生物医学工程股份有限公司㊁西门子医学诊断产品(上海)有限公司㊂本标准主要起草人:于婷㊁曲守方㊁孙楠㊁黄杰㊁张娟丽㊁李晓霞㊁卫文峰㊁袁锦云㊁汪少颖㊁南钢㊂
胰岛素样生长因子Ⅰ测定试剂盒
1 范围
本标准规定了胰岛素样生长因子Ⅰ测定试剂盒的分类㊁要求㊁试验方法㊁标签和使用说明书㊁包装㊁
运输㊁贮存㊂本标准适用于以双抗体夹心法为原理定量测定胰岛素样生长因子Ⅰ的试剂盒,包括以酶标记㊁(电)
化学发光标记㊁(时间分辨)荧光标记等标记方法的免疫分析试剂盒㊂本标准不适用于:用胶体金或其他方法标记的半定量测定胰岛素样生长因子Ⅰ的试剂(如:试纸条等);用125Ⅰ等放射性同位素标记的各类胰岛素样生长因子Ⅰ放射免疫或免疫放射试剂盒㊂

细胞因子检测试剂盒的性能评估及标准化方
法
细胞因子检测试剂盒是一种常用的生物学实验试剂,用于测定细胞因子在生物样本中的浓度。准确评估细胞因子检测试剂盒的性能和标准化方法对于提高实验结果的可靠性至关重要。本文将介绍细胞因子检测试剂盒的性能评估和标准化方法,以及常见的技术要点。
一、细胞因子检测试剂盒性能评估方法
1. 准确性评估
准确性是评估细胞因子检测试剂盒性能的重要指标,可以通过对已知浓度的标准样本进行测定来评估。选择多个浓度的标准样本,分别进行实验测定,并与已知浓度进行比较。计算测定值和已知值之间的差异,以评估检测试剂盒的准确性。
2. 精密度评估
精密度是评估细胞因子检测试剂盒性能的另一个重要指标,用于评估同一样本的重复测定结果的一致性。选择同一生物样本,重复进行多次实验测定,并计算测定值之间的变异系数。较小的变异系数表示测定结果的一致性较好,检测试剂盒的精密度较高。
3. 灵敏度评估
灵敏度是评估细胞因子检测试剂盒性能的关键指标,表示检测器对低浓度细胞因子的响应能力。选择不同浓度的标准样本,测定其信号强度,并记录变化幅度。计算最低检测浓度(LOD)和最低定量浓度(LOQ),以评估检测试剂盒的灵敏度。
4. 特异性评估
特异性是指检测试剂盒能否准确测定目标细胞因子而不受其他成分的干扰。进行对照实验,将目标细胞因子与其他相关分子进行交叉反应检测,并评估结果的差异。较小的交叉反应说明检测试剂盒具有较好的特异性。
二、细胞因子检测试剂盒标准化方法
1. 样本处理标准化
样本处理是细胞因子检测的关键环节,影响到最终测定结果的准确性。建立样本处理标准化方法,包括样本采集、储存和处理流程的规范化。确保样本的一致性处理可以提高实验结果的可靠性。

细胞因子检测试剂盒的技术优势及发展趋势
细胞因子是一类具有重要生物调控功能的蛋白质,它们在免疫、炎症、细胞增
殖和分化等生理过程中发挥关键作用。而细胞因子检测则是研究和诊断这些生理过程的关键手段之一。细胞因子检测试剂盒是一种用于定量或半定量测定细胞因子水平的工具,具有许多技术优势,并且在近年来呈现出迅猛的发展态势。
首先,细胞因子检测试剂盒的技术优势之一是高灵敏度。由于细胞因子在生理
过程中的浓度通常很低,因此需要高灵敏度的检测试剂盒来准确测定其浓度。现代细胞因子检测试剂盒利用了各种敏感的检测方法,如ELISA(酶联免疫吸附测定法)、流式细胞术和光化学发光等技术,能够在极小样本量下对细胞因子进行精确测量。
其次,细胞因子检测试剂盒还具有高特异性。细胞因子在体内的数量众多,种
类繁多,因此需要能够区分不同细胞因子的检测试剂盒来准确测定待测物的浓度。现代细胞因子检测试剂盒通过选择高亲和性的抗体对目标细胞因子进行捕获,并通过特定的探针或酶标记物来进行检测,从而实现细胞因子的特异性检测。
此外,细胞因子检测试剂盒具有快速、准确和可重复性的特点。传统的细胞因
子检测方法如ELISA需要较长的操作时间和多个步骤,而现代的细胞因子检测试
剂盒采用了快速和高通量的技术,大大缩短了检测时间,并能同时测定多个细胞因子。此外,由于细胞因子检测试剂盒具有较好的稳定性和重复性,可以在不同实验条件下进行多次测定,并保持一致的结果。
随着生物技术的不断进步,细胞因子检测试剂盒的发展也呈现出一些明显的趋势。首先,越来越多的新技术被应用于细胞因子检测试剂盒的研发中。如利用基因工程技术构建高亲和性的抗体,采用纳米材料增强检测信号,以及引入微流控技术提高检测效率等。这些新技术的引入将进一步提高细胞因子检测的精确性和灵敏度。