氧化还原反应复习课
- 格式:ppt
- 大小:481.50 KB
- 文档页数:24



氧化还原反应卢淳杰【回顾】基本逻辑关系元素化合价降低 得电子 还原反应 氧化剂 还原产物 元素化合价升高 失电子 氧化反应 还原剂 氧化产物(特征)(本质) (反应物) (生成物) (反应)1、分析反应【例】 2FeCl3 + Cu = 2FeCl2 +CuCl2 (1)用双线桥法标出该反应中电子转移的方向和数目,指出氧化剂、还原剂、氧化产物、还原产物2、比较氧化性/还原性化合价降低,得电子,被还原氧化剂+还原剂==还原产物+氧化产物化合价升高,失电子,被氧化氧化性——氧化剂>氧化产物还原性——还原剂>还原产物2、比较氧化性/还原性【例】 2FeCl 3 + Cu = 2FeCl 2 +CuCl 2(2)氧化性:FeCl 3 CuCl 2 ;Fe3+ Cu 2+ 还原性: Cu FeCl 2 ;Cu Fe 2+> > > >2、比较氧化性/还原性【拓展】在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )。
A①Fe2+;②Fe2+和Fe3+;③Fe2+和Cu2+;④Cu2+和Fe3+。
A.①③ B.②④ C.①④ D.②③2、比较氧化性/还原性【应用】1、判断反应先后:当有多种物质参加反应时,氧化(还原)性强的物质优先反应。
2、判断反应是否发生:氧化性强的物质能够反应生成氧化性弱的物质。
3、定量分析【例】 2FeCl 3 + Cu = 2FeCl 2 +CuCl 2 (3)在该反应中,若Cu 失去2 mol 电子,则FeCl 3得到 mol 电子,参与反应的Cu 物质的量为_____,产生FeCl 2物质的量为_____。
2 1 mol2 mol3、定量分析【变】 FeCl 3 + Cu -- FeCl 2 + CuCl 2 在该反应中,若有1 mol Cu 参加反应,则FeCl 3得到 mol 电子,参与反应的FeCl 3 物质的量为________。


第四讲 氧化还原反应的基本概念和规律(基础课)复习目标 1.了解氧化还原反应的本质。
2.了解常见的氧化还原反应。
根据化学式判断元素化合价。
3.会用“单、双线桥”分析电子转移的方向和数目。
4.掌握氧化性、还原性强弱的比较及价态规律的应用。
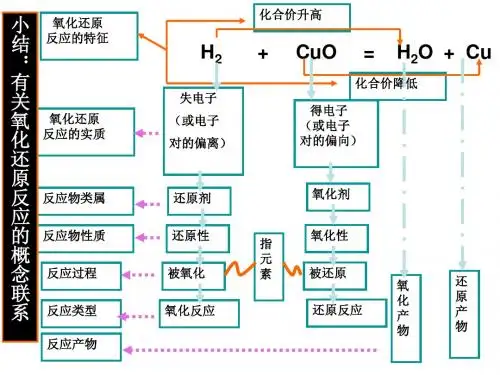
知识点一 与氧化还原反应相关的概念1.本质和特征2.相关概念间的关系 (1)有单质参加或生成的化学反应不一定是氧化还原反应,如______________________________________________________________________________________________(符合题意即可)。
(2)分析:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
上述反应中,氧化剂是________,还原剂是________,氧化产物是________,还原产物是________,KMnO4发生________反应,HCl发生________反应,盐酸表现的性质是________性和________性;生成1 mol Cl2时转移电子数目为________,被氧化的HCl 的物质的量是________ mol 。
提示 (1)3O 2=====放电2O 3 (2)KMnO 4 HCl Cl 2 MnCl 2 还原 氧化 还原 酸 2 mol 23.电子转移的表示方法——双线桥法与单线桥法(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
用双线桥法标出铜和稀硝酸反应电子转移的方向和数目:。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
用单线桥法标出铜和稀硝酸反应电子转移的方向和数目:。
4.常见的氧化剂与还原剂(1)常见的氧化剂及还原产物预测氧化剂还原产物KMnO4Mn 2+(酸性);MnO 2(中性);MnO 2-4(碱性)K 2Cr 2O 7(酸性)Cr 3+浓硝酸NO 2稀硝酸NO X 2(卤素单质)X -H 2O 2OH -(碱性);H 2O(酸性)Na 2O 2NaOH(或Na 2CO 3)NaClO(或ClO -)Cl -、Cl 2NaClO 3Cl -、Cl 2、ClO 2PbO 2Pb 2+(2)常见的还原剂及氧化产物预测还原剂氧化产物S 2-(或H 2S)S 、SO 2(或SO 2-3)、SO 2-4H 2C 2O 4CO 2H 2O 2O 2I -(或HI)I 2、IO -3CO CO 2金属单质(Zn 、Fe 、Cu等)Zn 2+、Fe 2+(与强氧化剂反应生成Fe 3+)、Cu 2+Fe 2+Fe 3+(酸性);Fe(OH)3(碱性)SO 2(或H 2SO 3、SO 2-3)SO 2-4(3)如H 2O 2既可作氧化剂,又可作还原剂。