华南理工大学《630量子力学》考研专业课真题试卷
- 格式:pdf
- 大小:640.06 KB
- 文档页数:13


【育明教育】中国考研考博专业课辅导第一品牌育明教育官方网站:12013年华南理工大学考研真题答案精解之量子力学2015考【育明教育】中国考研考博专业课辅导第一品牌育明教育官方网站:2研英语写作七大误区词汇与语法错误考研英语写作让很多同学都很头痛,有两点原因:一为词汇,二为语法。
因为英语与汉语的区别是一词多义,非常讲究用词准确而且正式。
同时,英语的词汇非常丰富,一个词语通常都有许多同义词和近义词。
考生如果平时注意积累并加以练习,就能够在考试中熟练地加以运用。
英文写作也同样非常讲究语法,尤其是考研作文作为正式文体,需要注意以下几点小细节:(1)尽量少用缩写形式。
如don't,can't,won't 应写为do not,cannot,will not 等。
(2)用更加正式的否定形式。
如not…any 应写为no,not…much 写为little,not many 写做few 等。
(3)尽量少用"etc.","and so on"等表达方式。
例如:Activities include dancing,singing,etc 。
Activities include dancing,singing,and other fun stuff 。
◎中文式思维模式很多考生在考试过程中把一些中文的成语、谚语翻译成英文,这种做法导致的结果就是文章不仅行文不符合英文的规律,读起来也让人觉得非常不舒服。
纠正中文思维习惯的关键依然在于培养英文语感,同时考生在平时的练习中也要尽量让自己用英文来思考。
如果考生需要用到谚语,名句等,最好的办法是直接掌握英文的谚语、名句,并灵活运用到文章中。
◎注意字数与标点考研英语作文一分钟平均7~8个字,字数多少算个够?自己目测一下,以大作文为例,中等大小一行15字,最起码写到12,13位置,因为阅卷人做的第一件事情就是看你的字数,就看你的位置到没有到。

629A华南理工大学2018 年攻读硕士学位研究生入学考试试卷(2)液态混合物中A的活度因子,并画出A的蒸气压随浓度变化示意图:(3)混合物的凝固点。
(15 分)(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)科目名称:物理化学(一)适用专业:无机化学:分析化学:有机化学:物理化学:高分子化学与物理共4页一、计算题1、将5 mol 理想气体(Cχ m= SR/2 )先等孀从25℃、100 kPa 压缩到700 kPa, 然后等容变温至50℃,求整个过程的Q、w、t:-.U、Ml、t:-.S。
(15 分)2、己知298 K 时的下列数据:4、由乙皖裂解制乙烯反应CH3CH3(g)→CH2=CH2(θ+H2(g)标准Gibbs自由能变Li,G,;;(lOOOK)=894.5J·mol"1,在lOOOK和150kPa压力下,反应开始前系统中只有2 mol 乙炕,求:(1)反应达平衡时的反应进度:(2)乙烯的最大产率;S,;;/J·K1·mol"1c:,m /J·K1·mol"1(3)当反应进行到乙皖分压为50 kPa 时,反应能否正向进行?(15分)计算反应A (g)282.0 73.265、把下列反应设计在碱性介质电池中进行:CH30H (1) + 3/2 02 (g) = C02 (g) + 2H20 (1)已知,298K 时,f..rG,;; (CH30H, 1) = -166刀kJ·mol"1 , t:-.rG,;; (COi, g) = -394.36 kJ·mol"1,A (g, 298 K, p6) =B (g, 298 K, p6) +C (g, 298 K, p6)的焰变,并用恼增加原理判断该反应在298K,p6下能否发生?若升温至633K,通过计算说明反应能否发生?己知反应的t:-.,H,;;(298 K) = 46.024 kJ·mor1 ,假设c:,m不随温度变化。

20001.苯的正常沸点为353K,摩尔蒸发焓为30.77kJ•mol-1,现将353K,标准压力下的1 摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽(设为理想气体)。
(1) 计算该过程苯吸收的热量和做的功;(2) 求过程的 G 和 S;(3) 求环境的熵变;(4) 可以使用何种判据判断过程的性质。
2.有关金刚石和石墨在298K 时的热力学数据如下表所示:金刚石石墨c H m/(kJ²mol-1) -395.3 -393.4S m/(J²K-1²mol-1) 2.43 5.69密度/(kg²dm-3) 3.513 2.260求:(1) 298K 时,由石墨转化为金刚石的 r G m;(2) 298K时,由石墨转化为金刚石的最小压力。
(本题10分)3.已知288.15K 时纯水的饱和蒸汽压为1705Pa,现将1mol NaOH 溶解在4.559mol 水中,测得该溶液的饱和蒸汽压596.5Pa,求:(1) 溶液中水的活度;(2) 在纯水中和在溶液中,水的化学势的差值。
(本题10 分)4.对MnO-Fe2O3 二组分系统,已知MnO 和Fe2O3 的熔点分别为1785℃和1370℃;在1430℃时,含有40%和70%Fe2O3(质量%)两间发生转熔变化,与其平衡的液相组成为85%Fe2O3;在1200℃,两个固溶体的组成为36%Fe2O3 和74%Fe2O3。
(1) 试绘制出该系统的相图;(2) 指出个区域和三相线对应的相态和自由度;(3) 当一含74%Fe2O3的二相组分系统,由1650℃缓慢冷至1100℃时,作出冷却曲线,简述其相态的变化。
(4) 当一含74%Fe2O3 的二相组分系统,由1650℃缓慢冷至无限接近1430℃,试分析此时个相的组成和质量。
假设系统的总质量为1kg。
(本题12 分)5.298K 时,电池Hg(1)∣HgCl2 (s) | HCl(a) | Cl2(g,p) | Pt 的电动势及它的温度系数分别为1.092V 和9.427X10-4V•K-1。

量子力学考试题量子力学考试题(共五题,每题20分)1、扼要说明:(a )束缚定态的主要性质。
(b )单价原子自发能级跃迁过程的选择定则及其理论根据。
2、设力学量算符(厄米算符)∧F ,∧G 不对易,令∧K =i (∧F ∧G -∧G ∧F ),试证明:(a )∧K 的本征值是实数。
(b )对于∧F 的任何本征态ψ,∧K 的平均值为0。
(c )在任何态中2F +2G ≥K3、自旋/2的定域电子(不考虑“轨道”运动)受到磁场作用,已知其能量算符为S H ??ω=∧H =ω∧z S +ν∧x S (ω,ν>0,ω?ν)(a )求能级的精确值。
(b )视ν∧x S 项为微扰,用微扰论公式求能级。
4、质量为m 的粒子在无限深势阱(0<x</x5、某物理体系由两个粒子组成,粒子间相互作用微弱,可以忽略。
已知单粒子“轨道”态只有3种:a ψ(→r ),b ψ(→r ),c ψ(→r ),试分别就以下两种情况,求体系的可能(独立)状态数目。
(i )无自旋全同粒子。
(ii )自旋 /2的全同粒子(例如电子)。
量子力学考试评分标准1、(a ),(b )各10分(a )能量有确定值。
力学量(不显含t )的可能测值及概率不随时间改变。
(b )(n l m m s )→(n’ l’ m’ m s ’)选择定则:l ?=1±,m ?=0,1±,s m ?=0 根据:电矩m 矩阵元-e →r n’l’m’m s ’,n l m m s ≠0 2、(a )6分(b )7分(c )7分(a )∧K 是厄米算符,所以其本征值必为实数。
(b )∧F ψ=λψ,ψ∧F =λψ K =ψ∧K ψ=i ψ∧F ∧G -∧G ∧F ψ =i λ{ψ∧G ψ-ψG ψ}=0 (c )(∧F +i ∧G )(∧F -i ∧G )=∧F 2+∧G 2-∧Kψ(∧F +i ∧G )(∧F -i ∧G )ψ=︱(∧F -i ∧G )ψ︱2≥0 ∴<∧F 2+∧G 2-∧K >≥0,即2F +2G ≥K 3、(a),(b)各10分(a) ∧H =ω∧z S +ν∧x S =2 ω[1001-]+2 ν[0110]=2 [ωννω-]∧H ψ=E ψ,ψ=[b a ],令E =2λ,则[λωννλω---][b a ]=0,︱λωννλω---︱=2λ-2ω-2ν=0 λ=±22νω+,E 1=-2 22νω+,E 2=222νω+ 当ω?ν,22νω+=ω(1+22ων)1/2≈ω(1+2 22ων)=ω+ων22E 1≈-2 [ω+ων22],E 2 =2[ω+ων22](b )∧H =ω∧z S +ν∧x S =∧H 0+∧H’,∧H 0=ω∧z S ,∧H ’=ν∧x S∧H 0本征值为ω 21±,取E 1(0)=-ω 21,E 2(0)=ω 21相当本征函数(S z 表象)为ψ1(0)=[10],ψ2(0)=[01 ]则∧H ’之矩阵元(S z 表象)为'11H =0,'22H =0,'12H ='21H =ν 21E 1=E 1(0)+'11H +)0(2)0(12'21E E H-=-ω 21+0-ων2241=-ω21-ων241 E 2=E2(0)+'22H +)0(1)0(22'12E E H -=ω 21+ων2414、E 1=2222ma π,)(1x ψ=0sin 2a xa π a x x a x ≥≤<<,00x =dx x a ?021ψ=2sin 202a dx a x x a a=?π x p =-i ?=a dx dx d011ψψ-i ?=aa x d a 020)sin 21(2π x xp =-i ??-=aaa x d a x x a i dx dx d x 0011)(sin sin 2ππψψ =-a a x xd a i 02)(sin 1π =0sin [12a a x x a i π --?adx a x 02]sin π=0+?=ai dx ih 02122 ψ 四项各5分5、(i ),(ii )各10分(i )s =0,为玻色子,体系波函数应交换对称。

846华南理工大学2008年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回)科目名称:电介质物理学适用专业:微电子学与固体电子学共 3 页一、 填充题:(50分)1.填写下列定义和概念:(30分,每空2分)⑴电介质在外电场的作用下,将一部分电能转变成热能的物理过程,称为。
⑵若两平行板之间充满均匀的电介质,在外电场作用下,电介质的内部将感应出偶极矩,与外电场垂直的电介质表面上出现与极板上电荷反号的极化电荷,这种现象称为_________________。
电介质极化后,电介质表面的极化电荷将削弱极板上的自由电荷所形成的电场,这种由极化电荷产生的场强被称为____________________。
⑶在离子晶体中,除存在电子位移极化以外,在电场作用下,还会发生正、负离子沿相反方向位移形成__________________。
⑷ 空间电荷极化是_____________电介质在电场作用下的一种主要的极化形式。
极化的起因是电介质中的自由电荷载流子可以在缺陷和不同介质的_____________上积聚,形成空间电荷的局部积累,使电介质中的电荷分布不均匀,产生宏观电矩。
⑸热离子松弛极化是由于电介质中某些弱联系的_____________质点在电场作用下作______________迁移,使局部离子过剩,结果在电介质内部建立起电荷的不对称分布,形成电矩。
⑹依照导电载流子种类的不同,电介质的电导可以分成以下几种形式:①;②;③。
在固体电介质中,在强电场下以为主,在弱电场下以为主;出现在液体电介质中。
846华南理工大学2009年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回)科目名称:电介质物理学适用专业:微电子学与固体电子学共 2 页一、填充题:(50分)1.填写下列定义和概念:(40分,每空2分)⑴电介质损耗包括、、。

【育明教育】中国考研考博专业课辅导第一品牌育明教育官方网站:12013年华南理工大学考研真题精讲精练之量子力学【育明教育】中国考研考博专业课辅导第一品牌育明教育官方网站:22015考研英语之如何快速记忆单词让背诵效率最大化通过做练习巩固单词。
对于背诵熟悉的单词要能灵活的运用绝对是另一种能力的体现。
见过很多学生词汇量不少,但是在实际运用中却无法正确运用自己掌握的词汇。
所以平时在准备单词的时候就要注意积累该词汇怎么运用,跟它意思相近的词汇又是怎么运用的,二者或多者之间的区别是怎样的。
很多同学觉的这样很麻烦,其实这是节省时间的一个巧妙方法,善于总结,学过一个词能记住与之相关的很多词,不仅记忆住还能准确辨识。
刚开始学英语的时候,我们一般只记一个单词的一个词义和一种用法,而考研英语作为一种较高程度的水平考试,它要求的是全面了解这个词的词义,也就是常说的一词多义和一词多用。
由于有些同学在思想上还没有这种认识上的转变,背单词时还停留在一词一义、一词一用的阶段,尽管背了不少单词,做起题来仍然捉襟见肘、处处被动。
海天考研辅导专家认为,大多数考生在复习时存在只知其一不知其二的毛病,而考研词汇大多一词多义,所以在复习时对于单词的延伸意也要加以把握。
这就要求大家在复习时注意理解和积累,大家可以通过看书或看杂志来积累相关知识,相信只要坚持下去,就一定会有好的效果。
学会查找重点单词我们学习英语的时候,比较重视长难的单词,看到多音节词就查字典,而对一些单音节的词或它们组成的短语常常忽略掉,不查也不记,觉得没什么用。
其实,像那些比较长的单词用作专业词汇的比较多。
那些小的单词则是英语的本土字,在日常生活中使用较频繁,而且词义一般比较多、变化也比较多,是较难掌握的,应该是大家学习的重点。
海天考研辅导专家认为,对于英文单词,大家不能只记它的中文意思,因为英文单词是有词性的,如果不清楚词性很容易导致句子结构的错误。
英语单词的每个词除了有多种意思,还几乎都有多个词性,比如名词、动词、形容词、副词和介词等等,各种词性的使用都是有明确规定的,比如介词总跟名词或名词从句连用、副词跟动词或形容词连用。


习题1一、填空题1.玻尔的量子化条件为。
2.德布罗意关系为。
3.用来解释光电效应的爱因斯坦公式为。
4.波函数的统计解释:_______________________________________________________________________________________________5.为归一化波函数,粒子在方向、立体角内出现的几率为,在半径为,厚度为的球壳内粒子出现的几率为。
6.波函数的标准条件为。
7.,为单位矩阵,则算符的本征值为__________。
8.自由粒子体系,__________守恒;中心力场中运动的粒子___________守恒。
9.力学量算符应满足的两个性质是。
10.厄密算符的本征函数具有。
11.设为归一化的动量表象下的波函数,则的物理意义为_______________________________________________。
12.______;_______;_________。
28.如两力学量算符有共同本征函数完全系,则___。
13.坐标和动量的测不准关系是____________________________。
14.在定态条件下,守恒的力学量是_______________________。
15.隧道效应是指__________________________________________。
16.量子力学中,原子的轨道半径实际是指____________________。
17.为氢原子的波函数,的取值范围分别为。
18.对氢原子,不考虑电子的自旋,能级的简并度为,考虑自旋但不考虑自旋与轨道角动量的耦合时,能级的简并度为,如再考虑自旋与轨道角动量的耦合,能级的简并度为。
19.设体系的状态波函数为,如在该状态下测量力学量有确定的值,则力学量算符与态矢量的关系为__________。
20.力学量算符在态下的平均值可写为的条件为____________________________。

2023年攻读硕士学位硕士入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学(含物理化学试验)合用专业:化学工程、化学工艺、工业催化、环境工程、材料物理与化学1. C6H6在100kPa时旳熔点为5℃,摩尔熔化焓为9916J·mol-1,C p,m(l)=126.8J·K-1·mol-1,C p,m(s)=122.6J·K-1·mol-1。
求100kPa、–5℃下1 mol过冷C6H6凝固成固态C6H6旳Q、△U、△H、△S、△A、△G,假设凝固过程旳体积功可以忽视不计。
(12分)解:波及过程如下:∆H= ∆H1+ ∆H2+ ∆H3= C p,m(l)(T’-T) +∆H2+C p,m(s)(T-T’)=9916 J·mol-1+(122.6-126.8)×(268-278) J·mol-1= 9958 J·mol-1恒压Q= ∆H= 9958 J·mol-1∆U= ∆H- ∆pV ≈∆H=9958 J·mol-1∆S= ∆S1+ ∆S2+ ∆S3= C p,m(l)ln(T’/T) +∆H2/T’+C p,m(s)ln(T/T’)= ∆H2/T’+[C p,m(s)-C p,m(s)]ln(T/T’)=9916 J·mol-1/278K+(122.6-126.8)ln(268/278) J·K-1·mol-1= 35.8 J·K-1·mol-1∆G≈∆A= ∆H- T∆S = 9958 J·mol-1-268K×35.8 J·K-1·mol-1 = 363.6 J·mol-12. 卫生部规定汞蒸气在1m3空气中旳最高容许含量为0.01mg。
已知汞在20℃旳饱和蒸气压为0.160Pa,摩尔蒸气发焓为60.7kJ·mol-1(设为常数)。


前言15概念及术语15BET公式BET formula 15DLVO理论DLVO theory 16HLB法hydrophile-lipophile balance method 16pVT性质pVT property 16ζ电势zeta potential 16阿伏加德罗常数Avogadro’number16阿伏加德罗定律Avogadro law 16阿累尼乌斯电离理论Arrhenius ionization theory 16阿累尼乌斯方程Arrhenius equation 16阿累尼乌斯活化能Arrhenius activation energy 16阿马格定律Amagat law 16艾林方程Erying equation 16爱因斯坦光化当量定律Einstein’s law of photochemical equivalence17 爱因斯坦-斯托克斯方程Einstein-Stokes equation 17安托万常数Antoine constant 17安托万方程Antoine equation 17盎萨格电导理论Onsager’s theory of conductance17半电池half cell 17半衰期half time period 17饱和液体saturated liquids 17饱和蒸气saturated vapor 17饱和吸附量saturated extent of adsorption 17饱和蒸气压saturated vapor pressure 17爆炸界限explosion limits 17比表面功specific surface work 17比表面吉布斯函数specific surface Gibbs function 17比浓粘度reduced viscosity 17标准电动势standard electromotive force 18标准电极电势standard electrode potential 18标准摩尔反应焓standard molar reaction enthalpy 18标准摩尔反应吉布斯函数standard Gibbs function of molar reaction 18 标准摩尔反应熵standard molar reaction entropy 18标准摩尔焓函数standard molar enthalpy function 18标准摩尔吉布斯自由能函数standard molar Gibbs free energy function 18 标准摩尔燃烧焓standard molar combustion enthalpy 18标准摩尔熵standard molar entropy 18标准摩尔生成焓standard molar formation enthalpy 18标准摩尔生成吉布斯函数standard molar formation Gibbs function 18 标准平衡常数standard equilibrium constant 19标准氢电极standard hydrogen electrode 19标准态standard state 19标准熵standard entropy 19标准压力standard pressure 19标准状况standard condition 19表观活化能apparent activation energy 19表观摩尔质量apparent molecular weight 19表观迁移数apparent transference number 20表面surfaces 20表面过程控制surface process control 20表面活性剂surfactants 20表面吸附量surface excess 20表面张力surface tension 20表面质量作用定律surface mass action law 20波义尔定律Boyle law 20波义尔温度Boyle temperature 20波义尔点Boyle point 21玻尔兹曼常数Boltzmann constant 21玻尔兹曼分布Boltzmann distribution 21玻尔兹曼公式Boltzmann formula 21玻尔兹曼熵定理Boltzmann entropy theorem 21泊Poise 21不可逆过程irreversible process 21不可逆过程热力学thermodynamics of irreversible processes 21 不可逆相变化irreversible phase change 21布朗运动brownian movement 21查理定律Charle’s law22产率yield 22敞开系统open system 22超电势over potential 22沉降sedimentation 22沉降电势sedimentation potential 22沉降平衡sedimentation equilibrium 22触变thixotropy 22粗分散系统thick disperse system 22催化剂catalyst 22单分子层吸附理论mono molecule layer adsorption 22单分子反应unimolecular reaction 22单链反应straight chain reactions 23弹式量热计bomb calorimeter 23道尔顿定律Dalton law 23道尔顿分压定律Dalton partial pressure law 23德拜和法尔肯哈根效应Debye and Falkenhagen effect 23德拜立方公式Debye cubic formula 23德拜-休克尔极限公式Debye-Huckel’s limiting equation23 等焓过程isenthalpic process 23等焓线isenthalpic line 23等几率定理theorem of equal probability 23等温等容位Helmholtz free energy 23等温等压位Gibbs free energy 23等温方程equation at constant temperature 23低共熔点eutectic point 24低共熔混合物eutectic mixture 24低会溶点lower consolute point 24低熔冰盐合晶cryohydric 24第二类永动机perpetual machine of the second kind 25第三定律熵Third-Law entropy 25第一类永动机perpetual machine of the first kind 25缔合化学吸附association chemical adsorption 25电池常数cell constant 25电池电动势electromotive force of cells 25电池反应cell reaction 25电导conductance25电导率conductivity 25电动势的温度系数temperature coefficient of electromotive force 26 电动电势zeta potential 26电功electric work 26电化学electrochemistry 26电化学极化electrochemical polarization 26电极电势electrode potential 26电极反应reactions on the electrode 26电极种类type of electrodes 26电解池electrolytic cell 26电量计coulometer 26电流效率current efficiency 26电迁移electro migration 27电迁移率electromobility 27电渗electroosmosis 27电渗析electrodialysis 27电泳electrophoresis 27丁达尔效应Dyndall effect 27定容摩尔热容molar heat capacity under constant volume 27定容温度计Constant voIume thermometer 27定压摩尔热容molar heat capacity under constant pressure 27定压温度计constant pressure thermometer 27定域子系统localized particle system 27动力学方程kinetic equations 27动力学控制kinetics control 27独立子系统independent particle system 28对比摩尔体积reduced mole volume 28对比体积reduced volume 28对比温度reduced temperature 28对比压力reduced pressure 28对称数symmetry number 28对行反应reversible reactions 28对应状态原理principle of corresponding state 28多方过程polytropic process 28多分子层吸附理论adsorption theory of multi-molecular layers 28 二级反应second order reaction 28二级相变second order phase change 29法拉第常数faraday constant 29法拉第定律Faraday’s law29反电动势back E.M.F. 29反渗透reverse osmosis 29反应分子数molecularity 29反应级数reaction orders 30反应进度extent of reaction30反应热heat of reaction 30反应速率rate of reaction 30反应速率常数constant of reaction rate 30范德华常数van der Waals constant 30范德华方程van der Waals equation 30范德华力van der Waals force 30范德华气体van der Waals gases 30范特霍夫方程van’t Hoff equation30范特霍夫规则van’t Hoff rule31范特霍夫渗透压公式van’t Hoff equation of osmotic pressure31非基元反应non-elementary reactions 31非体积功non-volume work 31非依时计量学反应time independent stoichiometric reactions 31菲克扩散第一定律Fick’s first law of diffusion31沸点boiling point 31沸点升高elevation of boiling point 31费米-狄拉克统计Fermi-Dirac statistics 31分布distribution 31分布数distribution numbers 31分解电压decomposition voltage 32分配定律distribution law 32分散系统disperse system 32分散相dispersion phase 32分体积partial volume 32分体积定律partial volume law 32分压partial pressure 32分压定律partial pressure law 32分子反应力学mechanics of molecular reactions 32分子间力intermolecular force 32分子蒸馏molecular distillation 32封闭系统closed system 32附加压力excess pressure 32弗罗因德利希吸附经验式Freundlich empirical formula of adsorption 32 负极negative pole 33负吸附negative adsorption 33复合反应composite reaction 33盖·吕萨克定律Gay-Lussac law 33盖斯定律Hess law 33甘汞电极calomel electrode 33感胶离子序lyotropic series 33杠杆规则lever rule 33高分子溶液macromolecular solution 34高会溶点upper consolute point 34隔离法the isolation method 34格罗塞斯-德雷珀定律Grotthus-Draoer’s law34隔离系统isolated system 34根均方速率root-mean-square speed 34功work 35功函work content 35共轭溶液conjugate solution 35共沸温度azeotropic temperature 35构型熵configurational entropy 35孤立系统isolated system 35固溶胶solid sol 35固态混合物solid solution 35固相线solid phase line 35光反应photoreaction 35光化学第二定律the second law of actinochemistry 35光化学第一定律the first law of actinochemistry 36光敏反应photosensitized reactions 36光谱熵spectrum entropy 36广度性质extensive property 36广延量extensive quantity 36广延性质extensive property 36规定熵stipulated entropy 36过饱和溶液oversaturated solution 36过饱和蒸气oversaturated vapor 36过程process36过渡状态理论transition state theory 36过冷水super-cooled water 36过冷液体overcooled liquid 36过热液体overheated liquid 36亥姆霍兹函数Helmholtz function 36亥姆霍兹函数判据Helmholtz function criterion 37亥姆霍兹自由能Helmholtz free energy 37亥氏函数Helmholtz function 37焓enthalpy 37亨利常数Henry constant 37亨利定律Henry law 37恒沸混合物constant boiling mixture 37恒容摩尔热容molar heat capacity at constant volume 37恒容热heat at constant volume 38恒外压constant external pressure 38恒压摩尔热容molar heat capacity at constant pressure 38恒压热heat at constant pressure 38化学动力学chemical kinetics 38化学反应计量式stoichiometric equation of chemical reaction 38化学反应计量系数stoichiometric coefficient of chemical reaction 38 化学反应进度extent of chemical reaction 38化学亲合势chemical affinity 38化学热力学chemical thermodynamics 38化学势chemical potential 38化学势判据chemical potential criterion 38化学吸附chemisorptions 39环境environment 39环境熵变entropy change in environment 39挥发度volatility 39混合熵entropy of mixing 39混合物mixture 39活度activity39活化控制activation control 40活化络合物理论activated complex theory 40活化能activation energy 40霍根-华森图Hougen-Watson Chart 40基态能级energy level at ground state 40基希霍夫公式Kirchhoff formula 40基元反应elementary reactions 40积分溶解热integration heat of dissolution 40吉布斯-杜亥姆方程Gibbs-Duhem equation 40吉布斯-亥姆霍兹方程Gibbs-Helmhotz equation 41吉布斯函数Gibbs function 41吉布斯函数判据Gibbs function criterion 41吉布斯吸附公式Gibbs adsorption formula 41吉布斯自由能Gibbs free energy 41吉氏函数Gibbs function 41极化电极电势polarization potential of electrode 41极化曲线polarization curves 41极化作用polarization 41极限摩尔电导率limiting molar conductivity 41几率因子steric factor 41计量式stoichiometric equation 42计量系数stoichiometric coefficient 42价数规则rule of valence 42简并度degeneracy 42键焓bond enthalpy 42胶冻broth jelly 42胶核colloidal nucleus 42胶凝作用demulsification 42胶束micelle 42胶体colloid 42胶体分散系统dispersion system of colloid 42胶体化学collochemistry 42胶体粒子colloidal particles 42胶团micelle 42焦耳Joule 42焦耳-汤姆生实验Joule-Thomson experiment 43焦耳-汤姆生系数Joule-Thomson coefficient 43焦耳-汤姆生效应Joule-Thomson effect 43焦耳定律Joule's law 43接触电势contact potential 43接触角contact angle 43节流过程throttling process 43节流膨胀throttling expansion 43节流膨胀系数coefficient of throttling expansion 43 结线tie line 43结晶热heat of crystallization 44解离化学吸附dissociation chemical adsorption 44 界面interfaces 44界面张力surface tension 44浸湿immersion wetting 44浸湿功immersion wetting work 44精馏rectify 44聚(合)电解质polyelectrolyte44聚沉coagulation 44聚沉值coagulation value 44绝对反应速率理论absolute reaction rate theory 44 绝对熵absolute entropy 44绝对温标absolute temperature scale 44绝热过程adiabatic process 45绝热量热计adiabatic calorimeter 45绝热指数adiabatic index 45卡诺定理Carnot theorem 45卡诺循环Carnot cycle 45开尔文公式Kelvin formula 45柯诺瓦洛夫-吉布斯定律Konovalov-Gibbs law 45科尔劳施离子独立运动定律Kohlrausch’s Law of Independent Migration of Ions45 可能的电解质potential electrolyte 45可逆电池reversible cell 45可逆过程reversible process 45可逆过程方程reversible process equation 45可逆体积功reversible volume work 46可逆相变reversible phase change 46克拉佩龙方程Clapeyron equation 46克劳修斯不等式Clausius inequality 46克劳修斯-克拉佩龙方程Clausius-Clapeyron equation 46控制步骤control step 46库仑计coulometer 46扩散控制diffusion controlled 46拉普拉斯方程Laplace’s equation46拉乌尔定律Raoult law 46兰格缪尔-欣谢尔伍德机理Langmuir-Hinshelwood mechanism 46雷利公式Rayleigh equation 47兰格缪尔吸附等温式Langmuir adsorption isotherm formula 47冷冻系数coefficient of refrigeration 47冷却曲线cooling curve 47离解热heat of dissociation 47离解压力dissociation pressure 47离域子系统non-localized particle systems 47离子的标准摩尔生成焓standard molar formation of ion 47离子的电迁移率mobility of ions 47离子的迁移数transport number of ions 48离子独立运动定律law of the independent migration of ions 48离子氛ionic atmosphere 48离子强度ionic strength 48理想混合物perfect mixture 48理想气体ideal gas 48理想气体的绝热指数adiabatic index of ideal gases 48理想气体的微观模型micro-model of ideal gas 48理想气体反应的等温方程isothermal equation of ideal gaseous reactions 48理想气体绝热可逆过程方程adiabatic reversible process equation of ideal gases 48 理想气体状态方程state equation of ideal gas 48理想稀溶液ideal dilute solution 48理想液态混合物perfect liquid mixture 49粒子particles 49粒子的配分函数partition function of particles 49连串反应consecutive reactions 49链的传递物chain carrier 49链反应chain reactions 49量热熵calorimetric entropy 49量子统计quantum statistics 49量子效率quantum yield 49临界参数critical parameter 50临界常数critical constant 50临界点critical point 50临界胶束浓度critical micelle concentration 50临界摩尔体积critical molar volume 50临界温度critical temperature 50临界压力critical pressure 50临界状态critical state 50零级反应zero order reaction 50流动电势streaming potential 50流动功flow work 50笼罩效应cage effect 50路易斯-兰德尔逸度规则Lewis-Randall rule of fugacity 50 露点dew point 50露点线dew point line 50麦克斯韦关系式Maxwell relations 51麦克斯韦速率分布Maxwell distribution of speeds 51麦克斯韦能量分布MaxwelIdistribution of energy 51毛细管凝结condensation in capillary 51毛细现象capillary phenomena 51米凯利斯常数Michaelis constant 51摩尔电导率molar conductivity 51摩尔反应焓molar reaction enthalpy 52摩尔混合熵mole entropy of mixing 52摩尔气体常数molar gas constant 52摩尔热容molar heat capacity 52摩尔溶解焓mole dissolution enthalpy 52摩尔稀释焓mole dilution enthalpy 52内扩散控制internal diffusions control 52内能internal energy 52内压力internal pressure 52能级energy levels 52能级分布energy level distribution 52能量均分原理principle of the equipartition of energy 52能斯特方程Nernst equation 53能斯特热定理Nernst heat theorem 53凝固点freezing point 53凝固点降低lowering of freezing point 53凝固点曲线freezing point curve 53凝胶gelatin 53凝聚态condensed state 54凝聚相condensed phase 54浓差超电势concentration over-potential 54浓差极化concentration polarization 54浓差电池concentration cells 54帕斯卡pascal 54泡点bubble point 54泡点线bubble point line 54配分函数partition function 54配分函数的析因子性质property that partition function to be expressed as a product of the separate partition functions for each kind of state 54碰撞截面collision cross section 54碰撞数the number of collisions 54偏摩尔量partial mole quantities 54平衡常数(理想气体反应)equilibrium constants for reactions of ideal gases 55平动配分函数partition function of translation 55平衡分布equilibrium distribution 55平衡态equilibrium state 55平衡态近似法equilibrium state approximation 55平衡状态图equilibrium state diagram 56平均活度mean activity 56平均活度系统mean activity coefficient 56平均摩尔热容mean molar heat capacity 56平均质量摩尔浓度mean mass molarity 56平均自由程mean free path 56平行反应parallel reactions 56破乳demulsification 56铺展spreading 56普遍化范德华方程universal van der Waals equation 56其它功the other work 57气化热heat of vaporization57气溶胶aerosol 57气体常数gas constant 57气体分子运动论kinetic theory of gases 57气体分子运动论的基本方程foundamental equation of kinetic theory of gases 57气溶胶aerosol 57气相线vapor line 57迁移数transport number 57潜热latent heat 57强度量intensive quantity 57强度性质intensive property 57亲液溶胶hydrophilic sol 58氢电极hydrogen electrodes 58区域熔化zone melting 58热heat 58热爆炸heat explosion 58热泵heat pump 58热功当量mechanical equivalent of heat 58热函heat content 58热化学thermochemistry 58热化学方程thermochemical equation 58热机heat engine 58热机效率efficiency of heat engine 58热力学thermodynamics 58热力学第二定律the second law of thermodynamics 59热力学第三定律the third law of thermodynamics 59热力学第一定律the first law of thermodynamics 59热力学基本方程fundamental equation of thermodynamics 59 热力学几率thermodynamic probability 59热力学能thermodynamic energy 59热力学特性函数characteristic thermodynamic function 59热力学温标thermodynamic scale of temperature 59热力学温度thermodynamic temperature 59热熵thermal entropy 59热效应heat effect 59熔点曲线melting point curve 60熔化热heat of fusion 60溶胶colloidal sol 60溶解焓dissolution enthalpy 60溶液solution 60溶胀swelling 60乳化剂emulsifier 60乳状液emulsion 60润湿wetting60润湿角wetting angle 60萨克尔-泰特洛德方程Sackur-Tetrode equation 61三相点triple point 61三相平衡线triple-phase line 61熵entropy 61熵判据entropy criterion 61熵增原理principle of entropy increase 61渗透压osmotic pressure 62渗析法dialytic process 62生成反应formation reaction 62升华热heat of sublimation 62实际气体real gas 62舒尔采-哈迪规则Schulze-Hardy rule 62松驰力relaxation force 62松驰时间time of relaxation 62速度常数reaction rate constant 62速率方程rate equations 63速率控制步骤rate determining step 63塔费尔公式Tafel equation 63态-态反应state-state reactions 63唐南平衡Donnan equilibrium 63淌度mobility 63特鲁顿规则Trouton rule 63特性粘度intrinsic viscosity 63体积功volume work 63统计权重statistical weight 63统计热力学statistic thermodynamics 63统计熵statistic entropy 63途径path 64途径函数path function 64外扩散控制external diffusion control 64完美晶体perfect crystalline 64完全气体perfect gas 64微观状态microstate 64微态microstate 64韦斯顿标准电池Weston standard battery 64维恩效应Wien effect 64维里方程virial equation 64维里系数virial coefficient 64稳流过程steady flow process 64稳态近似法stationary state approximation 64无热溶液athermal solution 64无限稀溶液solutions in the limit of extreme dilution 65 物理化学Physical Chemistry 65物理吸附physisorptions 65吸附adsorption 65吸附等量线adsorption isostere 65吸附等温线adsorption isotherm 65吸附等压线adsorption isobar 65吸附剂adsorbent 65吸附量extent of adsorption65吸附热heat of adsorption 65吸附质adsorbate 65析出电势evolution or deposition potential 65稀溶液的依数性colligative properties of dilute solutions 66稀释焓dilution enthalpy 66系统system 66系统点system point 66系统的环境environment of system 66相phase 66相变phase change 66相变焓enthalpy of phase change 66相变化phase change 66相变热heat of phase change 66相点phase point 66相对挥发度relative volatility 67相对粘度relative viscosity 67相律phase rule 67相平衡热容heat capacity in phase equilibrium 67相图phase diagram 67相倚子系统system of dependent particles 67悬浮液suspension 67循环过程cyclic process 67压力商pressure quotient 67压缩因子compressibility factor 67压缩因子图diagram of compressibility factor 67亚稳状态metastable state 67盐桥salt bridge 67盐析salting out 68阳极anode 68杨氏方程Young’s equation68液体接界电势liquid junction potential 68液相线liquid phase lines 68一级反应first order reaction 68一级相变first order phase change 68依时计量学反应time dependent stoichiometric reactions 68 逸度fugacity 68逸度系数coefficient of fugacity 69阴极cathode 69荧光fluorescence 69永动机perpetual motion machine 69永久气体Permanent gas 69有效能available energy 69原电池primary cell 69原盐效应salt effect 69增比粘度specific viscosity 70憎液溶胶lyophobic sol 70沾湿adhesional wetting 70沾湿功the work of adhesional wetting 70真溶液true solution 70真实电解质real electrolyte 70真实气体real gas 70真实迁移数true transference number70振动配分函数partition function of vibration 70振动特征温度characteristic temperature of vibration 70 蒸气压下降depression of vapor pressure 70正常沸点normal point 70正吸附positive adsorption 71支链反应branched chain reactions 71直链反应straight chain reactions 71指前因子pre-exponential factor 71质量作用定律mass action law 71制冷系数coefficient of refrigeration 71中和热heat of neutralization 71轴功shaft work 71转动配分函数partition function of rotation 71转动特征温度characteristic temperature of vibration 72 转化率convert ratio 72转化温度conversion temperature 72状态state 72状态方程state equation 72状态分布state distribution 72状态函数state function 72准静态过程quasi-static process 72准一级反应pseudo first order reaction 72自动催化作用auto-catalysis 72自由度degree of freedom 72自由度数number of degree of freedom 72自由焓free enthalpy 73自由能free energy 73自由膨胀free expansion 73组分数component number 73最低恒沸点lower azeotropic point 73最高恒沸点upper azeotropic point 73最佳反应温度optimal reaction temperature 73最可几分布most probable distribution 73最可几速率most propable speed 73练习题74第一章气体的PVT性质74选择题74问答题74第二章热力学第一定律75选择题76问答题82第三章热力学第二定律85选择题85问答题92第四章多组分系统热力学94选择题94问答题98第五章化学平衡100选择题100问答题104第六章相平衡104选择题104问答题110第七章电化学112选择题112问答题118第八章统计热力学119选择题119第九章表面现象125选择题125问答题129第十章化学动力学130选择题130第十一章胶体化学134选择题135第三部分模拟题145前言本书分为两大部分,第一部分为物理化学中的概念及术语。



-m2 V 1 .线温等为CG线 虚 中图’hu la-'P Lw h -G R 俨l i l --L rn Ef $4过Ch !-OL W ’r E’1程 判是Md 川热吸 口玉 咄L 还’过 体- 线热气 ,肉强 吸 阳山 l 姥 色 刷 拙J :i线 柑川 机川川执…M热勾 虚 两 这 断 · 队 放 但 吸 F F 吸 程中 惆 热程 程 放 叩2阳-1 .860华南理工大学2018 年攻读硕士学位研究生入学考试试卷( 试卷上做答无效 ,请在答题纸上做答 ,试后本卷必须与答题纸一同交回〉 。
d科目名称 :普通物理(含力 、热、电、光学) 适用专业 :理论物理:凝聚态物理 :声学:光学;材料科学与工程 :物理电子学 :共 f 页 。
;7' v材料工程(专硕)一、选择题 (共 48 分,每题 4 分〉l 、几个不同倾角的光滑斜面 ,有共同的底边 ,顶点也在同一坚直面上 .若使一物倒( 视为质点) 从斜面上端由静止滑到下端的时间最短 ,则斜面的倾角应选(A) 60。
. (B) 45° . (C) 30。
.(D) 15。
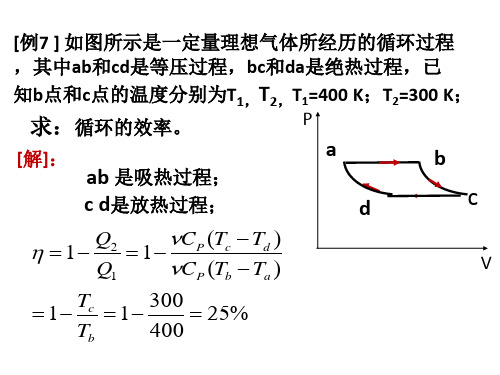
.[]2、某物体的运动规律为 d v / d t = -k v 勺 ,式中的 k 为大于零的常量 .当t = O 时,初速为 Vo ,则速度 U 与时间 t 的函数关系是(D) abc 过程和 def 过程都放热. []6、一定量的理想气体经历 二cb 过程时吸热500 J. 则经历 cbda 过程时 ,吸热为(A ) 马200 J. (B ) 一700 J.p (×105 Pa)(A) v=kt 2 叫(C) -400 J .(D) 700 J.。
V ( 10-3 m3)1 kt2 1(C) 一=--::-- +一’ , U 二L Vo3、一质量为 m 的质点,在半径为 R 的半球形容器中 ,由静止开始自边缘上的 A 点滑 下,到达最低点 B 时,它对容器的正压力为N. 则质点自 A℃!57[ ]47、一铜板厚度为 D= l .OO mm ,放罩在磁感强度为 B= 1.35 T 的匀强磁场中,磁场方|向垂直于导体的侧表面 ,如图所示 ,现测得铜板上下两面电势差为 V=1.10×10 5 v ,己B 知铜板中自 由电子数密度 n =4.20 ×102s m 3, 滑到 B 的过程中,摩擦力对其作的功为A(A) 护(N 训 电子电荷 e=l.60 ×10-19 c,则此铜板中的电 歹争叶阳一mg ) .(D)i R( N 切)[]8、如图所示 .一电荷为 q 的点电荷,以匀角速度ω作圆周 运动 ,圆周的半径为 R. 设 t = O 时 q 所在点的坐标为 xo = R , 4、如图,两木块质量为 m1 和 叫,由一轻弹簧连接,放在光滑水平桌面上 ,先使网木块靠近而将弹簧压紧 ,然后由静止释放 .若在弹簧伸长到原长时,m1 的速率为 V1,则弹簧原来在压缩状态时所具有的势能是o = O ,以T , ] 分别表示 x 轴和 y 轴上的单位矢景 ,则圆心处 点的位移电流密度为 :1 m1 + m2 2总 二点点达-2.口._L 二sm w t Iqw『x(i )(A) 一m 1V12(B) (A)(B)一一一τcos mt J2 m1 4 π R 24πRqw -qw-1 m1 + m2 z(C)一一k(D)一 丁(sin wti - c os mtj) (C)三(m1 + m2 ) V 1 .(D ) -m1V 1 . 4πR 22 m24πR第页第 2 页\Y i u )-E Er 饨A ~「, D G的一市民川r E F图nu 品UF 历经。