实验二考马斯亮蓝G-250染 料结合法测定蛋白质含量
- 格式:pdf
- 大小:356.16 KB
- 文档页数:12

实验二考马斯亮蓝法(Bradford法)测定蛋白质含量一、目的与要求1. 掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法2. 熟练分光光度计的使用和操作方法。
二、实验原理考马斯亮蓝G250测定蛋白质含量属于染料结合法的一种,它与蛋白质的疏水微区相结合,这种结合具有高敏感性。
它在酸性溶液中呈棕红色,最大光吸收峰在465nm,当它与蛋白质结合形成复合物时,其最大吸收峰改变为595nm。
考马斯亮蓝G-250—蛋白质复合物呈蓝色,在一定范围内,595nm下光密度与蛋白质含量呈线性关系,故可以用于蛋白质含量的测定。
考马斯亮蓝结合法是近年来发展起来的蛋白质定量测定法,本方法具有操作方便、快速、干扰因素少的特点。
附:(一)、分光光度法原理:光的吸收定律(朗伯-比尔定律):一束单色光(强度为I0)通过某吸光物质的溶液时,其光能量的被吸收与该物质浓度的关系符合朗伯—比尔定律即当入射光波长、温度和溶液的厚度一定时,吸光度与溶液的浓度成正比。
用公式表示为:T = I/I0则A = lg(1/T)=Kbc式中T —透光率I —透过光强度I0—入射光强度 A —吸光度K —比例常数 b —溶液的厚度 c —溶液的浓度(二)、离心机的使用说明:1.要离心的离心管和管套要称重,重量不等时将水加在管套里。
2.离心管的放置是对角线放置,要求必须对称。
3. 先将离心机转速旋钮恢复到零刻度后,再定时间,定好时间后缓慢旋转转速旋钮,使离心机均匀的提速到预定转速。
(三)、分光光度计的使用说明:1.接通电源开关,预热20min后,再选择须用的单色光波长。
2.放入已加入溶液的比色皿,盖上样品室盖,推动试样架拉手,使对照比色皿(溶液装入4/5高度,置第一格)置于光路上,调节100%透射比按钮,使吸光度值A=0.00。
3.推动试样架拉手,使样品比色皿置于光路上,读出吸光度值。
4.测量完毕,取出比色皿,洗净后置于乙醇溶液中浸泡脱色。
5.电源开关置于“关”,拔下电源插头。

考马斯亮蓝法测蛋白质含量一、原理考马斯亮蓝G-250(Coomassie G-250)是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在465nm处有最大吸收值。
考马斯亮蓝G-250能与蛋白质通过范得华相互作用形成蛋白质—考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收λmax的位置发生红移,在595nm处有最大吸收值。
由于蛋白质—考马斯亮蓝复合物在595nm处的光吸收远高于考马斯亮蓝在465nm处的光吸收,因此,可大大地提高蛋白质的测定灵敏度。
蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。
利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析,尤其适合于稀有蛋白质的微量分析。
考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在1ug左右。
二、操作步骤1. 标准曲线测定法分别取六只试管,其中一只加入 1.0ml蒸馏水做空白,5只分别加入不同体积的浓度为100ug/ml牛血清清蛋白标准液,补充水到1.0ml。
然后每只试管加入5.0ml考马斯亮蓝G-250试剂,摇匀放置5min,在紫外-可见分光光度计595nm处测定吸光值。
以A595吸光值为纵坐标,牛血清清蛋白的ug数量为横坐标绘制标准曲线。
具体操作见下表。
蛋白质标准曲线测定加样试剂空白1 2 3 4 5100ug/ml牛血清清蛋白/ml 1.0 0.1 0.2 0.4 0.6 0.8牛血清清蛋白/ug 0 10 20 40 60 80去离子水/ml 0 0.9 0.8 0.6 0.4 0.2考马斯亮蓝G-250试剂/ml 5.0 5.0 5.0 5.0 5.0 5.0吸光值A5952. 蛋白样品配制浓度约100ug/ml的待测蛋白质溶液。
取一只试管加入1.0ml蒸馏水做空白,一支加入0.5ml待测蛋白质溶液,补充水到1.0ml。
然后每支试管加入5.0ml考马斯亮蓝G-250试剂,摇匀放置5min后,在紫外-可见分光光度计595nm处测定吸光值。

实验六蛋白质含量测定(考马斯亮蓝G-250法)一、目的蛋白质是细胞中最重要的含氮生物大分子之一,承担着各种生物功能。
蛋白质的定量分析是蛋白质构造分析的基础,也是农牧产品品质分析、食品营养价值比较、生化育种、临床诊断等的重要手段。
根据蛋白质的理化性质,提出多种蛋白质定量方法。
考马斯亮蓝G -250法是比色法与色素法相结合的复合方法,简便快捷,灵敏度高,稳定性好,是一种较好的常用方法。
通过本实验学习考马斯亮蓝G-250法测定蛋白质含量的原理,了解分光光度计的结构、原理和在比色法中的应用。
二、原理考马斯亮蓝G-250是一种染料,在游离状态下呈红色,当它与蛋白质结合后变为青色。
蛋白质含量在0~1000μg范围内,蛋白质一色素结合物在595nm下的吸光度与蛋白质含量成正比,故可用比色法测定。
三、仪器、试剂和材料1.仪器(1)分析天平(2)具塞刻度试管10ml×8(3)吸管0.lml×I,lml×Z,5ml×I(4)研钵(5)漏斗(6)离心管10ml(7)容量瓶10ml(8)离心机(9)721型分光光度计2.试剂(1)标准蛋白质溶液称取10mg牛血清白蛋白,溶于蒸馏水并定容至100ml,制成100 pg/ml的原液。
(2)考马斯亮蓝G-250蛋白试剂称取100mg考马斯亮蓝G-250,溶于50ml 90%乙醇中,加入85%(m/v)的磷酸100ml,最后用蒸馏水定容到1000ml。
此溶液在常温下可放置一个月。
3.材料绿豆芽四、操作步骤1盖上塞子,摇匀。
放置2min后在595 nm波长下比色测定(比色应在l h内完成)。
以牛血清白蛋白含量(μg)为横坐标,以吸光度为纵坐标,绘出标准曲线。
2.样品中蛋白质含量的测定(1)准确称取约200mg绿豆芽下胚轴,放入研钵中,加入5ml蒸馏水在冰浴中研成匀浆,离心(4000r/min,10min),将上清液倒入10ml容量瓶,再向残渣中加入2ml蒸馏水,悬浮后再离心10min,合并上清液,定客至刻度。


蛋白质含量测定(考马斯亮蓝G-250法)一、目的考马斯亮蓝(Coomassie brilliant blue) G-250法是比色法与色素法相结合的复合方法,由Bradford于1976年建立,具有简便快捷,灵敏度高,稳定性好等特点,是一种较好的蛋白质定量测定常用方法。
通过本实验学习应用该法测定蛋白质含量的原理,复习分光光度计的使用及标准曲线的绘制等基本实验技能。
二、原理考马斯亮蓝G-250是一种染料,游离态呈红色,与蛋白质结合后转变为青色。
在0~1000μg 范围内,蛋白质-色素结合物在595 nm下的吸光度与蛋白质含量正相关,可用比色法测定。
三、仪器、试剂和材料1.仪器设备:(具塞刻度)试管吸管分光光度计2.试剂(1) 标准蛋白质溶液称取100 mg牛血清白蛋白,溶于蒸馏水并定容至100 ml,制成 1 mg/ml溶液。
(2) 考马斯亮蓝G-250蛋白试剂称取100 mg考马斯亮蓝G-250,溶于50 ml 95%乙醇中,加入85% (m/v)的磷酸100ml,最后用蒸馏水定容到1000 ml (此溶液在常温下可放置一个月)。
(3) 样品蛋白液(10~100 μg/ml)四、操作步骤1标准蛋白质含量(μg)为横坐标、吸光度为纵坐标,绘出标准曲线。
2.样品中蛋白质含量的测定取2支(具塞)试管,分别准确加入0.l ml样品蛋白液,再各加5 ml考马斯亮蓝G-50试剂,充分混合,放置2min后,以标准曲线0号试管做参比,在595 nm波长下比色,记录吸光度。
五、结果处理根据所测样品提取液的平均吸光度,在标准曲线上查得相应的蛋白质含量(μg/ml)六、思考题1.考马斯亮蓝G-250法测定蛋白质含量的原理是什么?还有哪些蛋白质定量法?2.如何正确使用分光光度计?。
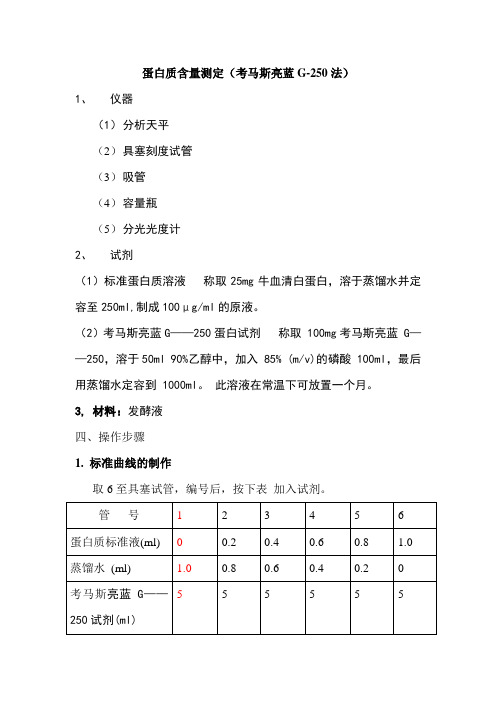
蛋白质含量测定(考马斯亮蓝G-250法)
1、仪器
(1)分析天平
(2)具塞刻度试管
(3)吸管
(4)容量瓶
(5)分光光度计
2、试剂
(1)标准蛋白质溶液称取25mg牛血清白蛋白,溶于蒸馏水并定容至250ml,制成100μg/ml的原液。
(2)考马斯亮蓝G——250蛋白试剂称取 100mg考马斯亮蓝 G——250,溶于50ml 90%乙醇中,加入 85% (m/v)的磷酸 100ml,最后用蒸馏水定容到 1000ml。
此溶液在常温下可放置一个月。
3, 材料:发酵液
四、操作步骤
1. 标准曲线的制作
取6至具塞试管,编号后,按下表加入试剂。
盖上塞子,摇匀。
放置2min后在595nm波长下比色测定(比色应在1h内完成)。
以牛血清白蛋白含量(μg/ml)为横坐标,以吸光度为纵坐标,绘出标准曲线。
标准曲线的相关系数≥0.99。
样品检测;
标准(空白):2 ml纯化水+10 ml考马斯亮蓝
样品:2 ml(根据样品中的蛋白含量稀释,使其吸收度在0.3-0.7即可)10 ml考马斯亮蓝,用分光光度计进行检测。


用考马斯亮蓝G250法测定蛋白质含量呵呵你的自己检查一下你的仪器蛋白质浓度的测定(四)??考马斯亮蓝染色法目的要求学习考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋白质浓度的原理和方法。
实验原理考马斯亮蓝法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
考马斯亮蓝G―250存在着两种不同的颜色形式,红色和蓝色。
它和蛋白质通过范德华力结合,在一定蛋白质浓度范围内,蛋白质和染料结合符合比尔定律(Beer’s law)。
此染料与蛋白质结合后颜色有红色形式和蓝色形式,最大光吸收由465nm变成595nm,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。
蛋白质和染料结合是一个很快的过程,约2min即可反应完全,呈现最大光吸收,并可稳定1h,之后,蛋白质―染料复合物发生聚合并沉淀出来。
蛋白质―染料复合物具有很高的消光系数,使得在测定蛋白质浓度时灵敏度很高,在测定溶液中含蛋白质5µL/ml时就有0.275光吸收值的变化,比Lowry法灵敏4倍,测定范围为10,100µg蛋白质,微量测定法测定范围是1,10µg蛋白质。
此反应重复性好,精确度高,线性关系好。
标准曲线在蛋白质浓度较大时稍有弯曲,这是由于染料本身的两种颜色形式光谱有重叠,试剂背景值随更多染料与蛋白质结合而不断降低,但直线弯曲程度很轻,不影响测定。
此方法干扰物少,研究表明:NaCl,KCl,MgCl2,乙醇,(NH4)2SO4无干扰。
强碱缓冲液在测定中有一些颜色干扰,这可以用适当的缓冲液对照扣除其影响。
Tris,乙酸,2―巯基乙醇,蔗糖,甘油,EDTA及微量的去污剂如TritonX―100,SDS,玻璃去污剂有少量颜色干扰,用适当的缓冲液对照很容易除掉。
但是,大量去污剂的存在对颜色影响太大而不易消除。
试剂与器材一、试剂考马斯亮蓝试剂:考马斯亮蓝G―250 100mg溶于50ml95%乙醇中,加入100ml85%磷酸,用蒸馏水稀释至1000ml,滤纸过滤。

实验二 染料结合法测定蛋白质含量一、目的要求学习用染料结合比色法测定蛋白质含量的原理和方法;了解染料结合比色法测定蛋白质含量的优缺点。
二、实验原理植物体内常含有许多酚类物质和游离氨基酸,这些物质能与Folin-酚试剂产生颜色反应,这使得测定值会高于实际含量。
1976年,Bradford 根据蛋白质与染料相结合的原理建立了考马斯亮蓝染色法测定生物体内的蛋白质含量。
此法简单快捷,且不受游离氨基酸和酚类物质的影响,适合于大量样品的分析。
考马斯亮蓝G-250(CBG)在酸性溶液中呈茶棕色,在465nm 有最大吸收峰。
当与蛋白质结合后,其转变成深蓝色,吸收峰移至595nm 。
在一定蛋白质浓度范围内,蛋白质浓度与吸光度成正比,可做定量分析。
三、材料、器材与试剂 〈1〉材料植物可溶性蛋白提取液 〈2〉器材与双缩脲反应相同 〈3〉试剂(1)CBG 试剂:称取100mgCBG 溶于50ml 95%乙醇,加蒸馏水约800ml ,加100ml 85%正磷酸,最后加蒸馏水至1000ml 。
(2)蛋白质标准溶液母液:称取0.1g 牛血清蛋白(BSA)溶于100ml 0.15mol/L NaCl 溶液,配成浓度为1000μg/ml 的母液。
标准液:取母液10ml ,溶于90ml 0.15mol/L NaCl 溶液中,配成浓度为100μg/ml 的标准液。
(3)0.15mol/L NaCl 溶液:称取0.87gNaCl ,溶于蒸馏水中,稀释至100ml 。
四、实验步骤〈1〉取6支试管,按表加入试剂。
染料(CBG)结合法测蛋白质含量的标准曲线012345BSA标准液0.00.20.40.60.8 1.00.15mol/L NaCl溶液1.00.80.60.40.20.0CBG5.0 5.0 5.0 5.0 5.0 5.0每管标准蛋白质含量/μg020*********A5950.0160.2250.0500.0880.164试剂/ml试管加完试剂后,混匀,室温静置3min ,以0号管为空白,在595nm 处比色,读取各管吸光度,作光吸收值-蛋白质浓度标准曲线。

考马斯亮蓝G-250法测定蛋白质含量专业班级:制药工程3班小组成员:梦娴敏林晓丝一、实验目的1、了解考马斯亮蓝法测定蛋白质的原理2、掌握考马斯亮蓝法测定蛋白质含量的操作步骤二、实验原理1、根据蛋白质的理化性质,有多种蛋白质定量方法。
考马斯亮蓝G-250是比色法与色素法相结合的复合方法。
考马斯亮蓝G-250是一种染料,在游离状态下呈棕红色,当与蛋白质结合后呈青蓝色。
在一定围,也就是蛋白质含量在0~1000ug围,蛋白质-色素结合物在595nm 下的吸光度与蛋白质含量成正比,所以可用比色法测定。
2、考马斯亮蓝G-250法有常量法和微量法两种。
三、仪器与试剂1、仪器:分析天平;铁架台;大漏斗;洗瓶;烧杯100m l×2、50m l×1;吸管10ml×2、5ml×1;胶头滴管;移液枪;离心管10个;722型分光光度计;容量瓶100ml×3;洗耳球×2;玻璃棒;记号笔。
2、试剂:(1)蒸馏水。
(2)标准蛋白质溶液:用移液枪吸取1ml浓度为1mg/ml标准蛋白质溶液,溶于蒸馏水并定容至10ml,制成0.1mg/ml的原液。
(3)考马斯亮蓝G-250(0.01%)染液:称取0.01g考马斯亮蓝G-250,溶于5ml 90%乙醇中,加入85%(m/v)的磷酸10ml,最后用蒸馏水定容至100ml(此溶液不宜久存,在常温中可放置1~2个月);将定容好的染液过滤并装入棕色瓶中保存。
(4)样品液:用移液枪取1ml纯牛奶液体(经调查,市场上大部分纯牛奶中蛋白质的含量大致为每100ml中2.5~3.5g),用蒸馏水稍做稀释,然后转移至一号100ml的容量瓶中并定容至100ml;用10ml的吸量管吸取10ml一号容量瓶中的液体于二号100ml的容量瓶中,最后用蒸馏水定容至100ml,此时二号容量瓶中为待测样品液。
四、操作步骤1、0~100μg/ml标准曲线的制作:取8支离心管,编号后,按下表加入试剂,盖塞后,将各试管中的溶液纵向倒转混匀,室温静止5min后,以管一为空白对照,在595nm 下比色测定。

植物总蛋白含量测定
植物总蛋白的测定采用Bradford于1976年建立的考马斯亮兰(Coomassie Brilliant
Blue)染色法。
试剂配制:
1考马氏亮蓝G-250染色液:
称取100mg考马氏亮蓝G-250溶解于50毫升95%的乙醇中,加入100毫升85%的磷
酸,用蒸馏水稀释到1升。
2蛋白标准(0.1mg/ml):
准确称取100.0mg牛血清白蛋白,在100ml容量瓶中加生理盐水至刻度,溶后分装于
1ml带盖eppendorf管中,-20℃冰箱保存。
3标准曲线绘制(1mg/ml)
按下表操作,在试管中分别加入0、10、20、40、60μl蛋白标准溶液,用水补足到1ml,
加入5ml考马斯亮兰染色液,混匀后在595nm波长比色,读出吸光度,以各管的标准
蛋白浓度为横坐标,以其吸光度为纵坐标绘制标准曲线。
编号 1 2 3 4 5 蛋白标准(ml) 0 0.01 0.02 0.04 0.06
蒸馏水(ml) 1.0 0.99 0.98 0.96 0.94
染色液(ml) 5 5 5 5 5 4 称取一定质量的植物组织,研磨后,加入水冲洗至小试管中,后定容至1mL。
加入5ml
考马斯亮兰染色液,混匀后在595nm波长比色,根据吸光度和标准曲线测定蛋白质
浓度,然后根据所称质量计算出单位质量植物组织的蛋白质总量。
注:(1)考马斯亮蓝为G-250,不是R-250。
(2)植物组织质量具体称取多少,要通过预实验测定。
一般比色时的吸光度值在
0.2-0.8为宜。

⽤考马斯亮蓝G250法测定蛋⽩质含量⽤考马斯亮蓝G250法测定蛋⽩质含量呵呵你的⾃⼰检查⼀下你的仪器蛋⽩质浓度的测定(四)??考马斯亮蓝染⾊法⽬的要求学习考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋⽩质浓度的原理和⽅法。
实验原理考马斯亮蓝法测定蛋⽩质浓度,是利⽤蛋⽩质―染料结合的原理,定量的测定微量蛋⽩浓度的快速、灵敏的⽅法。
考马斯亮蓝G―250存在着两种不同的颜⾊形式,红⾊和蓝⾊。
它和蛋⽩质通过范德华⼒结合,在⼀定蛋⽩质浓度范围内,蛋⽩质和染料结合符合⽐尔定律(Beer’s law)。
此染料与蛋⽩质结合后颜⾊有红⾊形式和蓝⾊形式,最⼤光吸收由465nm变成595nm,通过测定595nm处光吸收的增加量可知与其结合蛋⽩质的量。
蛋⽩质和染料结合是⼀个很快的过程,约2min即可反应完全,呈现最⼤光吸收,并可稳定1h,之后,蛋⽩质―染料复合物发⽣聚合并沉淀出来。
蛋⽩质―染料复合物具有很⾼的消光系数,使得在测定蛋⽩质浓度时灵敏度很⾼,在测定溶液中含蛋⽩质5µL/ml时就有0.275光吸收值的变化,⽐Lowry法灵敏4倍,测定范围为10,100µg蛋⽩质,微量测定法测定范围是1,10µg蛋⽩质。
此反应重复性好,精确度⾼,线性关系好。
标准曲线在蛋⽩质浓度较⼤时稍有弯曲,这是由于染料本⾝的两种颜⾊形式光谱有重叠,试剂背景值随更多染料与蛋⽩质结合⽽不断降低,但直线弯曲程度很轻,不影响测定。
此⽅法⼲扰物少,研究表明:NaCl,KCl,MgCl2,⼄醇,(NH4)2SO4⽆⼲扰。
强碱缓冲液在测定中有⼀些颜⾊⼲扰,这可以⽤适当的缓冲液对照扣除其影响。
Tris,⼄酸,2―巯基⼄醇,蔗糖,⽢油,EDTA及微量的去污剂如TritonX―100,SDS,玻璃去污剂有少量颜⾊⼲扰,⽤适当的缓冲液对照很容易除掉。
但是,⼤量去污剂的存在对颜⾊影响太⼤⽽不易消除。
试剂与器材⼀、试剂考马斯亮蓝试剂:考马斯亮蓝G―250 100mg溶于50ml95%⼄醇中,加⼊100ml85%磷酸,⽤蒸馏⽔稀释⾄1000ml,滤纸过滤。


考马斯亮蓝法测蛋白质含量实验概要bradford法是最常用的蛋白质快速定量方法。
coomassie brilliant blue g-250与蛋白质结合使染料的最大吸收峰由465 nm变为595 nm,溶液的颜色由棕色变为蓝色,595nm波长下吸光度值与蛋白含量成正比。
灵敏度比lowry法高4倍,与bca法相当。
反应迅速,2分钟即可达到平衡并在1小时内保持稳定。
操作简便,只需要一种反应试剂。
实验原理考马斯亮蓝(coomassie brilliant blue)法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。
这一方法是目前灵敏度最高的蛋白质测定法。
考马斯亮兰g-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰(lmax)的位置,由465 nm变为 595 nm,溶液的颜色也由棕黑色变为兰色。
通过测定595 nm处光吸收的增加量可知与其结合蛋白质的量。
研究发现,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。
主要试剂考马斯亮蓝g-250染色工作液: 10mg考马斯亮蓝g-250粉末溶于5ml 95%乙醇中,彻底溶解后,加入10ml 85%磷酸中,边加边搅拌(市售液体磷酸(h3po4)的质量分数≥85.0%,稠状透明液体,可直接使用,对皮肤有很强的腐蚀作用,建议使用5ml移液枪缓慢吸取使用)蒸馏水稀释至100ml。
后经滤纸过滤后储存于棕色试剂瓶中,避光保存。
长时间不用,可放置于4℃冰箱中保存1年,再次使用还需过滤,加入反应管前需要升至室温,否则虽不影响精度,但测得的od值较低,对仪器要求较高。
标准牛血清白蛋白(bsa):精确称取4mg bsa粉末,溶于1ml 0.15mol/l nacl溶液配制成4mg/ml标准蛋白溶液,-20℃保存。
(如用1cm比色皿测定,建议精确称取40mg bsa 粉末,溶于10ml 0.15mol/l nacl溶液配制成4mg/ml标准蛋白溶液,分装成小管,-20℃保存。

考马斯亮蓝测蛋白实验报告Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】实验二:分光光度计的学习之考马斯亮蓝G-250法(Bradford法)测定蛋白质含量定一实验目的学习分光光度计的基本原理和使用方法,并使用考马斯亮蓝G-250法测定蛋白质含量。
二实验原理考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。
考马斯亮蓝G-250 在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm 波长下有最大光吸收。
其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
蛋白质与考马斯亮蓝G-250 结合在2min 左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h 内保持稳定。
该法是1976年Bradford 建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry 法还高4 倍,可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。
三实验材料1. 实验材料:未知浓度的牛血清样品2. 主要仪器:试管、移液枪、分光光度计等。
3. 试剂:蛋白试剂考马斯亮蓝G-250 的配制:称取100mg 考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1 000mL。
此溶液在常温下可放置一个月。
四实验步骤标准曲线制作:取6 支10mL 干净的试管,按表1 取样。
摇匀后放置2min ,用1cm 光经的比色杯在595nm 波长下比色,记录测定的光密度OD595nm,并做标准曲线。
表1 低浓度标准曲线制作上图数据标准曲线如下:拟合标准方程:y=+2.未知蛋白质浓度的测定另取2 支10mL 试管,按下表取样。
吸取测定液,蒸馏水 mL放入试管中,加入5mL 考马斯亮蓝G-250 蛋白试剂,充分混合,放置2min 后用1cm 光径比色杯在595nm 下比色,记录光密度OD595nm,并通过标准曲线查得待测品提取液中蛋白质的含量X(μg)。

考马斯亮蓝G-250法测定蛋白质含量专业班级:制药工程3班小组成员:李梦娴李敏林晓丝一、实验目的1、了解考马斯亮蓝法测定蛋白质的原理2、掌握考马斯亮蓝法测定蛋白质含量的操作步骤二、实验原理1、根据蛋白质的理化性质,有多种蛋白质定量方法。
考马斯亮蓝G-250是比色法与色素法相结合的复合方法。
考马斯亮蓝G-250是一种染料,在游离状态下呈棕红色,当与蛋白质结合后呈青蓝色。
在一定范围内,也就是蛋白质含量在0~1000ug范围内,蛋白质-色素结合物在595nm下的吸光度与蛋白质含量成正比,所以可用比色法测定。
2、考马斯亮蓝G-250法有常量法和微量法两种。
三、仪器与试剂1、仪器:分析天平;铁架台;大漏斗;洗瓶;烧杯100m l×2、50m l×1;吸管10ml×2、5ml×1;胶头滴管;移液枪;离心管10个;722型分光光度计;容量瓶100ml×3;洗耳球×2;玻璃棒;记号笔。
2、试剂:〔1〕蒸馏水。
〔2〕标准蛋白质溶液:用移液枪吸取1ml浓度为1mg/ml标准蛋白质溶液,溶于蒸馏水并定容至10ml,制成0.1mg/ml的原液。
〔3〕考马斯亮蓝G-250(0.01%)染液:称取0.01g考马斯亮蓝G-250,溶于5ml 90%乙醇中,加入85%〔m/v)的磷酸10ml,最后用蒸馏水定容至100ml〔此溶液不宜久存,在常温中可放置1~2个月〕;将定容好的染液过滤并装入棕色瓶中保存。
〔4〕样品液:用移液枪取1ml纯牛奶液体〔经调查,市场上大部分纯牛奶中蛋白质的含量大致为每100ml中2.5~3.5g〕,用蒸馏水稍做稀释,然后转移至一号100ml的容量瓶中并定容至100ml;用10ml的吸量管吸取10ml一号容量瓶中的液体于二号100ml的容量瓶中,最后用蒸馏水定容至100ml,此时二号容量瓶中为待测样品液。
四、操作步骤1、0~100μg/ml标准曲线的制作:取8支离心管,编号后,按下表加入试剂,盖塞后,将各试管中的溶液纵向倒转混匀,室温静止5min后,以管一为空白对照,在595nm 下比色测定。

二、Bradford法(一)、原理:考马斯亮蓝G250 ( CBB- G-250)与蛋白质结合后形成蓝色的化合物,在595nm有最大吸收峰,且蓝色的深浅与蛋白浓度成正比。
这是一种快速、准确、重复性好的蛋白质定量方法。
该方法快速、准确、干扰因素少。
CBB- G-250在2分钟内即可完全与蛋白结合,并在2小时内保持稳定,该反应几乎不受钠、钾等阳离子的干扰,更不受蔗糖等碳水化合物的干扰。
但较高浓度的十二烷基硫酸钠(Soldium dodecyl sulfate),Triton X-100等对其有干扰,此影响可通过选择适当的对照品来消除。
(二)器材及试剂1、器材A. 分光光度计B. 微量加样器C. 移液管、试管及试管架D. 坐标纸2. 试剂(1)考马斯亮蓝G-250溶液:称取CBB- G-250 100毫克溶于50 ml 95%(V/V)乙醇溶液中,然后加入100毫升85%(V/V)磷酸,最后加蒸馏水定容至1000毫升。
(2)0.14mol/L 氯化钠溶液(生理盐水)(3)标准蛋白质溶液(0.1mg/ml):精确称取10.0毫克牛血清白蛋白,用生理盐水定容至100毫升。
(4) 血清样品(已稀释200倍)(5) 层析样品(三)、操作(标准曲线制作):取7支试管按下表操作:混匀,室温放置5分钟,在595nm测定各管O.D值并以蛋白浓度为横坐标,以O.D 值为纵坐标绘制标准曲线.以Bradford法测定层析分离蛋白内的蛋白浓度取试管从层析样品中各取20.0ul,加入生理盐水20ul,最后加入考马斯亮蓝G-250溶液5.0ml,混匀,以595nm 波长测定二者光密度,在标准曲线上查出其蛋白浓度以上需要购买的试剂有:1、标准蛋白质即牛血清白蛋白。
教学内容:实验八考马斯亮蓝法(Bradford法)测定蛋白质含量【实验目的】1. 掌握考马斯亮蓝染色法定量测定蛋白质的原理与方法2. 熟练分光光度计的使用和操作方法【实验原理】此方法是1976年Bradform建立。

