残留溶剂顶空分析方法验证方案模版最新版本
- 格式:doc
- 大小:211.00 KB
- 文档页数:15

残留溶剂分析方法验证方案引言:残留溶剂是指在制药、食品、化妆品、印刷等工业生产过程中可能残留在最终产品中的有机溶剂。
残留溶剂的检测和分析对于保障产品质量和消费者的健康非常重要。
本文将介绍一个残留溶剂分析方法验证的方案,确保该方法能够准确、可靠地检测残留溶剂。
一、验证目的和范围1.验证目的:验证残留溶剂分析方法的准确性、精密度、特异性、灵敏度和线性范围等性能指标。
2.验证范围:本验证方案适用于残留溶剂分析方法的验证。
二、验证实验设计1.准备样品:收集一批含有已知浓度残留溶剂的样品,确保样品的浓度分布能够覆盖方法的线性范围。
2.准备溶剂标准品:根据实际需要,准备残留溶剂的标准品,浓度与样品中的残留溶剂浓度相对应。
3.确定分析方法:根据实际情况,选择一种适用的残留溶剂分析方法,确保该方法能够准确地检测样品中的残留溶剂。
4.验证参数:(1)准确性:通过对样品添加已知浓度的残留溶剂标准品,并进行多次重复测定,计算准确度参数。
(2)精密度:通过对样品进行多次重复测定,计算精密度参数。
(3)特异性:通过对样品进行干扰试验,判断分析方法是否能够准确检测出残留溶剂。
(4)灵敏度:通过对样品进行逐步稀释,测定最低检测限,并评估方法的灵敏度。
(5)线性范围:通过对样品不同浓度的残留溶剂进行测定,并绘制标准曲线,估算线性范围和相关系数。
三、验证结果和数据分析1.准确性参数:根据重复测定数据,计算准确度参数,如相对标准偏差(RSD)和回收率。
2.精密度参数:根据重复测定数据,计算精密度参数,如RSD。
3.特异性结果:记录干扰试验结果,判断方法是否能够准确检测出残留溶剂。
4.灵敏度结果:记录最低检测限,并评估方法的灵敏度。
5.线性范围结果:通过绘制标准曲线,记录线性范围和相关系数。
四、验证结论和建议1.准确性和精密度:根据验证结果,评估方法的准确性和精密度,并根据实际需要确定接受范围。
2.特异性:确认方法的特异性,并排除其他可能的干扰物。
阿莫西林残留溶剂分析方法验证方案文件编号: VP-01-06-00-041方案起草方案审核方案批准生效日期:年月日1、概述在阿莫西林制备工艺中,使用了甲醇与丙酮两种对人体具有危害的二类溶剂,我公司为了确保阿莫西林原料中甲醇与丙酮的残留在国家要求范围内,开发了阿莫西林胶囊中甲醇与丙酮残留的检测方法,按照《中国药典》2015年版的要求对此检测方法进行方法学验证。
2、验证目的证明本方法能满足阿莫西林原料中甲醇与丙酮的残留溶剂测定,确保阿莫西林原料中甲醇与丙酮的残留溶剂检测方法准确、重现并耐用,检测结果数据真实可靠。
3、验证范围本验证方案适用于阿莫西林中甲醇与丙酮的残留溶剂检验方法验证。
4、确认小组成员及职责5、验证前的风险评估5.1验证小组人员按照《质量风险管理规程》,对分析方法进行了风险评估,确定了需进行方法确认的项目。
5.1.1严重性(S):危害可能产生后果的程度。
严重程度分为五个等级。
5.1.2可能性(P):影响检测结果的事件发生的可能性频率或概率,建立以下五个等级:5.1.3可检测性(D):检测到异常情况存在的能力的程度,定义如下:5.2风险优先数量等级判定(RPN)5.2.1风险等级判定标准的确定RPN是事件发生的严重程度、可能性和可探测性三者乘积,用来衡量可能的仪器缺陷,以便采取可能的预防措施。
RPN = Severity(严重程度)×Possibility(发生的可能性)×Detection(可探测性)5.2.2风险评价和处理注:当RPN≤8,但严重性S为5时,仍需按中等以上风险进行后续控制。
5.3风险分析6、验证前的准备6.1人员培训在本方案实施前,已对方案实施过程中涉及人员进行培训,以保证方案顺利实施,做好培训记录,培训记录见表1。
表1 训确认表7、验证内容7.1验证项目及可接受标准7.2仪器配置检查(见表2)表2仪器配置表7.3验证所用的试剂及样品(见表3)表3验证所用试剂及样品7.3实验条件:检测器:FID(氢火焰离子化检测器)色谱柱:WEL-624 30m×0.32mm×0.25um升温程序:50℃,维持6min,60℃/min的速率升温至240℃,维持3分钟进样口温度:200℃检测器温度:260℃载气:氮气流速:2.98 ml/min分流比1:1 进样方式:顶空进样,顶空瓶平衡温度80℃,平衡时间30min7.4方法学验证7.4.1专属性试验7.4.1.1目的:确定所需测定的目标溶剂可以很好的分离,并且不会受到来自溶媒及可能出现的杂质的干扰。

残留溶剂分析方法验证方案DOC一、目的和范围该验证方案的目的是验证残留溶剂分析方法的适用性和可靠性,以确保其在实际样品中的准确性和精密性。
该验证方案适用于分析实验室中使用的残留溶剂分析方法,包括仪器和设备的检验的验证。
二、实验室设备和试剂1.装备:(1)高效液相色谱仪(HPLC)(2)气相色谱仪(GC)(3)质谱仪(MS)2.试剂:(1)残留溶剂标准物质(2)气相色谱柱(3)质谱校准物三、验证参数1.准确性:通过添加已知浓度的标准物质到实际样品中,检测其残留浓度与添加浓度之间的差异来评估方法的准确性。
2.精密性:通过重复测定同一样品多次,计算相对标准偏差(RSD)来评价方法的精确性和重复性。
3.线性范围:通过在一系列浓度范围内测定溶剂标准物质的浓度,并绘制峰面积与浓度的线性回归曲线来评估方法的线性范围。
4.检出限和定量限:通过测定稀释系列标准物质的峰高或峰面积,并根据信号噪声比进行计算来确定方法的检出限和定量限。
四、方法验证步骤1.准备一系列已知浓度的溶剂标准物质,尽量覆盖预计样品中的溶剂浓度范围。
2.对每个标准物质进行HPLC、GC和MS的分析,记录峰高或峰面积。
3.根据测定结果绘制标准曲线,并计算线性回归方程和相关系数。
4.确定方法的线性范围,并计算线性回归曲线的斜率、截距和相关系数。
5.随机选择多个实际样品并进行多次测定(至少3次),计算RSD。
6.将已知浓度的标准物质添加到实际样品中,分析其残留浓度,并与已知浓度进行比较,计算准确性。
7.测定不同浓度的稀释系列标准物质的峰高或峰面积,并计算检出限和定量限。
8.整理实验数据并进行统计分析,评估方法的可靠性和适用性。
五、验证结果与评价根据验证结果,对方法的准确性、精密性、线性、检出限和定量限进行评价。
如果结果符合规定的标准和要求,则证明方法可靠且可应用于实际样品中。
如果结果不符合要求,则需要对方法进行修正或重新验证。
六、记录和报告将验证过程的所有数据、结果和评价进行详细记录,形成验证报告。

残留溶剂方法学验证方案残留溶剂是指在其中一种溶剂处理过程中,溶剂不能完全挥发,残留在处理物中的化合物。
残留溶剂的测试和分析对于保证产品质量和安全性非常重要。
下面是一个关于残留溶剂方法学验证方案的简要说明,包含实验步骤、仪器设备、数据处理和结果评估等。
1.实验目的:验证残留溶剂的测试方法是否准确可靠,适用于特定产品或材料的检测。
2.实验步骤:2.1样品准备:选取代表性的产品样品或材料样品,并按照标准或法规的要求制备样品。
2.2定量添加溶剂:根据实际应用情况,向样品中添加已知浓度的溶剂,以模拟实际环境中的残留情况。
2.3提取和浓缩:使用适当的提取方法(如固相萃取、溶剂萃取等)将残留溶剂从样品中提取出来,并将提取液浓缩。
2.4仪器分析:使用适当的分析仪器(如气相色谱-质谱联用仪、高效液相色谱仪等),对浓缩后的提取液进行定量分析。
3.仪器设备:3.1分析仪器:根据需要选择适当的分析仪器,如气相色谱-质谱联用仪(GC-MS)、高效液相色谱仪(HPLC)、液相色谱-质谱联用仪(LC-MS)等。
3.2样品制备设备:如研磨仪、超声波清洗器、离心机等,用于样品制备和处理。
4.数据处理:4.1标准曲线绘制:根据已知浓度的溶剂标准品,利用分析仪器进行测定,得到残留溶剂的峰面积与浓度之间的关系,绘制标准曲线。
4.2样品测定:将提取液注入分析仪器,进行测定。
根据标准曲线,计算样品中残留溶剂的浓度。
5.结果评估:5.1方法验证:通过实验结果,验证残留溶剂的测试方法是否能准确测定残留溶剂的浓度,并评估方法的重复性和精密度。
5.2检出限和定量限:根据实验结果,计算出测定方法的检出限和定量限,评估方法的敏感度和适用范围。
5.3结果分析:对于不同样品的测定结果,进行统计分析和比较,评估残留溶剂的含量是否符合标准要求。
5.4结论:根据实验结果,得出对于残留溶剂测试方法的验证结论,并提出改进建议。
以上为残留溶剂方法学验证方案的简要说明,具体实验细节和方法参数需要根据实际情况进行调整。

顶空气相色谱测定有机溶剂残留法概述及解释说明1. 引言1.1 概述顶空气相色谱测定有机溶剂残留法(简称顶空法)是一种常用的分析技术,广泛应用于工业生产和环境监测领域。
该方法通过将样品中的有机溶剂在升温下转化为气态,然后利用气相色谱技术进行定性和定量分析。
顶空法具有无需前处理、操作简便快捷、灵敏度高等优点,因此被广泛认可并得到了广泛的实际应用。
1.2 文章结构本文将首先对顶空法的原理进行介绍,包括有机溶剂从液态转化为气态的过程以及气相色谱技术的基本原理。
然后介绍了使用顶空法所需的设备和方法,并展示了其在不同领域的应用案例。
接着讨论了当前研究进展以及存在的局限性,并提出了改进方向。
最后对该方法进行优点与局限性对比分析,并探讨其可行性和未来发展前景,给出实际工作中的应用建议和注意事项。
1.3 目的本文旨在全面概述和解释顶空气相色谱测定有机溶剂残留法,向读者介绍该方法的原理、设备和方法、应用领域以及研究进展。
通过讨论与分析,希望能够准确评估顶空法的优点与局限性,并为实际工作提供可行性探讨和发展前景展望。
最终总结该方法的主要观点和结果,并指出其在未来研究中的意义和启示。
2. 顶空气相色谱测定有机溶剂残留法2.1 原理介绍顶空气相色谱(Headspace Gas Chromatography, HSGC)是一种用于分析液体或固体样品中挥发性成分的方法。
它通过将样品封装在闭合容器中,利用温度升高和压力调节,使样品中的挥发性成分转移到顶空(即气相空间)中,并通过气相色谱技术进行分析和检测。
该方法适用于检测有机溶剂在样品中的残留量。
当使用有机溶剂在溶剂型反应、合成或处理过程中时,可能会残留在最终制得的产品或样品中。
由于有机溶剂可对人体造成潜在危害,因此需要准确可靠地确定其残留量。
2.2 设备和方法顶空气相色谱测定有机溶剂残留法主要包括以下步骤:首先,将待测试的样品置于密封的头空瓶内,并加入适量的内标物质。
然后将头空瓶安装到顶空进样系统中。


残留溶剂检测方法验证验证报告Validation Report项目名称Name 残留溶剂检测方法Determination of residual solvents报告编号Report №版本Version方案编号Protocol №版本Version起草Prepared byQC审核Reviewed by QC部门审核Reviewed by Dept.QA审核Reviewed by QA批准Approved by报告日期Report Date目录CONTENTS报告总结按批准的方案(编号 ),对xxx有机挥发性物质的检测方法进行验证。
结果如下:1. 考察了方法的专属性、检测限、定量限、精密度、线性范围和准确度/回收率。
2. 根据实验中所得数据及图谱分析,与方案中可接受标准比较,均符合规定。
3. 此方法可作为xxxx有机挥发性物质的检测,方法可行。
1.目的Purpose对XX中残留溶剂乙醇的检测方法进行验证,确保方法可行性,以便为有效控制XX的质量提供依据。
2. 验证范围Scope乙醇。
3. 验证依据Validation BasisICH Q2axxxxx(各个公司自己的产品的SOP)Xxxxx4. 责任者Person Responsibility姓名职务技术职称验证实施分工起草验证方案,进行验证,编制验证报告按照验证方案进行验证组织实施验证,对验证报告审核对验证报告结果审核对验证监督和组织定稿5. 接受标准Acceptance Criterion项目名称考核方法限度专属性各杂质峰之间分离度依据自己的产品要求写各杂质峰理论塔板数以下皆同各杂质峰拖尾因子检测限(S/N=3±1)乙醇在样品中的含量(ppm)定量限(S/N≥10)乙醇在样品中的含量(ppm)精密度重复性:3个浓度的标准溶液分别进样3针,RSD中间精密度:3个浓度的标准溶液不同日不同人分别进样3针,与重复性试验的9针一起计算RSD线性范围各杂质相关系数R准确度/回收率回收率RSD6. 残留溶剂的测定Determination of residual solvent6.1 残留溶剂的限度Limit of residual solvents指标名称技术要求方法乙醇自己公司的检测方法即依据6.2 溶液配制Preparation of solutions6.2.1 储备溶液写出各个储备液的配置过程6.2.2 标准溶液分别按附表定量吸取上述储备溶液(上述称量改变时,吸取体积作相应调整),置于同一个100ml量瓶中,用合适的溶剂(依据自己的情况写)稀释至刻度,混匀。

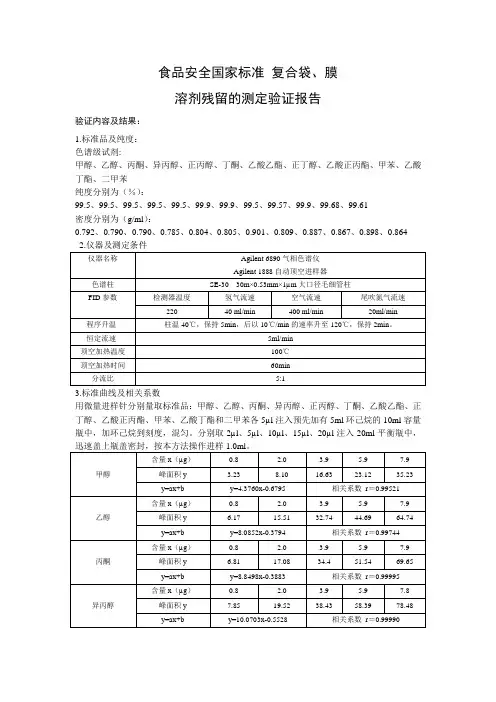
食品安全国家标准复合袋、膜溶剂残留的测定验证报告验证内容及结果:1.标准品及纯度:色谱级试剂:甲醇、乙醇、丙酮、异丙醇、正丙醇、丁酮、乙酸乙酯、正丁醇、乙酸正丙酯、甲苯、乙酸丁酯、二甲苯纯度分别为(%):99.5、99.5、99.5、99.5、99.5、99.9、99.9、99.5、99.57、99.9、99.68、99.61密度分别为(g/ml):0.792、0.790、0.790、0.785、0.804、0.805、0.901、0.809、0.887、0.867、0.898、0.8643.标准曲线及相关系数用微量进样针分别量取标准品:甲醇、乙醇、丙酮、异丙醇、正丙醇、丁酮、乙酸乙酯、正丁醇、乙酸正丙酯、甲苯、乙酸丁酯和二甲苯各5µl注入预先加有5ml环己烷的10ml容量瓶中,加环己烷到刻度,混匀。
分别取2µl、5µl、10µl、15µl、20µl注入20ml平衡瓶中,4.精密度取OPP/AL/PE复合膜样品0.01m2(按内表面积计),裁成两张放入20ml平衡瓶中,盖上瓶由表可见,分别精密吸取上述加标样品顶空气1ml进样,结果S为0.0294。
RSD为2.80%,结果符合规定。
5.准确度取OPP/AL/PE复合膜样品0.01m2(按内表面积计),裁成两张放入20ml平衡瓶中,盖上瓶盖密封,用微量注射针加入甲醇标准品10µl(用微量进样针量取甲醇标准品10µl注入预先加有5ml环己烷的10ml容量瓶中,加环己烷到刻度,混匀,每1µl相当于甲醇0.788µg),进样1.0ml。
由表可见,加标3次,回收率范围96.2%~100.5%,平均回收率98.4%,准确度符合规定要求。
验证结论:经验证,方法回收率范围96.2%~100.5%,精密度试验RSD范围2.80%,基本达到建立方法的要求。
6、检出限按信噪比3:1定检测限的原则,本方法各溶剂的检出限分别为:甲醇220ng、乙醇16ng、丙酮39ng、异丙醇39ng、正丙醇80ng、丁酮80ng、乙酸乙酯90ng、丁醇80ng、乙酸丙酯88ng、甲苯17ng、乙酸丁酯63ng、二甲苯17ng,当样品取样量为0.01m2时,检出浓度分别为0.02mg/m2;0.002 mg/m2;0.004 mg/m2;0.004 mg/m2;0.008 mg/m2;0.008 mg/m2;0.009mg/m2;0.008 mg/m2;0.009 mg/m2;0.002mg/m2;0.006 mg/m2;0.002mg/m2。

方案批准注:在方案批准部分签字表明签字者同意方案中规定的检测项目检测方法和记录要求。
在执行本方案的过程中可能会出现影响严格执行本方案的偏差,对较小的偏差将通过偏差报告的形式来解决,对于关键性偏差,如对方法的调整、对参数或接受标准的调整必须制定出增补方案并按照原方案批准程序得到批准才能进行。
所有的偏差报告和增补方案必须在提交验证报告供批准时一同提交。
目录1.概述 (3)2.参考资料 (4)3. 职责 (4)4. 色谱系统及色谱条件 (4)5. 器材与试剂 (5)6. 验证试验 (5)6.1系统适应性 (5)6.2专属性 (6)6.3耐用性 (7)6.4定量限 (7)6.5检测限 (8)6.6线性与范围 (8)6.7准确度 (9)6.8精密度 (11)7.再验证周期 (12)8.偏差及纠正措施 (12)9.最终审核和批准 (12)药品残留溶剂顶空分析方法草案 (14)1.概述1.1根据ICH对药品中残留溶剂含量的要求及盐酸噻氯匹定生产工艺,必须控制盐酸噻氯匹定生产工艺中使用到的溶剂乙醇、丁酮、甲苯、N,N-二甲基甲酰胺(DMF)的残留量。
限度分别为:乙醇≤5000ppm、丁酮≤5000ppm、甲苯≤890ppm、DMF≤880ppm。
1.2分析方法草案见附件。
1.3本分析方法属于杂质定量分析,因此需要验证的项目有:系统适应性、专属性、线性、准确度、检测限、定量限、精密度、耐用性,具体参数及接受标准要求见下表:2.参考资料ICH Q3C (R3), November 2005.ICH Q2 (R1), November 2005.<467> Residual Solvents, United States Pharmacopoeia 31, November 2007. <20424> Residual Solvents, European Pharmacopoeia 6.0, June 2007.3. 职责4.1色谱系统5.表2. 器材列表6. 验证试验6.1系统适应性目的:对由分析设备、实验操作、被分析供试品组成的完整的系统进行评估。

检验方法验证复核方案(实验部分)方法名称编制人/日期:复核人/日期:批准人/日期:Tabel of Contentsl内容表1.目的PURPOSE (3)2.范围SCOPE (3)3.引言INTRODUCTION (3)4.参考资料REFENRENCE (3)5.分析方法TEST METHOD (3)6.验证的特性指标和接受标准VALIDATION CHARACTERISTICS AND ACCEPTANCE CRITERIA (4)6.1准确度Accuracy (4)6.2线性范围LINEARITY RANGE (5)6.3检测限/定量限LIMIT OF DETECTION / LIMIT OF QUANTITATION (5)6.4专一性SPECIFICITY (5)7.附件APPENDIX (5)1.目的PURPOSE对盐酸文拉法辛清洁残留的测试方法进行方法复核。
2.范围SCOPE此复核方案包含了盐酸文拉法辛清洁残留测定方法的准确度(包括不锈钢;塑料;橡胶三种材料的回收率);线性范围;检测限/定量限;专一性测试。
3.引言INTRODUCTION根据SOPQC-67要求,我们将对生产过程中盐酸文拉法辛清洁残留测定方法的准确度、线性范围、检测限/定量限、专一性进行复核。
4.参考资料REFENRENCE方案编号 :QC-PQ-304 Revision 1 -----见附件1方案编号:02-CV-PKG-OC.IMAC90.001 Revision 0 -----见附件25.分析方法TEST METHOD5.1试剂:(1)水:纯化水(2)乙腈:色谱级,Fisher Scientific公司。
(3)磷酸(85%): 色谱级,TEDIA公司。
(4)三乙胺:分析纯,国药集团化学试剂有限公司。
三乙胺缓冲液:取三乙胺2ml,加水稀释至800ml,用85%磷酸调节pH至3.0。
(5)盐酸文拉法辛(Venlafaxine HCL):Lot2000129753 100.0% Wyeth ReferenceStandard。
溶剂残留方法学验证溶剂残留检查多采用气相色谱法。
一般认为残留溶剂测定属限度检查,按相关指导原则只需提供专属性、检测限、定量限及进样精密度等方法学研究资料,故未进行线性、准确度和耐用性方面研究.残留量检查究竟是属于定量还是限度检查的范畴,《化学药物残留溶剂研究的技术指导原则》中未明确规定。
考虑到药物合成情况比较复杂,根据所使用的有机溶剂种类、数量等的不同,残留溶剂研究需要进行的程度、目标也可能不同,对方法学的要求也可能随之不同.当检测结果明显低于规定限度时,通常按限度检查要求,无需得出准确含量;当检测结果明显高于规定限度(尤其当检测结果为限度边缘时),或需残留溶剂量进行含量纯度折算时,需按定量检查要求进行方法学研究。
一、系统适用性试验取对照品溶液,进样,记录色谱图.柱效:以被测物的色谱峰计,填充柱法的理论板数应大于1000,毛细管色谱柱的理论板数应大于5000。
分离度:色谱图中被测物色谱峰与其相邻色谱峰的分离度应大于1.5。
重复性:以内标法测定时,对照品溶液连续进样5次,所得被测物与内标物峰面积之比的相对标准偏差(RSD)应不大于5%;以外标法测定时,所得被测物峰面积的相对标准偏差(RSD)应不大于10%。
二、专属性1、对各种残留溶剂定位和进行混合溶剂的分离度试验,并附代表性图谱. 取各种残留溶剂对照品溶液,分别单独进样,记录色谱图。
取混合溶液,进样,记录色谱图。
2、排除供试品中的未知杂质或其挥发性热降解产物对残留溶剂的测定产生的干扰。
①如果未知杂质或其挥发性热降解产物与被测物的保留值相同(共出峰),通常采用在另一种极性相反的色谱柱系统中对相同样品进行测定,比较不同色谱系统的测定结果的方法。
如二者结果一致,则可以排除测定中有共出峰的干扰;如二者结果不一致,则表明测定中有共出峰的干扰.②热降解产物与被测物的结构相同(如甲氧基热裂解产生甲醇),通常要通过测定已知不含该溶剂的对照样品来加以判断.三、检测限和定量限检测限为信噪比3:1时相应浓度或注入仪器的量。
残留溶剂分析方法验证方案***产品残留溶剂分析方法验证方案20**年**月验证方案的起草与审批方案实施日期:目录1.验证目的 (4)2.方法简介与确认范围 (4)3.标准品、供试品 (4)4.风险评估 (4)5.验证的可接受标准 (5)6.验证步骤 (6)6.1系统适应性 (6)6.2专属性 (6)6.3定量限与检测限 (7)6.4线性 (7)6.5准确度 (8)6.6精密度 (9)6.7范围 (9)6.8耐用性 (9)6.9样品测定 (10)7.偏差 (10)8.风险的接收与评审 (10)9.再验证 (10)10.确认结果评审和结论 (10)11.更改历史 (10)12. 附录 (10)1.验证目的根据法规的要求,分析方法应进行验证,证明采用的方法适合于相应的检测要求。
这个验证方案的目的是为验证提供具体方法参数、可接受标准和研究步骤。
2.方法简介与确认范围***产品生产过程中用到有机溶剂乙醇、丙酮、二氯甲烷、乙酸乙酯、四氢呋喃,为了准确测定溶剂在成品中的残留量,现对该测定方法进行验证,验证包括方法的专属性、检测限与定量限、线性、范围、准确度、精密度及耐用性。
3.标准品、供试品3.1标准品3.2供试品4.风险评估按照《质量风险管理规程》,质量控制部和质量管理部共同对分析方法进行了风险评风险评估人:评估日期:5.验证的可接受标准6.验证步骤6.1系统适应性精密称取乙醇200mg、丙酮200mg、二氯甲烷24mg、乙酸乙酯200mg、四氢呋喃28.8mg,置于已加入10ml二甲基亚砜的50ml 量瓶中,用二甲基亚砜溶解并稀释至刻度,作为对照溶液储备液;精密移取对照液储备液5ml,置于一100ml量瓶中,用二甲基亚砜稀释至刻度;精密移取5ml,置于20ml顶空瓶中,密封。
同法配制6份,连续顶空进样,记录色谱图,相邻组份之间的分离度R均应不小于1.5,各组份峰面积的相对标准偏差(RSD A)均应不大于10%。
验证报告Validation Report目录CONTENTS报告总结按批准的方案(编号),对xxx有机挥发性物质的检测方法进行验证。
结果如下:1. 考察了方法的专属性、检测限、定量限、精密度、线性范围和准确度/回收率。
2. 根据实验中所得数据及图谱分析,与方案中可接受标准比较,均符合规定。
3. 此方法可作为xxxx有机挥发性物质的检测,方法可行。
1.目的Purpose对XX中残留溶剂乙醇的检测方法进行验证,确保方法可行性,以便为有效控制XX的质量提供依据。
2. 验证范围Scope乙醇。
3. 验证依据Validation BasisICH Q2axxxxx(各个公司自己的产品的SOP)Xxxxx4. 责任者Person Responsibility5. 接受标准Acceptance Criterion6. 残留溶剂的测定Determination of residual solvent6.1 残留溶剂的限度Limit of residual solvents6.2 溶液配制Preparation of solutions6.2.1 储备溶液写出各个储备液的配置过程6.2.2 标准溶液分别按附表定量吸取上述储备溶液(上述称量改变时,吸取体积作相应调整),置于同一个100ml量瓶中,用合适的溶剂(依据自己的情况写)稀释至刻度,混匀。
(相对溶剂在样品中的量配制标准溶液)6.2.3 供试溶液写出各个供试液的配置过程6.3 色谱系统Chromatographic System仪器:色谱柱:进样口:温度xxx ℃压力恒流流速xxxml/min分流方式:xxx柱温:xxx检测器:FID温度 xxx ℃ H 2 xxml/min Air xxxml/min 尾吹气(N 2) xxxml/min 进样量:xxμL6.4 系统适应性试验System Suitability Test标准溶液中所有的组分峰均能在色谱图上分开,任何二个成分峰之间的分离度R 不得小于xx ,重复进样时各峰面积的相对标准偏差不大于15%。
方案批准注:在方案批准部分签字表明签字者同意方案中规定的检测项目检测方法和记录要求。
在执行本方案的过程中可能会出现影响严格执行本方案的偏差,对较小的偏差将通过偏差报告的形式来解决,对于关键性偏差,如对方法的调整、对参数或接受标准的调整必须制定出增补方案并按照原方案批准程序得到批准才能进行。
所有的偏差报告和增补方案必须在提交验证报告供批准时一同提交。
目录1.概述 (3)2.参考资料 (4)3. 职责 (4)4. 色谱系统及色谱条件 (4)5. 器材与试剂 (5)6. 验证试验 (5)6.1系统适应性 (5)6.2专属性 (6)6.3耐用性 (7)6.4定量限 (7)6.5检测限 (8)6.6线性与范围 (8)6.7准确度 (9)6.8精密度 (11)7.再验证周期 (12)8.偏差及纠正措施 (12)9.最终审核和批准 (12)药品残留溶剂顶空分析方法草案 (14)1.概述1.1根据ICH对药品中残留溶剂含量的要求及盐酸噻氯匹定生产工艺,必须控制盐酸噻氯匹定生产工艺中使用到的溶剂乙醇、丁酮、甲苯、N,N-二甲基甲酰胺(DMF)的残留量。
限度分别为:乙醇≤5000ppm、丁酮≤5000ppm、甲苯≤890ppm、DMF≤880ppm。
1.2分析方法草案见附件。
1.3本分析方法属于杂质定量分析,因此需要验证的项目有:系统适应性、专属性、线性、准确度、检测限、定量限、精密度、耐用性,具体参数及接受标准要求见下表:2.参考资料ICH Q3C (R3), November 2005.ICH Q2 (R1), November 2005.<467> Residual Solvents, United States Pharmacopoeia 31, November 2007. <20424> Residual Solvents, European Pharmacopoeia 6.0, June 2007.3. 职责4.1色谱系统5.表2. 器材列表6. 验证试验6.1系统适应性目的:对由分析设备、实验操作、被分析供试品组成的完整的系统进行评估。
接受标准:计算标准溶液图谱中目标峰各检测参数:●连续六次进样标准溶液所得图谱中目标峰峰面积RSD≤10%●理论塔板数(N):≥ 10000●分离度(R):≥2.0 (残留溶剂间)●拖尾因子(T):≤2.06.1.1溶液配制空白溶液:DMI。
标准储备溶液:精密称取乙醇0.25g、丁酮0.25g、甲苯 0.0445g、DMF0.044g置于已有20ml DMI的100.0ml容量瓶中,以DMI稀释至刻度,混匀。
标准溶液:移取标准储备溶液10.0ml,置100.0ml容量瓶中,用DMI稀释至刻度,混匀。
即得乙醇250μg/ml、丁酮250μg/ml、甲苯 44.5μg/ml、DMF44μg/ml。
分别移取5.0ml空白溶液、标准溶液,置于顶空瓶中,密封,即得。
6.1.2分析色谱系统稳定后,按下列顺序进样分析:6.2 专属性目的:对分析方法准确可靠测定被分析物的能力进行测试。
接受标准●空白溶液图谱中目标峰出峰位置附近无显著干扰峰。
●供试品-标准溶液图谱中目标峰与相邻峰的分离度应不小于1.5。
●对各残留溶剂出峰位置进行定位,用RRT表示。
6.2.1溶液配制注:分别配制各残留溶剂限度水平的定位溶液,及残留溶剂混合定位溶液(标准溶液)。
乙醇定位溶液:称取乙醇0.25g,置于已有20mlDMI的100ml容量瓶中,以DMI稀释至刻度,混匀。
移取上述溶液10ml,置100ml容量瓶中,以DMI稀释至刻度,混匀。
浓度250μg/ml。
丁酮定位溶液:称取丁酮0.25g,置于已有20mlDMI的100ml容量瓶中,以DMI稀释至刻度,混匀。
移取上述溶液10ml,置100ml容量瓶中,以DMI稀释至刻度,混匀。
丁酮250μg/ml。
DMF定位溶液:称取DMF0.044g,置于已有20mlDMI的100ml容量瓶中,以DMI稀释至刻度,混匀。
移取上述溶液10ml,置100ml容量瓶中,以DMI稀释至刻度,混匀。
DMF44μg/ml。
甲苯定位溶液:称取甲苯0.0445g,置于已有20mlDMI的100ml容量瓶中,以DMI稀释至刻度,混匀。
移取上述溶液10ml,置100ml容量瓶中,以DMI稀释至刻度,混匀。
甲苯 44.5μg/ml标准溶液:配制同“6.1系统适应性” 项下。
供试品-标准溶液:称取0.25g供试品,置20ml顶空瓶中,向其中加入5.0ml标准溶液,密封,即得供试品-标准溶液。
分别移取5.0ml空白溶液、标准溶液、各定位溶液,置于顶空瓶中,密封,即得。
6.2.2分析色谱系统稳定后,按下列顺序进样分析:6.3 耐用性目的:确认在测定条件有微小变动时,测定结果不受影响的承受程度。
接受标准各项改变测试结果均应满足系统适应性要求。
6.3.1柱温改变试验(±2%),其他条件不变。
原柱温:40℃改变后柱温(1)39℃(2) 41℃溶液配制:同“6.1系统适应性”项下。
分析进样:同“6.1系统适应性”项下。
6.3.2改变载气流速(±5%),其他色谱条件不变。
原载气流速:4.8ml/min改变后载气流速:(1)4.6ml/min(2)5.0 ml/min溶液配制:同“6.1系统适应性”项下。
分析进样:同“6.1系统适应性”项下。
6.3.3改变色谱柱批号,其他色谱条件不变。
用同一型号、不同批号的色谱柱对系统适应性进行测试。
溶液配制:同“6.1系统适应性”项下。
分析进样:同“6.1系统适应性”项下。
6.4 定量限在仪器系统稳定后,连续进样空白溶液3次,记录空白溶液图谱基线噪声值。
按信噪比(S/N)在10~15范围的要求,配制定量限溶液,进样3次。
以下式计算信噪比(S/N):S/N=2H h上式中:H—定量限溶液图谱中待测残留溶剂峰高;h—空白溶液图谱中在待测残留溶剂出峰位置附近的基线噪声。
如有可能,基线噪声范围应对称地覆盖待测残留溶剂出峰位置。
接受标准:残留溶剂定量限应不大于其限度的50%,3次重复进样所得目标峰面积RSD不大于10%。
6.5检测限在仪器系统稳定后,连续进样空白溶液3次,记录空白溶液图谱基线噪声值。
按信噪比(S/N) 3~5范围之内的要求,配制检测限溶液。
信噪比(S/N)计算方法同“6.4 定量限”项下。
6.6 线性与范围目的:测试在给定的范围内,待测物的响应值与供试品中被分析物的浓度成正比例关系的程度。
注:线性范围从各待测残留溶剂定量限到标准溶液浓度的120%,共8个点,分别为:定量限、10%水平、20%水平、40%水平、60%水平、80%水平、100%水平、120%水平。
残留溶剂线性范围最低浓度应为定量限浓度;若残留溶剂定量限溶液图谱峰面积大于某浓度水平线性溶液图谱中残留溶剂峰面积,则该浓度水平溶液及以下各浓度水平溶液不计算。
接受标准用峰面积和与其相对的浓度绘制标准曲线y=mx+b。
●计算残差平方和;●∣%bias∣≤5%。
●相关系数不小于0.99。
●报告Y轴截距95%置信区间。
●每个浓度水平溶液三次重复进样所得峰面积RSD%不大于10%。
%bias=100b/(mC+b)其中: C为100%水平线性溶液浓度,μg/mlm为线性曲线斜率b为线性曲线Y轴截距6.6.1溶液配制空白溶液:DMI。
标准储备溶液:精密称取乙醇0.25g、丁酮0.25g、甲苯 0.0445g、DMF0.044g置于已有20ml DMI的100.0ml容量瓶中,以DMI稀释至刻度,混匀。
其中乙醇2500μg/ml、丁酮2500μg/ml、甲苯 445μg/ml、DMF440μg/ml标准溶液:移取标准储备溶液10.0ml,置100.0ml容量瓶中,用DMI稀释至刻度,混匀。
即得乙醇250μg/ml、丁酮250μg/ml、甲苯 44.5μg/ml、DMF44μg/ml。
线性溶液:按照下列水平配制各水平线性溶液。
6.6.2在获得稳定的基线后,按下列顺序进样分析:6.7准确度目的:考察残留溶剂分析方法测定结果与真实值或参考值接近的程度。
注:分别向供试品中加入80%、100%、120%浓度水平稀释溶液,得三个水平准确度溶液。
每个水平配制三份。
接受标准●单一回收率应在80.0%~120.0%之间●各浓度水平内的回收率及各浓度水平回收率平均值之间的RSD 不大于10.0%。
●报告平均回收率95%置信区间6.7.1 溶液配制空白溶液:DMI。
标准溶液:同“6.1系统适应性”项下。
80%稀释液:称取乙醇0.20g 、丁酮0.20g 、甲苯0.0356g 、DMF0.0352g 置于已有20ml DMI 的100ml 容量瓶中,以DMI 稀释至刻度,移取上述溶液10ml ,置100ml 容量瓶中,用DMI 稀释至刻度,混匀。
80%准确度溶液:称取供试品0.25g ,置20ml 顶空瓶中,加入80%稀释液5.0ml ,密封瓶盖,即得。
同法配制三份。
100%稀释液:称取乙醇0.25g 、丁酮0.25g 、甲苯0.0445g 、DMF0.044g ,置于已有20ml DMI 的100ml 容量瓶中,以DMI 稀释至刻度,移取上述溶液10ml ,置100ml 容量瓶中,用DMI 稀释至刻度,混匀。
100%准确度溶液:称取供试品0.25g ,置20ml 顶空瓶中,加入100%稀释液5.0ml ,密封瓶盖,即得。
同法配制三份。
120%稀释液:称取乙醇0.30g 、丁酮0.30g 、甲苯0.0534g 、DMF0.0528g ,置于已有20ml DMI 的100ml 容量瓶中,以DMI 稀释至刻度,移取上述溶液10ml ,置100ml 容量瓶中,用DMI 稀释至刻度,混匀。
120%准确度溶液:称取供试品0.25g ,置20ml 顶空瓶中,加入120%稀释液5.0ml ,密封瓶盖,即得。
同法配制三份。
6.7.2 分析在获得稳定的基线后,按下列顺序进样分析:6.7.3 计算以外标法计算准确度溶液中残留溶剂的测得量,减去供试品中残留溶剂的量,以此差值除以加入的稀释液中残留溶剂量,即得回收率,计算公式如下: 1005P C C W 5C 100%A F ⨯⨯⨯⨯-⨯=⨯-=加入量样品原有量测得量回收率上式中:C F 为准确度溶液各残留溶剂的测定浓度,μg/ml ; W 为供试品的称重,g ;C 为供试品中残留溶剂的含量,ppm ; 计算公式见附件C A 为加入的稀释液各残留溶剂的浓度,μg/ml 。
P 为残留溶剂标准品纯度; SS F F A PC A C 测定浓度⨯⨯=上式中:A F 为准确度溶液图谱中残留溶剂峰面积; A s 为标准溶液图谱中残留溶剂峰面积; C s 为标准溶液中各残留溶剂浓度,μg/ml ; 6.8精密度注:由于实际供试品中目标残留溶剂有些能够检出,有些未检出,此时比较供试品含量测定结果无法反映精密度。