10.1 常见的酸和碱--酸
- 格式:ppt
- 大小:10.32 MB
- 文档页数:88


知识图谱盐酸:刺激性气味,挥发性硫酸:吸水性(作干燥剂),脱水性,溶解放热(稀释时“硫入水”) 紫色石蕊:变红 无色酚酞:不变色 与金属(活泼金属)反应:酸 + 活泼金属 === 盐 + H 2↑ 与金属氧化物(如Fe 2O 3、CuO )反应:H + O === + H 2O 与碱反应:H + OH === + H 2O (中和反应) 与盐(如碳酸盐)反应:H + CO 3 === + H 2O+CO 2↑ 腐蚀性:用途:NaOH :火碱、烧碱、苛性钠 Ca(OH)2:熟石灰、消石灰氢氧化钠:吸水性(易潮解,作干燥剂),易溶于水 氢氧化钙:无吸水性[注:生石灰有吸水性CaO+H 2O===Ca(OH)2],微溶于水 紫色石蕊:变蓝 无色酚酞:变红 与非金属氧化物反应:(如CO 2、SO 2、SO 3)(都生成H 2O ) 与酸反应:H + OH === + H 2O (中和反应)与盐反应:[如Ca(OH)2+Na 2CO 3 === CaCO 3↓+ 2NaOH] 腐蚀性:用途:酸性[酸溶液、一些盐溶液(如AlCl 3溶液)]:pH <7 与溶液酸碱性的关系 碱性[碱溶液、一些盐溶液(如Na 2CO 3溶液)]:pH >7 中性[蒸馏水、一些盐溶液(如NaCl 溶液)]:PH=7 酸性越强:pH 值↘碱性越强:pH 值↗物性 (个性) 酸(H + + 酸根离子)盐酸(HCl )硫酸(H 2SO 4)使指示剂变色 化性 (共性) 物性(个性) 俗称 使指示剂化性 (共性) 碱(金属离子 + OH -)氢氧化钠(NaOH ) 氢氧化钙[Ca(OH)2]与溶液酸碱度的关系p H 值一、酸、碱与指示剂作用跟酸或者碱的溶液起作用而显示不同颜色的物质叫酸碱指示剂,简称指示剂。
常用的指示剂有紫色石蕊溶液和无色酚酞溶液。
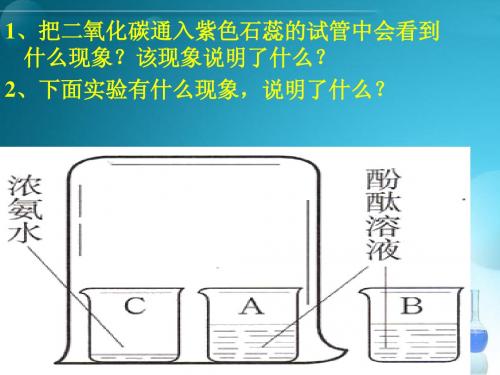
石蕊溶液遇酸溶液变红,遇碱溶液变蓝。
酚酞溶液遇酸溶液不变色,遇碱溶液变红色。
⎧⎨⎩遇酸变红紫色石蕊遇碱变蓝⎧⎨⎩遇酸不变色无色酚酞遇碱变红二、常见的酸1.盐酸和硫酸基本性质及用途2(1)浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱去,这种作用通常叫做脱水作用。



知识点讲义——第十单元酸和碱课题1 常见的酸和碱知识点1 酸、碱与指示剂1.酸碱指示剂(1)定义:能跟酸或碱的溶液起作用而显示不同颜色的物质,叫做酸碱指示剂,通常也简称指示剂。
(2)常用酸碱指示剂:紫色的石蕊溶液和无色的酚酞溶液。
2.酸碱指示剂在酸、碱中的变色情况②向其中一组试管中加入紫色石蕊溶液,向另一组试管中加入无色酚酞溶液。
观察现象。
【实验现象】如下表【实验结论】石蕊溶液遇酸溶液变成红色,遇碱溶液变成蓝色;酚酞溶液遇酸溶液不变色,遇碱溶液变成红色。
(2)酸碱指示剂在酸、碱中的变色情况3【实验目的】探究自制酸碱指示剂的方法并试验自制酸碱指示剂。
【实验步骤】①取几种植物的花瓣或果实,如牵牛花、月季花、紫甘蓝,分别在研钵中捣碎,加入酒精(乙醇与水的体积比为1:1)浸泡;②用纱布将浸泡出的汁液过滤或挤出,得到指示剂;③试验指示剂在白醋、石灰水、盐酸和氢氧化钠溶液中的颜色变化。
【【实验结论】牵牛花、月季花、紫甘蓝汁液在酸、碱溶液中的颜色变化明显,可做指示剂。
【易错点津】(1)溶质只是能溶解的一部分,没有溶解的部分不能算溶;(2)洁净水合物溶解于水时,其溶质是指不含水的化合物,结晶水是溶剂,如:蓝矾(CuSO4●5H2O)溶解于水,溶质是(CuSO4),而结晶水则转为溶剂;(3)有些物质溶于水时,如果和水发生反应,溶质就不是加入的物质,而是反应后生成的物质。
如将SO3通入水中将发生如下反应:SO3 + H2O == H2SO4,其溶质不是SO3 ,而是生成的H2SO4 .知识点2 常见的酸(重、难点)1.几种常见的酸(1)探究盐酸、硫酸的物理性质【实验目的】探究盐酸、硫酸的物理性质【实验步骤】①观察盐酸、硫酸的颜色和状态;②分别打开盛有盐酸、硫酸的试剂瓶,观察现象并闻气味。
①浓盐酸是无色液体,有刺激性气味,易挥发,在空气中会形成白雾,这是浓盐酸挥发出来的氯化氢气体和空气中的水蒸气接触,形成盐酸小液滴的缘故。