化学复习:第2章 第6讲 专题总结
- 格式:ppt
- 大小:619.00 KB
- 文档页数:18
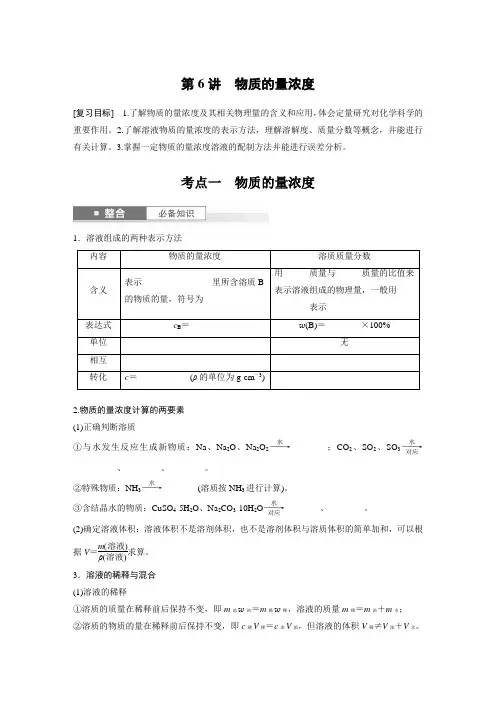
第6讲 物质的量浓度[复习目标] 1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.了解溶液物质的量浓度的表示方法,理解溶解度、质量分数等概念,并能进行有关计算。
3.掌握一定物质的量浓度溶液的配制方法并能进行误差分析。
考点一 物质的量浓度1.溶液组成的两种表示方法内容物质的量浓度溶质质量分数含义表示________________里所含溶质B 的物质的量,符号为______用______质量与______质量的比值来表示溶液组成的物理量,一般用________表示表达式 c B =______w (B)=________×100%单位 无 相互转化 c =____________(ρ的单位为g·cm -3)2.物质的量浓度计算的两要素 (1)正确判断溶质①与水发生反应生成新物质:Na 、Na 2O 、Na 2O 2――→水________;CO 2、SO 2、SO 3――→水对应__________、________、________。
②特殊物质:NH 3――→水________(溶质按NH 3进行计算)。
③含结晶水的物质:CuSO 4·5H 2O 、Na 2CO 3·10H 2O ――→水对应________、________。
(2)确定溶液体积:溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V =m (溶液)ρ(溶液)求算。
3.溶液的稀释与混合 (1)溶液的稀释①溶质的质量在稀释前后保持不变,即m 浓w 浓=m 稀w 稀,溶液的质量m 稀=m 浓+m 水; ②溶质的物质的量在稀释前后保持不变,即c 稀V 稀=c 浓V 浓,但溶液的体积V 稀≠V 浓+V 水。
(2)溶液(溶质相同)的混合①物质的量浓度不同(分别为c 1、c 2)的两溶液:混合前后溶质的物质的量保持不变,即c 1V 1+c 2V 2=c 混V 混。



高二化学知识点:化学反应原理复习高二化学知识点:化学反应原理复习知识讲解第1章、化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收。
一、化学反应的热效应1、化学反应的反应热(1)反应热的概念:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
用符号Q表示。
(2)反应热与吸热反应、放热反应的关系。
Q>0时,反应为吸热反应;Q<0时,反应为放热反应。
(3)反应热的测定测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:Q=-C(T2-T1)式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。
实验室经常测定中和反应的反应热。
2、化学反应的焓变(1)反应焓变物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。
反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。
(2)反应焓变ΔH与反应热Q的关系。
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。
(3)反应焓变与吸热反应,放热反应的关系:ΔH>0,反应吸收能量,为吸热反应。
ΔH<0,反应释放能量,为放热反应。
(4)反应焓变与热化学方程式:把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1书写热化学方程式应注意以下几点:①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。
②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或kJ·mol-1,且ΔH后注明反应温度。


高中化学第2章总结教案主题:化学物质的分类与性质一、学习目标:1. 理解化学物质分类的方法和原理;2. 掌握常见化学物质的性质及其分类;3. 能够用系统的方法总结化学物质的性质和分类。
二、教学重点:1. 化学物质的分类方法;2. 化学物质的性质及其分类;3. 化学式的写法和表示。
三、教学内容:1. 化学物质的分类方法:a. 根据物质的组成,可将物质分为元素和化合物;b. 根据物质的形态,可将物质分为固体、液体和气体;c. 根据物质的不溶性或溶解度,可将物质分为溶解度物质和不溶性物质。
2. 化学物质的性质及其分类:a. 化学物质的物理性质:包括颜色、形状、密度等;b. 化学物质的化学性质:包括燃烧性、反应性等;c. 化学物质的结构性质:包括化学键性质、分子结构等。
3. 化学式的写法和表示:a. 元素符号的写法;b. 化合物的化学式表示;c. 离子的表示方法。
四、教学过程:1. 导入:通过实验或图片,展示不同类型的化学物质,引导学生思考不同化学物质的分类和性质。
2. 教学内容讲解:依次介绍化学物质的分类方法、性质分类和化学式的表示方法,引导学生进行学习。
3. 教学实践:组织学生进行实验或观察,让学生通过实践感受化学物质的性质和分类方法。
4. 总结归纳:让学生结合实验结果,总结化学物质的分类和性质,加深对知识的理解和记忆。
五、作业布置:1. 完成课后习题,巩固对化学物质分类方法和性质的理解;2. 选取一种化学物质,分析其化学性质和结构性质,写出对应的化学式。
六、教学反思:通过本节课的教学,学生应该对化学物质的分类与性质有更深入的理解,能够根据化学式和化学性质判断物质的种类和特性。
同时,教师也应该根据学生的学习情况及时调整教学方法,帮助学生更好地掌握知识点。
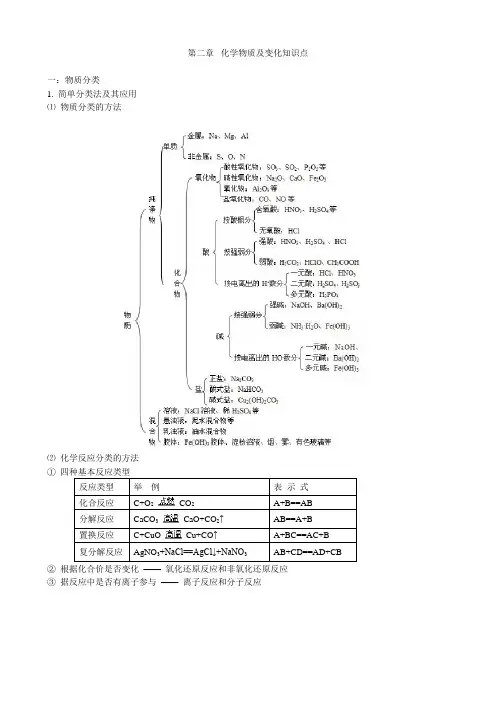
第二章化学物质及变化知识点一:物质分类1. 简单分类法及其应用⑴物质分类的方法⑵化学反应分类的方法①四种基本反应类型反应类型举例表示式化合反应C+O2CO2A+B==AB分解反应CaCO3CaO+CO2↑AB==A+B置换反应C+CuO Cu+CO↑A+BC==AC+B复分解反应AgNO3+NaCl==AgCl↓+NaNO3AB+CD==AD+CB②根据化合价是否变化——氧化还原反应和非氧化还原反应③据反应中是否有离子参与——离子反应和分子反应二、分散系及其分类分散系分散系粒子大小主要特征举例溶液分散质<1nm 透明、稳定、均一NaCl溶液、H2O浊液分散质>100nm 不透明、不稳定、不均一泥水、石灰水胶体1n m<分散质<100nm 较透明、较稳定、均一豆浆、牛奶、墨水(一)、胶体的性质1、丁达尔效应:当光束照射胶体时出现一个光亮的“通路”。
而溶液没有这样的一个现象,所以可以利用此效应区分溶液和胶体。
2、电泳现象①、胶体稳定的原因:a、主要原因:胶体粒子带电,同种胶体粒子的电性相同,它们之间相互排斥阻碍了胶体粒子变大,使它们不易聚沉。
注:胶体本身不带电,胶粒带电。
b、次要原因:胶体粒子作布朗运动。
②、电泳现象:在外加电场的作用下,胶体粒子在分散剂里面作定向移动。
③胶体粒子所带电荷分类:a、正电荷:金属氧化物、金属氢氧化物;例Fe(OH) 3、Fe2O3、卤化银(AgCl、AgBr、AgI)胶体等。
b、负电荷:非金属氧化物、金属硫化物;例SiO2、Ag2S、H2SiO3等。
(二)、胶体的聚沉————中和胶体粒子的电荷1、加电解质溶液2、加相反电荷的胶体二、离子反应(一)、电解质1、电解质:(酸、碱、盐、水)在水溶液里或熔融状态下能够导电的化合物。
非电解质:(包括CO2、SO2)在水溶液里或熔融状态下不能够导电的化合物。
注:电解质实际上是指不与水反应通过自身电离出自由移动的离子而导电的化合物。
例:①、NaCl=Na++Cl-KOH=K++OH-H2SO4=2H++SO42-②、CO2溶于H2O的溶液能导电,那么CO2是电解质吗?回答:CO2+H2O=H2CO3H2CO3=2H++CO32-CO2本身不能电离故CO2不是电解质。

第2章化学反应的基本原理知识点第1章热化学与能量1.几个基本概念1)系统:作为研究对象的那一部分物质和空间a.开放系统:有物质和能量交换 b.封闭系统:只有能量交换 c.隔离系统:无物质和能量交换2)环境:系统之外,与系统密切联系的其它物质和空间3)相:系统中任何物理和化学性质完全相同的、均匀部分——单相(均匀),多相(不均匀)注意:一个气态(固体)一个相;液体,若相溶,一个相,若不相溶,几种液体,几个相同一物质不同状态就是不同相;碳元素同素异形体不同相4)状态:用来描述系统;状态函数:描述系统状态(如pV=nRT)5)状态函数的性质:状态函数是状态的单值函数;当系统的状态发生变化时,状态函数的变化量只与系统的始、末态有关,而与变化的实际途径无关6)状态函数的分类:广度性质:其量值具有加和性,如体积、质量,热容,焓,熵等强度性质:其量值不具有加和性,如温度、压力,密度,摩尔体积等两个广度性质的物理量的商是一个强度性质的物理量7)过程:系统状态发生任何的变化VS 途径:实现一个过程的具体步骤8)化学计量数其中nB 称为B的化学计量数(根据具体的反应式子系数)反应物:nB为负;产物:nB为正9)反应进度ξ:反应进度只与化学反应方程式的书写有关2.反应热:化学反应过程中系统放出或吸收的热量;热化学规定:系统放热为负,系统吸热为正注意:摩尔反应热指当反应进度为1mol时系统放出或吸收的热量3.热效应:等容热效应(弹式量热计);等压热效应(火焰热量计)qV =ΔU qp = ΔU + p(V2–V1)反应热:(两种液体时比热容不同需分开,注意比热单位)摩尔反应热:4.热化学方程式:表示化学反应与热效应关系的方程式注意:先写出反应方程,再写出相应反应热,两者之间用分号或逗号隔开若不注明T, p, 皆指在T=298.15 K,p=100kPa下标明反应温度、压力及反应物、生成物的量和状态5.热力学第一定律封闭系统,不做非体积功时,若系统从环境吸收热q,从环境得功w,则系统热力学能的增加ΔU(U2–U1)为:ΔU=q + w(热力学能从前称为热能)6.内能的特征:状态函数(状态确定,其值确定;殊途同归;周而复始)、无绝对数值、广度性质7.热:系统吸热为正,放热为负热量q不是状态函数8.功:系统对外功为负,外部对系统作功为正功w不是状态函数9.体积功w体的计算w体=–p外(V2 –V1)=–p外ΔV10.焓(状态函数)(kJ/mol)ΔrHm:反应的摩尔焓H =U + pV qp =H2–H1=ΔH(ΔH<0放热;ΔH>0吸热)注意:qV=ΔU(定容)VS qP=ΔH(定压) qp – qV = n2(g)RT – n1(g)RT = Δn(g)RT对于没有气态物质参与的反应或Δn(g)=0的反应,q V »qp对于有气态物质参与的反应,且Δn(g)¹0的反应,qV ¹qp11.盖斯定律:化学反应的恒压或恒容反应热只与物质的始态或终态有关而与变化的途径无关标准压力p=100kPa12.标准摩尔生成焓:标准状态时由指定单质生成单位物质的量的纯物质B时反应的焓变称为标准摩尔生成焓,记作注意:标准态指定单质的标准生成焓为0。
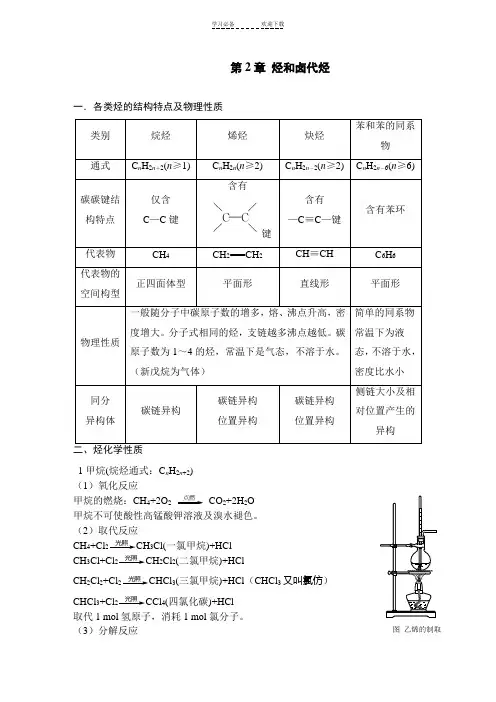
第2章烃和卤代烃一.各类烃的结构特点及物理性质含有键CH===CH1甲烷(烷烃通式:C n H2n+2)(1)氧化反应甲烷的燃烧:CH4+2O2点燃CO2+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH4+Cl光照3Cl(一氯甲烷)+HClCH3Cl+Cl光照2Cl2(二氯甲烷)+HClCH2Cl2+Cl光照3(三氯甲烷)+HCl(CHCl3又叫氯仿)CHCl3+Cl光照4(四氯化碳)+HCl取代1 mol氢原子,消耗1 mol氯分子。
(3)分解反应图乙烯的制取甲烷分解:CH高温22. 乙烯(烯烃通式:C n H2n)=CH2↑+H2O(消去反应)乙烯的制取:CH3CH2浓硫酸170℃2(1)氧化反应乙烯的燃烧:CH2=CH2+3O点燃2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=CH2+Br2Br—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3与氯化氢加成:CH2=CH2+HCl催化剂CH3CH2Cl与水加成:CH2=CH2+H2O催化剂CH3CH2OH马氏规则:当不对称烯烃与卤化氢加成时,通常氢加到含氢最多的不饱和碳原子一侧。
(3)聚合反应乙烯加聚,生成聚乙烯:n CH2=CH2催化剂[CH2—CH2 ] n(4)1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br CH2Br-CHBr-CHBr-CH2Br 与溴1,2-加成:CH2=CH-CH=CH2+Br CH2Br-CHBr-CH=CH2与溴1,4-加成:CH2=CH-CH=CH2+Br CH2Br-CH=CH-CH2Br(5)烯烃的顺反异构(a)并不是所有的烯烃都存在顺反异构,只有当双键两端的同一碳原子上连接不同的原子或原子团时烯烃才存在顺反异构。
(b)判断烯烃是否存在顺反异构的方法:①分子中有碳碳双键;②双键两端的同一碳原子上不能连接相同的基团。

第二单元 我们周围的空气课题1 空 气考试要求:知道空气的主要成分,认识空气对人类生活的重要作用。
了解大气污染的原因及其危害. 能从组成上区分纯净物和混合物一、空气成分的研究史1、18世纪70年代,瑞典科学家舍勒和英国的科学家化学家普利斯特里,分别发现并制得了氧气。
2、法国科学家拉瓦锡最早运用天平作为研究化学的工具,用定量的方法研究了空气的成分,第一次明确提出了“空气是由氧气和氮气组成的”。
其中氧气约占空气总体积的1/5的结论。
二、空气中氧气成分的测定:(考点一)1、装置图(见书P27)2、实验现象:A 、红磷燃烧发出黄白色火焰,放出热量,冒出白色浓烟B 、(过一会儿白烟消失,装置冷却到室温后打开弹簧夹)烧杯内的水倒流入集气瓶,约占瓶子容积的1/5。
3、实验结论:说明空气不是单一的物质;氧气约占空气总体积的1/5。
4、原理:表达式:磷(P ) + 氧气(O 2)五氧化二磷(P 2O 5) 化学方程式: 4P + 5O 2 2P 2O 5 5、注意事项:A 、所用的红磷必须过量,过少则氧气没有全部消耗完B 、要等集气瓶(装置)冷却后才能打开弹簧夹,C 、装置的气密性要好,(否则测量结果偏小),D 、要先夹住橡皮管,然后再点红磷(否则测量结果偏大)。
思考:可否换用木炭、硫磺等物质?如能,应怎样操作?答:不能用木炭或蜡烛(燃烧产生了气体,瓶内体积变化小),不能用铁(铁在空气中不能燃烧)6、实际在实验中测得的结果比真实值小,其原因可能是A 红磷量不足;B 装置气密性差;C 未冷却至室温就打开止水夹;D 、没有预先在导管中装满水三、空气的主要成分(考点二)(按体积分数):氮气(N 2)78%,氧气(O 2)21%(氮气比氧气约为4:1),稀有气体0.94%,二氧化碳(CO 2)0.03%,其它气体和杂质0.03%。
空气的成分以氮气和氧气为主,属于混合物。
空气成分口诀:氮七八氧二一,零点九四是稀气;零点零三有两个,二氧化碳和杂气四、物质的分类:纯净物和混合物(考点三)点燃点燃1、纯净物:由一种物质组成的,“纯净”是相对的,绝对纯净的物质是没有的,只要杂质含量低,不至于对生产和科学研究产生影响的物质就是纯净物。

第二章 化学物质及其变化第一讲 物质的组成、性质和分类考点1 物质的组成与分类一、元素、微粒及物质间的关系1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
2.元素:具有相同核电荷数(即质子数)的一类原子的总称。
3.元素与物质的关系元素A――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物4.元素在物质中的存在形态(1)游离态:元素以单质形式存在的状态。
(2)化合态:元素以化合物形式存在的状态。
5.混合物和纯净物(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
6.同素异形体(1)同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同 ,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(2)同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化,但不属于氧化还原反应。
7.元素、微粒及物质间的关系图二、物质的分类1.交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)2.树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。
考点2物质的性质与变化一、物质的性质与变化二、单质、氧化物、酸、碱、盐的转化关系1.理解物质转化关系图2.形成转化关系一条线:(氢化物→)单质→氧化物→酸或碱→盐。
三、化学反应的分类化学反应⎩⎪⎪⎪⎨⎪⎪⎪⎧按反应物、生成物种类及数目多少分为⎩⎪⎨⎪⎧化合反应分解反应置换反应复分解反应按反应中有无离子参与分为⎩⎪⎨⎪⎧离子反应非离子反应按反应中有无电子转移分为⎩⎪⎨⎪⎧氧化还原反应非氧化还原反应按反应进行的程度和方向分为⎩⎪⎨⎪⎧可逆反应不可逆反应按反应的能量变化分为⎩⎪⎨⎪⎧吸热反应放热反应四、物质变化中的“三馏”“四色”“五解”和“十八化”归类考点3分散系与胶体一、分散系1.概念:把一种(或多种)物质(分散质)分散在另一种(或多种)物质(分散剂)中所得到的体系。
化学第二章知识点总结化学第二章主要介绍了化学的基本概念和化学方程式的应用。
下面对本章涉及的主要知识点进行总结。
1. 元素和化合物:元素是由相同类型的原子组成的物质,化合物是由不同元素通过化学键结合而成的物质。
2. 原子:原子是构成物质的基本单位,由质子、中子和电子组成。
原子量是元素相对于碳-12同位素的质量。
3. 化学式:化学式用来表示化合物中元素的种类和数量。
分子式表示化合物中原子的实际个数,而实际式则表示化合物中各元素的摩尔比。
4. 化学反应:化学反应是物质转化为其他物质的过程,可以通过化学方程式来描述。
5. 定律和原理:化学反应遵循一些定律和原理,如质量守恒定律、比如vin休特定律、电荷守恒定律等。
6. 摩尔:摩尔是化学中计量物质的单位,摩尔质量是一个物质的摩尔质量除以1摩尔的质量。
7. 化学方程式:化学方程式描述化学反应中物质的转化关系。
方程式中的化学式表示了反应物和生成物的种类和数量。
8. 反应类型:化学反应可以分为合成反应、分解反应、置换反应、双替反应等不同类型。
9. 配平方程式:配平方程式是为了满足质量守恒定律和电荷守恒定律,使化学方程式符合实验结果。
10. 摩尔比:摩尔比是化学反应中各组分的摩尔个数之比。
11. 综合反应、实验摩尔质量和理论摩尔质量:综合反应是根据实验数据确定化学方程式中各物质的摩尔比。
实验摩尔质量是实验数据确定的反应物和生成物的摩尔质量,而理论摩尔质量是根据化学方程式计算得出的摩尔质量。
12. 摩尔及摩尔式:摩尔是化学反应过程中的基本单位,摩尔式表示化学方程式中各物质的摩尔个数和种类。
13. 反应物的限定性、过剩和理论产量:反应物的限定性是指在反应中消耗完的反应物,过剩是指在反应中剩余未消耗的反应物,理论产量是根据化学方程式计算得出的理论上可能的产量。
14. 化学计量:化学计量是通过化学方程式和摩尔比计算化学反应的摩尔和质量关系。
15. 摩尔体积:摩尔体积是气体在一定条件下,占据的体积与摩尔数之间的关系。
化学反应原理第二章重难点复习提纲一、可逆反应的特征:反应物和生成物共存,不可能完全反应例题1、N2+3H22NH3 ΔH=-QA.反应开始时充入1mol N2,平衡时放出热量Q kgB.当反应达到平衡时,放出Q kg热量的同时生成2mol NH3例题2、在一密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g),已知反应过程中的某一时刻SO2、O2、SO3的浓度分别为:0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是A.SO2为0.4mol/L,O2为0.2mol/LB.SO2为0.15mol/LC.SO2,SO3均为0.25mol/LD.SO3为0.4mol/L二、化学反应达到平衡的标志1、正反应速率等于逆反应速率(一定平衡)例题:(1)可以证明可逆反应N2 + 3H22NH3已达到平衡状态的是A.一个N≡N断裂的同时,有3个H-H键断裂B.一个N≡N键断裂的同时,有6个N-H键断裂C. 2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)E.单位时间内生成1molN2,同时生成3molH2F.单位时间内生成2mol NH3,同时生成3molH22、各组分的浓度,物质的量,质量分数,体积分数,颜色(有颜色参与)不变(一定平衡)3、压强不变 PV=nRT(考虑反应前后气体系数是否相等)4、密度不变(考虑恒容、恒压及是否有固体参与反应)5、平均相对分子质量不变(考虑气体系数及是否有固体参与反应)例题(1)、在恒温下的密闭容器中, 有可逆反应: 2NO + O2 2NO2 (正反应为放热反应), 不能说明已经达到平衡状态的是()A、正反应生成NO2的速率和逆反应生成O2的速率相等B、反应容器中压强不随时间的变化而变化C、混合气体颜色深浅保持不变D、混合气体的平均分子量不随时间变化而变化在密闭容器中反应,达到平衡状态的标志是: (2)、可逆反应:2AB(g)=2A(g) +B2(s)A.混合气体的密度不再改变的状态;B.压强不再发生改变;C.混合气体的平均相对分子质量不再改变的状态三、平衡常数1、K的表达式:平衡时,生成物浓度系数次方的乘积与反应物浓度系数次方的乘积是一个常数(纯固体和溶剂不列入平衡常数表达式)例题:写出平衡常数K的表达式(1)mA(g)+nB(s) 3C(g)(2)CO(g)+H2O(g) CO2(g)+H2(g)(3)3Cu(s)+8H+(aq)+2NO3(aq)-=3Cu2+(aq)+2NO(g)+4H2O(l)2、K与Q的关系:判断化学反应是否达到平衡状态例题(1).在可逆反应2SO2+O22SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Q c为浓度商) ( )。
化学高二第2章知识点归纳总结高二化学第2章知识点归纳总结第一节:化学键的形成与性质在化学中,化学键是指原子通过电子的共享或转移而形成的连接。
化学键的形成与性质对于理解化学反应和分子结构至关重要。
下面将对化学键的形成和一些常见化学键的性质进行总结。
1. 电子的共享和转移化学键的形成主要涉及到电子的共享和转移。
在共价键中,原子通过共享电子来建立连接。
在离子键中,原子通过电子的转移来形成稳定的正负离子之间的吸引力。
共价键和离子键是最常见的两种化学键类型,也是描述分子和化学反应的重要工具。
2. 共价键的特点共价键在非金属元素之间形成,其中的电子是共享的。
共价键的一些重要特点包括:- 强度:共价键通常比离子键弱,但强于金属键。
- 构型:通过共价键形成的分子具有特定的几何构型,如线性、三角形平面、四面体等。
- 极性:共价键可以是极性的或非极性的,取决于原子之间的电负性差异。
3. 离子键的特点离子键是金属和非金属元素之间形成的。
离子键的一些重要特点包括:- 强度:离子键通常是较强的化学键。
- 结构:离子键会形成晶体结构,其中阳离子和阴离子按照特定的比例排列。
- 极性:离子键通常是极性的,因为阳离子和阴离子之间存在电荷差异。
第二节:化学键的类型和命名在上一节中我们已经了解到了化学键的形成与性质,现在进一步总结化学键的类型和相应的命名规则。
1. 单一键、双键和三键原子间的共价键可以根据共享的电子数量来分类。
单一键是指一个共享电子对,双键是指两个共享电子对,而三键是指三个共享电子对。
在化学式中,一条线表示单一键,两条线表示双键,三条线则表示三键。
2. 极性共价键极性共价键是指在共享电子对中,由于原子的电负性差异而导致电子云不对称分布的情况。
在极性共价键中,电子云更加靠近电负性较大的原子。
在命名中,极性共价键可以用箭头表示。
3. 金属键金属键是金属元素之间形成的一种特殊的连接方式。
金属键的形成涉及到金属的电子云在整个金属中的扩展和流动。
高一化学必修2第二章六个重难点 详细解析1、化学反应中热量的变化我们在做化学实验时,经常会感受到有热量的变化,比如钠与水的反应等,其实在化学反应中,不仅有物质的变化,即新物质的生成,而且还伴随着能量的变化,有的反应是吸热的,有的反应是放热的。
而化学反应中物质变化的实质是旧化学键断裂和新化学键形成。
化学反应是化学科学研究的核心,化学反应过程中的物质变化要遵循质量守恒定律,而能量变化要遵循能量守恒定律。
在化学反应过程中一定存在着能量的变化,而这些能量变化大多数表现为热量的变化,这就实现了化学能与热能的转化。
1.从化学键的角度理解在化学变化前后,参加反应的原子的种类和个数并没有改变,只是进行了原子之间的重组和整合;原子进行重组、整合的过程,实际上就是反应物中化学键断裂和生成物中化学键形成的过程。
由于反应物中化学键的断裂要消耗能量,而生成物中化学键的形成要释放能量,因此我们将化学反应中能量变化表示为反应物――――――――――――→旧化学键断裂吸收能量新化学键形成释放能量生成物 这样,当反应中吸收的能量大于释放的能量,则反应表现为吸收能量,该反应为吸热反应; 当反应中吸收的能量小于释放的能量,则反应表现为放出能量,该反应为放热反应。
【典例1】 已知:①1 mol H 2分子中化学键断裂时需吸收436 kJ 的能量;②1 mol Cl 2分子中化学键断裂时需吸收243 kJ 的能量;③由氢原子和氯原子形成1 mol HCl 分子时释放 431 kJ 的能量。
则1 mol H 2和1 mol Cl 2反应生成氯化氢气体时的能量变化为( )A .放出能量183 kJB .吸收能量183 kJC .吸收能量248 kJD .吸收能量862 kJ 解析 根据反应的化学方程式:H 2+Cl 22HCl ,可知在反应过程中,断裂1 mol H—H 键、1 mol Cl—Cl 键,同时形成2 mol H—Cl 键。
计算可知生成2 mol HCl 气体时,吸收的热量为436 kJ +243 kJ =679 kJ ,放出的热量为431 kJ ×2=862 kJ ,故反应中放出的热量为862 kJ -679 kJ =183 kJ ,A 对。