第二节 氯及其化合物
以氯气的制备为例探究实验室气体制备思路
(1)将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。
第2课时 氯气的实验室制法和氯离子的检验 装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
(2)制取的氯气有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗。
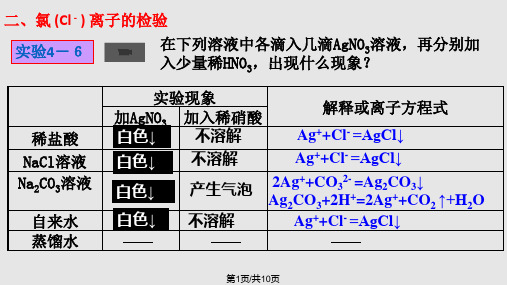
有少量白色沉淀生成
沉__淀__不__溶__解___
⑤蒸馏水
__无__明__显__变__化_
无__明__显__变__化___
2.请写出上述实验中有关的化学方程式: ② NaCl+AgNO3===AgCl↓+NaNO;3 ③ Na2CO3+2AgNO3===Ag2CO3↓+2NaN,O3 Ag2CO3+2HNO3===CO2↑+H2O+2AgNO。3
提示:利用焰色试验为黄色证明Na+的存在;加入硝酸酸化的 硝酸银溶液,生成白色沉淀,证明Cl-的存在。
【思维拓展】 以氯气的制备为例探究实验室气体制备思路
1.设计气体制备装置的基本思路
2.气体制备装置的连接顺序
3.装置要点分析
(1)气体发生装置的组装: ①组装仪器的一般原则:先零后整、先主后辅,从下到上、从左到右。 ②在装入药品前要检查装置的气密性,其基本方法是:一般先把导气管 插入盛水的水槽中,把有关活塞关闭,微热主发生器,有气泡从水中冒出, 停止微热后,水倒吸进入导气管形成一段水柱,表示装置气密性良好。
【思考·讨论】 (1)实验室制备氯气的装置中,盛放饱和食盐水和浓硫酸的 洗气瓶能否颠倒位置?为什么?
提示:不能。若颠倒位置浓硫酸将水蒸气吸收后,气体通过 饱和食盐水时又会混入水蒸气。
(2)将1 mol MnO2与含4 mol HCl的浓盐酸反应,能否制 得1 mol Cl2?为什么?