- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
确;平衡常数改变,则意味着温度必然改变,平衡必定移动,C项正确;通 过改变除温度之外的其他条件使平衡移动,则平衡常数不变,D项不正 确。
2020/10/27
4.高温下,某反应达平衡,平衡常数K=
c(CO) c(H2O) c(CO2) c(H2)
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
⑩温度和压强一定时,混合气体的密度不再变化
讨论:在上述⑥~⑩的说法中能说明2NO2 达到平衡状态的是_⑥__⑦__⑧__⑨_⑩__。
N2O4
2020/10/27
解析:这是一个反应前后气体体积不变的反应。无论是否平衡, 混合气体的总压强、 M 、ρ都不发生变化(从其公式推导)。 ①②④从“v正是否等于v逆”来判断。③⑤⑥从“浓度保持 不变”来判断。
2020/10/27
②含量特征:指“定”,即反应混合物中各组成成分的含量保 持不变。
(2)间接特征:指所表述的内容并非直接而是间接反映“等” 和“定”的意义。
①反应物的转化率保持不变。 ②产物的产率保持不变。 ③平衡体系的颜色保持不变。 ④绝热的恒容反应体系中的温度保持不变。
2020/10/27
(3)“特殊”特征:指所表述的内容并不能表明所有反应均已达 平衡状态,只是在某些特定的情况下才能表示反应已经达 到化学平衡状态。
平衡 0.4 mol 1.8 mol
变化 0.6 mol 1.8 mol
由变化量与化学计量数成正比可知x=3。
A中说明反应2 mol A同时生成1 mol B,达平衡状态;B中密度
始终不变;C中压强始终不变(Δv=0);D可作为判据。
2020/10/27
3.下列叙述中,不正确的是( ) A.某特定反应的平衡常数仅是温度的函数 B.催化剂不能改变平衡常数的大小 C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡 D.化学平衡发生移动,平衡常数必发生变化 答案:D 解析:化学平衡常数只受温度影响,与是否使用催化剂无关,A、B选项均正
”或“不能确定”)。
(4)850 ℃时,在1 L固定容积的密闭容器中放入2 molCO2和1 mol H2,平衡后CO2的转化率为__3_3_._3_%____,H2的转化率为 __6_6_._7_%____。
2020/10/27
解析:化学平衡常数是反应达到平衡时,生成物浓度化学计量 数次幂之积与反应物浓度化学计量数次幂之积的比值,本 题反应的化学平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)] 。
2020/10/27
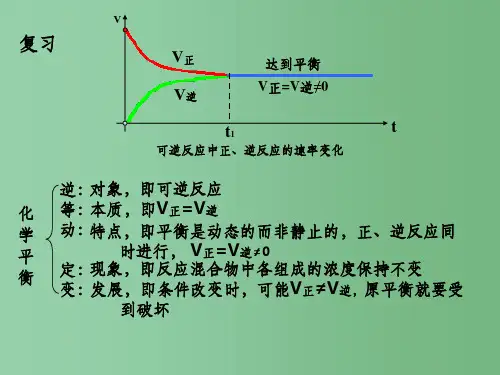
2.化学平衡状态的含义 (1)构成化学平衡体系的基本要求是反应物和所有产物均处于
同一反应体系中,反应条件保持不变。 (2)达到化学平衡状态时,体系中所有反应物和生成物的含量
保持不变。但反应并没停止,而且正、逆反应速率相等,这说 明化学平衡是动态平衡。 (3)化学平衡研究的对象是可逆反应,对于弱电解质的电离、气 体的溶解和逸出、固体的溶解和结晶及盐类的水解等存在 可逆过程的问题都可用平衡的观点去分析。
①体系中气体物质的总质量保持不变。 ②体系中气体物质的总物质的量(或体积或分子个数)保持不
变。 ③体系中气体物质的平均相对分子质量保持不变。
2020/10/27
④气体的总压强不再发生改变。
⑤体系中气体的密度不再发生改变。
以上五项中,对于Δn≠0的可逆反应如2NO(g)+O2(g)
2NO2(g)来说,除①外均可作为判断平衡的特征;但
2020/10/27
5.在一固定容积的密闭容器中,进行如下化学反应
:CO2(g)+H2(g)
CO(g)+H2O(g),其化学平衡常
数K和温度T的关系如下表:
T(℃) 700 800 850 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
2020/10/27
试回答下列问题: (1)该反应为____吸_热_____反应(填“吸热”或“放热”)。 (2)能判断该反应是否达到化学平衡状态的依据是__b_、_c__。 a.容器中气体压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
对于Δn=0的可逆反应如H2(g)+I2(g)
2HI(g)来说,此
五项均不能作为判断平衡的特征。
2020/10/27
【例1】下列方法中可以证明2HI(g) 平衡状态的是___②_⑥__⑨____。
H2(g)+I2(g)已达
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
学案27 化学平衡
2020/10/27
轻松学教材
2020/10/27
可逆反应与化学平衡 1.可逆反应及其特征 (1)溶液达到饱和之后,溶液中固体溶质溶解和溶质分子回到
固体溶质表面的结晶过程一直在进行,而这两种过程速率 相等,我们把这类过程称做可逆过程,表述这类过程可采用 号,把从左向右的过程称做正反应,把从右向左的过程称做 逆反应。 (2)可逆反应指反应物和产物必须同时存在于同一反应体系中 ,而且在相同条件下,正、逆反应都能够自动进行。
6.PCl5的热分解反应如下:
PCl5(g)
PCl3+Cl2(g) ΔH>0
(1)写出反应的平衡常数表达式。 KcPcClP3Ccl5Cl2
(2)已知t ℃时,在容积为10.0 L的密闭容器中充入2.00 mol
PCl5,达到平衡后,测得容器内PCl3的浓度为0.150 mol/L。 ①该温度下的平衡常数K为___0_.4_5_0____。
反应速率减小的倍数
D.方向移动
2020/10/27
答案:A 解析:由平衡常数概念可知K值越大,X的转化率越大,A项正确
。达平衡时2v正(X)=v逆(Z),故B项错。达平衡后降低温度,正 逆反应速率均减小,又因平衡向正反应方向移动,所以正反 应速率减小的倍数小于逆反应速率减小的倍数,C项错。增 大压强平衡不移动,升高温度平衡逆向移动,D项错。
A.vA(正)∶vB(逆)=2∶1 B.混合气体密度不再变化
C.混合气体压强不再变化
D.A的转化率不再变化 答案:AD
2020/10/27
解 析 : 由 题 意 知 , 平 衡 时 n(C)=0.45 mol/(L·min)×2 L×2
min=1.8 mol
根据 2A(g)+B(g)
xC(g)知
开始 2 mol 1 mol 0 mol
2020/10/27
3.化学平衡状态的标志 以mA(g)+nB(g) xC(g)+yD(g)(m+n≠x+y)为例。 (1)实质:v正=v逆,如v(B)耗=v(B)生;v(C)耗∶v(C)生=1∶1; (2)某物质的质量、浓度、物质的量、质量分数等不变; (3)反应体系的总物质的量或压强恒定; (4)若A为有色气体,气体的颜色不变; (5)单位时间内A物质化学键的断裂量等于形成量; (6)转化率不变,如α(A)不变; (7)体系的平均相对分子质量不变。
2020/10/27
(3)800 ℃时,向固定容积的密闭容器中放入混合物,起始浓度
分 别 为 c(CO)=0.01
mol/L,c(H2O)=0.03
mol/L,c(CO2)=0.01 mol/L,c(H2)=0.05 mol/L,则反应开始 时,H2O的消耗速率比生成速率____小______(填“大”“小
,H2浓度减小,说明升温平衡向正反应方向进行,因此正反应 是吸热的,A项正确;由于恒温恒容,若增大压强,只有充入气 体,若充入“惰性”气体,则平衡不移动,H2浓度不变,若通 入CO2,H2浓度会减小,但若通入H2、CO或H2O(g),则H2浓 度会增大,B项错误;升高温度,正逆反应速率都会增大,C项 错误。
2020/10/27
【方法归纳】
2020/10/27
2020/10/27
2020/10/27
2020/10/27
2020/10/27
体验热身
2020/10/27
1.(2009·杭州模拟)等物质的量的X(g)与Y(g)在密闭容器中进
行可逆反应:X(g)+Y(g)
2Z(g)+W(s) ΔH<0,
下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z) C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向
2020/10/27
2.在某温度时将2 mol A和1 mol B两种气体通入容积为2 L
的密闭容器中,发生如下反应:2A(g)+B(g)
xC(g),
2 min时反应达平衡状态,经测定B的物质的量为0.4 mol,C的 反应速率为0.45 mol/(L·min)。下列各项能表明该反应达到 平衡的是( )
CO2(g)+H2(g) CO(g)+H2O(g) 起始量(mol) 2 1 0 0 转化量(mol) x x x x 平衡量(mol) 2-x 1-x x x 根据化学平衡常数的关系可知:(2-x)(1-x)=x2 解得x=2/3,则CO2的转化率为33.3%,H2的转化率为66.7%。
2020/10/27
2020/10/27
②在210℃时,反应PCl5(g)
PCl3(g)+Cl2(g)的平衡常数K′
为1,则t______<210 ℃(填“>”“=”或“<”)。
③该温度下PCl5的分解率为__7_5_.0_%_____。
2020/10/27
2020/10/27
重点探究
2020/10/27
一、化学平衡状态的判断 可逆反应达到化学平衡状态时有两个主要特征:一是正反应