必修一第一章第一节第二课时
- 格式:doc
- 大小:55.50 KB
- 文档页数:3

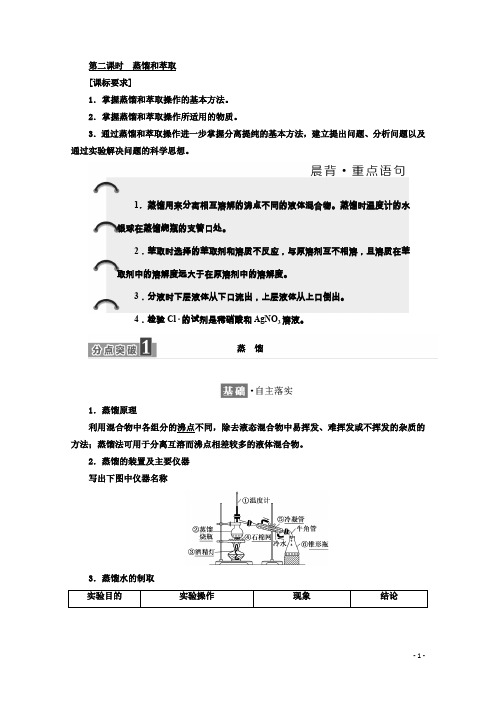
第二课时 蒸馏和萃取[课标要求]1.掌握蒸馏和萃取操作的基本方法。
2.掌握蒸馏和萃取操作所适用的物质。
3.通过蒸馏和萃取操作进一步掌握分离提纯的基本方法,建立提出问题、分析问题以及通过实验解决问题的科学思想。
1.蒸馏原理 利用混合物中各组分的沸点不同,除去液态混合物中易挥发、难挥发或不挥发的杂质的方法;蒸馏法可用于分离互溶而沸点相差较多的液体混合物。
2.蒸馏的装置及主要仪器写出下图中仪器名称3.蒸馏水的制取1.蒸馏用来分离相互溶解的沸点不同的液体混合物。
蒸馏时温度计的水银球在蒸馏烧瓶的支管口处。
2.萃取时选择的萃取剂和溶质不反应,与原溶剂互不相溶,且溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
3.分液时下层液体从下口流出,上层液体从上口倒出。
4.检验Cl -的试剂是稀硝酸和AgNO 3溶液。
蒸 馏[特别提醒] 用AgNO 3溶液检验自来水中的Cl -时要用稀HNO 3酸化而不能使用盐酸和硫酸酸化。
1.(1)实验室制取蒸馏水的装置与常用蒸馏装置相比,少了温度计。
是什么原因呢?(2)为什么冷却水通入方向与被冷凝蒸气流向相反?提示:(1)温度计的作用是控温和显示加热范围。
因为制蒸馏水是除去溶解在水中的难挥发性杂质,蒸馏出水,水的沸点恒定为100 ℃,故不需要温度计。
(2)冷却水通入方向与被冷凝蒸气流向相反,是为了使馏出物充分冷却。
2.蒸馏实验中,为什么要使用温度计?应如何放置温度计?提示:在蒸馏实验中,温度计用来测量蒸气的温度,所以温度计的水银球应位于蒸馏烧瓶支管口处。
3.某溶液中加入AgNO 3溶液产生白色沉淀,原溶液中一定含有Cl -吗?提示:不一定;原溶液中也可能含有CO 2-3等杂质离子。
1.蒸馏实验的操作步骤(1)检查蒸馏装置的气密性。
(2)向蒸馏烧瓶中加入待分离或提纯的液体混合物,并加入几粒碎瓷片。
(3)向冷凝管中通入冷却水。
(4)给蒸馏烧瓶加热。
(5)收集馏分。
(6)停止加热,拆卸装置。


地球是一颗既普通又特殊的星球。
二、行星地球
1、地球的普通性
地球是太阳系中的一颗普通行星,这可以从八大行星的结构特征和运动特征进行分析。
通过太阳系八大行星的结构图可以进行分析地球在八大行星中体积和质量都是适中的,与太阳的相对位置也是适中的。
活动三:八大行星的运动共性
展示太阳系八大行星的运动材料,完成相关问题:
(1)从距日远近和自身体积分析地球与太阳系其他行星的共性。
(2)从八大行星的公转方向、公转轨道分析它们的共性。
总结八大行星饶日运动特征:同向性、共面性、近圆性。
2、地球的特殊性
地球是八大行星中唯一存在高级智慧生命的星球。
活动四:地球的特殊性
(1)地球所处的位置对地球的温度有何影响?
(2)地球的体积和质量对地球上存在大气有何影响?
(3)地球上存在大量的液态水与地球所处位置有何关系?
答:(1)地球距离太阳间的距离适中,使得地球上的温度适宜。
(2)地球的体积和质量适中,使得地球的引力适中,气体在表面形成厚厚的大气层,随着地球的演变慢慢形成适合生物生存的大气条件,并且大气层还能缩小昼夜温差。
(3)液态水的存在和距日远近存在很大的关系,距离太阳过近,温度高,水会以气态形式存在;距离太阳过远,温度过低,水会以固态形式存在。
无论固态还是气态水都难以孕育出生命。
同事地球所处的宇宙环境比较安全这也有利于地球形成生命:八大行星各行其道,互不干扰;太阳正处于壮年期,提供的光热资源比较稳定。
延伸提问:除地球外,其他星球上是否存在生命?
人们不断是研制新的工具加强对宇宙的观测。


1.将NaCl固体溶解在水中,下列相关描述不正确的是()A.NaCl=Na++Cl-B.NaCl溶液中存在自由移动的水合钠离子、水合氯离子C.该过程中,水分子的作用是氯化钠溶液能够导电的重要原因D.氯化钠固体中不存在钠离子、氯离子,所以氯化钠固体不导电2.电解质是一类在水溶液里或熔融状态下能够导电的化合物。
下列物质属于电解质的是()A.CuB.K2SO4C.MgCl2溶液D.NaOH溶液3.HCl气体溶于水后形成的溶液称盐酸,该溶液中大量存在的粒子有()A.HClB.HCl、H2OC.H+、Cl-D.H+、Cl-、H2O二、填空题4.电解质溶液的导电实验如图所示,请补全表格。
实验编号溶液接通电源后灯泡是否亮实验解释(用电离方程式表示)①稀盐酸②氢氧化钠溶液③乙醇溶液④蔗糖溶液⑤食盐溶液5.写出下列物质的电离方程式。
(1)H2SO4;(2)KMnO4;(3)Ba(OH)2;(4)NaHCO3;其中,属于酸的是(填序号,下同),属于碱的是,属于盐的是,属于电解质的是。
学习任务单A.H+、Na+、C O32-B.Cl-、Ba2+、S O42-C.H+、OH-、S O42-D.H+、Ag+、N O3-二、填空题4.往碎蛋壳上滴盐酸,会产生一种使澄清石灰水变浑浊的气体。
已知蛋壳的化学成分中含有CaCO3,则上述两个反应的离子方程式分别为:、。
5.同学们利用等浓度等体积的硫酸、硝酸钡、氢氧化钠、碳酸钾四种物质的水溶液对“复分解反应发生的条件”进行再探究。
(1)图1是HCl和NaOH在水中发生电离的示意图,其电离方程式分别为、;以此类推硝酸钡在水中会电离出的离子是(填离子符号)。
图1 图2(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为(填离子方程式);用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质为(填离子方程式)。
(3)通过上述探究发现,在溶液中H+和OH-不能大量共存,还发现在溶液中(填离子符号)也不能大量共存。

高一化学必修一课题:第一节:化学基本实验方法课时:第二课时编号:2学习目标1.掌握过滤、蒸发基本操作2.常用离子检验方法学习重点难点:过滤蒸发的操作学习任务:一.过滤与蒸发1.过滤——适于固液混合物的分离(1)主要仪器:漏斗、烧杯、玻璃棒、铁架台、滤纸等。
(2)在进行过滤操作时要注意以下几个问题:过滤时,将滤纸折叠好放入漏斗,加少量水,使滤纸紧贴漏斗内壁。
滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘。
向漏斗中倾倒液体时,烧杯的尖嘴应与玻璃棒接触;玻璃棒的底端应和过滤器内的三层滤纸的一边轻轻接触;漏斗颈的末端应与烧杯内壁相接触。
以上就是平常所说的“一贴”“二低”“三靠”。
2.蒸发——适于分离溶于溶剂中的溶质(1)主要仪器:铁架台、蒸发皿、酒精灯、玻璃棒。
(2)在进行蒸发操作时要注意以下几个问题:a.在加热蒸发过程中,应用玻璃棒不断搅拌,防止局部过热造成液滴飞溅;b.加热到蒸发皿中剩余较多固体时(出现较多晶体)时应停止加热,用余热蒸干;c.热的蒸发皿应用坩埚钳取下,不能直接放在实验台上,以免烫坏实验台或遇上水引起蒸发皿破裂。
如果确要立即放在实验台上,则要垫在石棉网上。
3.利用所学知识完成P5实验1-1.并思考:1.粗盐水过滤后,滤液仍浑浊,请分析可能的原因?2. 整个过滤蒸发过程中,几次用到玻璃棒?其作用分别是什么?整个过滤蒸发过程中:过滤(1次):引流;蒸发(2次):搅拌,使液体受热均匀转移固体二.SO42-的检验(P6实验1-2)1.试剂:盐酸、BaCl2溶液2.现象:有白色沉淀,且沉淀不溶解3.化学方程式:BaCl2 +H2SO4 ===BaSO4 ↓+2HCl4.问题探讨:(1)在试样中是否含有某种物质时,每次应取少量进行检验,而不能将检测试剂一次全部加入到待检测的试样溶液中,为什么?因为检测试剂不可能只用于一次实验,你第一个实验就把试剂全部用完,那么在做之后的实验的时候,就没有试剂可以用了. 而之后是会有继续的实验证明试剂的成分的.(2)甲、乙两同学分别设计了两个不同的方案检验某试液中是否含有SO42-,评价下列两个方案是否严密?并说明理由。

新课程高中生物必修1全套教案第1章走近细胞第1节从生物圈到细胞第2节细胞的多样性和统一性第2章组成细胞的分子第1节细胞中的元素和化合物第2节生命活动的主要承担者——蛋白质第3节遗传信息的携带者——核酸第4节细胞中的糖类和脂质第5节细胞中的无机物第3章细胞的基本结构第1节细胞膜——系统的边界第2节细胞器——系统内的分工合作第3节细胞核——系统的控制中心第4章细胞的物质输入和输出第1节物质跨膜运输的实例第2节生物膜的流动镶嵌模型第3节物质跨膜运输的方式第5章细胞的能量供应和利用第1节降低化学反应活化能的酶第2节细胞的能量“通货”——ATP第3节ATP的主要来源——细胞呼吸第4节能量之源——光和光合作用第6章细胞的生命历程第1节细胞的增殖第2节细胞的分化第3节细胞的衰老与凋亡第4节细胞的癌变探索生物大分子的奥秘一、教学目标:【知识】:初步了解分子与生物学之间的关系了解中国合成牛胰岛素事件。
【技能】;培养分析分析资料的能力。
【情感与态度】:了解中国是首个人工合成有生物活性的有机物的国家,增强学生的民族自豪感;初步了解分子生物学的成果,帮助学生树立学习的目标;阅读访谈,学习科学家们实事求是、艰苦钻研的精神。
二、教学重难点:激发学生对高中生物的兴趣是本课的重点。
三、教学用具:ppt幻灯片四、教学准备五、教学过程:(一)以概述《细胞与分子》模块作为引入。
师:比较初中阶段所学习的生物知识特点,大家拿到课本可能会想,初中的时候不是已经学过细胞了吗?为什么高中还要再学呢?初中的生物知识着重让学生了解生物学的大概情况,而且因为学生没有相关的化学知识和足够的空间想象能力,所以很多知识在初中阶段是没有办法说明白的。
就拿细胞结构来说吧,初中的时候,老师只能让学生知道动物细胞是由细胞膜、细胞质、细胞核构成,至于细胞为什么是有生命的,细胞是怎么样生活的,都没有办法说得清楚。
只有在同学们在初三、高一学习了化学的基础知识后我们才可以对生命进一步的学习。

人教版高中化学《必修1》§1-1(第二课时)《化学实验基本方法》萃取和分液说课稿山西省晋城市高平市第一中学廖玲各位评委老师:大家好!今天我说课的题目是人教版高中化学必修一第一章第一节《化学实验基本方法》中的萃取和分液。
我将从以下几个方面进行说课:展PPT-2 凡事预则立,不预则废,确定一个详细且针对性强的目标是上好每堂课的第一步。
我是沿着这样的思路来确定目标的:一、教学背景分析分析课标要求:(PPT-3)课标要求学生初步学会物质的检验、分离、提纯等实验技能,体验科学探究的过程,学习运用以实验为基础的实证研究方法。
并能够独立或与同学合作完成实验,记录实验现象,完成实验报告,并能主动进行交流。
教材分析:萃取与分液对于学生来说是全新的分离和提纯操作,它是对溶解性规律的一个应用,其原理也在今后卤族元素和有机物的学习中多次体现,在生活中也有多方面的应用。
也是高中阶段的两个基本实验操作,学生对于相关内容及部分仪器还比较陌生,本节课的主要目的就是让学生了解其操作及过程,学习主要仪器分液漏斗的使用方法,并进一步丰富分离提纯物质的方法和手段。
学情分析:我校属于山西省示范高中,学生基础较好,主动性较强,探究积极。
展示ppt-4已有知识:初中已经学过了有关物质分离提纯的方法,能进行简单的实验操作,在上节课他们已经熟悉了过滤和蒸发及蒸馏这三种分离方法;已具备能力:学生具备简单实验方案的设计能力,能够合作完成实验探究;但缺乏:对分离和提纯方法的进一步认识,实验技能的进一步提高。
基于教材的重要地位及学生的实际情况,我为本节课设定了以下教学目标:展示ppt-5二、实验教学目标及重难点知识与技能:掌握萃取和分液的原理及操作;掌握分液漏斗的使用方法;过程与方法:体验实验室较正规的萃取和分液的操作法;学会对混合物采取合理的分离和提纯的方法。
情感态度与价值观:通过组织学生完成实验让学生养成良好的实验习惯,通过分组实验培养学生的合作精神,让学生明白细节决定成败的道理,体验成功的喜悦。

第一章 第一节 第二课时《反应热与焓变》学案【学习目标】1. 了解反应热与反应焓变之间的关系。
2. 从宏观角度辨识化学能与热能的相互转化,理解化学反应中的能量变化的本质原因。
3. 从微观角度探析化学反应中能量变化的主要原因,能根据键能定量计算反应热。
【学习过程】一、辨识化学反应中能量的转化【任务1】:为什么化学反应有热量变化?二、宏观角度认识反应热 1. 内能体系内物质的的总和,受温度、压强和物质的聚集状态等影响。
2. 焓与焓变实例 原电池 燃放烟花 暖宝宝 能量转化能转化成能能转化成能、能能转化成能3. ΔH 与吸热反应和放热反应【任务2】:化学反应中能量是如何转化的?三、微观角度理解反应热1. 以H 2(g)+Cl 2(g)===2HCl(g)反应的能量变化为例说明,如图所示:化学反应中能量变化注意 等压条件下进行的化学反应,其反应热等于反应的焓变。
体系从环境中吸收能量,反应体系的焓增大, ΔH 为,即ΔH 0。
体系向环境释放能量,反应体系的焓减小, ΔH 为,即ΔH 0。
结论:化学键的和时的能量变化是化学反应中能量变化的主要原因。
1.反应热计算公式:ΔH=E(反应物的总键能)-E(生成物的总键能)化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:其中,E1可看作反应物断裂化学键吸收的总能量,E2可看作生成物形成化学键放出的总能量,反应热ΔH=。
上述反应过程表示该反应为反应。
【例题】根据下列信息判断氢气燃烧生成气态水时的热量变化,其中一定正确的是 ( )A.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙B.生成1 mol H2O(g)时吸收热量245 kJC.H2O(g)分解为H2与O2时放出热量D.氢气和氧气的总能量小于气态水的能量【任务3】:研究反应热的意义是什么?四、反应热应用放热反应:热量综合利用吸热反应:供能、能耗【学习效果】一、单项选择题I1.下列说法正确的是( )A.任何化学反应一定伴随能量的变化,且都以热能形式表现出来B.焓变就是反应热,焓、焓变的单位都是kJ·mol-1C.吸热反应中生成物总能量高于反应物总能量D.水蒸气变为液态水时放出的能量就是该变化的反应热2.下列说法正确的是( )A.吸热反应使环境的温度升高B.当反应放热时ΔH>0,反应吸热时ΔH<0C.需要加热才能发生的反应一定是吸热反应D.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值3.科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。


第二节化学计量在实验中的应用(第2课时)
一、教学目标
【知识目标】
1、进一步巩固物质的量的概念及其与质量、摩尔质量、物质的量、物质的粒子数之间的相互关系
2、知道气体摩尔体积的概念,学会有关气体摩尔体积的简单计算
【能力目标】初步学会分析处理数据、推理演绎、归纳总结的科学学习方法【道德情感目标】
1、体验发现问题、分析问题、解决问题的探究性学习过程
2、通过理解并运用概念,培养严谨的科学态度,激发严谨务实、循序渐进、探索真理的科学态度,培养科学归纳的思维能力、空间想像能力和运用事物规律分析解决问题的。
二、重点与难点
【重点】气体摩尔体积的概念及其简单计算
【难点】气体摩尔体积的计算
三、教学器材
投影仪
四、教学方法与过程
讨论法、归纳法、总结法
〖引入〗通过学习我们已经知道,1mol任何粒子的集合体所含的粒子数目都相同,1mol粒子的质量往往不同。
那么1mol物质的体积是否相同呢?下面通过计算来证明。
〖投影〗
温度0°C、压强101 kPa
〖活动〗学生对数据进行分组计算,然后进行归纳处理。
〖小结〗数据处理的方法:先将数据有序排列,再将数据进行对比异同,观察规律。
〖讨论〗组织学生分组汇报讨论结果,从中提炼并总结出决定影响物质体积大小的微观因素及主要因素。
(此时教师可以通过模型或形象的比喻进行引导)
〖结论〗在温度和压强一定时,物质的体积主要由物质所含粒子的数目、粒子的大小和粒子之间的距离决定。
当粒子数相同,粒子间距离很小时,决定物质体积大小的主要因素是构成物质的粒子大小;粒子间距离很大时,决定物质体积大小的主要因素是粒子之间的距离。
〖小结〗物质在固态或液态时,粒子间的平均距离比气态小得多,决定固体、液体的体积的主要因素是粒子的大小,由于粒子的大小是不同的,所以,1mol 不同的固态或液态物质的体积是不相同的。
而气体物质分子之间的距离很大,故气体物质的体积主要决定于粒子间的距离。
决定粒子间距离的主要因素是温度和压强(有何影响?),不同气体在相同的温度和压强下,分子之间的距离可以看作是相同的,所以,粒子数相同的气体在相同条件下有着近似相同的体积。
反之,在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子,这就是著名的阿伏加德罗定律。
〖讲解〗 气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义。
如果将单位物质的量的气体所占的体积称为气体摩尔体积,用V m 表示,单位为L/mol ,那么在一定温度和压强下,V m 是个常数,如果条件变化了,则V m 亦随之改变。
如在0℃、101 kPa 时,V m =22.4 L/mol ;在25℃、101 kPa 时,V m =24.8 L/mol 。
〖归纳〗归纳得出公式:气体体积V= n •V m
〖小结〗指导学生构建知识网络——小结物质的量、质量、粒子数、气体体积之间的相互关系,用实物投影仪展现学生小结出的不同知识网络,组织学生相互评价,在讨论和交流中再次展现和发展学生的思维。
补充习题
1、标准状况下,2.2 g CO 2的体积是多少?
2、标准状况下10g 氢气的体积是多少升?6.72L 二氧化碳气体的质量为多少克?
3、现有3.4 g H 2S 和0.1 mol HBr 气体。
(1)不同条件下,哪个分子数较多?
(2)相同条件下,哪个该用较大的容器装? (3)不同条件下,哪个质量大?大多少? (4)哪个所含H 原子的物质的量多?多多少? (5)其中含S 和Br 各多少克?
4、标准状况下有(1)6.72LCH 4 (2) 3.01×1023个HCl 分子 (3)13.6gH 2S ,下列对这三种气体的关系从小到大的排列顺序是:
A 、物质的量______________
B 、体积___________________
C 、质量__________________
D 、氢原子数_______________
5、N 2、CO 2、SO 2三种气体的质量比为7:11:16时,它们的分子个数比为___________;物质的量之比为___________;同温同压下体积比为___________。