最新中考化学专项复习物质的分离和除杂专项复习(共17张PPT)教育课件
- 格式:ppt
- 大小:238.50 KB
- 文档页数:18
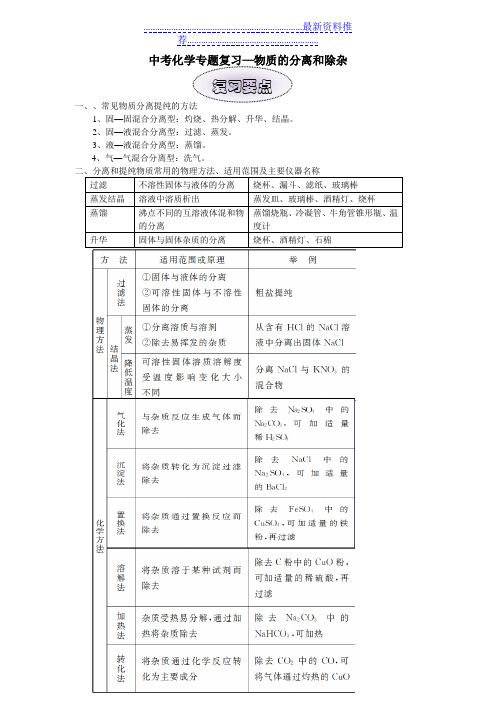
1、固—固混合分离型:灼烧、热分解、升华、结晶。
2、固—液混合分离型:过滤、蒸发。
3、液—液混合分离型:蒸馏。
4、气—气混合分离型:洗气。
三、分离和提纯物质常用的化学方法1、气化法:向混合物中加入适量的某种试剂,使其中的杂质转变为气体逸出而除去。
2、化水法:向混合物中加入适量的某种试剂,使其中的杂质转变为水而除去。
3、沉淀法:向混合物中加入适量的某种试剂,使其中的杂质与该试剂反应转化为沉淀,再过滤从而达到除杂目的。
4、加热(高温)法:加热或高温混合物使杂质分解或变为气体)而除去。
5、溶解法:向混合物中加入适量的某种试剂,使其中的杂质与该试剂反应生成易溶物质,再过滤从而达到除杂目的。
6、吸收法:将气体混合物通过洗气装置,杂质气体被装置内所盛装试剂吸收而除去。
四、物质分离和提纯应遵循的原则及注意事项:1、不能引入新杂质,杂质便于分离2、提纯后的物质成分只增加不减少。
3、实验过程和操作方法简单易行。
4、节约试剂。
对多组分的混合物的分离提纯,一般要考虑物理方法和化学方法综合运用。
5、除杂试剂必须过量。
6、过量试剂必须除尽(去除过量试剂带入的新杂质时应注意加入试剂的顺序)。
7、选择最佳的除杂途径。
KNO3NaCl 降温结晶,过滤(冷却热饱和溶液)(蒸发浓缩,冷却热饱和溶液,减压过滤)NaCl KNO3蒸发浓缩,趁热过滤,冷却结晶NaOH Ca(OH)2 加入适量碳酸钠溶液,过滤H2 HCL 通过碱溶液,再干燥H2HCl,H2O 通过盛有足量生石灰和氢氧化钠固体混合物的干燥管主要基于几点,第一、NaCl的溶解度不算高,而且几乎不随温度变化;第二、KNO3的溶解度岁温度上升增加很快。
NaCl与KNO3,都易溶于水,它们的分离和相互除杂,都是结晶,或者重结晶。
不管是哪种方法,要明确的是杂质永远留在母液中,主要物质要结晶析出。
1.NaCl 中有KNO3 的杂质蒸发结晶,最后留一点母液。
蒸发时温度高,KNO3溶解度高,几乎不析出,而NaCl溶解度不算高,可以结晶出来。






中考专题复习物质的分离与除杂教学相长活动设计除杂质:将混合物中的几种物质分开而区分失掉较纯真的物质,这种方法叫做混合物的分别。
将物质中混有的杂质除去而取得纯真物质,叫提纯或除杂。
除杂题是初中化学的罕见题,它灵敏多变,可以综合调查先生的解题才干。
现罗列几种方法,供大家参考。
除杂的原那么是:方法简便可行,杂质除的洁净!其含义是:能用物理法,就不用化学法,原来杂质既要除掉,又不能引进新杂质。
而且要便于分别。
方法:有过滤法、沉淀法、吸收法、转化法等多种除杂方法。
1 物理方法一、物理方法过滤法.原理:把不溶于液体的固体与液体经过过滤而分开的方法称为过滤法。
如:氯化钙中含有大批碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,失掉固体氯化钙。
假设要取得杂质碳酸钙,可洗濯烘干。
例1. 如何除去食盐中的泥沙。
简析:将含有泥沙的食盐溶于水,应用食盐溶于水而泥沙不溶,经过过滤把泥沙从食盐中除去,再把滤液蒸干即得纯真的食盐。
练习1 以下混合物可以用溶解、过滤、蒸发操作来分别的是:〔〕A.CaCO3 CaO B.NaCl KNO3 C.NaNO3 BaSO4 D.KCl KClO3结晶法.原理:几种可溶性固态物质的混合物,依据它们在同一溶剂中的溶解度或溶解度随温度的变化趋向不同,可用结晶的方法分别。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐渐冷却,由于硝酸钾的溶解度随温度的降低而清楚增大,温度降低,大局部硝酸钾成为晶体析出,而氯化钠的溶解度随温度的降低而增大得不清楚,所以大局部氯化钠仍留在母液中,经过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
例2. 如何除去硝酸钾中大批的氯化钠。
简析:将含有大批氯化钠的硝酸钾配成热的饱和溶液,应用硝酸钾的溶解度受温度变化影响大的性质,采用降温冷却的方法使硝酸钾结晶析出,而氯化钠那么留在母液里,再过滤即可得纯真的硝酸钾晶体。





