天津大学物理化学第二章 热力学第一定律-2
- 格式:ppt
- 大小:2.58 MB
- 文档页数:58




第一章 热力学第一定律1. 热力学第一定律U Q W ∆=+只适用于:答案:D〔A 〕单纯状态变化 〔B 〕相变化〔C 〕化学变化 〔D 〕封闭体系的任何变化2. 1mol 单原子理想气体,在300K 时绝热压缩到500K ,则其焓变H ∆约为:4157J3. 关于热和功,下面说法中,不正确的是:答案:B〔A 〕功和热只出现在体系状态变化的过程中,只存在于体系和环境的界面上〔B 〕只有封闭体系发生的过程中,功和热才有明确的意义〔C 〕功和热不是能量,而是能量传递的两种形式,可称为被交换的能量〔D 〕在封闭体系中发生的过程,如果内能不变,则功和热对体系的影响必互相抵消4. 涉与焓的下列说法中正确的是:答案:D〔A 〕单质的焓值均为零 〔B 〕在等温过程中焓变为零〔C 〕在绝热可逆过程中焓变为零〔D 〕化学反应中体系的焓变不一定大于内能变化5. 下列过程中,体系内能变化不为零的是:答案:D〔A 〕不可逆循环过程 〔B 〕可逆循环过程〔C 〕两种理想气体的混合过程 〔D 〕纯液体的真空蒸发过程6. 对于理想气体,下列关系中那个是不正确的?答案:A〔A 〕0)(=∂∂V TU 〔B 〕0)V U (T =∂∂〔C 〕0)P U (T =∂∂〔D 〕0)P H (T =∂∂ 7. 实际气体的节流膨胀过程中,哪一组的描述是正确的?答案:A〔A 〕 Q=0 ;H ∆=0;P ∆<0 〔B 〕 Q=0 ;H ∆= 0;P ∆>0〔C 〕 Q>0 ;H ∆=0;P ∆<0 〔D 〕 Q<0 ;H ∆= 0;P ∆<08. 3mol 的单原子理想气体,从初态T 1=300 K 、p 1=100kPa 反抗恒定的外压50kPa 作不可逆膨胀至终态T 2=300 K 、p 2=50kPa ,对于这一过程的Q=3741J 、W=-3741J 、U ∆=0、H ∆=0。
9. 在一个绝热的刚壁容器中,发生一个化学反应,使物系的温度从T 1升高到T 2,压力从p 1升高到p 2,则:Q = 0 ;W = 0 :U ∆= 0。



物理化学上册第五版天津大学出版社第二章 热力学第一定律习题答案2-1 1mol 理想气体于恒定压力下升温1℃,试求过程中气体与环境交换的功W 。
解:J T nR nRT nRT pV pV V V p W am b 314.8)(121212-=∆-=+-=+-=--=2-2 1mol 水蒸气(H 2O ,g )在100℃,101.325 kPa 下全部凝结成液态水。
求过程的功。
解: )(g l am b V V p W --=≈kJ RT p nRT p V p gam b 102.315.3733145.8)/(=⨯===2-3 在25℃及恒定压力下,电解1mol 水(H 2O ,l ),求过程的体积功。
)(21)()(222g O g H l O H +=解:1mol 水(H 2O ,l )完全电解为1mol H 2(g )和0.50 mol O 2(g ),即气体混合物的总的物质的量为1.50 mol ,则有)()(2l O H g am b V V p W --=≈)/(p nRT p V p g am b -=-kJ nRT 718.315.2983145.850.1-=⨯⨯-=-= 2-4 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,W a = -4.157kJ ;而途径b 的Q b = -0.692kJ 。
求W b 。
解:因两条途径的始末态相同,故有△U a =△U b ,则 b b a a W Q W Q +=+所以有,kJ Q W Q W b a a b 387.1692.0157.4078.2-=+-=-+=2-5 始态为25℃,200kPa 的5 mol 某理想气体,经a ,b 两不同途径到达相同的末态。
途径a 先经绝热膨胀到 – 28.57℃,100kPa ,步骤的功W a = - 5.57kJ ;在恒容加热到压力200 kPa 的末态,步骤的热Q a = 25.42kJ 。


第一章 气体的pVT 关系1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1TT p V p V V T V V ⎪⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p 摩尔数为133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。

第⼆章热⼒学第⼀定律-附答案第⼆章热⼒学第⼀定律――附答案引⽤参考资料(1)天津⼤学物理化学习题解答(第五版);(2)江南⼤学课件附带习题中选择题和填空题部分;(3)2001-⼭东⼤学-物理化学中的术语概念及练习;⼀、填空题1. 理想⽓体向真空膨胀过程, 下列变量中等于零的有: 。
2. 双原⼦理想⽓体经加热内能变化为,则其焓变为。
3. 在以绝热箱中置⼀绝热隔板,将向分成两部分,分别装有温度,压⼒都不同的两种⽓体,将隔板抽⾛室⽓体混合,若以⽓体为系统,则此过程。
=、=、=4. 绝热刚壁容器内发⽣CH4+2O2=CO2+2H2O的燃烧反应,系统的Q ___ 0 ; W ___ 0 ; ?U ___ 0 ; ?H ___ 0 ===<+==VH?ppVU5. 某循环过程Q = 5 kJ, 则?U + 2W + 3 ?(pV) = __________. -10kJ6. 298K时, S的标准燃烧焓为-296.8 kJ?mol-1, 298K时反应的标准摩尔反应焓?r H m= ________ kJ?mol-1 . 148.47. 已知的, 则的。
-285.848. 某均相化学反应在恒压,绝热⾮体积功为零的条件下进⾏,系统的温度由升⾼到则此过程的;如果此反应是在恒温,恒压,不作⾮体积功的条件下进⾏,则。
=、<9. 25 ℃的液体苯在弹式量热计中完全燃烧 , 放热则反应的。
-6528 、-653510.系统的宏观性质可以分为(),凡与系统物质的量成正⽐的物理量皆称为()。
⼴度量和强度量;⼴度量11.在300K 的常压下,2mol 的某固体物质完全升华过程的体积功W=( ).。
-4.99kJ()kJ 99.4-J 300314.82-g =??-==-=?-=nRT pV V p W12.某化学反应:A(l)+0.5B(g)-- C(g) 在500K 恒容条件下进⾏,反应进度为1mol 时放热10KJ,若反应在同样温度恒压条件下进⾏,反应进度为1mol 时放热()。




第二章热力学第一定律2.1 热力学的理论基础与方法1.热力学的理论基础热力学涉及由热所产生的力学作用的领域,是研究热、功及其相互转换关系的一门自然科学。
热力学的根据是三件事实:①不能制成永动机。
②不能使一个自然发生的过程完全复原。
③不能达到绝对零度。
热力学的理论基础是热力学第一、第二、第三定律。
这两个定律是人们生活实践、生产实践和科学实验的经验总结。
它们既不涉及物质的微观结构,也不能用数学加以推导和证明。
但它的正确性已被无数次的实验结果所证实。
而且从热力学严格地导出的结论都是非常精确和可靠的。
不过这都是指的在统计意义上的精确性和可靠性。
热力学第一定律是有关能量守恒的规律,即能量既不能创造,亦不能消灭,仅能由一种形式转化为另一种形式,它是定量研究各种形式能量(热、功—机械功、电功、表面功等)相互转化的理论基础。
热力学第二定律是有关热和功等能量形式相互转化的方向与限度的规律,进而推广到有关物质变化过程的方向与限度的普遍规律。
利用热力学第三定律来确定规定熵的数值,再结合其他热力学数据从而解决有关化学平衡的计算问题。
2.热力学的研究方法热力学方法是:从热力学第一和第二定律出发,通过总结、提高、归纳,引出或定义出热力学能U,焓H,熵S,亥姆霍茨函数A,吉布斯函数G;再加上可由实验直接测定的p,V,T等共八个最基本的热力学函数。
再应用演绎法,经过逻辑推理,导出一系列的热力学公式或结论。
进而用以解决物质的p,V,T变化、相变化和化学变化等过程的能量效应(功与热)及过程的方向与限度,即平衡问题。
这一方法也叫状态函数法。
热力学方法的特点是:(i)只研究物质变化过程中各宏观性质的关系,不考虑物质的微观结构;(ii)只研究物质变化过程的始态和终态,而不追究变化过程中的中间细节,也不研究变化过程的速率和完成过程所需要的时间。
因此,热力学方法属于宏观方法。
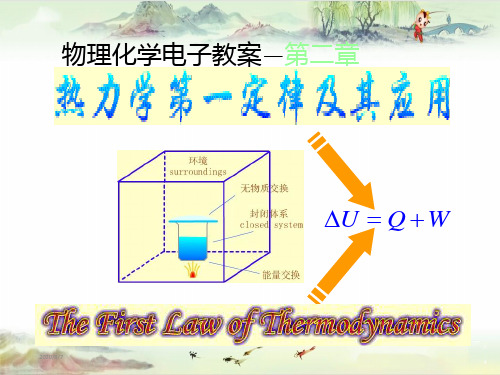
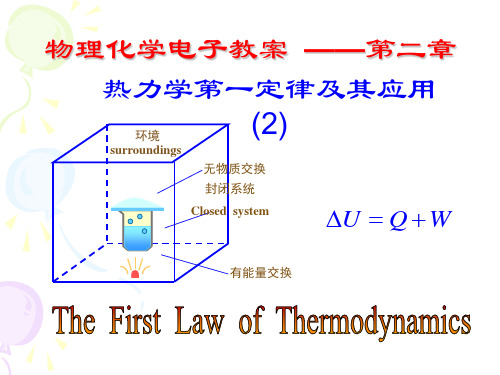
2.2 热力学的基本概念1.系统与环境系统:作为某热力学问题研究对象的部分;环境:与系统相关的周围部分;按系统与环境交换内容分为:(1)敞开系统(open system) :体系与环境间既有物质交换又有能量交换的体系。

天津大学物理化学课件第二章热力学第一定律教学内容:本节课的教学内容选自天津大学物理化学课件,第二章热力学第一定律。
本节内容主要包括热力学第一定律的表述、内能的概念、能量守恒定律以及热力学第一定律的应用。
具体内容包括:1. 热力学第一定律的表述:能量不能被创造或者消灭,只能从一种形式转化为另一种形式,或者从一个物体转移到另一个物体。
在转化或转移的过程中,能量的总量保持不变。
2. 内能的概念:内能是指物体内部所有分子无规则运动的动能和分子势能的总和。
内能与物体的温度、质量和物质的种类有关。
3. 能量守恒定律:能量守恒定律指出,在一个封闭系统中,能量不会凭空消失或凭空产生,只能从一种形式转化为另一种形式,或者从一个物体转移到另一个物体。
在转化或转移的过程中,能量的总量保持不变。
4. 热力学第一定律的应用:通过实际例题,讲解热力学第一定律在实际问题中的应用,如热机效率的计算、热力学循环等。
教学目标:1. 学生能够理解并掌握热力学第一定律的表述和内能的概念。
2. 学生能够运用热力学第一定律分析和解决实际问题。
3. 学生能够理解并应用能量守恒定律。
教学难点与重点:重点:热力学第一定律的表述、内能的概念、能量守恒定律。
难点:热力学第一定律在实际问题中的应用。
教具与学具准备:教具:PPT、黑板、粉笔。
学具:笔记本、笔。
教学过程:1. 实践情景引入:通过一个简单的例子,如烧水的过程,引出热力学第一定律的概念。
2. 讲解内能的概念:通过PPT和板书,详细讲解内能的定义和影响因素。
3. 讲解热力学第一定律:通过PPT和板书,详细讲解热力学第一定律的表述和意义。
4. 讲解能量守恒定律:通过PPT和板书,详细讲解能量守恒定律的表述和意义。
5. 例题讲解:通过PPT和板书,讲解热力学第一定律在实际问题中的应用,如热机效率的计算。
6. 随堂练习:学生分组讨论并解答PPT上的练习题。
板书设计:板书内容主要包括热力学第一定律的表述、内能的概念、能量守恒定律以及热力学第一定律的应用。
