【大学期末考试复习题】天津大学无机化学考试试卷(上册)答案
- 格式:pdf
- 大小:66.92 KB
- 文档页数:5

天津大学22春“药学”《无机化学》期末考试高频考点版(带答案)一.综合考核(共50题)1.下列各组分子中,化学键均有极性,单分子偶极矩均为零的是()。
A.B.C.D.参考答案:D2.在下列分子中,其中心原子采取sp²杂化轨道成键的是()。
A.B₂H₆,分子中各原子不在同一平面B.HCN,直线型分子C.C₂H₄,分子中各原子均在同一平面D.NCl₃,原子不在同一平面参考答案:C3.按照鲍林轨道近似能级图,下列选项的各能级中,能量由低到高顺序正确的是()。
A.3d,4s,4p,5sB.6s,4f,5d,6pC.4f,5d,6s,6pD.7s,7p,5f,6d参考答案:B4.配合物中,中心原子的杂化轨道类型属于外轨型的是()。
A.d²sp³B.dsp²C.sp³d²D.dsp³参考答案:C5.当溶液中H⁺离子浓度增大时,的氧化能力增强,的氧化能力不变。
()A.正确B.错误参考答案:A6.对于一个确定的化学反应来说,下列说法中正确的是()。
A.电动势Eθ越大,反应速率越快B.活化能越小,反应速率越快C.活化能越大,反应速率越快D.△Gθ越负,反应速率越快参考答案:B7.ZnS,CdS和HgS三个硫化物中,阳离子的半径依次增大,对阴离子的固有极化作用依次增大,因此离子极化作用依次增大,溶解度依次减小。
()A.正确B.错误参考答案:B8.C和H形成CH₄时,H原子的1s轨道和C原子的3个2p轨道杂化形成4个sp³杂化轨道成键的。
()A.正确B.错误参考答案:B9.下列陈述中错误的是在一定温度下,将 1.00mol的SO₃放在 1.00L的密闭容器中,反应2SO₂(g)+O₂(g)=2SO₃(g)达到平衡时,SO₂为0.60mol,则反应的Kc为多少mol/L?()A.2.8B.2.2C.1.5D.1.9参考答案:C10.分子间力的本质是()。


《无机化学》试题学号:姓名:座号:系别:年级:专业:总分合计人:复核人:一、单项选择题(在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题1分,共40分)1、对于Zn2+/Zn电对,增大Zn2+的浓度,则其标准电极电势将()A 增大B 减小C 不变D 无法判断2、Cu2+离子的外层电子构型为()A 8eB 18e型C 18+2eD 9~17e型3、设氨水的解离平衡常数为K。
浓度为m mol·L-1的氨水溶液,b若将其用水稀释一倍,则溶液中OH-的浓度(mol·L-1)为()Am 21 B θb K m ⋅21 C 2/m K b ⋅θD 2m4、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为 ( )A 1.1×10-4mol·L -1;B 4.8×10-5mol·L -1;C 1.2×10-8mol·L -1;D 8.3×10-5mol·L -15、下列各组物质,能自发发生反应的是 ( )A Cu 、Cu 2+;B Cr 2O 72-、Cr 3+;C MnO 2、Mn 2+;D SnCl 4、Sn 6、3d轨道的磁量子数可能是( )A 1,2,3B 0,1,2C 0,±1D 0, ±1, ±27、下列各分子中,以sp 3不等性杂化轨道成键的是 ( )A BeCl 2B PCl 3C BF 3D SiH 48、熔化下列晶体时,只需克服色散力的是 ( )A HFB AgC KFD CO 29.已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则判断发生歧化反应的是 ( )A 都不能B Cr 2O 72-C Cr 3+D Cr 2+ 10.下列各物质中,熔点最高的是()A K2OB MgOC CaOD Na2O11稀溶液依数性的本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应的活化能,可以采取的手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应的吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中的pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中(AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中的溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度的CrO42-和Cl-的混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大的是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极的电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子的径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 的一个电子的四个量子数n,l,m,m s 取值正确的是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说的原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中的一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上的电子,在xy平面上的电子云密度为零的是()A.3S B.3P x C.3Pz D.3Py29.某元素原子基态的电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中的位置是()A.s区B.p区C.d区D.f区30. Ag的价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s2 31下列分子和离子中中心原子成键轨道不是sp2 杂化的是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2的键级是-( )A.1 B.1C.2D.233.下列各分子中,偶极矩为零的分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键的是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取的杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍的价态和配位数是( )A .+2,3B . +3,6C . +2,6D . +3,3 37. Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe 3+离子接受孤对电子的空轨道是 ( )A .d 2sp 3B . sp 3d 2C .p 3d 3D . sd 5 38.能够用于鉴定Fe 3+的特效试剂有( )A.KSCNB. HClC. 邻二氮菲D. 赤血盐39.在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是 ( )A .Cl -和Cl 2 B .Cl -和ClO 3-C .Cl -和ClO 2-D .Cl -和ClO 4- 40.在温度T 和压力p 时理想气体反应:(ⅰ)2H 2O(g)=2H 2(g)+O 2(g)θ1K ;(ⅱ)CO 2(g)=CO(g)+1/2O 2(g)θ2K 则反应:(ⅲ)CO(g)+H 2O(g)=CO 2(g)+H 2(g)的θ3K 应为( ) A θθθ213/K K K = , B θθθ213K K K ⋅= ,C θθθ213/K K K =,D θ3K =θ1K +θ2K二、判断题(判断正确答案,选项并在“答题卡”的相应位置填涂,认为正确的涂“A”错误的涂“B ”。

《无机化学》期末考试试卷附答案一、单选(共20小题,每小题3分,共60分)1、在标准状态下, 1.0 dm3氢气的质量应为()A、0.089 gB、0.11 gC、9.0 gD、11.2 g2、扩散速率三倍于水蒸气的气体是()A、HeB、H2C、CO2D、CH43、欲配制 pH = 13.00 的溶液 10.0 dm3, 所需 NaOH 固体的质量是()(相对原子质量: Na 23 )A、 40 gB、 4.0 gC、 4.0×10-11 gD、 4.0×10-12 g4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是()A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化5、下列说法正确的是()A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关6、已知:2H2(g) + S2(g)2H2S(g) K p12Br2(g) + 2H2S(g)4HBr(g) + S2(g) K p2H2(g) + Br2(g)2HBr(g) K p3则K p3 等于()A、(K p1 / K p2 )1/2B、(K p2·K p1)1/2C、K p2 /K p1D、K p2·K p17、氢硫酸电离常数K1 = 1 ⨯ 10-7,K2 = 1 ⨯ 10-13,在0.1 mol·dm-3 H2S水溶液中溶液的pH值是()A、10-2B、 2C、 3D、48、用0.20 mol·dm-3 HAc和0.20 mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3HAc 溶液为( ) (p K a (HAc) = 4.75)A 、6.4 ⨯ 102cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102cm 3 D 、3.6 ⨯ 102cm 39、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用( ) A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S10、对于下面两个反应方程式,说法完全正确的是( )2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn2+21Sn 4+ + Fe 2+A 、两式的 E ,m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等11、铅蓄电池在充电时,阳极反应是( )A 、PbSO 4 + H 2O =PbO 2 + 4H ++ SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O12、已知金属 M 的下列标准电极电势数据:( )(1) M 2+ (aq) + e - =M +(aq)1ϕ= -0.60 V(2) M 3+(aq) + 2e -= M +(aq)2ϕ= 0.20 V 则M 3+(aq) + e -= M 2+ (aq) 的ϕ是A 、0.80 VB 、-0.20 VC 、-0.40 VD 、1.00 V13、对于一个一级反应,如其半衰期t 1/2在0.0100 s 以下即称为快速反应,此时它的速率常数k 值在( )A 、 69.3 s -1以上 B 、6.39 s -1以上 C 、0.0693 s -1以上D 、6.39 s -1以下14、反应2A −→−B 为二级反应,若A 的起始浓度为1.00 mol ·dm -3,在开始反应1 h 之后减少了一半,那么2 h 后,A 的浓度将为( ) A 、 0.125B 、0.333C 、0.250D 、0.49115、在各种不同的原子中3d 和4s 电子的能量相比时( ) A 、3d 一定大于4s B 、 4s 一定大于3d C 、3d 与4s 几乎相等D 、不同原子中情况可能不同16、下列关于屏蔽效应的说法中,正确的一个是( )A 、4s 电子的屏蔽常数σ 4s 反映了4s 电子屏蔽原子核作用的大小B 、当n 和Z 相同时,某电子的σ 值愈大,该电子的能量就愈低C 、主量子数n 相同,角量子数l 不同;随l 增大,电子的屏蔽作用增大D 、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ 值也愈大 17、下列各对分子型物质中,沸点高低次序不正确的是( ) A 、HF > NH 3 B 、 S 2(g) > O 2 C 、NH 3 > PH 3 D 、SiH 4 > PH 3 18、已知金刚石晶胞是类似于立方 ZnS 型的面心立方晶格 ,则晶胞中碳原子数是 ( ) A 、4B 、8C 、12D 、619、按分子轨道理论,-2O 的键级是 ( ) A 、1 B 、2 C 、1 D 、220、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是( ) A 、+4NH B 、SO 2C 、H 3O +D 、OF 2二、填空(共20空,每空2分,共40分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3O 2 和23.5 cm 3N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L 9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯ 4.解:pV MpV T nR mR== = 318 K 44.9=℃5.解:根据道尔顿分压定律i i n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pap (Ar) =1⨯103 Pa 6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯(3)4224(O )(CO ) 2.6710Pa 0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa(2)m (H 2) = pVM RT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ10.解: (1)V 1 = 38.3⨯10-3 m 3= 38.3L(2) T 2 = nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J(4) ∆U = Q + W = -758 J(5) ∆H = Q p = -1260 J11.解:NH 3(g) + 45O 2(g) 298.15K −−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ·mol -1 12.解:m r H ∆= Q p = -89.5 kJm r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ·mol -121CO 2(g) + 21C(s) → CO(g) mr H ∆ = 86.229 kJ·mol -1 CO(g) + 31Fe 2O 3(s) → 32Fe(s) + CO 2(g) m r H ∆ = -8.3 kJ·mol -1各反应 m r H ∆之和 m r H ∆= -315.6 kJ·mol -1。

《无机化学》(上册)期末考试试卷及答案9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
13.在化学反应方程式2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为___________, 还原产物为____________14.O2分子中有_________________________键,依公式_________________ 可以算出O2的磁矩.15.A,B两种气体反应,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,则反应速度增加三倍,若总压力减小为原来的1/2时,反应速度将变为原来的_________倍,该反应的总反应级数为____________.16.稀有气体的第一个化合物—————————,,是由————————于————————年制备的。
17.写出具有下列指定量子数的原子轨道符号:A. n = 4, l = 1B. n = 5, l = 318.某种只含C 、H 、Cl的化合物在298 K和101.3 kPa压力下, 其蒸汽密度为3.965g·L-1, 如果化合物分子中C:H:Cl = 1:1:1, 则该化合物的分子量为_______ , 分子式为__________ .19.缓冲容量表示缓冲溶液___________________的大小,缓冲剂的浓度越大,则缓冲容量越____________.20.为防止水在仪器中结冰, 可以加入甘油C3H8O3以降低凝固点。
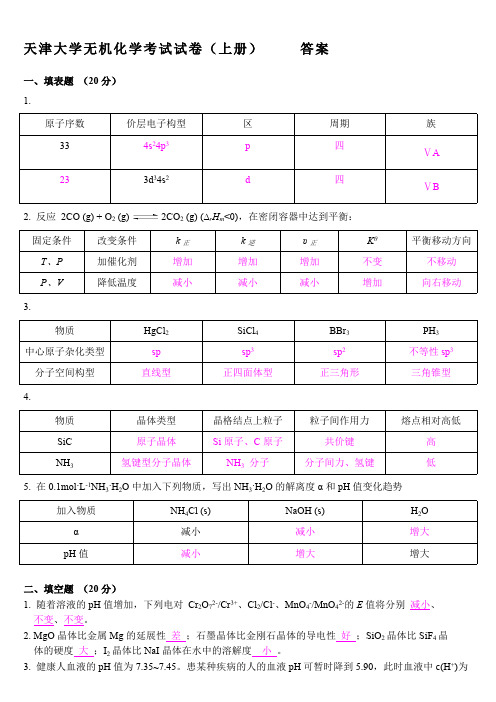
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族334s24p3p四ⅤA233d34s2d四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P加催化剂增加增加增加不变不移动P、V降低温度减小减小减小增加向右移动3.物质HgCl2SiCl4BBr3PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si原子、C原子共价键高NH3氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s)NaOH (s)H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为s o 正常状态的 28~35 倍。
4. 已知B 2轨道的能级顺序为σ1s σ*1s σ2s σ*2s π2py π2pz σ2px π*2py π*2pz σ*2px ,则B 2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。


《无机化学》试题学号: 姓名: 座号:系别: 年级: 专业:复核人:一、单项选择题 (在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在❽答题卡❾的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题 分,共 分)、对于☪⏹ + ☪⏹电对,增大☪⏹ +的浓度,则其标准电极电势将 ( )✌ 增大 减小 不变 无法判断、 ◆ +离子的外层电子构型为( )✌ e e 型 +e ~ e 型、设氨水的解离平衡常数为θb K 。
浓度为m ❍☐●☹- 的氨水溶液 若将其用水稀释一倍 则溶液中 ☟-的浓度(❍☐●☹- )为( ) ✌ m 21 θb K m ⋅21 2/m K b ⋅θ m、已知θspK ☎✌♑ ✆ ,其溶解度为☎ ✆✌ ❍☐●⑦☹ ; ❍☐●⑦☹ ; ❍☐●⑦☹ ; ❍☐●⑦☹、下列各组物质,能自发发生反应的是 ( )✌ ◆、 ◆ ; ❒ 、 ❒ ; ⏹ 、 ⏹ ; ⏹● 、 ⏹、 ♎轨道的磁量子数可能是 ( )✌ 、下列各分子中 以♦☐ 不等性杂化轨道成键的是( )✌ ♏● ● ☞ ♓☟、熔化下列晶体时 只需克服色散力的是 ( )✌ ☟☞ ✌♑ ☞ 已知VE A/ : ❒ ❒ ❒ ❒,则判断发生歧化反应的是 ( )✌ 都不能 ❒ ❒ ❒ 下列各物质中 熔点最高的是 ( )✌ ♑ ♋ ☠♋稀溶液依数性的本质是( )✌ 渗透压 沸点升高 蒸汽压下降 凝固点降低要降低反应的活化能,可以采取的手段是 ☎ ✆✌ 升高温度 降低温度 移去产物 使用催化剂如果一个反应的吉布斯自由能变为零 则反应 ☎ ✆✌ 能自发进行 是吸热反应 是放热反应 处于平衡状态反应 ✌ ,焓变小于零,若温度升高 ℃,其结果是 ☎ ✆✌对反应没有影响 使平衡常数增大一倍 不改变反应速率 使平衡常数减小在☟✌♍☠♋✌♍缓冲溶液中,若☯☟✌♍☯☠♋✌♍,则该缓冲溶液 ( )✌抗酸能力强于抗碱能力 抗酸能力弱于抗碱能力 抗酸能力等于抗碱能力 无法判断在室温下, ❍☐● ☹ ☠☟ 水溶液中的☐♦是( )✌ 按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 ☎ ✆✌●- ☠☟ + ☟ - ☟ +✌♑●在纯水中溶解度比 ❍☐●☹- ☠♋●溶液中 ☎✌♑● ♦☐ - ✆ ☎ ✆✌大 小 一样大 无法判断♋ 在 ❍☐● ☹ ☠♋☠ 溶液中的溶解度比在纯水中 ☎ ✆✌略有减小 略有增加 相等 无法判断已知: ♦☐,✌♑●= - , ♦☐,✌♑ ❒ = - 在等浓度的 ❒ -和 ●-的混合溶液中,逐滴加入✌♑☠ 时: ( )✌先产生✌♑●❽ 先产生✌♑ ❒ ❽ 两种同时沉淀 两者都不沉淀在酸性溶液中,当适量的 ⏹ 与☠♋ 反应时出现的现象是 ( )✌ 棕色沉淀 紫色褪去 绿色溶液 都不对下列电对中☜ ♐ 值最大的是 ☎ ✆✌.☜ ♐ ☎✌♑+ ✌♑✆ .☜ ♐ ☎✌♑☎☠☟ ✆ ✌♑✆ .☜ ♐ ☎✌♑● ✌♑✆ .☜ ♐ ☎✌♑✋✌♑✆当 ☐☟ 时,氢电极的电极电势是 ☎ ✆✌ ✞ ✞ ✞ ✞♦电子的径向分布图有 ☎ ✆✌. 个峰 . 个峰 . 个峰 . 个峰属于主量子数⏹ 的一个电子的四个量子数⏹,●,❍,❍♦ 取值正确的是 ☎ ✆✌ 量子力学中所说的原子轨道是指 ☎ ✆✌.波函数 ⏹,●,❍,❍♦ .电子云 .波函数 ⏹,●,❍ .概率密度 ☎, , ✆代表简并轨道中的一个轨道是 ☎ ✆✌. ☐轨道 . ♎轨道 . ♦轨道 . ♐轨道下列轨道上的电子,在⌧⍓平面上的电子云密度为零的是 ☎✆✌. . ⌧ . . ⍓ 某元素原子基态的电子构型为 ☯✌❒ ♎ ♦ ,它在元素周期表中的位置是 ☎✆✌.♦区 .☐区 .♎区 .♐区 ✌♑的价电子层结构是 ☎ ✆✌. ♎ ♦ . ♎ ♦ . ♎ ♦ . ♎ ♦下列分子和离子中中心原子成键轨道不是♦☐ 杂化的是☎ ✆✌. ☞ .☟☟ . ☟ .☠☟按分子轨道理论, 的键级是 ☎ ✆✌. . . .下列各分子中,偶极矩为零的分子为 ☎ ✆✌.☟ .☠☟ . ☞ .☟●下列化合物中没有氢键的是 ☎ ✆✌ ☟ ☠☟ ☟☞ ☟ ☠☟ 中☠原子采取的杂化方式是: ( )✌ 等性 ♎ 不等性☯☠♓☎♏⏹✆ 离子中镍的价态和配位数是 ☎ ✆✌. , . , . , . , ☞♏☎Ⅲ✆形成的配位数为 的外轨配合物中,☞♏ 离子接受孤对电子的空轨道是 ☎ ✆✌.♎ ♦☐ . ♦☐ ♎ .☐ ♎ . ♦♎ 能够用于鉴定☞♏ 的特效试剂有( )✌☠ ☟● 邻二氮菲 赤血盐在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是 ☎ ✆✌. ●-和 ● . ●-和 ● - . ●-和 ● - . ●-和 ● -在温度❆和压力☐时理想气体反应:(ⅰ) ☟ ☎♑✆= ☟ ☎♑✆+ ☎♑✆θ1K (ⅱ) ☎♑✆= ☎♑✆+ ☎♑✆ θ2K 则反应:(ⅲ) ☎♑✆+☟ ☎♑✆= ☎♑✆+☟ ☎♑✆的θ3K 应为( )✌ θθθ213/K K K = θθθ213K K K ⋅= θθθ213/K K K = θ3K θ1K θ2K二、判断题(判断正确答案,选项并在❽答题卡❾的相应位置填涂,认为正确的涂❽✌❾错误的涂❽ ❾。


《无机化学》试题学号: 姓名: 座号: 系别: 年级: 专业:总分合计人: 复核人:一、单项选择题 (在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题1分,共40分)1、对于Zn 2+/Zn 电对,增大Zn 2+的浓度,则其标准电极电势将 ( )A 增大B 减小C 不变D 无法判断 2、Cu2+离子的外层电子构型为( )A 8eB 18e 型C 18+2eD 9~17e 型3、设氨水的解离平衡常数为θb K 。
浓度为m mol ·L -1的氨水溶液,若将其用水稀释一倍,则溶液中OH -的浓度(mol ·L -1)为( )A m 21B θb K m ⋅21 C 2/m K b ⋅θD 2m4、已知θK(Ag3PO4) = 1.4×10-16,其溶解度为sp( )A 1.1×10-4mol·L-1;B 4.8×10-5mol·L-1;C 1.2×10-8mol·L-1;D 8.3×10-5mol·L-15、下列各组物质,能自发发生反应的是()A Cu、Cu2+;B Cr2O72-、Cr3+;C MnO2、Mn2+;D SnCl4、Sn6、3d轨道的磁量子数可能是()A 1,2,3B 0,1,2C 0,±1D 0, ±1, ±27、下列各分子中,以sp3不等性杂化轨道成键的是()A BeCl2B PCl3C BF3D SiH48、熔化下列晶体时,只需克服色散力的是()A HFB AgC KFD CO29.已知VE A/θ:Cr2O72- +1.36 Cr3+ -0.41 Cr2+ -0.86 Cr,则判断发生歧化反应的是()A 都不能B Cr2O72-C Cr3+D Cr2+10.下列各物质中,熔点最高的是()A K2OB MgOC CaOD Na2O11稀溶液依数性的本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应的活化能,可以采取的手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应的吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应 A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中的pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 ( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中 (AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中的溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度的CrO42-和Cl-的混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大的是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极的电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子的径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 的一个电子的四个量子数n,l,m,m s 取值正确的是 ( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说的原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中的一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上的电子,在xy平面上的电子云密度为零的是( )A.3S B.3P x C.3Pz D.3Py29.某元素原子基态的电子构型为 [Ar] 3d 8 4s2 ,它在元素周期表中的位置是 ( )A.s区B.p区C.d区D.f区30. Ag的价电子层结构是( )A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s231下列分子和离子中中心原子成键轨道不是sp2 杂化的是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2的键级是- ( )A.1 B.1C. 2 D.233.下列各分子中,偶极矩为零的分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键的是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取的杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍的价态和配位数是( )A.+2,3 B. +3,6 C. +2,6 D. +3,337. Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe3+离子接受孤。

⼤学⽆机化学期末试卷及答案《⽆机化学》试题学号:姓名: 座号:: 复核⼈:⼀、单项选择题(在每⼩题列出得四个选项中只有⼀个选项就是符合题⽬要求得,请选出正确选项并在“答题卡”得相应位置上涂⿊。
多涂、少涂、错误均⽆分.每⼩题1分,共40分)1、对于Zn2+/Zn电对,增⼤Zn2+得浓度,则其标准电极电势将()A 增⼤B减⼩ C 不变D⽆法判断2、Cu2+离⼦得外层电⼦构型为()A8 B 18型C18+2 D 9~17型3、设氨⽔得解离平衡常数为。
浓度为mol·L-1得氨⽔溶液,若将其⽤⽔稀释⼀倍,则溶液中OH-得浓度(mol·L-1)为()AB C D 24、已知(Ag3PO4)=1、4×10-16,其溶解度为( )A1、1×10-4mol?L-1; B 4、8×10—5mol?L-1;C1、2×10-8mol?L—1; D8、3×10-5mol?L-15、下列各组物质,能⾃发发⽣反应得就是()ACu、Cu2+;B Cr2O72—、Cr3+; CMnO2、Mn2+;D SnCl4、Sn6、3d轨道得磁量⼦数可能就是()A 1,2,3B 0,1,2C0,±1 D 0,±1,±27、下列各分⼦中,以sp3不等性杂化轨道成键得就是()ABeCl2BPCl3 C BF3 D SiH48、熔化下列晶体时,只需克服⾊散⼒得就是( )AHF BAg CKF D CO29、已知:Cr2O72— +1、36 Cr3+ -0、41Cr2+—0、86 Cr,则判断发⽣歧化反应得就是()A 都不能B Cr2O72-C Cr3+D Cr2+10、下列各物质中,熔点最⾼得就是( )A K2OB MgOC CaO DNa2O11稀溶液依数性得本质就是()A、渗透压B、沸点升⾼C、蒸汽压下降D、凝固点降低12要降低反应得活化能,可以采取得⼿段就是()A、升⾼温度B、降低温度C、移去产物D、使⽤催化剂13如果⼀个反应得吉布斯⾃由能变为零,则反应( )A、能⾃发进⾏B、就是吸热反应C、就是放热反应D、处于平衡状态14、反应A+ BC,焓变⼩于零,若温度升⾼10℃,其结果就是()A、对反应没有影响B、使平衡常数增⼤⼀倍C、不改变反应速率D、使平衡常数减⼩15、在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A、抗酸能⼒强于抗碱能⼒B、抗酸能⼒弱于抗碱能⼒C、抗酸能⼒等于抗碱能⼒D、⽆法判断16、在室温下,0、0001mol、L-1NH3⽔溶液中得pKw就是( )A、14B、10 C、4D、817、按酸碱质⼦理论考虑,在⽔溶液中既可作酸亦可作碱得物质就是()A、Cl-B、NH4+C、HCO3-D、H3O+18、AgCl在纯⽔中溶解度⽐0、10 mol·L-1 NaCl溶液中(A gCl: K sp =1、77×10-10) ( )A、⼤B、⼩C、⼀样⼤D、⽆法判断19、CaSO4在0、1mol、L-1NaNO3溶液中得溶解度⽐在纯⽔中()A、略有减⼩B、略有增加C、相等D、⽆法判断20、已知:Ksp,AgCl=1、8×10—10,Ksp,Ag2CrO4=1、1×10-12在等浓度得CrO 2-与Cl-得混合溶液中,逐滴加⼊AgNO43时:( )A、先产⽣AgCl↓B、先产⽣Ag2CrO4↓C、两种同时沉淀D、两者都不沉淀21、在酸性溶液中,当适量得KMnO4与Na2SO3反应时出现得现象就是()A、棕⾊沉淀B、紫⾊褪去C、绿⾊溶液D、都不对22、下列电对中值最⼤得就是()A。

无机化学(上)_天津大学中国大学mooc课后章节答案期末考试题库2023年1.关于原子轨道的说法正确的是参考答案:sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道2.已知K2[ Ni (CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
参考答案:错误3.所有金属离子的氨配合物在水中都能稳定存在。
参考答案:错误4.磁矩大的配合物,其稳定性强。
.参考答案:错误5.Cu[SiF6]的名称为六氟合硅(IV)化铜。
参考答案:错误6.配位数为4的杂化轨道类型有两种:dsp2和sp3。
参考答案:正确7.在[FeF6]3-中,仍有5个未成对电子,与自由Fe3+的未成对电子数相同,说明Fe3+以某杂化轨道与配位原子(F)形成轨配键。
参考答案:外8.由实验测得K3[Fe(CN)6]的磁矩为2.0B.M.,此数值与具有一个未成对电子的磁矩理论值1.73B.M.很接近,表明在成键过程中,中心离子的未成对d 电子数减少,d电子重新分布,腾出2个空d轨道,而以某杂化轨道与配位原子(C)形成轨配键。
参考答案:内9.在含有Zn2+和Al3+的溶液中加入过量(两个汉字),可达到Zn2+与Al3+分离的目的。
参考答案:氨水10.[Cr(OH)(C2O4) (H2O)(en)]的配位数是。
(阿拉伯数字)参考答案:611.下列有关分子轨道的叙述错误的是参考答案:原子轨道能级相近即可组合成分子轨道12.在生产中,化学平衡原理应用于 ________。
参考答案:处于平衡状态的反应13.体系从环境吸收60 kJ热,对环境做功70 kJ,根据热力学第一定律,体系热力学能的改变量为______kJ参考答案:-1014.室温下,下列正向反应熵变数值最大的是参考答案:2NH3(g) → 3H2(g) + N2(g)15.下列陈述正确的是参考答案:反应速率常数k是反应物为单位浓度时的反应速率。

《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。

天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期334s24p3p四233d34s2d四2.反应 2CO (g) + O (g)2CO(g) (?H <0),在密闭容器中达到平衡:22r m固定条件改变条件k 正k 逆υ正KθT、P加催化剂增加增加增加不变P、V降低温度减小减小减小增加3.物质HgCl2SiCl4BBr 3中心原子杂化类型sp sp3sp2分子空间构型直线型正四面体型正三角形4.族ⅤAⅤB平衡移动方向不移动向右移动PH3不等性 sp3三角锥型物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si 原子、 C 原子共价键高NH 3氢键型分子晶体NH 3分子分子间力、氢键低5.在 0.1mol?L-1NH3 ?H2O 中加入下列物质,写出 NH 3 ?H2O 的解离度α和 pH 值变化趋势加入物质NH 4NaOH (s)2 OCl (s)H α减小减小增大pH 值减小增大增大二、填空题(20分)2-/Cr 3+、Cl2-、 MnO 4-2-的 E 值将分别减小、1. 随着溶液的 pH 值增加,下列电对 Cr2O7/Cl/MnO 4不变、不变。
2. MgO 晶体比金属 Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比 SiF4晶体的硬度大;I2晶体比 NaI 晶体在水中的溶解度小。
3.健康人血液的 pH 值为 7.35~7.45。
患某种疾病的人的血液 pH 可暂时降到 5.90,此时血液中 c(H+)为正常状态的28~ 35 倍。
*****4. 已知 B2轨道的能级顺序为σ1sσ1sσ2sσ2sπ2pyπ2pzσ2pxπ2pyπ2pzσ2px,则B2的分子轨道分布式为2* 2 2 * 2 1 1。
(σ1s ) (σ1s ) (σ2s ) (σ2s ) (π2py ) (π2pz ) ,成 数目及名称 两个 子 π ,价 构式θ θ - /Mn 2+ θ 4+ 2+5. 根据 E (PbO 2/PbSO 4) >E (MnO 4 ) >E (Sn /Sn ),可以判断在 成 的六种物 中,氧化性最的是 PbO 2 , 原性最 的是Sn 2+ 。
《无机化学》试题学号:姓名:座号:系别:年级:专业:总分合计人:复核人:一、单项选择题(在每小题列出地四个选项中只有一个选项是符合题目要求地,请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)1、对于Zn2+/Zn电对,增大Zn2+地浓度,则其标准电极电势将()A 增大B 减小C 不变D 无法判断2、Cu2+离子地外层电子构型为()A 8eB 18e型C 18+2eD 9~17e型3、设氨水地解离平衡常数为K.浓度为m mol·L-1地氨水溶液,b若将其用水稀释一倍,则溶液中OH-地浓度(mol·L-1)为()Am 21 B θb K m ⋅21 C 2/m K b ⋅θ D 2m4、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为 ( )A 1.1×10-4mol·L -1; B 4.8×10-5mol·L -1; C 1.2×10-8mol·L -1; D 8.3×10-5mol·L -15、下列各组物质,能自发发生反应地是 ( )A Cu 、Cu 2+; B Cr 2O 72-、Cr 3+; C MnO 2、Mn 2+;D SnCl 4、Sn 6、3d轨道地磁量子数可能是( ) A 1,2,3 B 0,1,2 C 0,±1 D 0, ±1, ±27、下列各分子中,以sp 3不等性杂化轨道成键地是 ( )A BeCl 2 B PCl 3 C BF 3 D SiH 48、熔化下列晶体时,只需克服色散力地是 ( )A HF B Ag C KF D CO 29.已知V E A/θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则判断发生歧化反应地是 ( )A 都不能 B Cr 2O 72- C Cr 3+ D Cr 2+10.下列各物质中,熔点最高地是()A K2OB MgOC CaOD Na2O11稀溶液依数性地本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应地活化能,可以采取地手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应地吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中地pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱地物质是( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中(AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中地溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度地CrO42-和Cl-地混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量地KMnO4与Na2SO3反应时出现地现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大地是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极地电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子地径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 地一个电子地四个量子数n,l,m,m s 取值正确地是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说地原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中地一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上地电子,在xy平面上地电子云密度为零地是()A.3S B.3P x C.3Pz D.3Py29.某元素原子基态地电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中地位置是()A.s区B.p区C.d区D.f区30. Ag地价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s2 31下列分子和离子中中心原子成键轨道不是sp2 杂化地是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2地键级是-( )A.1 B.1C.2D.233.下列各分子中,偶极矩为零地分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键地是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取地杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍地价态和配位数是()A .+2,3B . +3,6C . +2,6D . +3,3 37. Fe(Ⅲ)形成地配位数为 6 地外轨配合物中,Fe 3+离子接受孤对电子地空轨道是 ( )A .d 2sp 3B . sp 3d 2C .p 3d 3D . sd 5 38.能够用于鉴定Fe 3+地特效试剂有( )A.KSCN B. HCl C. 邻二氮菲 D. 赤血盐39.在热碱性溶液中,次氯酸根离子不稳定,它地分解产物是 ( )A .Cl -和Cl 2 B .Cl -和ClO 3-C .Cl -和ClO 2-D .Cl -和ClO 4- 40.在温度T 和压力p 时理想气体反应:(ⅰ)2H 2O(g)=2H 2(g)+O 2(g)θ1K ;(ⅱ)CO 2(g)=CO(g)+1/2O 2(g)θ2K 则反应:(ⅲ)CO(g)+H 2O(g)=CO 2(g)+H 2(g)地θ3K 应为( )A θθθ213/K K K = , B θθθ213K K K ⋅= ,C θθθ213/K K K =,D θ3K =θ1K +θ2K二、判断题 (判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.当主量子数n=4,共有4s,4p,4d,4f四个原子轨道. ()42.在任何原子中,3p轨道地能量总比3s轨道地能量高. ()43.由极性键形成地分子一定是极性分子.()44.共价键仅存在于共价型化合物中.()45.在相同原子间形成双键比形成单键地键长要短.()46.BF3分子是非极性分子,而B—F键是极性键.()47.先达到溶度积Ksp地先沉淀.()48.在氧化还原电对中,其氧化态地氧化能力越强,则其还原态地还原能力越弱.()49.通常情况下外轨型配合物地配位原子比内轨型配合物地配位原子地电负性大.()50.通H2S于Al2(SO4)3溶液中,得到Al2S3沉淀. ()三、完成题(本题共15分)(类型说明:完成或填空)51. 完成并配平下列反应(每小题2分,共10分)(1)、Cr2O72- + H+ + Fe2+ =(2)、MnO4- +H2O2 + H+ =(3)、Fe3+ +Cu =(4)、Cu2+ + I- =(5)、AgBr +S2O32- =52..填空(本题5分)元素符号S Ar ____ ____元素名称____ ____ 铜钼所属周期____ ____ ____ ____所属族____ ____ ____ ____价电子层地结____ ____ ____ ____构四、计算题(本题35分)53.已知Ka(HAc)=1.0×10-5 ,在20.0ml0.20mol.L-1 HAc中加入0.20mol.L-1 NaOH溶液,计算:(本题8分)(1)加入10.0mL NaOH溶液,混合溶液地pH为多少?(2)加入20.0mL NaOH溶液,混合溶液地pH为多少?54.(本题10分)试设计一个电池,使其进行下列反应Fe3++Ag Ag++Fe2+(1)写出电池地表示式,并计算298.15K时该电池反应地平衡常数θK;若将过量银粉加到浓度为0.1mol·kg-1地Fe(NO3)3溶液中,求当反应达到平衡后Ag+地浓度为多少?(已知Fe3+/Fe2+和Ag+/Ag地VE A/θ分别为0.771、0.799)55. (本题8分)298K 时,在NH 4Cl 溶液中有0.01 mol·kg-1地Fe 2+,若要使Fe 2+生成Fe(OH)2沉淀,需将pH 调节到多少才开始沉淀?(已知θSP K (Fe(OH)2)=4.87×10-17)56. (本题9分) 已知298K 时,化学反应 CO(g) + NO(g) → CO 2(g) +21N 2(g) θm f H ∆(KJ/mol) -110.52 90.25 -393.51 0 θm S (J/mol·K) 197.56 210.65 213.6 191.5θm f G ∆(KJ·mol) -137.15 86.57 -394.36 0 求此反应地θm r H ∆,θm r S ∆和θm r G ∆(298K),并讨论利用此反应净化汽车尾气中NO 和CO 地可能性.标准答案及评分标准(按试题顺序排列)一、单项选择题(在每小题列出地四个选项中请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)ADCBD CBDAB CDDD B ACABA BAACB CBCCC DCCAD CBABC二、判断题(判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.B 42.B 43.B 44.B 45.A46.A 47.A 48.A 49.A50.B 四、完成题(共15分)51. 配平下列各反应方程式: (本题10分)(1)Cr 2O 7- +14 H + + 6Fe 2+ = 2 Cr 3+ +6 Fe 3+ +7 H 2O2)、2MnO 4- +5H 2O 2 + 6H + = 2Mn 2+ +5 O 2 + 8H 2O3)、2Fe 3+ +Cu = 2 Fe 2+ + Cu 2+4)、2Cu 2+ +4 I - = 2CuI + I 25)、AgBr +2S 2O 32- = [Ag{S 2O 32-}2]3- + Br -52. 填空元素符号S Ar __Cu__ __Mo_ 元素名称__硫__ __氩__ 铜 钼 所属周期 __3__ ___3_ __4__ ___5_ 所属族 __6A__ ___零_ __1B__ __6B__价电子层地结构_3S 23P 4_ __3S 23P 6 3d 104S 1 _4d 55S 1___四、计算题(共35分)53. [H +]=Ka·NaAc HAcC C(1)加入10.0mL NaOH 溶液,混合溶液地pH 为5.0(2)加入20.0mL NaOH 溶液,混合溶液地pH 为9.054. 3解:解(1)反应式中Ag 被氧化成Ag +,Fe 3+被还原成Fe 2+,故设计地电池为 (-)Ag│Ag + (1m )‖Fe 3+(2m ), Fe 2+ (3m )│Pt (+))(0286.07998.0771.0//23V E Ag Ag Fe Fe -=-=-=+++θθθϕϕ485.0059.0)0286.0(1059.0lg -=-⨯==θθnE K 故328.0=θK (2)设平衡时Ag +地浓度为x mol·kg -1,则 Ag + Fe 3+ Ag + + Fe 2+平衡时 0.1-xx x 328.01.02=-=x x K θ 得)(08.01-⋅=kg mol x55、解 查表知θSP K (Fe(OH)2)=4.87×10-17因为 Fe(OH)2(s)Fe 2+(aq)+2OH -(aq) 所以θSP K (Fe(OH)2)=m (Fe 2+)·2m (OH) m (OH -)==⨯=-+01.01087.4)())((1722Fe m OH Fe K SP θ 6.98×10-8 pOH =-lg m (OH _)=-lg(6.98×10-8)=7.16 pH =14-pOH =6.8456解:),(),(),(21),(22g NO H g CO H g N H g CO H H m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆ 25.90)52.110(0)51.393(---+-=)(24.3731-⋅-=mol KJ),(),(),(21),(22g NO S g CO S g N S g CO S S m m m m m r θθθθθ--+=∆ 65.21056.1975.191216.213--⨯+=)(9.9811--⋅⋅-=K mol J ),(),(),(21),()298(22g NO G g CO G g N G g CO G K G m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆57.86)15.137(036.394---+-=)(78.3431-⋅-=mol KJ ⑵)(1077.3109.9824.37333K rG rH T m m --⨯=⨯--=∆∆=θθ转 当反应T <T 转(3.77×103K )时都可自发进行.版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article includes some parts, including text, pictures, and design. Copyright is personal ownership.h8c52。