九年级化学碳和碳的化合物课件
- 格式:ppt
- 大小:266.00 KB
- 文档页数:41

九年级化学上册碳知识点碳,作为化学元素周期表中的第六号元素,是一种非常重要的元素,对于生命、环境和工业都有着深远的影响。
本文将从碳的基本性质、碳的存在形态、碳的化合物以及碳的应用等方面,探讨九年级化学上册中的碳知识点。
1. 碳的基本性质碳是一种非金属元素,原子序数为6,原子量为12.01。
碳具有几乎抗腐蚀的性质,具有高熔点和高沸点,能够存在于多种形态,如炭、石墨和钻石等。
碳还是生命存在的基础,所有的有机物都含有碳元素。
2. 碳的存在形态碳以不同的存在形态出现,其中最常见的是炭、石墨和钻石。
炭是一种由无定形碳组成的物质,常用于燃烧和制造活性炭。
石墨是由层状的碳原子结构组成的,具有良好的导电性和润滑性,常用于铅笔芯、电池和高温润滑剂等。
钻石是由高度有序排列的碳原子构成的晶体,是最硬的天然物质之一,广泛应用于宝石和工业领域。
3. 碳的化合物碳可以与其他元素形成众多的化合物,其中最重要的是碳氢化合物、卤代烃和羧酸等。
碳氢化合物是由碳和氢元素组成的化合物,如烷烃、烯烃和炔烃等,广泛应用于石油、天然气和塑料等领域。
卤代烃是由碳、氢和卤素元素组成的化合物,如氯代烷和溴代烷等,常用于溶剂、冷冻剂和杀虫剂等。
羧酸是由碳、氢和羧基组成的化合物,常见的有甲酸、乙酸和醋酸等,用途广泛,包括食品添加剂和化妆品等。
4. 碳的应用碳在工业生产中有着广泛的应用。
首先是炭的应用,炭作为固体燃料,广泛用于工业和家庭的供能。
其次是石墨的应用,石墨具有良好的导电性和润滑性,常用于铅笔芯、电池和高温润滑剂等。
钻石作为宝石具有高光泽和高硬度的特点,被用于珠宝和切割工具等领域。
此外,碳纳米管、石墨烯等新材料的研究和应用也成为了当今科技领域的热点。
综上所述,碳作为化学元素周期表中的非金属元素,具有多样的存在形态和广泛的应用领域。
了解碳的基本性质、存在形态、化合物和应用,对于我们深入理解九年级化学上册中的碳知识点具有重要意义。
通过这些知识的学习,我们不仅能够更好地掌握化学的基础知识,还能够认识到碳在生命中的重要性和对人类社会的巨大贡献。



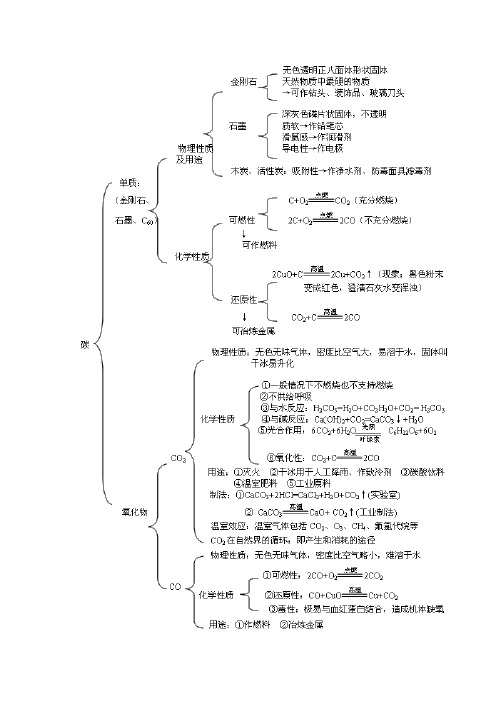
1、碳的单质(金刚石、石墨)的物理性质和用途金刚石石墨外观无色透明正八面体状晶体深灰色磷片状固体光泽加工琢磨后有光泽略有金属光泽硬度最硬软导电性无良好导热性无良好用途钻探机钻头、刻刀、装饰品等电极、铅笔芯、润滑剂等注:由于碳原子排列方式不同,导致金刚石和石墨在物理性质上存在较大差异。
2CO2CO物理性质无色、无味气体,可溶于水,密度比空气大,干冰易吸热升华。
无色无味气体,难溶于水,密度与空气接近,略小于空气密度。
化学性质可燃性一般情况下既不能燃烧,也不支持燃烧。
有可燃性2CO+O22CO2还原性没有还原性,有较弱的氧化性C+CO22CO有还原性CO+CuO Cu+CO2与水反应与水反应CO2+H2O===H2CO3不能与水反应与石灰水的反应与石灰水反应CO2+Ca(OH)2===CaCO3↓+H2O不能与石灰水反应毒性无毒有剧毒主要用途可制汽水,作制冷剂,灭火,气体肥料。
可作气体燃料和冶金工业的还原剂。
注:由于CO和CO2的分子构成不同,决定了二者性质的不同。
C CO相似点都具有可燃性、还原性,常用作燃料和作还原剂冶炼金属不同点属于固体单质,常温下具有稳定性属于气体化合物,具有毒性4、实验室制取二氧化碳时需注意的几个问题(1)正确选择制取二氧化碳的药品实验室制取二氧化碳用大理石或石灰石(主要成分是碳酸钙)和稀盐酸。
不用稀硫酸、浓盐酸代替稀盐酸,不用碳酸钠、纯净碳酸钙代替大理石或石灰石(要会分析原因)。
原因:①用大理石或石灰石跟稀盐酸反应,速度适中,便于收集CO2气体;大理石或石灰石原料价低易得。
②不用稀硫酸与大理石反应的理由:刚开始二者反应生成微溶于水的硫酸钙覆盖在大理石的表面,阻止了酸与大理石的接触,使反应不能持续进行下去。
③不用浓盐酸的原因:浓盐酸易挥发出HCl气体,会使生成的CO2中混有HCl气体,使制得的CO2不纯。
④不用纯CaCO3或Na2CO3等代替大理石(或石灰石)是因为它们与稀盐酸反应速度太快,很难控制,且药品价格比石灰石要贵(成本较高)。




第六单元 碳和碳的氧化物考点1 碳的单质:金刚石C 、石墨C 、C 60⒉木炭、活性炭★⑴木炭:有吸附作用,用于吸附一些食品和工业产品里的色素,吸附有异味的物质。
★⑵活性炭:有较强的吸附作用,用于防毒面具、冰箱的除臭剂。
⒊同一种元素可以组成不同的单质。
考点2 碳的化学性质★⒈常温下,碳的化学性质不活泼(碳原子最外层有4 个电子)应用:解释古代字画为什么经历几千年而不变色?档案资料为什么要求用碳素墨水书写? ★⒉碳的可燃性(相同的反应物,因反应物的量不同,生成物不同)充分燃烧 ★2放热 不充分燃烧 ★ ===== 2CO⒊碳的还原性(以木炭还原CuO 为例)——用于冶炼金属 ⑴现象:黑色粉末变红色,澄清的石灰水变浑浊。
⑵化学方程式★:2↑★ C + CO 考点3 还原反应(从得氧失氧的角度分析)⒈还原反应:含氧化合物里的氧被夺去的反应叫还原反应。
⒉还原剂:在化学反应中,得氧的物质叫还原剂。
⒊还原性:在化学反应中,物质夺取氧的性质叫还原性。
考点4 实验室制取二氧化碳⒈药品:★大理石(或石灰石)、稀盐酸⒉原理:★CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑★注意:⑴不能用浓盐酸代替稀盐酸,因为浓盐酸易挥发,使制得的CO 2不纯(混有氯化氢气体);⑵不能用稀硫酸代替稀盐酸,因为稀硫酸与CaCO 3反应生成微溶于水的硫酸钙覆盖在大理石(或石灰石)的表面,阻止反应的进行;⑶不能用Na 2CO 3 或CaCO 3代替大理石(或石灰石),因为Na 2CO 3与稀盐酸的反应速度太快,不便于收集。
⒊发生装置:固 + 液——不加热型⒋收集装置:只用向上排空气法(因为CO 2能溶于水,密度比空气大)⒌★CO 2的检验:将气体通入澄清的石灰水中,如果石灰水变浑浊,则该气体为CO 2。
化学方程式:CO 2 + Ca (OH )2 == CaCO 3↓+ H 2O⒍★CO 2的验满:用燃着的木条放在集气瓶口,如果木条熄灭,则已充满。

