
各种燃料电池简述
1.碱性燃料电池(AFC)
AFC是以碱性溶液为电解质,将存在于燃料和氧化剂中的化学能直接转化为电能的发电装置,是最早获得应用的燃料电池,由于其电解质必须是碱性溶液,因此而得名碱性燃料电池。氢氧化钠和氢氧化钾溶液,以其成本低,易溶解,腐蚀性低,而成为首选的电解液。催化剂主要用贵金属铂、钯、金、银和过渡金属镍、钴、锰等。在1973年成功地应用于Apollo登月飞船的主电源,使人们看到了燃料电池的诱人前景。具有启动快、效率高、价格低廉的优点,有一定的发展潜力。其反应式为:
阳极:2H2+4OH-→2 H2O +4e-
阴极: 2 H2O +O2→4OH-
总反应:2H2+O2→2H2O
这种电池常用35%-45%的KOH为电解液,渗透于多孔而惰性的基质隔膜材料中,工作温度小于100℃。该种电池的优点是氧在碱液中的电化学反应速度比在酸性液中大,因此有较大的电流密度和输出功率,但氧化剂应为纯氧,电池中贵金属催化剂用量较大,而利用率不高。目前,此类燃料电池技术的发展已非常成熟,并已经在航天飞行及潜艇中成功应用。国内已研制出200W氨-空气的碱性燃料电池系统,制成了1kW、10kW、20kW的碱性燃料电池,20世纪90年代后期在跟踪开发中取得了非常有价值的成果。发展碱性燃料电池的核心技术是要避免二氧化碳对碱性电解液成分的破坏,不论是空气中百万分之几的二氧化碳成分还是烃类的重整气使用时所含有的二氧化碳,都要进行去除处理,这无疑增加了系统的总体造价。此外,电池进行电化学反应生成的水需及时排出,以维持水平衡。因此,简化排水系统和控制系统也是碱性燃料电池发展中需要解决的核心技术。
2.磷酸型燃料电池(PAFC)
PAFC自20世纪60年代在美国开始研究一来,由于操作温度低,耐CO中毒能力强等特点,得到了优先发展,是目前技术成熟、发展最快的燃料电池。
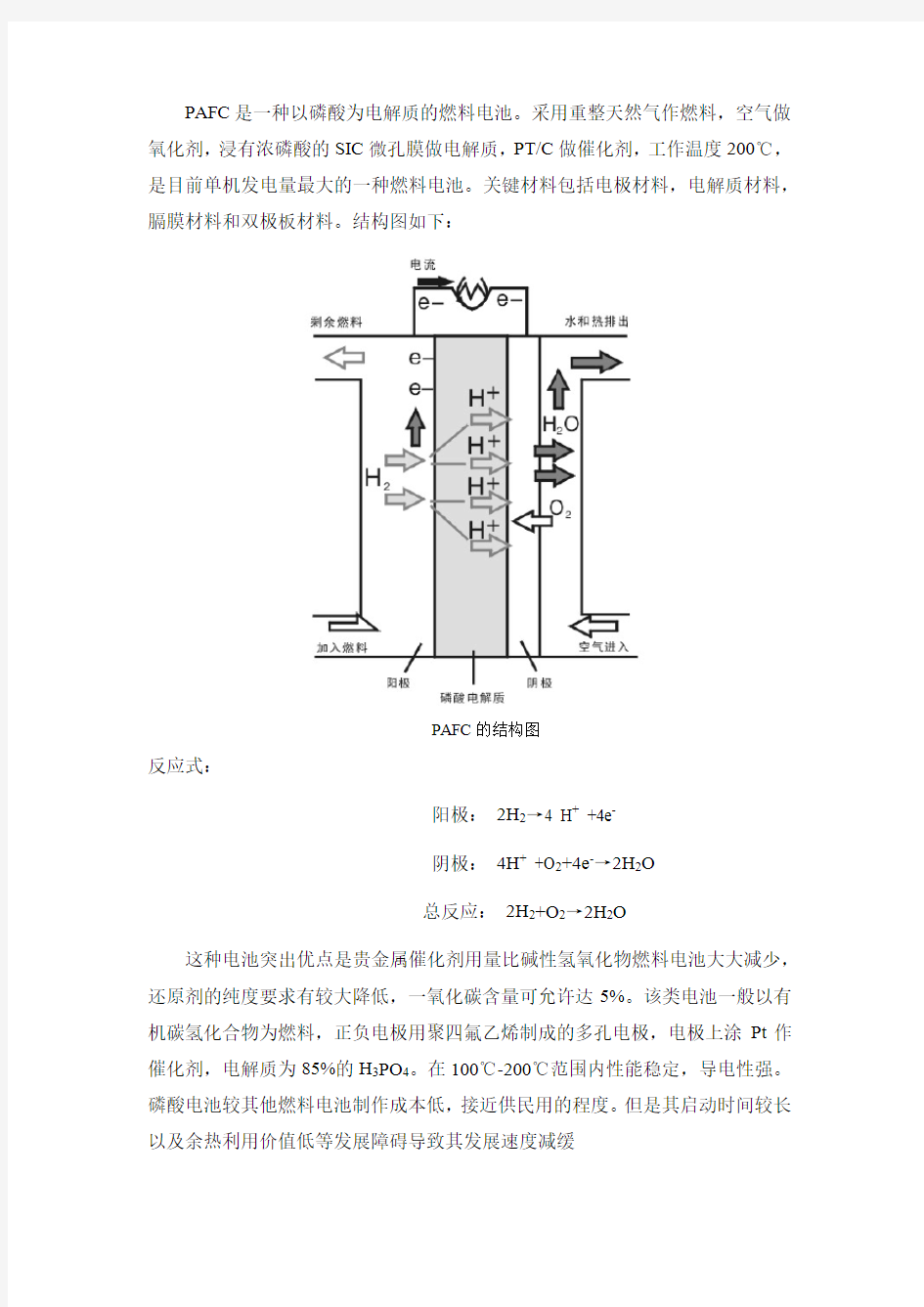
PAFC是一种以磷酸为电解质的燃料电池。采用重整天然气作燃料,空气做氧化剂,浸有浓磷酸的SIC微孔膜做电解质,PT/C做催化剂,工作温度200℃,是目前单机发电量最大的一种燃料电池。关键材料包括电极材料,电解质材料,膈膜材料和双极板材料。结构图如下:
PAFC的结构图
反应式:
阳极:2H2→4 H+ +4e-
阴极:4H+ +O2+4e-→2H2O
总反应:2H2+O2→2H2O
这种电池突出优点是贵金属催化剂用量比碱性氢氧化物燃料电池大大减少,还原剂的纯度要求有较大降低,一氧化碳含量可允许达5%。该类电池一般以有机碳氢化合物为燃料,正负电极用聚四氟乙烯制成的多孔电极,电极上涂Pt作催化剂,电解质为85%的H3PO4。在100℃-200℃范围内性能稳定,导电性强。磷酸电池较其他燃料电池制作成本低,接近供民用的程度。但是其启动时间较长以及余热利用价值低等发展障碍导致其发展速度减缓
目前,PAFC主要用于发电厂,其中分散性发电厂,容量在10-20MW之间,中心电站型发电厂,装机容量可达100MW以上,即使在发电负荷较低时,依然保持高的发电效率。还可用于现场发电,就是把PAFC直接安装在用户附近,同时提供热和电。这被认为是PAFC的最佳应用方案。这种方案的优点是:可根据需要设置装机容量或调整发电负荷,却不会影响装置的发电效率,既使小容量PAFC装置也能达到相当于现代大型热电厂的效率;有效利用电和热,传输损失小。
国际上功率较大的实用燃料电池电力站均用这种燃料的电池。美国将磷酸型燃料电池列为国家级重点科研项目进行研究开发,向全世界出售200kW级的磷酸型燃料电池,日本制造出了世界上最大的(11MW)磷酸型燃料电池。到2002年初,美国已在全世界安装测试了200 kW级PAFC发电装置235套,累计发电470万小时,2001年卖出23套。在美国和日本有几套装置已达到连续发电1万小时的设计目标;欧洲现有5套200kW级PAFC发电装置在运转;日本福日电器和三菱电器已经开发出500 kW级PAFC发电系统。
车用上可以以PAFC作为基本动力电源,配备蓄电池以满足车辆启动和爬坡是峰值用电要求;PAFC可以用作通讯、紧急供电、娱乐等的电源。与通常的柴油发电系相比,PAFC作为军事上的而通讯电源,其诱人之处在于运行时噪音低和热辐射量极少,有利于隐蔽目标。
另外,许多石油化工厂,如炼油厂、氯碱厂、合成氨厂等,经常排放大量富氢气体。在现场安装PAFC装置,就可以把排放气体中的氢转化为电能,或者从中分离出纯氢气体,从而减少资源浪费。
3.固体氧化物燃料电池(SOFC)
SOFC的开发始于20世纪40年代,但是在80年代以后其研究才得到蓬勃发展。早期开发出来的SOFC的工作温度较高,一般在800℃-1000℃。科学家已经研发成功中温SOFC,其工作温度一般在750℃左右。一些科学家也正在努力开发低温SOFC,其工作温度更可以降低至650℃-700℃。工作温度的进一步降低,使得SOFC的实际应用成为可能。
电池中的电解质是复合氧化物,在高温(1000℃以下)时,有很强的离子导电功能。它是由于钙、镱或钇等混入离子价态低于锆离子的价态,使有些氧负离子晶格位空出来而导电。目前世界各国都在研制这类电池,并已有实质性的进展,但SOFC在高温下工作也给其带来一系列材料,密封和结构上的问题,如电极的烧结,电解质与电极之间的界面化学扩散以及热膨胀系数不同的材料之间的匹配和双极板材料的稳定性等。这些也在一定程度上制约着SOFC的发展,成为其技术突破的关键方面。SOFC的结构图和反应式如下:
SOFC的原理图
阳极:H2→2H++2e-
阴极:2H++1/2O2+2e-→H2O
总反应:H2+1/2O2→H2O
目前国际上,从几十瓦的便携式电源系统到千瓦级的家庭热电联供系统,再到数百千瓦级的分布式电源系统,均已有了相对成熟的产品进入市场。产品的功能性和适应性也越来越强,它们的发展已经进入了降低成本、提高产品功能以适应具体环境的新阶段。
有西门子-西屋公司的SOFC发电系统长期稳定的成功经验和目前包括Bloom Energy、HEXIS、Kyocera和CFCL等公司的大量SOFC电堆、系统的演示验证,SOFC 的技术可行性毋庸置疑。现在SOFC发电系统已经入初步量产和成本降低的阶段,有理由相信距离走入千家万户已为时不远。
Bloom Energy SOFC系统安装与eBay数据中心
西门子-西屋电力公司的220KW的SOFC/GT联合循环电站
4. 熔融碳酸盐燃料电池(MCFC)
熔融碳酸盐燃料电池(简称MCFC),是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池。
MCFC工作原理
其电解质是熔融态碳酸盐,一般为碱金属Li、K、Na、Cs的碳酸盐混合物,隔膜材料是LiAiO2,正极和负极分别为添加锂的氧化镍和多孔镍。反应式为:
阳极:H2+CO2-3→H2O+CO2+2e-
阴极:CO2+1/2 O2+2e-→CO2-3
总反应:H2+1/2O2→H2O
由上述反应可知,MCFC的导电离子为CO2-3,CO2在阴极为反应物,而在阳极为产物。实际上电池工作过程中CO2在循环,即阳极产生的CO2返回到阴极,以确保电池连续地工作。通常采用的方法是将阳极室排出来的尾气经燃烧消除其中的H2和CO,再分离除水,然后将CO2返回到阴极循环使用。
MCFC的优点在于工作温度较高(650-700℃),反应速度加快;对燃料的纯度要求相对较低,可以对燃料进行电池内重整;不需贵金属催化剂,成本较低;采用液体电解质,较易操作。不足之处在于,高温条件下液体电解质的管理较困难,长期操作过程中,腐蚀和渗漏现象严重,降低了电池的寿命。
MCFC中阴极、阳极、电解质隔膜和双极板是基础研究的4大难点,这4大部件的集成和对电解质的管理是MCFC电池组及电站模块的安装和运转的技术核心。目前,加压MCFC方面,美国FCE(Full Cell Energy,以前称ERC公司)和日本Melco公司领先;常压MCFC方面,则是美国MCP公司和日本IHI公司领先。
美国FCE公司从20世纪70年代开始研究MCFC,现已实现商业化,从2001年开始进人分布式发电电源市场。其产品为250kW~3MW内部重整型电站。电站模块目前销售价格为3500-4000美元/ kW。日本日立公司2000年开发出1 MMCFC发电装置,三菱公司2000年开发出200kWMCFC发电装置,东
芝开发出低成本的10kWMCFC发电装置。
日本“月光计划”从1981年开始研究MCFC,1984年研制成功1kW MCFC 电堆,1986年为10 kW,1991年为30 kW,1992年为50~1000 kW,1997年为01MW。1987年日本成立MCFC协会。日立、东芝、富士电机、三菱电机、IHI 分别对5台10 kW级电堆进行发电试验。
在德国,主要是由公司的子公司MTU进行MCFC的开发研究。从降低费用角度出发,MTU从FCE公司购入了常压内重整型250kW MCFC电池组,在此基础上开放了0.8MPa加压MCFC。
荷兰在中断MCFC研究15年后,于1986年重新开始MCFC开发。作为荷兰能源组织(NDNEM)和美国IGT合作项目的一部分,荷兰能源研究中心逐渐成为欧洲MCFC、SOFC和PEMFC系统的测试中心。
安装在日本的200 kW MCFC(主要用于工厂废水处理)自20世纪90年代以来,我国多家研究机构开展了MCFC研究工作,上海交通大学和中国科学院大连化学物理研究所都于2001年成功进行了1 kW熔融碳酸盐燃料电池组的发电试验。目前,上海交通大学与上海汽轮机有限公司合作,已完成50kW MCFC发电外围系统的建设,10kW的MCFC电池组已经制作完成。
5.质子交换膜燃料电池(PEMFC)
PEMFC的结构组成如图所示。PEMFC由膜电极和带气体流动通道的双极板组成。其核心部件膜电极是采用一片聚合物电解质膜和位于其两侧的两片电极热压而成,中间的固体电解质膜起到了离子传递和分割燃料和氧化剂的双重作用,而两侧的电极是燃料和氧化剂进行电化学反应的场所。
PEMFC结构图
PEMFC的工作原理
PEMFC通常以全氟磺酸型质子交换膜为电解质,Pt/C或PtRu/C为电催化剂,氢或净化重整气为燃料,空气和纯氧为氧化剂,带有气体流动通道的石墨或表面改性金属板为双极板。PEMFC工作时,燃料气和氧化剂气体通过双极板上的导气通道分别到达电池的阳极和阴极,反应气体通过电极上的扩散层到达电极催化层的反应活性中心,氢气在阳极的催化剂作用下解离为氢离子(质子)和带负电的电子,氢离子以水合质子H+(nH2O,n约为3-5)的形式在质子交换膜中从一个磺酸基(-SO3H)迁移到另一个磺酸基,最后到达阴极,实现质子导电。质子的这种迁移导致阳极出现带负电的电子积累,从而变成一个带负电的端子(负极)。与此同时,阴极的氧分子在催化剂作用下与电子反应变成氧离子,使得阴极变成带正电的端子(正极),在阳极的负电终端和阴极的正电终端之间产生了一个电压。如果此时通过外部电路将两端相连,电子就会通过回路从阳极流向阴极,从而产生电流。同时,氢离子和氧与电子反应生成水。电极反应如下:
阳极:H2+2H2O→2H3O++2e-
阴极:O2+4H++4e-→2H2O
总反应:H2+1/2O2→H2O
PEMFC是继AFC、PAFC、SOFC、MCFC之后正在迅速发展起来的温度最低、比能最高、启动最快、寿命最长、应用最广的第五代燃料电池,它是为航天和军用电源而开发的。在美国《时代周刊》的社会调查结果中被列为21世纪十大科技新技术之首。质子交换膜燃料电池的核心技术是电极-膜-电极三合一组件的制备技术。为了向气体扩散,电极内加入质子导体,并改善电极与膜的接触,采用热压的方法将电极、膜、电极压合在一起,形成了电极-膜-电极三合一组件,其中,质子交换膜的技术参数直接影响着三合一组件的性能,因而关系到整个电池及电池组的运行效率。PEMFC的价格也制约着其商业化进程,因此,改进其必要组件性能,降低运行成本是发展PEMFC的重要方向。
经过多年的基础研究与应用开发,质子交换膜燃料电池用作汽车动力的研究已取得实质性进展,微型质子交换膜燃料电池便携电源和小型质子交换膜燃料电池移动电源已达到产品化程度,中、大功率质子交换膜燃料电池发电系统的研究也取得了一定成果。由于质子交换膜燃料电池发电系统有望成为移动装备电源和重要建筑物备用电源的主要发展方向,因此有许多问题需要进行深入的研究。就备用氢能发电系统而言,除质子交换膜燃料电池单电池、电堆质量、效率和可靠性等基础研究外,其应用研究主要包括适应各种环境需要的发电机集成制造技术,质子交换膜燃料电池发电机电气输出补偿与电力变换技术,质子交换膜燃料电池发电机并联运行与控制技术,备用氢能发电站制氢与储氢技术,适应环境要求的空气(氧气)供应技术,氢气安全监控与排放技术,氢能发电站基础自动化设备与控制系统开发,建筑物采用质子交换膜燃料电池氢能发电电热联产联供系统,以及质子交换膜燃料电池氢能发电站建设技术等等。采用质子交换膜燃料电池氢能发电将大大提高重要装备及建筑电气系统的供电可靠性,使重要建筑物以市电和备用集中柴油电站供电的方式向市电与中、小型质子交换膜燃料电池发电装置、太阳能发电、风力发电等分散电源联网备用供电的灵活转变,极大地提高建筑物的智能化程度、节能水平和环保效益。
美国多家公司、日本、三洋、三菱等公司也已研究开发出便携式PEMFC发电堆。加拿大电力系统公司与日本的EBARA公司合作研究开发250kWPEMFC 发电设备和1kW的PEMFC便携式发电系统。德国在柏林建造了一个250kW PEMFC的实验堆。
在我国有中国科学院大连化学物理研究所、清华大学、武汉理工大学、上海空间电源研究所、上海神力等很多单位在开展PEMFC的研究,并取得了长足进展,接近国外先进水平。就技术而言,千瓦级的PEMFC技术已基本成熟,阻碍其大规模商业化的主要原因是燃料电池的价格还远远没有达到实际应用的要求,影响燃料电池成本的两大因素是材料价格昂贵和组装工艺没有突破,例如使用贵金属铂作为催化剂;昂贵的质子交换膜及石墨双极板加工成本等,导致PEMFC成本约为汽油、柴油发动机成本(50$/kW)的10~20倍。PEMFC要作为商品进入市场,必须大幅度降低成本,这有赖于燃料电池关键材料价格的降低和性能的进一步提高。
表:各种燃料电池比较
燃料电池 燃料电池(FuelC el l)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。 燃料电池含有阳阴两个电极,分别充满电解液,而两个电极间则为具有渗透性的薄膜所构成.氢气由阳极进入供给燃料,氧气(或空气)由阴极进入电池. 电池经由催化剂的作用,使得阳极的氢原子分解成氢质子(pro to n)与电子(electro n),其中质子进入电解液中,被氧“吸引"到薄膜的另一边,电子经由外电路形成电流后,到达阴极。在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子。这正是水的电解反应的逆过程,因此水是燃料电池唯一的排放物. 利用这个原理,燃料电池便可在工作时源源不断地向外部输电,为一种 "发电机"。 阳极反应 - 阴极反应 总反应 伴随着电池反应, 电池向外输出电能。只要保持氢气和氧气的供给,该燃料电池就会连续不断地产生电能。 燃料电池的分类 1 按燃料电池的运行机理分 根据燃料电池的运行机理的不同,可分为酸性燃料电池和碱性燃料电池.例如磷酸燃料电池(PA FC)和液态氢氧化钾燃料电池(LPH FC)。 2按电解质种类分 根据燃料电池中使用电解质种类的不同,可分为酸性、碱性、熔融盐类或固体电解质的燃料电池。即碱性燃料电池(AFC )、磷酸燃料电池(PAFC )、熔融碳酸盐燃料电池(MCF C)、固体氧化物燃料电池(SOF C)和质子交换膜燃料电池(PEMFC )等。在燃料电池中,磷酸燃料电池(PAFC )、质子交换膜燃料电池(PEMFC )可以冷起动和快起动,可以用作为移动电源,适应燃料电池电动汽车(FCEV)使用的要求,更加具有竞争力。 3按燃料类型分 燃料电池的燃料有氢气、甲醇、甲烷、乙烷、甲苯、丁烯、丁烷等有机燃料和汽油、柴油以及天然气等气体燃料,有机燃料和气体燃料必须经过重整器“重整”为氢气后,才能成为燃料电池的燃料。根据燃料电池使用燃料类型的不同,可分为直接型燃料电池、间接型燃料电池和再生型燃料电池。 4按工作温度分 e H H 222+→+O H O e H 222122→+++O H O H 22222=+
燃料电池原理与发展 燃料电池是一种能够持续的通过发生在阳极和阴极的氧化还原反应将化学能转化为电能的能量转换装置。燃料电池与常规电池的区别在于,它工作时需要连续不断地向电池内输入燃料和氧化剂,只要持续供应,燃料电池就会不断提供电能。由于燃料电池能将燃料的化学能直接转换为电能,因此,它没有像普通火力发电厂那样的通过锅炉、汽轮机、发电机的能量形态变化,可避免过程中转换损失,达到市制发电效率。 近20多年来,燃料电池经历了碱式、磷酸、熔融碳酸盐和固体电解质等几种类型的发展阶段。美、日等国已相继建立了一些碳酸燃料电池电厂、熔融碳酸盐燃料电池电厂和质子交换膜燃料电池电厂。燃料电池的结构与普通电池基本相同,有阳极和阴极,通过电解质将这两个电极分开。与普通电池的区别是,燃料电池是开式系统。它要求连续供应化学反应物,以保证连续供电。其工作原理:燃料电池由阳极、阴极和离子导电的电解质构成,其工作原理与普通电化学电池类似,燃料在阳极氧化,氧化剂在阴极还原,电子从阳极通过负载流向阴极构成电回路,产生电流。 介绍一下熔融碳酸盐燃料电池(MCFC)一、MCFC概述 1.1 燃料电池简述燃料电池(FC)是一种将贮存在燃料和氧化剂中的化学能直接转化为电能的发电装置,结构如图1-1所示。它的发电方式与常规的化学电源一样,电极提供电子转移的场所,阳极催化燃料(如氢)的氧化过程,阴极催化氧化剂(如氧)的还原过程,导电离子在将阴阳极分开的电解质内迁移,电子通过外电路作功并构成总的电回路。在电池内这一化学能向电能的转化过程等温进行,即在燃料电池内,可在其操作温度下利用化学反应的自由能。但是,燃料电池的工作方式又与常规的化学电源不同,它的燃料和氧化剂并非贮存在电池内。同汽油发电机相似,它的燃料和氧化剂都贮存在电池之外的贮罐中。当电池工作时,要连续不断地向电池内送入燃料和氧化剂,排出反应产物,同时排出一定的废热,以维持电池温度的恒定。燃料电池本身只决定输出功率的大小,其贮能量则由燃料罐和氧化剂罐的贮量决定。总体上,燃料电池具有以下特点: (l) 不受卡诺循环限制,能量转换效率高。 (2) 燃料电池的输出功率由单电池性能、电极面积和单电池个数决定。
简述燃料电池的基本工作原理及主要用途 1.燃料电池的工作原理 燃料电池是一种按电化学原理,即原电池的工作原理,等温地把贮存在燃料和氧化剂中的化学能直接转化为电能的能量转换装置。其单体电池是由电池的正极(即氧化剂发生还原反应的阴极)、负极(即还原剂或燃料发生氧化反应的阳极)和电解质构成,燃料电池与常规电池的不同之处在于,它的燃料和氧化剂不是贮存在电池内,而是贮存在电池外部的贮罐内,不受电池容量的限制,工作时燃料和氧化剂连续不断地输入电池内部,并同时排放出反应产物。 以磷酸型燃料电池为例,其反应式为: 燃料极(阳极) H2→2H++2e- 空气极(阴极) 1/2O2+2H++2e-→H2O 综合反应式H2+1/2O2→H2O 以上反应式表示:燃料电池工作时向负极供给燃料(氢),向正极供给氧化剂(空气),燃料(氢)在阳极被分解成带正电的氢离子(H+)和带负电的电子(e-),氢离子(H+)在电解质中移动与空气极侧提供的O2发生反应,而电子(e-)通过外部的负荷电路返回到空气极侧参与反应,连续的反应促成了电子(e-)连续地流动,形成直流电,这就是燃料电池的发电过程,也是电解反应的逆过程。 2. 燃料电池的应用 2.1能源发电 燃料电池电站的每一套设备都包括了一整套采用天然气发电的电力系统。分为以下几个分单元:①燃料电池组②燃气制备③空气压缩机④水再生利用⑤逆变器⑥测量与控制系统。燃料电池组产生的直流电通过逆变器转换成电力系统所需的交流电。各国工业界人士普遍对于燃料电池在发电站的应用前景看好。 2.2汽车动力 目前,各国的汽车时用量均在不断增加,其排放的尾气已成为城市环境的主要污染源之一,特别是发展中国家,由于环境治理的力度不够,这一问题更加突出。于是人们要求开发新型的清洁、高效的能源来解决这一问题。质子交换膜燃料电池的出现,解决了燃料电池在汽车动力成本和技术方面存在的若干问题,使燃料电池电动车的开发和使用成为可能。这种电池具有室温快速启动、无电解液流失、水易排出、寿命长、比功率与比能量高等特点,适合做汽车动力,是目前世界各国积极开发的运输用燃料电池。 2.3家庭用能源 天然气作为一种洁净的能源已经在家庭中被广泛使用,但其主要被用于炊事和生活热水,以天然气为燃料的燃气电池在家庭中的广泛应用在开辟了天然气在家庭中一种新的用途的同时也将解决目前高峰用电紧张的状况。家庭的一切用电无论是电视机、冰箱、空调等家用电气还是电脑等办公设备都可以通过燃料电池来提供电源,作为家庭使用的分散电源,并可同时提供家庭用热水和采暖,这样可将天然气的能量利用率提高到70%~90%。 2.4其它方面的应用 碱性燃料电池和质子交换膜燃料电池运行时基本没有红外辐射,而且噪音小,用做潜艇动力,可大大提高其隐蔽性;同时由于它们可在常温下启动工作,且能量密度高,还是理想的航天器工作电源。此外,质子交换膜燃料电池还可用作野外便携式电源。 总之,燃料电池的用途将越来越广泛,它将遍布我们身边的每个角落,成为我们生活中不可缺少的能量来源。
三、试简述五大类燃料电池的工作原理和各自的特点 燃料电池按燃料电解质的类型来分类的,可分为碱性燃料电池(AFC)、磷酸燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)和质子交换膜燃料电池(PENFC)五大类。 3.1 碱性燃料电池(AFC) 碱性燃料电池是该技术发展最快的一种电池,主要为空间任务,包括航天飞机提供动力和饮用水。 3.1.1原理 使用的电解质为水溶液或稳定的氢氧化钾基质,且电化学反应也与羟基(OH)从阴极移动到阳极与氢反应生成水和电子略有不同。这些电子是用来为外部电路提供能量,然后才回到阴极与氧和水反应生成更多的羟基离子。 负极反应:2H2 + 4OH-→ 4H2O + 4e- 正极反应:O2 + 2H2O + 4e- → 4OH- 碱性燃料电池的工作温度大约80℃。因此,它们的启动也很快,但其电力密度却比质子交换膜燃料电池的密度低十来倍,在汽车中使用显得相当笨拙。不过,它们是燃料电池中生产成本最低的一种电池,因此可用于小型的固定发电装置。 如同质子交换膜燃料电池一样,碱性燃料电池对能污染催化剂的一氧化碳和其它杂质也非常敏感。此外,其原料不能含有一氧化碳,因为一氧化碳能与氢氧化钾电解质反应生成碳酸钾,降低电池的性能。 3.1.2 特点 低温性能好,温度范围宽,并且可以在较宽温度范围内选择催化剂,但是才用的碱性电解质易受CO2的毒化作用因此必须要严格出去CO2,成本就偏高。 3.2 磷酸燃料电池(PAFC) 磷酸燃料电池(PAFC)是当前商业化发展得最快的一种燃料电池。正如其名字所示,这种电池使用液体磷酸为电解质,通常位于碳化硅基质中。磷酸燃料电池的工作温度要比质子交换膜燃料电池和碱性燃料电池的工作温度略高,位于
各种燃料电池简述 1.碱性燃料电池(AFC) AFC是以碱性溶液为电解质,将存在于燃料和氧化剂中的化学能直接转化为电能的发电装置,是最早获得应用的燃料电池,由于其电解质必须是碱性溶液,因此而得名碱性燃料电池。氢氧化钠和氢氧化钾溶液,以其成本低,易溶解,腐蚀性低,而成为首选的电解液。催化剂主要用贵金属铂、钯、金、银和过渡金属镍、钴、锰等。在1973年成功地应用于Apollo登月飞船的主电源,使人们看到了燃料电池的诱人前景。具有启动快、效率高、价格低廉的优点,有一定的发展潜力。其反应式为: 阳极:2H2+4OH-→2 H2O +4e- 阴极: 2 H2O +O2→4OH- 总反应:2H2+O2→2H2O 这种电池常用35%-45%的KOH为电解液,渗透于多孔而惰性的基质隔膜材料中,工作温度小于100℃。该种电池的优点是氧在碱液中的电化学反应速度比在酸性液中大,因此有较大的电流密度和输出功率,但氧化剂应为纯氧,电池中贵金属催化剂用量较大,而利用率不高。目前,此类燃料电池技术的发展已非常成熟,并已经在航天飞行及潜艇中成功应用。国内已研制出200W氨-空气的碱性燃料电池系统,制成了1kW、10kW、20kW的碱性燃料电池,20世纪90年代后期在跟踪开发中取得了非常有价值的成果。发展碱性燃料电池的核心技术是要避免二氧化碳对碱性电解液成分的破坏,不论是空气中百万分之几的二氧化碳成分还是烃类的重整气使用时所含有的二氧化碳,都要进行去除处理,这无疑增加了系统的总体造价。此外,电池进行电化学反应生成的水需及时排出,以维持水平衡。因此,简化排水系统和控制系统也是碱性燃料电池发展中需要解决的核心技术。 2.磷酸型燃料电池(PAFC) PAFC自20世纪60年代在美国开始研究一来,由于操作温度低,耐CO中毒能力强等特点,得到了优先发展,是目前技术成熟、发展最快的燃料电池。
燃料电池发展综述 摘要本文对燃料电池的基本概念,基本工作原理和特性作了详细介绍,对其工作效率和提高效率的方法作了定量讨论,并着重研究了在中国有广阔应用前景的熔融氧化物燃料电池发电装置的工作情况,提出了改进方案。 关键词燃料电池MCFC 整体煤气化联合循环燃料电池 1 引言能源作为现代人类文明的支柱产业之一,越来越受到人们的高度重视。目前能源利用中存在两大问题: (1)利用效率不高:普通的热力发电效率平均仅为30%-40%,面对日益紧缺的能源现状,提高能源利用效率迫在眉睫。 (2)污染严重:能源消耗中所产生的各种废气已严重污染了环境,给人类和生物生存空间带来严重威胁。面对如此现状,研究开发高效,节能,低污染的"绿色技术"--燃料电池成为当今一大热门话题。 由于成本过高,难以投入实际生产等原因,燃料电池(fuel cell)自从1893 年由英国人W.Grove 发明以后,曾一度被遗忘,直到本世纪60 年代后期也只能被用于阿波罗(Apollo)和双子星座(Gemini)宇宙飞船等特殊场合。可是近年来,由于低价格催化剂的开发,再加上许多一般发电方式不可比拟的优点,燃料电池发电特别是大规模发电厂的建设又重新为人们所重视。一般的火力发电是把燃料转换为热能,驱动气轮机旋转而发电,而燃料电池是把燃料的化学能直接转变为电能的装置,省去了热机的环节。燃料电池比普通发电方式有众多优点:1.不受热机效率(卡诺循环)的限制,从而使循环效率有了质的提高。实际效率可达60%以上。这比普通的蒸汽发电有很大的优越性。2.产物污染少,例如:氢氧燃料电池的最终产物只有水。3.由于无大型旋转机械,故噪音小。目前燃料电池的发展主要有两种趋势:第一是小型化,以适应在汽车和手提电脑内使用,主要以PEMFC 为代表。第二种是形成规模化燃料电池发电厂,以期替代传统的火力发电形成第四代新型能源。这方面主要以熔融碳酸盐型MCFC 为代表。本文将重点对其进行讨论。2 燃料电池基本工作原理按一般电池的表示方法,燃料电池可表示为Re/电解质/Ox 式中,Re 表示氢,肼,烃,CO 等活性还原剂。Ox 表示氧,过氧化氢等氧化剂;电解质为用氢氧化钾溶液,浓磷酸溶液,离子交换膜,熔融碳酸盐等,其原理模型如图 1 所示。比如现在设想一个用氢作燃料,用氧做氧化剂,电解质用氢氧化钾溶液的燃料电池。这个电池的体系可表示为H /KOH/O 这时电池反应为:图 1 燃料电池原理模型负极侧正极侧总反应由于燃料电池的基本性能对电站设计起重要作用,故首先对其进行必要的讨论。电池有两大基本性能参数:1.发电能量2.开路电压。现分别分析如下:(1).最大发电能量根据化学热力学知,对以可逆定温反应的燃料电池,设和稳定流入系统,而从系统稳定流出,忽略动能和位能变化,则此燃料电池在标准状态下对外做的最大有用功为:由得:即消耗每kJ ,最大可发出237146kJ 的电能。如反应温度变为500K,根据G=H-TS 得:不同温度下(其它参数不变)燃料电池反应的最大输出电能如图3 所示,可见,随着温度的升高,输出最大有用功略有下降。(2).开路电压一般电池电动势等于组成电池的两个电极的平衡电极电相位差。如下式: 式中:E 为电池的电动势(V)为正极平衡电极电位(V)为负极平衡电极电位(V)在非标准状态下,电极电位由方程给出其中 a 和分别为电极反应中氧化态和还原态物质活度。对于总反应为的燃料电池有:(1)其中,可见,提高温度可使开路电压和E 提高,如T=273.15 时而当T=900K 时,由式(1)可算得E=1.56v,同时我们看到,T 不变时,与lgP P 成正比,如图 4 所示图4 压力的对数与开路电压线性关系示意图可见:1.单个燃料电池电压很低,实际生产中要采用多个电池串连的电堆(Stack)的方式。2.提高反应温度T 和反应气体压力可提高输出电压,从而
一、燃料电池的工作原理 燃料电池是用一种特定的燃料,通过一种质子交换膜(PEMProtonExchangeMembrane)和催化层(CLCatalystLayer)而产生电流的一种装置,这种电池只要外界源源不断地供应燃料(例如氢气或甲醇),就可以提供持续电能。它的工作原理,是利用一种叫质子交换膜的技术,使氢气在覆盖有催化剂的质子交换膜作用下,在阳极将氢气催化分解成为质子,这些质子通过质子交换膜到达阴极,在氢气的分解过程中释放出电子,电子通过负载被引出到阴极,这样就产生了电能。 在阳极经过质子交换膜和催化剂的作用,在阴极质子与氧和电子相结合产生水。也就是说燃料电池内部的氢与空气中的氧进行化学反应,生成水的过程,同时产生了电流,也可以理解为是电解水的逆反应。 燃料电池在阳极除供应氢气外,同时还收集氢质子(H+),释放电子;在阴极通过负载捕获电子产生电能。质子交换膜的功能只是允许质子H+通过,并与阴极中的氧结合产生水。这种水在反应过程中的温度作用下,以水蒸气的形式散发在空气中(对汽车用的大功率燃料电池就要设置水的回收装置)。注意,用氢作燃料电池所生成的是纯净水可以饮用,而用甲醇作燃料生成的水溶液中可能产生甲醛之类有毒物质不能饮用。图1为燃料电池工作原理的示意图。
二、燃料电池的分类 由于人们是从不同角度来研究和开发燃料电池的,所以其种类也繁多,但目前主要有3种。 1 质子交换膜技术 质子交换膜技术(或者称聚合物电解液膜技术)——简称PEMFC (ProtonExchangeMembreneFuelCell)。由于它能提供比传统锂离子电池大约高出5~10倍的能量密度,比甲醇燃料电池也有更高的能量密度,所以,人们都看好质子交换膜技术的氢燃料电池,虽然它还存在着储存及安全等问题,但人们正在克服它,最终有望在3~5年实现可存储在像打火机大小的容器中,充一次氢气发电可供手机使用几天,它将是未来便携式电子产品供电系统的首选。 2 直接甲醇燃料电池 直接甲醇燃料电池——简称DMFC(DirectMethanolFuelCell)。它是以甲醇为燃料,通过与氧结合产生电流的,优点是直接使用甲醇,省去了氢的生产与存储,因为,在汽车上早已使用甲醇溶液作为挡风玻璃的刮洗液了,故不存在安全问题。但甲醇存在泄漏问题,虽然用水稀释可以解决,但是电解效率却大大降低,目前正在解决渗漏问题。 3 直接乙醇燃料电池 直接乙醇燃料电池——简称DEFC(DirectEthanolFuelCell)。为避免甲醇的渗漏问题,而采用乙醇,它也是由两个电极、燃料及电解液组成的。
燃料电池的基本工作原理 燃料电池的基本工作原理我们在准备长途旅行之前,总是不会忘记检查是否随身携带了信用卡或者钱包,当然还有手机或者笔记本电脑的备用电池和充电器,它们的重要性伴随着人们对手机和笔记本电脑的依赖日益彰显。其症结所在就是电池的有限的工作时间,目前便携式电子产品使用的锂离子电池已经无法应付长时间操作的需求。一块手机普通的锂电池只能维持几天时间,笔记本电脑的电池也就几个小时。而随着无线技术和音视频功能越来越受欢迎 燃料电池的基本工作原理 我们在准备长途旅行之前,总是不会忘记检查是否随身携带了信用卡或者钱包,当然还有手机或者笔记本电脑的备用电池和充电器,它们的重要性伴随着人们对手机和笔记本电脑的依赖日益彰显。其症结所在就是电池的有限的工作时间,目前便携式电子产品使用的锂离子电池已经无法应付长时间操作的需求。一块手机普通的锂电池只能维持几天时间,笔记本电脑的电池也就几个小时。而随着无线技术和音视频功能越来越受欢迎,对电池的工作时间的要求与日俱增,传统二次电池(包括锂电池和镍电池)已经成为瓶颈,桎梏了便携式产品向更丰富功能的方向发展。 与传统二次电池相比,燃料电池的能量至少要高10倍。一个锂离子电池能提供300 Whr/L的电量密度,而甲醇燃料电池的电量密度却高达4800 Whr/L,10ml的甲醇可以保证13.5小时的通话时间或者642小时的待机时间。因此,东芝、IBM、NEC等许多国际著名的电子公司都倾注精力和财力研究燃料电池,目前世界前十大营收企业,除Walmart外,均有投资氢能或燃料电池产业。 专攻便携式应用的DMFC 理论上,燃料电池(Fuel Cell)并不是电池,只是把燃料(例如氢气)和氧化剂通过电极反应直接生成电流的装置,由于它的生成物是水,因而具有相当的环保优势。燃料电池的典型结构就是层迭电池单元的堆栈(Stack),一个堆栈可以包含多个单独的燃料单元(图1)。而每个单元的基本结构与电解水装置相类似,包含2个正负电极(阳极和阴极),电解质以及催化剂。阳极为氢电极,阴极为氧电极,阳极和阴极上都含有一定量的催化剂,目的是用来加速电极上发生的电化学反应。以氢氧反应为例,在阴极催化剂的作用下,一个氢分子分解成2个氢离子,同时释放出2个电子,由于阻隔膜对电子的过滤作用,电子无法通过电解质只能绕行,从而形成电流。而氢离子可以顺利通过电解质达到阴极和空气中的氧原子反应生成水(图2)。 图1 燃料电池的基本结构
燃料电池(FuelCell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。 燃料电池含有阳阴两个电极,分别充满电解液,而两个电极间则为具有渗透性的薄膜所构成。氢气由阳极进入供给燃料,氧气(或空气)由阴极进入电池。 电池经由催化剂的作用,使得阳极的氢原子分解成氢质子(proton)与电子(electron),其中质子进入电解液中,被氧“吸引”到薄膜的另一边,电子经由外电路形成电流后,到达阴极。在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子。这正是水的电解反应的逆过程,因此水是燃料电池唯一的排放物。 利用这个原理,燃料电池便可在工作时源源不断地向外部输电,为一种 "发电机"。 阳极反应 - 阴极反应 总反应 伴随着电池反应,电池向外输出电能。只要保持氢气和氧气的供给,该燃料电池就会连续不断地产生电能。 燃料电池的分类 1 按燃料电池的运行机理分 根据燃料电池的运行机理的不同,可分为酸性燃料电池和碱性燃料电池。例如磷酸燃料电池(PAFC)和液态氢氧化钾燃料电池(LPHFC)。 2按电解质种类分 根据燃料电池中使用电解质种类的不同,可分为酸性、碱性、熔融盐类或固体电解质的燃料电池。即碱性燃料电池(AFC)、磷酸燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)和质子交换膜燃料电池(PEMFC)等。在燃料电池中,磷酸燃料电池(PAFC)、质子交换膜燃料电池(PEMFC)可以冷起动和快起动,可以用作为移动电源,适应燃料电池电动汽车(FCEV)使用的要求,更加具有竞争力。 3按燃料类型分 燃料电池的燃料有氢气、甲醇、甲烷、乙烷、甲苯、丁烯、丁烷等有机燃料和汽油、柴油以及天然气等气体燃料,有机燃料和气体燃料必须经过重整器“重整”为氢气后,才能成为燃料电池的燃料。根据燃料电池使用燃料类型的不同,可分为直接型燃料电池、间接型燃料电池和再生型燃料电池。 4按工作温度分 根据燃料电池工作温度的不同,可分为低温型,温度低于200℃;中温型,温度为200-750℃;高温型,温度高于750℃。质子交换膜燃料电池(PEMFC)在常温下可以正常工作,这类燃料电池需要采用贵金属作为催化剂,燃料的化学能绝大部分都能转化为电能,只产生少量的废热和水,不产生污染大气环境的氮氧化物。熔融碳酸盐燃料电池(M C F C)和固体氧化物燃料电池(SOFC)在高温下作,这类燃料电池不需要采用贵金属作为催化剂。但由于工作温度高,需要采用复合废热回收装置来利用废热,体积大。
燃料电池的工作原理 作者:佚名来源:不详录入:Admin更新时间:2008-8-18 10:07:07点击数:8 【字体:】 燃料电池的一般结构为:燃料(负极)|电解质(液态或固态)|氧化剂(正极)。在燃料电池中,负极常称为燃料电极或氢电极,正极常称为氧化剂电极、空气电极或氧电极。燃料有气态如氢气、一氧化碳、二氧化碳和碳氢化合物,液态如液氢、甲醇、高价碳氢化合物和液态金属,还有固态如碳等。按电化学强弱,燃料的活性排列次序为:肼>氢>醇>一氧化碳>烃>煤。燃料的化学结构越简单,建造燃料电池时可能出现的问题越少。氧化剂为纯氧、空气和卤素。电解质是离子导电而非电子导电的材料,液态电解质分为碱性和酸性电解液, 固态电解质有质子交换膜和氧化锆隔膜等。在液体电解质中应用微孔膜,0.2mm~0.5mm厚。固体电解质为无孔膜,薄膜厚度约为20μm。 燃料电池的反应为氧化还原反应,电极的作用一方面是传递电子、形成电流;另一方面是在电极表面发生多相催化反应,反应不涉及电极材料本身,这一点与一般化学电池中电极材料参与化学反应很不相同,电极表面起催化剂表面的作用。 在氢氧燃料电池中,氢和氧在各自的电极反应。氧电极进行氧化反应,放出电子,氢电极进行还原反应,吸收电子,总反应为: O2+2H2→2H2O 反应结果是氢和氧发生电化学燃烧,生成水和产生电能。由热力学变量可得到以下理论电动势和理论热效率公式: Eo=-(ΔG/2F)=1.23V η=ΔG/ΔH=83.0% 式中,ΔG和ΔH分别为自由能变化和热焓变化,F是法第常数。
燃料电池工作的中心问题是燃料和氧化剂在电极过程中的反应活性问题。对于气体电极过程,必需采用多孔气体扩散电极和高效电催化剂,提高比表面,增加反应活性,提高电池比功率。 氢在负极氧化是氢原子离解为氢离子和电子的过程,若用有机化合物燃料,首先需要催化裂化或重整,生成富氢气体,必要时还要除去毒化催化剂的有害杂质。这些反应可在电池内部或外部进行,需附加辅助系统。正极中的氧化反应缓慢,燃料电池的活性主要依赖正极。随着温度升高,氧的还原反应有相当的改善。高温反应有利于提高燃料电池反应活性。 对于燃料电池发电系统,核心部件是燃料电池组,它由燃料电池单体堆集而成,单体电池的串联和并联选择,依据满足负载的输出电压和电流,并使总电阻最低,尽量减小电路短路的可能性。其余部件是燃料预处理装置、热量管理装置、电压变换调整装置和自动控制装置。通过燃料预处理,实现燃料的生成和提纯。燃料电池的运行或起动,有的需要加热,工作时放出相当的热量,由热量管理装置合理地加热或除热。燃料电池工作时,在碱性电解液负极或酸性电解液正极处生成水。为了保证电解液浓度稳定,生成的水要及时排除。高温燃料电池生成水会汽化,容易排除,水量管理装置将实现合理的排水。燃料电池与化学电池一样,输出直流电压,通过电压变换成为交流电送到用户或电网。燃料电池发电系统通过自控装置使各个部件协调工作,进行统一控制和管理。
燃料电池种类工作原 理及结构
燃料电池 燃料电池(FuelCell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。 燃料电池含有阳阴两个电极,分别充满电解液,而两个电极间则为具有渗透性的薄膜所构成。氢气由阳极进入供给燃料,氧气(或空气)由阴极进入电池。 电池经由催化剂的作用,使得阳极的氢原子分解成氢质子(proton )与电子(electron ),其中质子进入电解液中,被氧“吸引”到薄膜的另一边,电子经由外电路形成电流后,到达阴极。在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子。这正是水的电解反应的逆过程,因此水是燃料电池唯一的排放物。 利用这个原理,燃料电池便可在工作时源源不断地向外部输电,为一种 "发电机"。 阳极反应 - 阴极反应 总反应 伴随着电池反应,电池向外输出电能。只要保持氢气和氧气的供给,该燃料电池就会连续不断地产生电能。 燃料电池的分类 1 按燃料电池的运行机理分 e H H 222+→+O H O e H 222 122→+++O H O H 22222=+
根据燃料电池的运行机理的不同,可分为酸性燃料电池和碱性燃料电池。例如磷酸燃料电池(PAFC)和液态氢氧化钾燃料电池(LPHFC)。 2按电解质种类分 根据燃料电池中使用电解质种类的不同,可分为酸性、碱性、熔融盐类或固体电解质的燃料电池。即碱性燃料电池(AFC)、磷酸燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)和质子交换膜燃料电池(PEMFC)等。在燃料电池中,磷酸燃料电池(PAFC)、质子交换膜燃料电池(PEMFC)可以冷起动和快起动,可以用作为移动电源,适应燃料电池电动汽车(FCEV)使用的要求,更加具有竞争力。 3按燃料类型分 燃料电池的燃料有氢气、甲醇、甲烷、乙烷、甲苯、丁烯、丁烷等有机燃料和汽油、柴油以及天然气等气体燃料,有机燃料和气体燃料必须经过重整器“重整”为氢气后,才能成为燃料电池的燃料。根据燃料电池使用燃料类型的不同,可分为直接型燃料电池、间接型燃料电池和再生型燃料电池。 4按工作温度分
应用电化学 论文作业 题目燃料电池的发展现状及研究进展学院化学与化学工程学院 专业班级制药134班 姓名郭莹莹
摘要 燃料电池是一种清洁高效的能源利用方式,它是一种能够持续将化学能转化为电能的能量转换装置。发展燃料电池对于改善环境和实现能源可持续发展有重要意义。本文介绍了燃料电池的工作原理、分类及燃料电池的优点,详细阐述了燃料电池现在的发展现状和未来研究前景的展望。 关键词:燃料电池转换装置应用发展
1 燃料电池的工作原理及分类 燃料电池( Fuel Cell,FC) 是把燃料中的化学能通过电化学反应直接转换为电能的发电装置。按电解质分类,燃料电池一般包括质子交换膜燃料电池( Proton Exchange Membrane Fuel Cell,PEM-FC) 、磷酸燃料电池( Phosphoric Acid Fuel Cell,PAFC) 、碱性燃料电池( Alkaline Fuel Cell,AFC) 、固体氧化物燃料电池( Solid Oxide Fuel Cell,SOFC) 及熔融碳酸盐燃料电池( Molten CarbonateFuel Cell,MCFC) 等。以质子交换膜燃料电池为例,主要部件包括: 膜电极组件( Membrane Elec-trode Assembly,MEA) 、双极板及密封元件等。膜电极组件是电化学反应的核心部件,由阴阳极多孔气体扩散电极和电解质隔膜组成。电解质隔膜两侧分别发生氢氧化反应与氧还原反应,电子通过外电路作功,反应产物为水。额定工作条件下,一节单电池工作电压仅为0.7 V 左右。为了满足一定应用背景的功率需求,燃料电池通常由数百个单电池串联形成燃料电池堆或模块。因此,与其它化学电源一样,燃料电池的均一性非常重要。燃料电池发电原理与原电池类似( 见图1) ,但与原电池和二次电池比较,需要具备一相对复杂的系统,通常包括燃料供应、氧化剂供应、水热管理及电控等子系统,其工作方式与内燃机类似。理论上只要外部不断供给燃料与氧化剂,燃料电池就可以续发电。 图1 PEMFC 基本原理 燃料电池从发明至今已经经历了100 多年的历程。于能源与环境已成为人
燃料电池 燃料电池(FuelCell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。 燃料电池含有阳阴两个电极,分别充满电解液,而两个电极间则为具有渗透性的薄膜所构成。氢气由阳极进入供给燃料,氧气(或空气)由阴极进入电池。 电池经由催化剂的作用,使得阳极的氢原子分解成氢质子(proton )与电子(electron ),其中质子进入电解液中,被氧“吸引”到薄膜的另一边,电子经由外电路形成电流后,到达阴极。在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子。这正是水的电解反应的逆过程,因此水是燃料电池唯一的排放物。 利用这个原理,燃料电池便可在工作时源源不断地向外部输电,为一种 "发电机"。 阳极反应 - 阴极反应 总反应 伴随着电池反应,电池向外输出电能。只要保持氢气和氧气的供给,该燃料电池就会连续不断地产生电能。 燃料电池的分类 1 按燃料电池的运行机理分 根据燃料电池的运行机理的不同,可分为酸性燃料电池和碱性燃料电池。例如磷酸燃料电池(PAFC)和液态氢氧化钾燃料电池(LPHFC)。 2按电解质种类分 根据燃料电池中使用电解质种类的不同,可分为酸性、碱性、熔融盐类或固体电解质的燃料电池。即碱性燃料电池(AFC)、磷酸燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)和质子交换膜燃料电池(PEMFC)等。在燃料电池中,磷酸燃料电池(PAFC)、质子交换膜燃料电池(PEMFC)可以冷起动和快起动,可以用作为移动电源,适应燃料电池电动汽车(FCEV)使用的要求,更加具有竞争力。 3按燃料类型分 燃料电池的燃料有氢气、甲醇、甲烷、乙烷、甲苯、丁烯、丁烷等有机燃料和汽油、柴油以及天然气等气体燃料,有机燃料和气体燃料必须经过重整器“重整”为氢气后,才能成为燃料电池的燃料。根据燃料电池使用燃料类型的不同,可分为直接型燃料电池、间接型燃料电池和再生型燃料电池。 4按工作温度分 e H H 222+→+O H O e H 222122→+++O H O H 22222=+
应用电化学 论文作业题目燃料电池的发展现状及研究进展学院化学与化学工程学院 专业班级制药134班 姓名郭莹莹
摘要 燃料电池是一种清洁高效的能源利用方式,它是一种能够持续将化学能转化为电能的能量转换装置。发展燃料电池对于改善环境和实现能源可持续发展有重要意义。本文介绍了燃料电池的工作原理、分类及燃料电池的优点,详细阐述了燃料电池现在的发展现状和未来研究前景的展望。 关键词:燃料电池转换装置应用发展 1 燃料电池的工作原理及分类 燃料电池( Fuel Cell,FC) 是把燃料中的化学能通过电化学反应直接转换为电能的发电装置。按电解质分类,燃料电池一般包括质子交换膜燃料电池( Proton Exchange Membrane Fuel Cell,PEM-FC) 、磷酸燃料电池( Phosphoric Acid Fuel Cell,PAFC) 、碱性燃料电池( Alkaline Fuel Cell,AFC) 、固体氧化物燃料电池 ( Solid Oxide Fuel Cell,SOFC) 及熔融碳酸盐燃料电池( Molten CarbonateFuel Cell,MCFC) 等。以质子交换膜燃料电池为例,主要部件包括: 膜电极组件( Membrane Elec-trode Assembly, MEA) 、双极板及密封元件等。膜电极组件是电化学反应的核心部件,由阴阳极多孔气体扩散电极和电解质隔膜组成。电解质隔膜两侧分别发生氢氧化反应与氧还原反应,电子通过外电路作功,反应产物为水。额定工作条件下,一节单电池工作电压仅为0.7 V 左右。为了满足一定应用背景的功率需求,燃料电池通常由数百个单电池串联形成燃料电池堆或模块。因此,与其它化学电源一样,燃料电池的均一性非常重要。燃料电池发电原理与原电池类似( 见图1) ,但与原电池和二次 电池比较,需要具备一相对复杂的系统,通常包括燃料供应、氧化剂供应、水热管理及电控等子系统,其工作方式与内燃机类似。理论上只要外部不断供给燃料与氧化剂,燃料电池就可以续发电。 图1 PEMFC 基本原理 燃料电池从发明至今已经经历了 100 多年的历程。于能源与环境已成为人类社会赖以生存的重点问题。近20 年以来,燃料电池这种高效、洁净的能量 转化装置得到了各国政府、开发商及研究机构的普遍重视。燃料电池在交通运输、便携式电源、分散电站、航空及水下潜器等民用与军用领域展现出广阔的应用前景。目前,燃料电池汽车、电站及便携式电源等均处于示范阶段,在商
氢燃料电池原理 Document number【AA80KGB-AA98YT-AAT8CB-2A6UT-A18GG】
氢燃料电池的工作原理 燃料电池本质是水电解的“逆”装置,主要由3 部分组成,即阳极、阴极、电解质,如图 1[3]。其阳极为氢电极,阴极为氧电极。通常,阳极和阴极上都含有一定量的催化剂,用来加速电极上发生的电化学反应。两极之间是电解质。 以质子交换膜燃料电池(PEMFC)为例,其工作原理如下: (1) 氢气通过管道或导气板到达阳极; (2) 在阳极催化剂的作用下,1 个氢分子解离为 2 个氢质子,并释放出 2 个电子,阳极反应为: H2→2H++2e。 (3) 在电池的另一端,氧气(或空气)通过管道或导气板到达阴极,在阴极催化剂的作用下,氧分子和氢离子与通过外电路到达阴极的电子发生反应生成水,阴极反应为:1/2O2+2H++2e→H2O 总的化学反应为:H2+1/2O2=H2O 电子在外电路形成直流电。因此,只要源源不断地向燃料电池阳极和阴极供给氢气和氧气,就可以向外电路的负载连续地输出电能。
3 PEMFC 的特点及研发应用现状 燃料电池种类较多,PEMFC 以其工作温度低、启动快、能量密度高、寿命长等优点特别适宜作为便携式电源、机动车电源和中、小型发电系统。 PEMFC 发电机由本体及其附属系统构成。本体结构除上述核心单元外,还包括单体电池层叠时为防止汽、水泄漏而设置的密封件,以及压紧各单体电池所需的紧固件等。附属系统包括:燃料及氧化剂贮存及其循环单元,电池湿度、温度调节单元,功率变换单元及系统控制单元。图 2 是一个典型的PEMFC 发电系统示意图[4]。 (1) PEMFC 作为移动式电源的应用 PEMFC 作为移动式电源的应用领域分为两大类:一是可用作便携式电源、小型移动电源、车载电源等。适用于军事、通讯、计算机等领域,以满足应急供电和高可靠性、高稳定性供电的需要。实际应用是手机电池、笔记本电脑等便携电子设备、军用背负式通讯电源、卫星通讯车载电源等。二是用作自行车、摩托车、汽车等交通工具的动力电源,以满足环保对车辆排放的要求。从目前发展情况看,PEMFC 是技术最成熟的电动车动力电源。
一、前言 科技文明不停的进步,人口不断的增加以及为了追求更美好的生活,人们不停的增加能源的使用量,使得石化燃料(石油、煤炭、天然气等)日已枯竭,大量的使用石化燃料也衍生出许多问题如:空气污染、酸雨以及温室效应等问题。据统计,以现今石油消耗的速度,地球上的石油储存量最多能再用40到50年,为了避免届时世界陷入难以估计的经济恐慌,各国提出了各种以绿色能源取代石化燃料的方案。 目前世界上绿色能源有太阳能、风力、水力、潮汐、地热、生物能以及氢能等。但太阳能转化效率不高、制造过程复杂生产成本昂贵;而风力会受到地形天候限制;水力发电建设费用相当高,且在河流上建造水坝会破坏河流生态;地热又少;因此在这些绿色能源中以燃料电池最具发展潜力。 燃料电池能够应用的领域相当广泛,包括电力、工业、运输、太空、军事、通讯产品等等。目前许多国家都在发展燃料电池,经过多年研究以及技术改良现在燃料电池技术已经进入商业化阶段,未来极有可能成为最重要的绿色科技之一。 二、燃料电池发展史 燃料电池技术起源于1838年,C. F. Schonbein发现了燃料电池的电,氢气与白 金电极上的氯气或氧气发生的化学反应能产生电流,并将这种现象命名为极化效应。 1839年,Willian Grove设计了一款气体电池,他的基本设想来自于水的电解反应,水电解之后产生氧气和氢气,若将电解反应逆转则能产生电流,于是用两条白金分别放入两个密封的瓶子中,一瓶充满氢气,一瓶充满氧气,将两容器浸入稀硫酸溶液时,电流便在两个电极之间流动,为了提高装置产生的电压,就将四组装置串联起来,此装置就是后来全世界公认的第一个燃料电池。 1899年,Nernst提出将固态氧化物当做电解质用于燃料电池之中。 1959年,Francis T. Bacon 制作出一个5KW的燃料电池,能够推动电焊,电锯以及堆高机,使燃料电池技术走出实验室。 1960年美国太空署为了发展太空科技而开始将燃料电池实用化。 1965年氢燃料电池正式应用在太空船双子星五号上,为美国太空计划中的电力提供系统,因产物是纯水也为太空人提供饮用水。此后燃料电池在太空行动如阿波罗7~17号中均起到重责大任。 1973年发生石油能源危机,各国开始认识到能源的重要性,纷纷拟定各种能源政策以期望降低对石油的依赖。燃料电池因其高的能源转化率而引起各国重视。 1980年代环保意识的高涨,开法绿色能源技术使人类的发展不用受限于有限的天然资源,也可以让人类在享受能源提供生活便利的同时还能维持一个良好的生活环境,燃料电池以其低污染的特性再次走入大众视野。 现今燃料电池生产状况并不轻松,与化石燃料的竞争过于激烈。而且受制于成本问题,除非国家政策扶植力度大,否则很多燃料电池企业都很难盈利甚至亏损。如FuelCell能源公司2010年就在燃料电池领域亏损。但是燃料电池的优势还是十分显著的,环保方面的零排放,应用围之广,无论大到发电厂,还是汽车,还是小到电子消费产品都可以使用燃料电池。业认为,随着今后数十年的发展,再配合液态氢基础设施网络的建设和完善,燃料电池就会变得更稳定廉价,燃料电池发展的真正春天也就来了。
2.1.1.技术简介 2.1.1.1.燃料电池原理 燃料电池是一种能量转换装置。它按电化学原理,即原电池(如日常所用的锌锰干电池)的工作原理,等温地把贮存在燃料和氧化剂中的化学能直接转化为电能。 对于一个氧化还原反应,如: [O]+ [R]→P [O]代表氧化剂,[R]代表还原剂,P代表反应产物。原则上可以把上述反应分为两个半反应,一个为氧化剂[O]的还原反应,一个为还原剂[R]的氧化反应,若e-代表电子,即有: [R]→[R]+ + e- [R]+ +[O] + e-→P [R] +[O]→P 以最简单的氢氧反应为例,即为: H2→2H+ + 2e- 1/2 O2 + 2H+ +2e-→H2O H2 + 1/2 O2→H2O 如图1-1所示,氢离子在将两个半反应分开的电解质内迁移,电子通过外电路定向流动、 贮罐中。当它工作时(输出电流并做功时),需要不间断地向电池内输入燃料和氧化剂并同时排出反应产物。因此,从工作方式上看,它类似于常规的汽油或柴油发电机。 由于燃料电池工作时要连续不断地向电池内送入燃料和氧化剂,所以燃料电池使用的燃料和氧化剂均为流体,即气体和液体。最常用的燃料为纯氢、各种富含氢的气体(如重整气)和某些液体(如甲醇水溶液)。常用的氧化剂为纯氧、净化空气等气体和某些液体(如过氧化氢和硝酸的水溶液等)。 2.1.1.2.特点 (1) 高效燃料电池按电化学原理等温地直接将化学能转化为电能。在理论上它的热电转化效率可达85~90%。但实际上,电池在工作时由于各种极化的限制,目前各类电池实际的能量转化效率均在40~60%的范围内。若实现热电联供,燃料的总利用率可高达80%以上。
燃料电池的分类及应用 【摘要】在能源问题成为世界核心问题的今天,燃料电池作为一种新型能源应用方式得到了越来越广泛的应用。本文首先介绍了燃料电池的原理和特点,然后对燃料电池的分类进行了详细说明,最后简要介绍了其主要应用。 【关键词】燃料电池;原理;分类;应用 0.引言 时至今日,世界经济大体上仍然是化石燃料依赖型的,石油、煤和天然气占世界初级能源消费总量的85%左右,剩下的部分主要是水电和核电,真正的可再生清洁能源如风能、太阳能等所占比例不到3%。世界能源需求仍在以1.5%~2%的年率增长,而地质学家预测说,石油和天然气价格将大幅度上升,再也不会回落。 燃料电池的出现与发展,给便携式电子设备带来一场深刻的革命,并且还会波及到汽车业,住宅,以及社会各方面的集中供电系统。在21世纪中它将会把人类由集中供电带进一种分散供电的新时代。燃料电池供电,没有二氧化碳的排放,可减轻温室效应使全球气候变暖问题,它解决了火力发电使全球环境污染的问题,它是一个纯正的绿色清洁能源。 1.燃料电池的原理 1.1 燃料电池的组成和工作原理 燃料电池的基本组成:阳极、阴极、电解质和外电路。燃料电池中的电解质有不同的种类。燃料电池是靠氢氧结合成水的反应来发电的,因而不会产生氮氧化物(NOX)和碳氢化合物(HC)等易对空气造成污染的物质。它由三部分组成:阴极、阳极和电解液。 燃料电池有着几个独特的性质: (1)燃料电池在工作时必须有能量(燃料)输入,才能产出电能。 (2)燃料电池所能够产生的电能只和燃料的供应有关,只要供给燃料就可以产生电能,其放电是连续进行的。 (3)燃料电池本体的质量和体积并不大,但需要一套燃料储存装置或燃料转换装置和附属设备才能获得氢气,而这些燃料储存装置或燃料转换装置和附属设备的质量和体积远远超过燃料电池本身。 1.2 燃料电池中的催化作用 燃料电池中的电催化作用是用来加速燃料电池化学反应中电荷转移的一种作用,一般发生在电极与电解质的分界面上。催化剂是一类可产生电催化作用的物质。电催化剂可以分别用于催化阳极和阴极反应。这种分离的催化特征,使得人们可以更好地优选不同的催化剂。 评价催化剂的主要技术指标为稳定性、电催化活性、电导率和经济性。 2.燃料电池的特点 由于燃料电池能将燃料的化学能直接转化为电能,因此,它没有像通常的火力发电机那样通过锅炉、汽轮机、发电机的能量形态变化,可以避免中间的转换的损失,达到很高的发电效率。同时还有以下一些特点: 不管是满负荷还是部分负荷均能保持高发电效率;不管装置规模大小均能保持高发电效率;具有很强的过负载能力;通过与燃料供给装置组合的可以适用的燃料广泛;用天然气和煤气等为燃料时,NOX及SOX等排出量少,环境相容