构成物质的微粒知识点0301汇编
- 格式:docx
- 大小:17.07 KB
- 文档页数:3

微粒构成物质知识点总结一、微粒构成物质的基本概念1. 微粒概念微粒是物质的基本组成单位,是构成物质的微小颗粒。
微粒构成物质的基本概念是微观世界中对物质结构的描述,是我们认识和理解物质的基础。
2. 微粒的性质微粒具有质量、体积和能量等物理性质,不同的微粒具有不同的化学性质,如原子、分子、离子等微粒在化学反应中具有独特的反应性。
3. 微观世界与宏观世界微观世界是指微观尺度下的物质结构和性质,宏观世界是指人们能够直接感观到的物质现象和性质。
微粒构成物质的认识是通过对微观世界的研究来理解物质的宏观性质和现象。
二、原子1. 原子的发现与性质原子是物质的最小单位,是由质子、中子和电子三种亚原子粒子组成的。
质子带正电荷,中子不带电,电子带负电荷。
原子具有质量、体积和能量,并且具有化学性质。
2. 原子的结构原子的结构由原子核和电子构成。
原子核由质子和中子组成,电子以轨道方式围绕原子核运动。
原子的结构对于物质的性质和化学反应具有重要影响。
3. 元素和同位素元素是由同种原子组成的物质,同位素是指同一元素的原子核中质子数相同、中子数不同的原子。
同位素具有相同的化学性质,但物理性质有所不同,可以用于放射性同位素的应用和研究。
三、分子1. 分子的概念分子是由不同原子通过化学键结合而成的,是物质的基本结构单位。
分子可以包括原子间的共价键、离子键等化学键。
2. 分子的性质分子具有质量、体积和能量,不同种类的分子具有不同的化学性质。
分子的结构对于物质的性质和化学反应起着决定性的作用。
3. 分子的结构分子的结构由原子的排列和化学键的方式确定。
分子的结构决定了分子的性质和化学行为,是研究物质的关键。
四、离子1. 离子的概念离子是失去或获得电子而带有电荷的原子或分子。
正离子是失去电子而带正电荷,负离子是获得电子而带负电荷。
2. 离子的性质离子具有电荷、质量和化学性质。
正负离子之间通过静电作用相互吸引,形成化合物,影响物质的性质和化学反应。
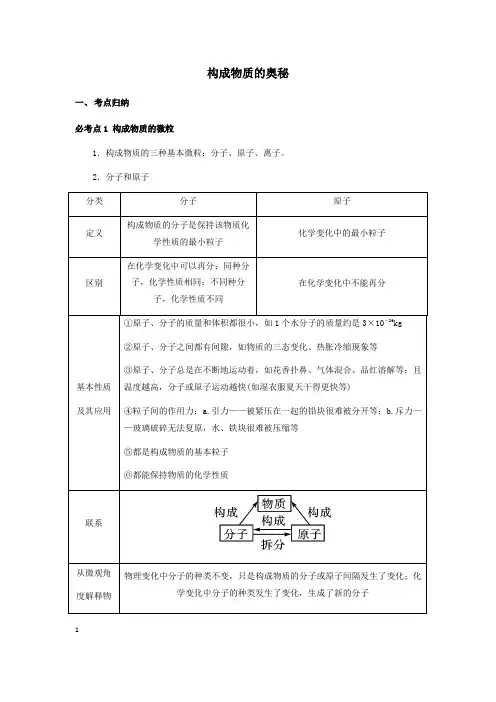
构成物质的奥秘一、考点归纳必考点1 构成物质的微粒1.构成物质的三种基本微粒:分子、原子、离子。
2.分子和原子123.离子(1)带电的原子或原子团叫做离子,带正电的原子叫做阳离子,带负电的原子叫做阴离子。
(2)离子符号周围的数字表示的意义(以Mg 为例)(3)原子和离子的区别(以Na 、S 为例)(4)常见的带电的原子团:OH -(氢氧根离子),SO 4 (硫酸根离子),CO 3 (碳酸根离子),NO -3 (硝酸根离子),HCO -3 (碳酸氢根离子),NH +4 (铵根离子)。
归纳总结(1)原子不能再分的前提是在化学变化中,事实上原子是由更小的微粒构成的。
(2)从分子和原子角度分析,化学变化的微观本质是分子分解成原子,原子重新组合成新的分子或直接构成新的物质。
(3)虽然分子由原子构成,但不同的原子大小差异较大,所以分子不一定比原子大,分子只是比构成该分子的原子大。
4.构成物质的微观粒子(1)物质由分子构成有:气态非金属单质(氧气、氢气、氮气等)、氧化物(二氧化碳、二氧化硫)和不溶性碱和盐(氢氧化镁、氢氧化铜、碳酸钙等);(2)物质由原子构成有:稀有气体(氦气、氖气等)、金属单质(镁条、铁丝、铜片等)和固态非金属(硫磺、碳等)。
(3)物质由离子构成有:可溶性碱和盐(氢氧化钠、氢氧化钾、氯化钠、碳酸钠等)和酸(硫酸、盐酸、硝酸等)。
必考点2 原子的结构1.原子的结构3特别提醒①虽然原子中的质子和核外电子都带电荷,但整个原子不带电,因为原子中质子数(核电荷数)=核外电子数。
②不是所有的原子都有中子(如有一种氢原子,原子核内只有一个质子,没有中子)。
③构成物质的基本微粒有三种:分子、原子、离子。
④一般来说,原子最外层电子数相同的元素,具有相似的化学性质,但并不绝对,如氦原子最外层有2个电子,但由于其核外只有一个电子层而具有相对稳定结构,镁、钙等原子的最外层也是2个电子,在化学反应中却易失去2个电子。


第一讲构成物质的微粒知识梳理1.原子化学变化中的最小微粒。
质量和体积都很小,在不断地运动,原子之间存在间隙,同种原子性质相同,可以直接构成物质.2.原子的构成原子原子核质子个质子带个单位的正电荷。
中子中子不带电质量与质子相当。
核外电子个电子带有个单位的负电荷质量为质子质量的原子由原子核和核外电子构成,核外电子绕核高速运动.原子核通常由质子和中子构成,普通的氢原子原子核中只有一个质子,不含中子.原子中:原子序数=质子数=核电荷数=核外电子数。
3.原子核外电子的分层排布(1)核外电子由里向外分层排布.n表示电子层数.(2)各电子层最多容纳的电子数为2n2个,第一层最多排2个,第二层最多排8个,第三层最多排18个,以此类推。
(3)最外层不超过8个,次外层不超过18个,倒数第三层不超过32个.4. 分子保持物质化学性质的一种微粒。
质量和体积都很小,在不断地运动,分子之间存在间隙,同种分子性质相同,可以构成物质.5. 元素元素是以核电荷数(即核内质子数)为标准对原子进行分类,是同一类原子的总称.用于描述物质的宏观组成,可描述种类、质量,不描述个数. 有游离态和化合态两种存在形态。
地壳中元索含量前五位: O, Si, Al, Fe,Ca. 人体中元素含量前五位:O, C, H, N, Ca; 一切生命的基础元素:C.6.原子团某些元素的原子集合在一起作为一个整体参加化学反应,它所起的作用和个原子一样,这样的原子集团称为原子团. 常见原子团:NH4,OH,NO3,CO,SO4,PO4.等.7.离子原子或原子团通过得失电子所形成的带电微粒.阳离子:原子或原子团失去电子形成带正电的微粒,质子数大于电子数。
例如:Na+,Mg2+,A13+,NH+4等.阴离子:原子或原子团得到电子形成带负电的微粒,质子数小于电子数.例如:Cl-,S2-,OH-,等.8. 同位素质子数相同,中子数不同的原子互称为同位素。
例如1H,2H,3H;12C,13C,14C;16O,17O,18O;35Cl,37Cl。


2024九年级化学上册“第三单元物质构成的奥秘”必背知识点一、物质的构成1. 构成物质的微粒:物质由分子、原子、离子等微观粒子构成。
分子:由分子构成的物质,分子是保持其物质化学性质的最小粒子。
如氧气(O₂)、氢气(H₂)、二氧化碳(CO₂)、水(H₂O)等。
原子:原子是化学变化中的最小粒子。
如金属(如Fe、Cu)、金刚石(C)、硅(Si)等。
离子:带电的原子或原子团。
如氯化钠(NaCl)由Na₂和Cl₂构成,硫酸铜(CuSO₂)由Cu²₂和SO₂²₂构成。
2. 微粒的基本性质:微粒的质量和体积都很小。
微粒在不断地运动,温度越高,运动速率越快。
微粒之间有间隔,间隔大小随温度和压强的变化而变化。
同种微粒化学性质相同,不同种微粒化学性质不同。
二、分子与原子的关系1. 分子与原子的区别:在化学变化中,分子可以再分为原子,而原子则不能再分,只是重新组合成新的分子。
2. 分子与原子的联系:分子由原子构成,原子可以相互结合成分子。
三、原子的构成1. 原子的基本构成:原子由居于中心的带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成 (氢原子除外,它只有质子没有中子)。
2. 原子中的数量关系:核电荷数= 质子数= 核外电子数= 原子序数。
相对原子质量≈质子数+ 中子数。
3. 电子排布:电子在核外是分层排布的,能量低的电子优先排在离核近的电子层中。
四、元素与物质的关系1. 元素的定义:元素是具有相同核电荷数(即质子数)的一类原子的总称。
元素只讲种类,不讲个数。
2. 物质的组成与构成:物质由元素组成,如水由氢元素和氧元素组成。
物质由粒子 (分子、原子、离子)构成,如水由水分子构成,金由金原子构成,氯化钠由钠离子和氯离子构成。
五、化学反应的实质1. 化学反应的实质:在化学反应中,分子分裂为原子,原子重新组合成新的分子。
2. 物理变化与化学变化的区别:物理变化中没有新物质的生成,只是物质的状态或形状发生改变;化学变化中有新物质的生成。

1 一、构成物质的微粒:分子、原子、离子1、由原子直接构成的物质:金属单质:如:铁、铜、银 等 固态非金属单质(碘除外):如:碳(C )、硅(Si )、硫(S )、磷(P )稀有气体:如:氦气(He )、氖气(Ne )、氩气(Ar ) 等2、由分子直接构成的物质:水、过氧化氢和大部分的气体(稀有气体除外)3、由离子直接构成的物质:例如:氯化钠 NaCl 、氯化镁MgCl 2、 硫酸铜 CuSO 4 等二、分子1、 定义:由分子构成的物质,分子是保持物质化学性质的最小粒子。
2、 分子的性质: (1)分子的质量和体积都很小。
(2)分子在永不停息的做无规则运动,且温度越高,运动速率越快。
(3)分子之间有间隔,气态物质的分子间隔大,液态、固态物质的分子间隔小。
(4)分子可直接构成物质,同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
3、 分子观点解释物理变化和化学变化——是否生成新分子(1)发生物理变化时,分子本身没有变化,只是分子间的间隔发生变化。
(2)发生化学变化时,分子破裂成原子,原子重新组合成新的分子或物质。
(分子种类变了,原子种类不变。
)4、 分子观点解释纯净物和混合物纯净物:同种分子构成 混合物:不同种分子构成三、原子1、 定义:原子是化学变化中的最小粒子。
(化学变化中,分子可分,原子不可再分)2、 原子的性质:小、动、间、同。
3、 原子可以构成分子,也可以直接构成物质。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子或物质。
(分子的再分,原子的重新组合)四、原子的结构1、 原子的构成质子(+)原子核(+) 原子 中子(不带电)(不显电性) 核外电子2、原子结构规律: (1)不是所有原子都有中子(氢原子无中子)。
(2)原子中质子数和中子数不一定相等。
(3)不同种类的原子,质子数不同。
(4)同一原子中:核电荷数=质子数=核外电子数(=原子序数)(5)原子不显电性。
(质子数=核外电子数)3 、原子核体积小,却集中了几乎整个原子的质量。

3.1 构成物质的基本微粒第1课时微粒的性质一、微粒的性质1.微粒的质量和体积都很小例如:1个水微粒的质量大约是3×10-26 kg。
用胶头滴管滴下的一滴水中大约含有1.7×1021个水微粒。
2.微粒在不断地运动,且温度越高运动速率越快探究微粒运动的实验(1)现象:试管中酚酞溶液变红;A烧杯中的酚酞溶液变红,B烧杯中酚酞溶液不变色。
(2)解释:试管中酚酞溶液变红证明酚酞溶液遇浓氨水变红;A烧杯中的酚酞溶液变红证明C烧杯中浓氨水中的氨气微粒运动到了A烧杯中,所以A中的溶液变红,由于大烧杯的遮挡作用,氨气微粒不能运动到B烧杯中,所以B中的溶液不变色。
其他示例:酒香不怕巷子深、湿衣服晾干、打开酒精试剂瓶瓶塞能闻到酒精气味、闻到花园里的花香……都能证明微粒在不断地运动着。
3.微粒之间有间隔实验一:水与酒精的混合实验(提示:水中含有红墨水)现象:酒精与水混合后体积小于二者体积之和。
结论:实验证明微粒之间有间隔。
实验二:水和空气的压缩实验(1)水和空气都可以被压缩,因为构成物质的微粒之间有间隔。
(2)比较是一种很好的实验探究方法,通过上图对比发现,空气要比水更易被压缩,说明:气体微粒间的间隔大于液体微粒间的间隔。
二、构成物质的微粒构成物质的微粒有:分子、原子、离子。
1.由分子构成的物质:如氧气、水、酒精等。
2.由原子直接构成的物质:如铁、金刚石等。
3.由离子直接构成的物质:如氯化钠由氯离子和钠离子构成。
第2课时分子原子一、分子1.分子的基本性质(1)分子的质量和体积均很小、分子在不停地运动、分子之间有间隔。
(2)同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
如:氧气和液氧均能支持燃烧是因为二者均是由氧分子构成的。
(3)由分子构成的物质,分子是保持该物质化学性质的最小微粒。
(4)分子由原子构成,分子可以分成原子。
2.用分子的观点解释物质的变化及分类(1)区别物理变化和化学变化对于由分子构成的物质,发生物理变化时,分子本身不变,分子间间隔可能变化;发生化学变化时,分子本身发生变化,变成了其他物质的分子。

构成物质的微粒知识点引言:物质是构成世界的基本要素,包括我们周围的一切事物。
然而,物质的微观结构一直以来都是科学家们研究的重要话题之一。
近代科学研究发现,物质是由微粒构成的。
本文将介绍构成物质的微粒知识点,包括原子、分子和离子。
一、原子原子是构成物质的最基本单位,是物质的基本结构。
原子由质子、中子和电子组成。
1. 质子质子是原子核的组成部分,带有正电荷。
每个质子的电荷都等于基本电荷单位e,质子的质量大约是中子的1.007倍。
2. 中子中子也是原子核的组成部分,没有电荷。
中子的质量略大于质子。
电子是负电荷粒子,绕原子核轨道运动,电子的质量相对较小。
每个原子的电子数量决定了元素的化学性质。
二、分子分子是由两个或多个原子以共用电子而结合形成的。
分子是构成化合物的基本单位。
1. 共价键共价键是分子形成的关键。
当原子之间共享电子时,它们形成了共价键。
共价键的强度取决于原子之间电子的共享程度。
2. 分子的组成分子的组成可以是相同类型的原子(如氧气,由两个氧原子组成)或不同类型的原子(如水,由一个氧原子和两个氢原子组成)。
三、离子离子是带有正或负电荷的原子或分子,它们在化学反应中起着重要作用。
阳离子是带有正电荷的离子,通常是由金属元素及其化合物中失去电子形成的。
例如,Na+是一个阳离子,它是由钠原子失去一个电子形成的。
2. 阴离子阴离子是带有负电荷的离子,通常是由非金属元素及其化合物中获得电子形成的。
例如,Cl-是一个阴离子,它是由氯原子获得一个电子形成的。
结论:物质的微粒包括原子、分子和离子。
原子是构成物质的基本单位,由质子、中子和电子组成。
分子是两个或多个原子以共价键结合而成,它是构成化合物的基本单位。
离子是带有正或负电荷的原子或分子,在化学反应中起着重要作用。
对于我们理解物质的特性和相互作用有着重要的意义。
尽管本文只是简单介绍了构成物质的微粒知识点,但它们在化学和物质科学研究中有着重要的地位。
进一步深入研究微粒的性质和相互作用将帮助我们更好地理解物质世界的本质。
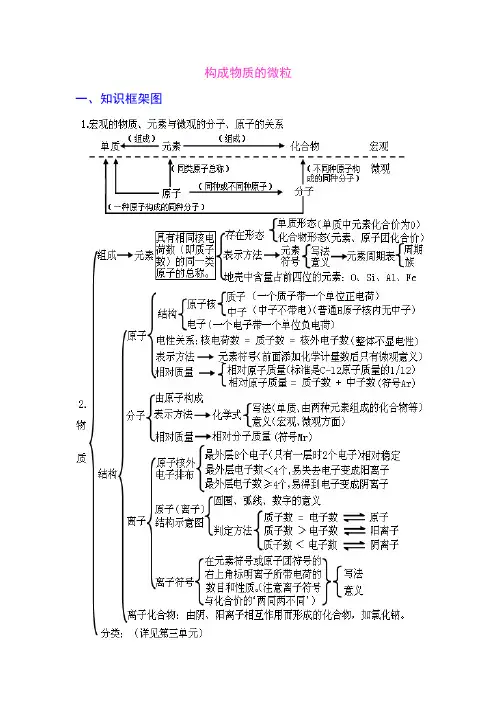
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
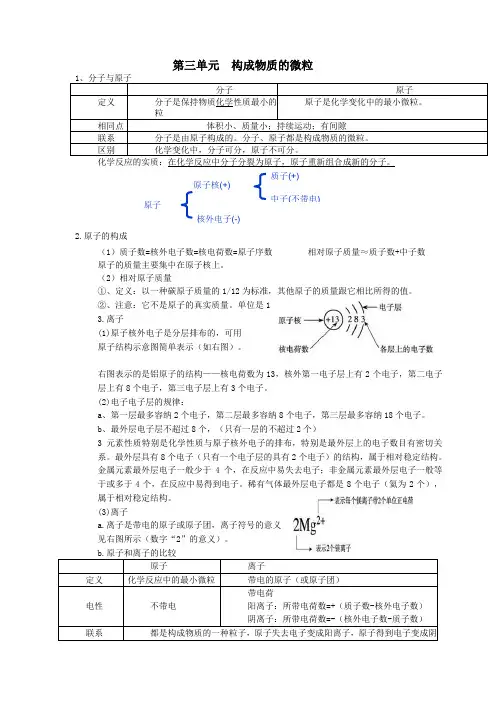
第三单元 构成物质的微粒 1、分子与原子 分子 原子 定义 分子是保持物质化学性质最小的微粒原子是化学变化中的最小微粒。
相同点 体积小、质量小;持续运动;有间隙联系 分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别 化学变化中,分子可分,原子不可分。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
2.原子的构成(1)质子数=核外电子数=核电荷数=原子序数 相对原子质量≈质子数+中子数 原子的质量主要集中在原子核上。
(2)相对原子质量①、定义:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比所得的值。
②、注意:它不是原子的真实质量。
单位是13.离子(1)原子核外电子是分层排布的,可用原子结构示意图简单表示(如右图)。
右图表示的是铝原子的结构——核电荷数为13,核外第一电子层上有2个电子,第二电子层上有8个电子,第三电子层上有3个电子。
(2)电子电子层的规律:a 、第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
b 、最外层电子层不超过8个,(只有一层的不超过2个)3元素性质特别是化学性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系。
最外层具有8个电子(只有一个电子层的具有2个电子)的结构,属于相对稳定结构。
金属元素最外层电子一般少于4个,在反应中易失去电子;非金属元素最外层电子一般等于或多于4个,在反应中易得到电子。
稀有气体最外层电子都是8个电子(氦为2个),属于相对稳定结构。
(3)离子a.离子是带电的原子或原子团,离子符号的意义见右图所示(数字“2”的意义)。
b.原子和离子的比较原子离子 定义化学反应中的最小微粒 带电的原子(或原子团) 电性不带电 带电荷 阳离子:所带电荷数=+(质子数-核外电子数) 阴离子:所带电荷数=-(核外电子数-质子数) 联系 都是构成物质的一种粒子,原子失去电子变成阳离子,原子得到电子变成阴离子原子 原子核(+)核外电子(-) 质子(+) 中子(不带电)4.元素(1)、定义:具有相同核电荷数(即核内质子数)的一类原子的总称(2)、决定因素:核电荷数或质子数(3)、特点:只讲种类,不讲个数(4)、地壳中元素居前五位的:氧、硅、铝、铁、钙生物体中元素居前三位:氧、碳、氢。
分解(化变) 钠原子(Na ): 构成 构成 构成 第三章 《构成物质的基本微粒》 3.1 构成物质的基本微粒 一.微粒的性质性质 示例 1微粒是不断运动 在花园里散步,能闻到花香 2 微粒间有空隙。
气体微粒间空隙较大,液体、固体微粒间空隙较小水与酒精混合后,总体积减小 ①热胀冷缩: 微粒间的空隙 随温度的改变而改变②三态变化: 构成物质的微粒不改变,改变的是微粒间的空隙二.分子、原子1.分子、原子、物质之间的关系原子 分子 物质由分子构成物质有:水、氮气、氧气、二氧化碳、氢气 …由原子直接构成物质有金属、稀有气体、碳、硫、磷、硅、金刚石(由碳原子构成)2.原子的构成⑴原子结构的发现汤姆生发现电子;卢瑟福通过a 粒子轰击金箔实验揭开了原子的内部结构。
⑵原子结构核电荷数(原子核所带电荷数)=质子数=电子数3.相对分子质量概念:分子中所有原子的相对原子质量的总和(注:相对分子质量没有单位)三.离子1.原子结构图电子分布规律:第1层最多分布2个电子,第2、3层最多分布8个电子 核电荷数 (质子数) 电子数最外层电子数2.离子形成离子是原子得或失电子形成的带电微粒。
得或失电子规律:最外层电子数<4,失去最外层电子;最外层电子数>4,得到电子达到最大化失去两个电子Mg Mg2+ (阳离子:核电荷数(质子数) > 电子数)得到1个电子Cl Cl— (阴离子:核电荷数(质子数)< 电子数)3.离子符号在符号的右上角依次标电量、电性(电量为1时,省略不写)4.由离子构成的物质:氯化钠(由钠离子和氯离子构成)等盐类物质3.2 组成物质的化学元素一.元素1.概念:元素是同一类原子的总称。
(元素是宏观概念:只论种类,不论个数)金属元素(除金、汞外,偏旁:钅)2.分类非金属元素(偏旁:气、石、氵)3.元素符号⑴书写:第一个字母大写,第二个字母小写⑵含义:宏观:元素微观:1个原子O 氧元素1个氧原子注:某些元素符号还可以表示物质。
《构成物质的基本微粒》知识清单一、物质由微粒构成我们生活的世界充满了各种各样的物质,从微小的尘埃到巨大的星体,从无色的空气到五彩斑斓的宝石。
但你是否想过,这些看似不同的物质,其实都是由一些微小的基本微粒构成的呢?就像搭建房屋需要砖块一样,物质也是由微小的“砖块”——微粒组成。
这些微粒包括分子、原子和离子。
二、分子分子是保持物质化学性质的一种微粒。
例如,氧气由氧分子构成,水由水分子构成。
分子的特点有很多。
首先,分子很小很小,我们的肉眼是无法直接看到的。
如果把一滴水放大到一个游泳池那么大,其中的水分子就像游泳池中的一个小乒乓球。
其次,分子在不停地运动。
我们能闻到花香,就是因为花中的分子在不断运动,扩散到空气中,进入我们的鼻腔。
再者,分子之间存在间隔。
比如,气体容易被压缩,就是因为气体分子之间的间隔较大,当受到压力时,分子间隔变小,体积也就随之减小。
不同的物质由不同的分子构成,同种物质的分子性质相同,不同种物质的分子性质不同。
三、原子原子是化学变化中的最小微粒。
在化学变化中,分子可以再分,而原子不能再分。
原子同样非常小,其直径大约只有 10^-10 米。
原子由原子核和核外电子构成,原子核又由质子和中子组成。
质子带正电荷,中子不带电,核外电子带负电荷。
质子数等于核外电子数,所以整个原子呈电中性。
原子可以通过一定的方式结合形成分子。
例如,一个氧原子和两个氢原子结合,就形成了水分子。
四、离子离子是带电的原子或原子团。
当原子得到或失去电子时,就会形成离子。
得到电子的原子带负电荷,称为阴离子;失去电子的原子带正电荷,称为阳离子。
例如,钠原子失去一个电子,就变成了带正电荷的钠离子(Na+);氯原子得到一个电子,就变成了带负电荷的氯离子(Cl)。
离子在我们的生活中也有很多应用。
比如,食盐(氯化钠)就是由钠离子和氯离子构成的。
五、分子、原子和离子的关系分子、原子和离子之间有着密切的联系。
分子是由原子通过一定的作用力结合而成的。
课堂备课笔记水的电解化学变化的本质:分子分裂成原子,原子重新组合成新分子的过程。
2.原子(1)概念:在化学变化中,不能再分的最小微粒。
(2)原子构成的物质:金属、稀有气体、金刚石、硅等问:原子能不能再分?原子的内部结构是什么样的?原子发展史:道尔顿、汤姆生、卢瑟福、查德威克原子核特点:体积小、质量大、带正电。
原子核几乎集中了原子全部重量,故原子质量分布不均匀原子不带电原因:原子核所带正电与核外电子所带负电电量相等、电性相反。
质子数=核电荷数=核外电子数(3)基本性质原子的质量和体积都很小原子在不停地运动原子间有空隙通过α粒子轰击金箔实验推导原子结构,及原子核、电子带电特点。
仔细分析水的电解过程,了解微观的变化。
原子是由原子核和核外电子构成的。
(4)相对原子质量:定义:以一个碳-12原子的质量的 1/12 作为标准,任何一个原子的质量跟它比较所得的值,就是该原子的相对原子质量(Ar)相对原子质量没有单位相对原子质量(取整数)≈ 质子数 + 中子数相对分子质量(Mr)== 构成分子的各原子的相对原子质量的总和3.离子(1)概念:原子或原子团由于得失电子而形成的带电微粒(2)由离子构成的物质:氯化钠(3)离子符号:利用元素符号表示离子时,离子的核电荷数和电性标注在元素符号右上角,数字在前,电性在后(4)得失电子:最外层电子数小于4时,在化学反应中易失去最外层电子,形成阳离子。
最外层电子数大于4时,在化学反应中易得到电子,形成阴离子。
离子不能单独稳定存在构成物质(5)基本性质:离子的质量和体积都很小离子在不停地运动离子间有空隙离子在化学变化中可再分不能够独立稳定存在构成物质。
《构成物质的微观粒子》知识清单一、原子原子是化学变化中的最小粒子。
1、原子的结构原子由原子核和核外电子构成。
原子核位于原子的中心,由质子和中子组成。
质子带正电荷,中子不带电。
核外电子带负电荷,围绕原子核做高速运动。
原子中,质子数等于核外电子数,因此整个原子呈电中性。
2、原子的质量原子的质量主要集中在原子核上。
由于质子和中子的质量大约相等,而电子的质量很小,几乎可以忽略不计。
3、相对原子质量以一种碳原子(碳 12)质量的 1/12 为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。
相对原子质量约等于质子数加中子数。
4、原子的种类不同元素的原子,质子数不同。
质子数决定了原子的种类。
二、分子分子是保持物质化学性质的最小粒子。
1、分子的性质(1)分子的质量和体积都很小。
例如,一滴水中大约有 167×10²¹个水分子。
(2)分子在不断地运动。
温度越高,分子运动越剧烈。
例如,能闻到花香就是因为分子在不断运动。
(3)分子之间有间隔。
一般来说,气体分子间的间隔较大,液体和固体分子间的间隔较小。
物质的三态变化就是分子间隔改变的结果。
2、分子与物质的关系由分子构成的物质,分子是保持其化学性质的最小粒子。
例如,氧气由氧分子构成,氧分子保持了氧气的化学性质。
3、分子的构成分子由原子构成。
例如,一个水分子(H₂O)由两个氢原子和一个氧原子构成。
三、离子离子是带电的原子或原子团。
1、离子的形成原子通过得失电子形成离子。
原子失去电子,带正电荷,形成阳离子;原子得到电子,带负电荷,形成阴离子。
2、离子的表示方法离子用离子符号表示。
在元素符号的右上角标明离子所带的电荷数和电性。
例如,钠离子表示为 Na⁺,氯离子表示为 Cl⁻。
3、离子与物质的关系离子化合物由离子构成。
例如,氯化钠(NaCl)由钠离子(Na⁺)和氯离子(Cl⁻)构成。
四、原子、分子、离子的关系1、原子可以构成分子,分子在化学变化中可以分解成原子。
第06讲构成物质的微粒物质的构成1.分子:定义:保持物质化学性质的一种微粒。
分子是有种类,也有个数。
基本性质:a.分子的质量和体积都很小。
b.分子在不断地做无规则运动,温度越高,分子运动越快。
c.分子之间有间隙。
d.在发生物理变化时,分子的本身没有变化。
(同种分子,性质相同)c.在化学变化过程中,分子可以再分,而原子不能再分。
分子分类:a.单原子分子如:稀有气体分子,He、Ne等b.双原子分子如:O2、H2、N2等c.多原子分子如:H2O、CO2、H2CO3等2.原子:定义:化学变化中最小的微粒。
原子有种类,也有个数。
基本性质:a.原子的质量和体积都很小。
b.原子在不断地做无规则运动,温度越高,分子运动越快。
c.原子之间有间隙。
重新组合OHHO H H 水分子(H 2O )氧分子(O 2)氢分子(H 2)O OH H HH OOHH通电HH分为氢原子和氧原子例:电解水3.构成物质的微粒1)构成物质的微粒有分子和原子_等。
2)物质是由分子或者原子构成的。
大部分物质是由分子直接构成物质;还有少部分物质是由原子直接构成的。
如:氧气是由_许多氧气分子_构成的,二氧化硫是由_许多二氧化硫分子构成的;金属铁是由铁原子直接构成;石墨是由碳原子直接构成;稀有气体氦气是由氦原子直接构成。
3)由原子直接构成的物质有:_金属单质_、碳、硅、硫、磷、稀有气体。
4.物质构成的分析:分析物质的微观构成用_分子、原子_的概念,还要注意物质的构成层次,例如,水是由_许多水分子构成的,水分子是由_两个氢原子和一个氧原子构成的;金刚石、氦气等都是由_原子直接构成的;金属可看作是由_原子直接构成的。
5.分子与原子之间的区别与联系:分子原子定义分子是保持物质化学性质的一种微粒.原子是化学变化中的最小微粒不同点1.在化学反应中,分子可以分解为原子,原子又可以重新组成新的分子,变成另外一种或几种分子。
在化学反应中原子不可再分,不能变成另外一种原子。
第三章物质构成的奥秘必备知识点1、构成物质的微粒:分子、原子、离子。
水是由水分子构成的,铁是由铁原子构成的,氯化钠是由离子构成的。
2、由分子构成的物质,分子是保持物质的化学性质的最小微粒 .3、物质的三态变化、体积变化体现了分子分子之间有间隔;能闻到花香、物质的挥发、扩散现象体现了分子在不断地运动;a一滴水中有1.67×1021个水分子,体现了分子的质量和体积都很小。
4、原子是化学变化中的最小的粒子5、分子和原子的主要区别是;在化学变化中,分子可以再分而原子不能再分6、分子和原子的联系是:分子是由原子构成.7、原子构成:由居于原子中心带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成。
每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
①质子数=电子数=核电荷数=原子序数②原子质量集中在原子核上③质子数不一定等于中子数;不是所有原子都有中子(氢原子无中子)8、相对原子质量(Ar):以一种碳原子质量的1/12为基准,其他原子质量与它的比值叫做这种原子的相对原子质量;①公式:,它是一种比值,单位是1,省略不写。
②相对原子质量≈质子数+中子数。
9、元素:具有相同质子数(即核核电荷数)的一类原子的总称。
10、元素种类由质子数决定。
11.两种元素的本质区别:质子数不同11、地壳中前四位元素含量顺序:氧硅铝铁;O、Si、Al、Fe12元素的化学性质由原子的最外层电子数决定13、元素符号书写:遵循“一大二小”14、记忆元素符号:氢H、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O 、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锰Mn、铁Fe、铜Cu、锌Zn、银Ag、钡Ba、金Au、铅Pb、汞Hg(共30种)13、元素符号意义:①表示一种元素(宏观意义);②表示该元素的一个原子(微观意义)。
元素符号前有系数只表示原子个数。
如:H:表示氢元素,表示一个氢原子。
学习-----好资料
构成物质的微粒知识点
一、化学变化中的最小微粒原子
1•原子的构成
r质子(带一个单位正电荷)
『原子核(带正
电)原子*
(不带电)
体积很小,质量占原子质量绝大多数'核外电子(每个电子带一个单位负电荷)
原子一般是由质子、中子和电子构成,有的原子不一定有中子(等于中子数。
原子的种类由核电荷数(质子数)决定。
2•在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带
的正电荷与核外电子所带的负电荷的电量相等,显电性。
3•定义式:Ar相对原子质量一个原子的实际质量(kg)标准碳原子的
质量(kg)—
12
精确应用:相对原子质量之比=原子实际质量之比,相对原子质量大的,实际质量就大计算应用:即相对原子质量~质子数+中子数
注意:相对原子质量不是原子质量,是一个比值,单位为1,可以用来比较几种原子的实际
质量大小
4•原子是化学变化中的最小微粒,化学变化中原子种类和数目不发生改变
二、原子核外电子排布与离子
1.电子排布一一分层排布:第一层不超过2个,其他层不超过8个(对前20号元素而言)
2.原子结构示意图:
(1)含义:(以镁原子结构示意图为例)
元素的分类最外层电子数得失电子趋势化学性质
稀有气体元素8个(氦为2个)
相对稳定,不易得失电子
稳定
金属元素
一般少于4个易失去最外层电子不稳定
•中子(不带电)
H原子),质子数也不一定
电性相反,所以原子整体不
元素的化学性质决定于原子的最外层电子数。
原子最外层电子数为8 (氦为2)的结构称为稳定结构。
(3)原子、阳离子、阴离子的判断:
原子:质子数=核外电子数
阴离子:质子数v核外电子数,带负电荷
阳离子:质子数〉核外电子数,带正电荷
(4 )原子与对应离子的异同
不变:质子数、中子数、核电荷数、相对原子质量
改变:最外层电子数、电子总数、微粒电性(从不带电到带电)、化学性质
可能改变:电子层数(阴离子不变,阳离子变少)
(5)原子和离子的稳定性
对于稀有气体原子,原子更稳定
对于其他原子,最外层达到8电子的离子更稳定
三、保持物质化学性质的微粒(分子)
化学反应的本质是原有的分子破裂,原子重新结合成新的分子,因此化学变化中分子的种类
必然改变,分子的数目可能不变(取决于具体的反应)。
2•分子的主要特点:分子在不断的运动(闻到气味,氨水、盐酸的挥发等),分子之间有间隙(物质三相变化的本质,压缩气体的原理,水和酒精混合总体积减小的原因),原子也具有以上特点,以稀有气体单质为例可以说明。
3•分子、原子、离子都可以构成物质,所有金属、稀有气体、金刚石(石墨)和硅是由原子构成的,其他大多数物质是由分子构成的,还有些物质由离子构成(比如NaCI晶体)。
考点与考题类型:
1•如何证明分子在运动及分子间的间隙
学习-----好资料
2•利用4个相等计算质子数、核外电子数等
3.相对原子质量的意义
4•原子与对应离子的异同点
5.离子结构示意图的理解和相关计算
6.原子与分子的异同。