2018年暨南大学710无机化学考研真题试题试卷
- 格式:pdf
- 大小:400.64 KB
- 文档页数:5

近几年来某些综合大学无机化学考研试题汇编复旦大学无机化学考研试题汇编一完成并配平下列反应式:1 BrO3- + XeF2 + H2O →2 SnS + (NH4)2S2 →3 BF3 + H2O →4 K2MnO4 + H2O →5 FeC2O4→6 [Co(NH3)6]2+ + O2 + H2O →7 BF3 + LiAlH4 →8 Pb(OH)3- + ClO- →9 Bi(OH)3 + Cl2 + NaOH →10 XeO3 + O3 + H2O →11 (NH4)2Cr2O7 →12 CaCO3 + H2O + Cl2→13 Pb3O4 + HCl →14 NH3 + CO2 →15 Zn + NH3 + H2O →二用反应式表示下列制备过程,注明必要反应条件及步骤,辅助原料自选。
1 以为NaNO3主要原料制备NaNO2;2 以SO2,NaOH,锌粉为原料制备保险粉;3 由CuCl2制备CuCl;4 利用配体取代反应制备cis-[PtCl2(NH3)2]。
可供选择的原料为[Pt(NH3)4]SO4、Na2[PtCl4]、NH3、NH4Cl,说明选择原料的依据;5 以H3PO4和NaOH为原料制备三聚磷酸钠;6 以粗硅为原料制取超纯硅;7 以Ba(IO3)2为原料制备偏高碘酸;8 试举两例实验室制备CO的合理方法。
三简答题:1 为什么硼砂(Na2B4O5(OH)4.8H2O))溶液具有缓冲作用?2 如何制取纯HD?(D=21H)3 锝在周期表中处于什么位置?写出锝最高氧化态的含氧酸的分子式。
4 稀土元素的离子和化合物的颜色主要是由什么引起的?稀土元素作为优良磁性材料的依据是什么?5 多硼烷中可能存在哪几种类型的化学键?丁硼烷(B4H10)中有哪几种类型的化学键?6 写出[PtCl2(NO2)(NH3)(en)]Cl的名称,并画出内界可能的几何异构体。
7 如何解释NH3是Lewis碱而NF3却不具有Lewis碱性?8 何谓沸石分子筛?以人工合成A型分子筛为代表,讨论它们的组成、结构、性质和应用。

暨南大学2018年真题参考答案一、名词解释1.由于手术创伤的反应,术后病人的体温可略升高0.1~1℃,一般不超过38℃,称之为外科手术热或吸收热。
(外6 P.115)2.脑组织从高压区向低压区移位,导致脑组织、血管及脑神经等重要结构受压和移位,被挤入小脑幕裂孔、枕骨大孔、大脑镰下间隙等生理性或病理性间隙或孔道中,从而出现一系列严重的临床症状。
(外6 P.222)3.分级护理是指根据病人病情的轻重缓急以及自理能力的评估结果,给予病人不同级别的护理,通常分为四个护理级别,即特级护理、一级护理、二级护理及三级护理。
(基6 P.096)4.体温骤然上升至39℃以上,持续数小时或更长,然后下降至正常或正常以下,经过一个间歇,体温又升高,并反复发作,即高热期和无热期交替出现。
(基6 P.240)5.由于支气管-肺组织、胸廓或肺血管病变引起肺血管阻力增加,产生肺动脉高压,继而右心室结构和(或)功能改变的疾病。
(内6 P.083)6.是由于窦房结病变导致功能减退,从而产生多种心律失常的综合表现。
(内6 P.172)7.又称过期流产,是指胚胎或胎儿已死亡滞留在宫腔内尚未自然排出者。
(妇6 P.140)8.由各种肾脏疾病所致的,以大量蛋白尿(尿蛋白>3.5g/d)、低蛋白血症(血清白蛋白<30g/L)、水肿、高脂血症为临床表现的一组综合征。
(内6 P.396)二、单项选择题1. C解析:外6 P.473 注:“外6 P.473”表示“第六版外科护理学第473页”2.C解析:外6 P.0153.D解析:外6 P.5964.A解析:外6 P.4235.E解析:外6 P.4996.D解析:外6 P.5737.B解析:外6 P.0928.A解析:外6 P.0659.B解析:外6 P.70910.B解析:外6 P.50111.A解析:外6 P.23412.A解析:外6 P.424解析:基6 P.346 14.A解析:基6 P.359 15.B解析:基6 P.150 16.E解析:基6 P.280 17.C解析:基6 P.270 18.B解析:基6 P.036 19.A解析:内6 P.498 20.A解析:内6 P.049 21.B解析:内6 P.574 22.D解析:内6 P.845 23.A解析:内6 P.083 24.D解析:内6 P.618 25.C解析:内6 P.296 26.E解析:内6 P.585 27.C解析:内6 P.329 28.B解析:内6 P.455 29.A解析:内6 P.485 30.C解析:内6 P.472 31.E解析:妇6 P.025 32.B解析:妇6 P.143 33.B解析:妇6 P.299 34.E解析:妇6 P.141解析:儿6 P.21336.B解析:儿6 P.44037.E解析:儿6 P.17638.D解析:儿6 P.38039.B解析:儿6 P.20040.B解析:儿6 P.342三、简答题1.答:凡是需要营养支持但又不能或不宜接受肠内营养的病人,包括预计1周以上不能进食、或因胃肠道功能障碍、不能耐受肠内营养者,或通过肠内营养无法达到机体需要的目标量者,均是肠外营支持的适应症。

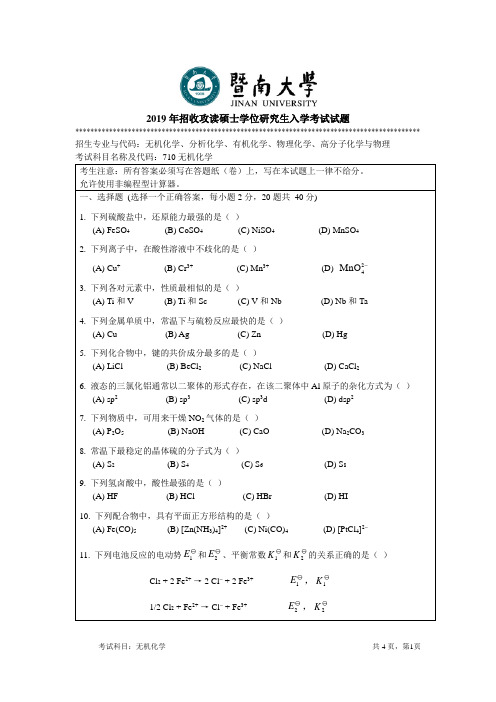

2008暨南大学无机(二)选择题 (选择一个正确答案,每小题2分, 25题共 50分 )1.CO 2晶体升华时,需要克服的作用力主要是……………………………()(A)离子键(B)氢键(C)共价键(D)范德华力2.Fe(CO)5的中心离子采用dsp 3杂化, 试问其的空间构型 ………………( )(A) 正四体形 (B)三角双锥形 (C) 平面四边形 (D) V 形3.N 2分子中存在的共价键为…………………………………………………( )A. 只有σ键B. 只有π键C. 一个σ键和二个π键D. 二个σ键和一个π键4.在[Co(en)(NH 3)4]3+配离子中,中心离子的配位数为……………………( )A. 3B. 4C. 5D. 65.下列反应的平衡常数可以用K p = 1/表示的 …………………………(2H p )(A) H 2(g) + S(g)H 2S(g)(B) H 2(g) + S(s)H 2S(g)(C) H 2(g) + S(s)H 2S(l) (D) H 2(l) + S(s)H 2S(s)6.下列元素属于ds 区元素的是………………………………………………( )A. 4d 105s 1B. 4s 24p 6C. 4s 2D. 3d 14s 27.过量AgCl 溶解在下列各物质中,问哪种溶液中Ag +浓度最小…………( )(A) 100 cm 3水 (B) 1000 cm 3水(C) 100cm 3 0.2mol ·dm -3 KCl 溶液 (D) 1000 cm 3 0.5mol ·dm -3 KNO 3溶液8.在工业上欲除去ZnSO 4溶液中的Fe 3+ 杂质,需加入最合适的试剂是……( )(A) NaOH (B) Na 2CO 3 (C) ZnCO 3 (D) Zn9.H 2O(l , 100℃, 101.3 kPa)H 2O(g, 100℃, 101.3 kPa),设H 2O(g)为理想气−→−体,则由始态到终态体系所吸收的热量Q 为……………………………………( )(A) >ΔH (B) <ΔH (C) =ΔH (D) =ΔU10.Li 、Be 、B 原子失去一个电子,所需要的能量相差不是很大, 但最难失去第二个电子的原子估计是……………………………………………………… ( )(A) Li (B) Be (C) B (D) 都相同11.性质最相似的两种元素是…………………………………………………( )(A) Zr 和Hf (B) Ru 和Rh (C) Mn 和Mg (D) Cu 和Cr12.pH 计上所用的指示电极是………………………………………………( )(A) 饱和甘汞电极 (B) 铂电极(C) 氯化银电极 (D) 玻璃电极13.下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是……………………………………………………( )(A) (B) SO 2 (C) H 3O + (D) OF 2+4NH 14.CrO 5中Cr 的氧化数为 ………………………………………………… ( )(A) 4 (B) 6 (C) 8 (D) 1015.由下列反应设计的电池不需要惰性电极的是……………………………( )(A) H 2(g) + Cl 2(g) = 2HCl(aq) (B) Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+(C) Zn + Ni 2+ = Zn 2+ + Ni (D) Cu + Br 2 = Cu 2+ + 2Br -16.在FeCl 3与KSCN 的混合液中加入过量NaF ,其现象是…………………( )(A) 产生沉淀 (B) 变为无色 (C) 颜色加深 (D) 无变化17.含有下列离子的溶液,与Na 2S 溶液反应不生成黑色沉淀的一组是……( )(A) Fe 2+,Bi 3+ (B) Cd 2+,Zn 2+ (C) Fe 3+,Cu 2 (D) Mn 2+,Pb 2+18.0.50 mol ·dm -3 HAc 的电离度是(K a = 1.8 ⨯ 10-5)……………………………( )(A) 0.60 % (B) 0.90 % (C) 0.030 % (D) 1.3 %19.已知,(Sn 4+ / Sn 2+) = 0.14 V ,(Fe 3+ / Fe 2+) = 0.77 V ,则不能共存于同 ϕ ϕ一溶液中的一对离子是…………………………………………………………… ()(A) Sn4+,Fe2+(B) Fe3+,Sn2+(C) Fe3+,Fe2+(D) Sn4+,Sn2+20.下列物质的酸性强弱顺序正确的是………………………………………()(A) HF> HI > HCl (B) HF> HCl > HI(C) HI > HF > HCl (D) HI > HCl >HF21.273 K 时, 蒸气压最高的物质是……………………………………………( )(A) 汽油(B) 甘油(C) 冰(D) 食盐22.下列量子数合理的一组是…………………………………………………()(A) n= 1 l = 0 m= 1 (B) n= 1 l = 1 m= 1(C) n= 3 l = 2 m= 1 (D) n= 2 l = 1 m= 223.某中心离子d5在八面体场中处于高自旋,由公式(n为未成μ=+n n()2对电子数)计算的数据应为………………………………………………………()(A) 5.48 (B) 0(C) 5.92 (D) 不能计算24.能生成氮气的方法是……………………………………………………()(A) 将硝酸铵(NH4NO3)加热(B) 将亚硝酸铵(NH4NO2)加热(C) 将氯气与氨混合(D) B和C25.下列各组混合液中,能作为缓冲溶液的是……………………………()(A) 10 cm3 0.2 mol·dm-3 HCl和10 cm3 0.1 mol·dm-3 NaCl(B) 10 cm3 0.2 mol·dm-3 HAc和10 cm3 0.1 mol·dm-3 NaOH(C) 10 cm3 0.2 mol·dm-3 HAc和10 cm3 0.3 mol·dm-3 NaOH(D) 10 cm3 0.2 mol·dm-3 HCl和10 cm3 0.2 mol·dm-3 NaOH二、填空题(1、5题每空2分,其余每空1分,共33分)1. 在Al3+和Cu2+的混合溶液中加入过量的NH3· H2O,生成的沉淀是________。

2017年招收攻读硕士学位研究生入学考试试题********************************************************************************************招生专业与代码:无机化学、分析化学、有机化学、物理化学、高分子化学与物理考试科目名称及代码:710无机化学考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
允许使用非编程型计算器。
一、选择题 (选择一个正确答案,每小题3分,20题共 60分)1. 波函数用于描述(A) 电子的能量 (B) 电子在核外空间的运动(C) 电子的运动速度 (D) 电子在某一空间出现的概率密度2. 下列化合物中,既有离子键又有共价键的是(A) CaO (B) CH 4 (C) BaCl 2 (D) NH 4Cl3. 下列物质中,不适宜作配体的是(A) 223S O - (B) H 2O (C) NH 4+ (D) Cl -4. H 3O +的杂化类型和空间构型为(A) sp 3杂化,正四面体 (B) sp 3杂化,三角锥形(C) sp 3不等性杂化,正四面体 (D) sp 3不等性杂化,三角锥形5. NaF 、NaCl 、NaBr 、NaI 中,熔点最低的是(A) NaF (B) NaCl (C) NaBr (D) NaI6. 与难挥发性非电解质稀溶液的蒸气压降低、沸点升高、凝固点降低有关的因素为(A) 溶液的体积 (B) 溶液的温度(C) 溶质的本性 (D) 单位体积溶液中溶质质点数7. 某金属离子生成的两种八面体配合物的磁矩分别为μ = 4.90 B.M 和μ = 0.00 B.M ,则该金属离子可能是(A) Cr 3+ (B) Mn 2+ (C) Mn 3+ (D) Fe 2+8. 将固体NH 4NO 3溶于水,溶液变冷,则该过程的G ∆、H ∆、S ∆的符号依次是(A) +、-、- (B) +、+、- (C) -、+、- (D) -、+、+9. 下列说法正确的是(A) 两难溶电解质作比较时,K sp 小的,溶解度一定小(B) 欲使溶液中某离子沉淀完全,加入的沉淀剂越多越好(C) 沉淀完全是指用沉淀剂将溶液中某一离子完全消除(D) 欲使Ca 2+沉淀完全,选择Na 2C 2O 4作沉淀剂效果比Na 2CO 3好考试科目: 无机化学 共 4 页,第 1 页。

2023年暨南大学《710 无机化学》考研真题考试科目:无机化学共4 页,第 1 页考试科目:无机化学共4 页,第 2 页二、填空题(6小题,每空1分,共25分)1.第二周期同核双原子分子或离子具有以下分子轨道电子排布,X2:(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2py)2(π2pz)2 (π2py*)1 (π2pz*)1, Y2-:(σ1s)2(σ1s*)2 (σ2s)2(σ2s*)2(π2py)2 (π2pz)2(σ2p)2(π2py*)1, 这两种元素分别是(X) 和(Y) 。
其中,具有顺磁性的分子是。
2. 有一白色固体A,加入油状无色液体B,可得紫黑色固体C;C微溶于水,加入A后,C 的溶解度增大,得一棕色溶液D。
将D分成两份,一份中加入一种无色溶液E,另一份通入气体F,都褪成无色透明溶液;E遇酸则有淡黄色沉淀产生;将气体F通入溶液E,在所得溶液中加入BaCl2溶液有白色沉淀,该白色沉淀难溶于硝酸。
则A为,B为,C为,D为,E为,F为。
3. NH4+的中心原子杂化形式为,中心原子孤对电子对数为,分子中有个σ键,个大π键,分子形状为。
NO2的中心原子杂化形式为,中心原子孤对电子对数为,分子中有个σ键,分子形状为。
4. 卤化银(AgX, X = F, Cl, Br 和I))的颜色随卤离子的半径增大而___________________;它们之间这些差异主要是因为____________________________5. 第四周期元素中,基态原子的4p轨道半充满的是;3d轨道半充满的是;4s 轨道半充满的是;4s电子数与3d电子数相等的是。
6. Na+和Ag+的离子半径相近,水合离子的酸性较强的是。
三、计算题(3小题,每题10分,共30分)1. Mg(OH)2溶解度为1.3×10-4mol·L-1,今在10mL 0.10 mol·L-1MgCl2溶液中加入10mL 0.10mol·L-1NH3·H2O,如果不希望生成沉淀,则需加入(NH4) 2SO4固体的量不应少于多少克?(M[(NH4) 2SO4]=132,K b [NH3·H2O]= 1.8⨯10-5)2. 已知:Cu+ + e Cu ϕO―= 0.52VCuCl + e Cu + Cl-ϕO―= 0.14V(1)计算CuCl的K sp;(2)将上述两电对组成电池,写出电池反应,并计算反应的平衡常数K O―及∆r G m O―值。

2023年硕士研究生入学统一考试无机化学考试大纲目录Ⅰ. 考察目标Ⅱ. 考试形式和试卷结构Ⅲ. 考察范围物质结构基础化学热力学与化学动力学初步水溶液化学原理元素化学之一:非金属元素化学之二:金属Ⅳ. 试题示例Ⅴ. 参考书推荐Ⅰ. 考察目标无机化学课程考试涵盖物质结构基础、化学热力学与化学动力学、水溶液化学原理、元素化学等内容。
要求考生全面系统地掌握无机化学的基本概念、基本理论、基本计算,并能很好地解释无机化学中的一些现象和事实,具备较强的分析问题和解决问题的能力。
基本要求按深入程度分为一般了解、了解、理解和掌握四个层次。
Ⅱ. 考试形式和试卷结构一、试卷满分及考试时间本试卷满分为150分,答题时间为180分钟二、答题方式答题方式为闭卷、笔试三、试卷内容结构物质结构基础:20~25分化学热力学与化学动力学初步:25~30分水溶液化学原理:40~45分元素化学之一:非金属:25~30分元素化学之二:金属:25~30分四、试卷题型结构选择、填空、判断:90分简答:25~30分计算:30~35分Ⅲ. 考察范围物质结构基础一、原子结构与元素周期系了解波函数的空间图象,掌握四个量子数,原子核外电子排布,元素基本性质的周期性变化规律。
二、分子结构掌握共价键的本质、原理和特点,价层电子对互斥理论,杂化轨道理论,分子轨道理论,分子间力的特征及类型,理解共轭大п键。
三、晶体结构了解晶胞的概念及14种布拉维点阵,理解离子的特征、离子键、晶格能、离子晶体基本类型,掌握离子极化对物质结构和性质的影响。
了解原子晶体及分子晶体。
四、配合物掌握配合物的基本概念,几何异构和对映异构的概念,配合物的价键理论及晶体场理论。
化学热力学与化学动力学初步一、化学热力学基础掌握热力学基本概念及其重要状态函数,掌握热力学相关计算。
二、化学平衡常数掌握标准平衡常数的概念,Kθ与△r G mθ的关系,多重平衡规则,浓度、压力、温度对化学平衡的影响,与化学平衡相关的计算。
目录
2018 年暨南大学710无机化学考研真题试题试卷 (2)
2018年招收攻读硕士学位研究生入学考试试题
********************************************************************************************
专业名称:无机化学、分析化学、有机化学、物理化学、高分子化学与物理、材料物理与化
学
研究方向:
考试科目:710无机化学
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
一、选择题(选择一个正确答案,每小题3分,20题共60分)
1.液体沸腾过程中,下列物理量中数值增大的是····························()
A.摩尔熵
B.摩尔自由能
C.蒸气压
D.液体质量
2.关于基元反应的论述,不正确的是·······································()
A.基元反应的逆反应也是基元反应
B.没有单分子基元反应
C.反应总级数等于反应的分子数
D.分子数大于3的反应不可能是基元反应
3.下列元素中,性质最相似的一组是····································()
A.Zr,Hf
B.Mg,Al
C.Li,Be
D.Co,Ni
4.下列哪个轨道上的电子在xy平面上出现的概率为0·····················()
A.3p z
B.3d x2-y2
C.3s
D.3d z2
5.下列物质中,中心原子采取不等性杂化的是····························()
A.NH4+ B.BI4- C.NCl3 D.BCl3
6.下列杂化轨道中可能存在的是·······································()
A.n=1的sp
B.n=3的sd
C.n=2的sp3
D.2s和3p形成的sp
7.下列分子中只含有一个π34键的是···································()
A.CO2
B.SiO2
C.SO3
D.SO2
8.[Co(NH3)6]3+是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是·()
A.4,sp3d2 B.0,sp3d2 C.0,d2sp3 D.4,d2sp3
9.超氧化钠与水反应的产物是·········································()
A.NaOH和H2
B.NaOH和O2
C.NaOH,O2和H2O2
D.NaOH和H2O2
考试科目:710无机化学共4页,第1页。