化学反应速率和平衡图像
- 格式:doc
- 大小:273.50 KB
- 文档页数:4




化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。



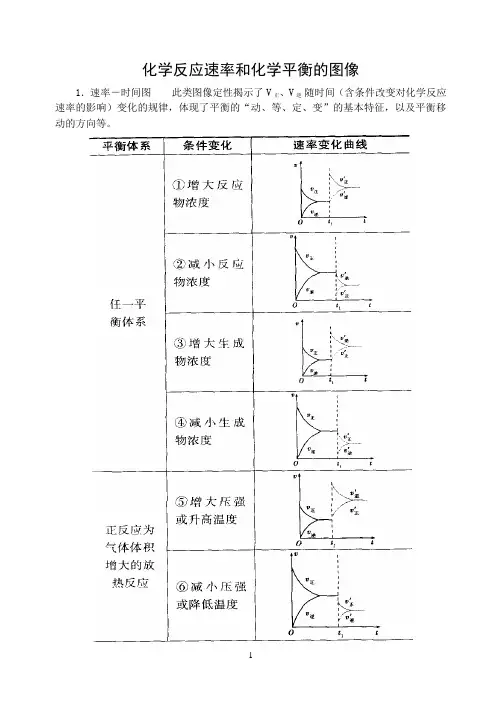
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。


专题五 化学反应的速率 化学平衡图像一、化学反应速率1、意义:衡量化学反应进行快慢程度的物理量。
2、表示方法:用单位时间内反应物 的减少或生成物 的增加来表示。
3、表达式:4、单位:5、注意事项:(1)为标量,取正值,是平均速率。
(如何判断瞬时速率的相对大小?)(2)对于同一反应,用不同物质表示的反应速率数值可能不同,但意义相同。
故描述反应速率时应指明物质种类,比较速率大小时要转化成同一物质(统一单位)。
(3)用不同物质表示的速率之比等于方程式计量数之比。
(4)不能用固体或纯液体表示反应速率。
(5)可逆反应中v 的意义。
(区别正、逆反应速率和净速率)62、外界条件的改变不能改变物质本身性质,如铁与稀硫酸制氢气,改用浓硫酸不能加快制氢速率。
3、升高温度,无论吸热还是放热反应,反应速率一定加快,只是加快程度不相同;温度每升高10℃,反应速率会变成原来2--4倍。
4、压强对速率的改变本质是对 的改变。
总结压强对反应速率的影响:5、催化剂在反应前后组成、质量和化学性质不变,而非不参与反应;对于可逆反应,催化剂能同等程度(倍数)改变正、逆反应速率。
催化剂不改变反应的方向、不改变转化率、不改变平衡常数、不改变反应的热效应,只是能缩短达到平衡所需的时间。
例:某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH <0。
下图表示该反应的速率(v )随时间(t )变化的关系,t 2、t 3、t 5时刻外界条件有所改变,但都没有改变各物质的加入量。
下列说法中正确的是A .t 2时加入了催化剂B .t 3时降低了温度C .t 5时增大了压强D .t 4~t 5时间内转化率最低练1:在某个容积为2.0 L 的密闭容器内,在T ℃时按下图1所示发生反应:mA(g)+nB(g)pD(g)+qE(s)+Q (Q >0)(m 、n 、p 、q 为最简整数比)。
(1)据图1所示,反应开始至达到平衡时,用D 物质表示的该反应速率为____ _;(2)根据上图可求得方程式中m :n :p :q = ,该反应的化学平衡常数的表达式K= ,升高温度,反应的化学平衡常数K (填“增大”、“减小”或“不变”,下同),B 的反应速率 。
化学反应速率和平衡图像
一、回顾
1.影响化学反应速率的外界因素
2.影响化学平衡的外界因素
外界因素改变的条件平衡移动的方向
浓度增大反应物浓度减小反应物浓度增大生成物浓度减小生成物浓度
压强增大体系压强减小体系压强
温度
升高体系温度
降低体系温度
二、内容
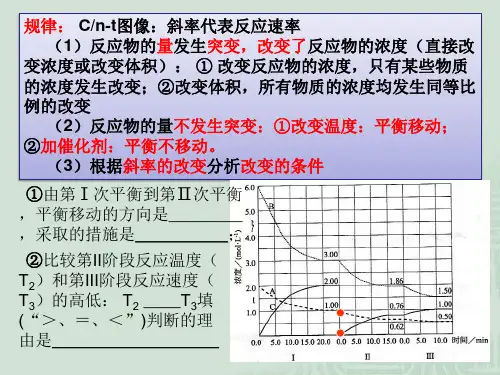
1.速率—时间图
解法识记:
1.增加反应物浓度,v正跳上得更大;减小反应物浓度,v正跳下得更大
2.增加生成物浓度,v逆跳上得更大;减小生成物浓度,v逆跳下得更大
3.升高温度,吸热方向跳上得更大;降底温度,吸热方向跳下得更大
4.增大压强,计量数减小方向跳上得更大;减小压强,计量数减小方向跳下得更大
若v正在v逆的上方,即平衡向正反应方向移动;若v逆在v正的上方,即平衡向逆反应方向移动。
2.浓度(或物质的量)—时间图
1.可逆反应a X(g)+b Y(g) c Z(g)
在一定温度下的一密闭容器内达到平衡后,
t0时改变某一外界条件,化学反应速率(v)
—时间(t)图象如图,则下列说法中正确的
是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
【典例2】(2013·成都模拟)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
1)根据图1请写出合成氨的热化学方程式______________
________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是_______________,t5时刻改变的条件是___________。
答案:(1)N2(g)+3H2(g) 2NH3(g)ΔH=-2(E3-E1)kJ·mol-1
(2)催化剂t2…t3 (3)减小压强升高温度
如有侵权请联系告知删除,感谢你们的配合!。